LAURA BARCÁN 1, 14, LAURA DUCATENZEILER 2, 14, MARÍA DEL CARMEN BANGHER 3, 14, LAURA BARCELONA 4, 5, 14, WANDA CORNISTEIN 6, 14, LUCÍA DACIUK 7, 14, JUAN DE PAULA 1, 15, JAVIER DESSE 8, 14, MIGUEL DICTAR 9, 14, LILIANA FERNÁNDEZ-CANIGIA 10, 16, FRANCISCO NACINOVICH 11, 5, 14, PABLO SCAPELLATO 12, 14, JORGE VICTOR MARTÍNEZ 13, 14 y GRUPO DE TRABAJO:
Epidemiología: Coordinadores: LAURA BARCELONA 14, LAURA BARCÁN 14.
Participantes: LAURA JORGE 14, MORA OBED 14, MARÍA LAURA YANTORNO 14, RAQUEL ROLLET 16, JORGE CORREA 14
Diagnóstico: Coordinadores: LILIANA FERNÁNDEZ-CANIGIA 16, JAVIER DESSE 14
Participantes: RAQUEL ROLLET 16, MARÍA LAURA MALDONADO 16, SILVIA C. PREDARI 16, MARÍA CRISTINA LEGARIA 16, LILIANA CASTELLO 16, MARÍA ADELAIDA ROSSETTI 16, DANIELA VAUSTAT 16, MIRTA LITTERIO 16, CLAUDIA BARBERIS 16, GRACIELA GRECO 16
Tratamiento: Coordinadores: FRANCISCO NACINOVICH 14, PABLO SCAPELLATO 14
Participantes: LORENA ABUSAMRA 14, JOSÉ BARLETTA 14, MARIANA RODRÍGUEZ RAIMONDO 14, MARTÍN BRIZUELA 14, MARÍA CELIA B. CUESTA 14, MARÍA CRISTINA EZCURRA 14, ANDREA DUARTE 14, JUAN PABLO CAEIRO 14, BLANCA S. MENA 14, CELESTE BELTRAMO 14, ALICIA SISTO 14.
Trasplante de Microbiota Fecal: Coordinadores: LAURA DUCATENZEILER 14, JORGE MARTÍNEZ 14, JUAN DE PAULA 15
Participantes: ASTRID SMUD 14, MARÍA LAURA PEREYRA 14, FABIÁN BENITO 15, MARÍA PAULA BERNACHEA 14, LAURA BARCÁN 14, JAVIER FARINA 14, CARLOS WALDBAUM 18
Poblaciones especiales: Coordinadores: MARÍA C. BANGHER 14, MIGUEL DICTAR 14
Participantes: SANDRA LAMBERT 14, JUAN PABLO CAEIRO 14, MARIA LAURA LESCANO 14, LUCRECIA SOLER PUY 14, SANDRA VALLE 14, FEDERICO SIMIOLI 14
Control de infecciones: Coordinadores: WANDA CORNISTEIN 14, LUCÍA DACIUK 14
Participantes: INÉS STANELONI 14, STELLA MAIMONE 17, WANDA ALCALA 17, GISELLA BEJARANO 14, MARÍA DE LOS ÁNGELES BAIGORRIA 17, YANINA NUCETELLI 14
1 Hospital Italiano de Buenos Aires, 2Hospital Italiano de San Justo Agustín Rocca, San Justo. Pcia. de Buenos Aires, 3Instituto de Cardiología de Corrientes, Corrientes, 4Hospital Municipal Dr. Bernardo Houssay, Vicente López, Pcia. de Buenos Aires, 5Dr. Stamboulian, Servicio de Salud, Buenos Aires, 6Hospital Universitario Austral, Pilar, Pcia. de Buenos Aires, 7Hospital Nacional Alejandro Posadas, El Palomar, Pcia. de Buenos Aires, 8Hospital Zonal Dr. Enrique Erill, Pcia. de Buenos Aires, 9Instituto Alexander Fleming, Buenos Aires, 10Hospital Alemán, Buenos Aires, 11Instituto Cardiovascular Buenos Aires, 12Hospital Donación Francisco Santojanni, Buenos Aires, 13Hospital Británico, Buenos Aires, 14Sociedad Argentina de Infectología (SADI), 15Sociedad Argentina de Gastroenterología (SAGE), 16Subcomisión de Bacterias Anaerobias, Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas (SADEBAC), Asociación Argentina de Microbiología (AAM), 17Asociación de Enfermeros en Control de Infecciones (ADECI), 18División Gastroenterología, Hospital de Clínicas José de San Martin, Buenos Aires, Argentina
Resumen Las infecciones por Clostridioides difficile están entre las principales causas de infecciones asociadas al sistema de salud. Su epidemiología ha sufrido importantes cambios en la última década con aumento en incidencia, gravedad y frecuencia de recidivas. El objetivo de este documento es brindar recomendaciones nacionales para el diagnóstico, el tratamiento y la prevención de las infecciones por C. difficile. Estas recomendaciones fueron elaboradas por especialistas pertenecientes a cuatro sociedades científicas de la República Argentina: Sociedad Argentina de Infectología (SADI), Sociedad Argentina de Gastroenterología (SAGE), Sociedad Argentina de Bacteriología, Micología y Parasitología Clínica (SADEBAC) y Asociación de Enfermeros en Control de Infecciones (ADECI). La metodología utilizada consistió en la revisión sistemática de la evidencia publicada hasta diciembre 2018. Seis grupos de especialistas fueron formados a tal fin: Epidemiología, Diagnóstico, Tratamiento, Trasplante de Microbiota Fecal, Poblaciones Especiales y Control de Infecciones. En reuniones individuales de grupo y plenarias se presentaron y discutieron las conclusiones y se elaboraron las recomendaciones. En este documento se actualizan los algoritmos diagnósticos, las opciones terapéuticas, in-cluido el trasplante de microbiota fecal, en paciente inmunocompetentes e inmunocomprometidos, y las medidas de control de infecciones por C. difficile.
Palabras clave: Clostridioides difficile, recomendaciones, diagnóstico, tratamiento, prevención
Abstract Clostridioides difficile infections (CDI) are among the leading causes of health care-associated infections. The epidemiology of CDI has undergone major changes in the last decade, showing an increase in incidence, severity, and rate of relapse. These guidelines were developed by specialists from four scientific societies: Sociedad Argentina de Infectología (SADI), Sociedad Argentina de Gastroenterología (SAGE), Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas (SADEBAC) and Asociación de Enfermeras en Control de Infecciones (ADECI). The objective of these intersociety guidelines is to provide national recommendations on CDI diagnosis, treatment and prevention. The methodology used involved the systematic review of the bibliography available up to December 2018, which was performed by six groups formed ad hoc: Epidemiology, Diagnosis, Treatment, Fecal Microbiota Transplantation, Special Populations, and Infection Control. The conclusions were presented and discussed in meetings held by each individual group and plenary meetings. In this document, updated diagnosis algorithms, therapeutic options (including fecal microbiota transplant) for immunocompetent and immunocompromised patients are presented, as well as strategies for the control of C. difficile infection.
Key words: Clostridioides difficile, guidelines, diagnosis, treatment, prevention
Dirección postal: Laura Barcán, Hospital Italiano de Buenos Aires, Tte. Gral. Juan D. Perón 4190, 1199 Buenos Aires, Argentina
e-mail: laura.barcan@hospitalitaliano.org.ar
Clostridioides difficile constituye una de las principales causas de infecciones asociadas al cuidado de la salud 1. Las primeras descripciones datan de 1978, y su interés principal estaba centrado en las consecuencias que la infección generaba en la morbimortalidad de pacientes añosos y hospitalizados. Con el correr de los años se ha observado un incremento en su incidencia, diferentes presentaciones clínicas, nuevos escenarios epidemiológicos y nuevos factores de riesgo 2.
C. difficile puede ocasionar desde diarrea leve hasta manifestaciones graves como megacolon, íleo, perforación intestinal, sepsis y shock séptico, con una mortalidad global en pacientes hospitalizados estimada en 9% 3.
Probablemente, el cambio epidemiológico más importante ocurrió con la emergencia de la cepa BI/NAP1/027 que ha sido la responsable de la expansión geográfica y de brotes intrahospitalarios tanto en EE.UU. como en Canadá y Europa 1-4, dando origen a cuadros clínicos de mayor gravedad. La infección por C. difficile (ICD) adquirida en la comunidad también aumentó su frecuencia en los últimos años 4 y emerge como una enfermedad que afecta a pacientes considerados de bajo riesgo, jóvenes y embarazadas con curso clínico más favorable que la ICD nosocomial 4-6.
En EE.UU., la incidencia de ICD se duplicó entre 2001 y 2010 (4.5 casos a 8.2 casos/1000 admisiones), al igual que en Canadá 4. Si bien este incremento es multifactorial, la principal causa fue la emergencia de la cepa BI/NAP1/027 7,8. En Europa se estima una incidencia global de 11/1000 admisiones, y los ribotipos más prevalentes son 001, 014 y 027 9,10. En el continente asiático los ribotipos prevalentes fueron variando, siendo 017 el más frecuente 11.
C. difficile es un bacilo gram positivo anaerobio, esporulado, posee una enzima antigénica muy conservada, la glutamato deshidrogenasa, produce dos toxinas, una enterotoxina (TcdA) y una citotoxina (TcdB), y la toxina binaria que se produce en menos del 10% de las cepas 12.
Estas últimas despolimerizan los filamentos de actina, generan apoptosis y aumento de la permeabilidad epitelial. Además, activan la producción de factor de necrosis tumoral e interleuquinas y causan un aflujo masivo de neutrófilos y la formación de pseudomembranas.
C. difficile puede encontrarse en el ámbito hospitalario y en la microbiota intestinal humana. La colonización es más frecuente en neonatos y niños sanos (18-90%). En adultos es 0-15%, pero en internados asciende hasta el 51% 13. Así, la ICD está directamente asociada al consumo de antibióticos y a la disrupción de la microbiota intestinal habitual que dicho consumo ocasiona.
El objetivo de este documento es brindar recomendaciones nacionales para el diagnóstico, el tratamiento y la prevención de las infecciones por C. difficile. Estas recomendaciones fueron desarrolladas por especialistas pertenecientes a cuatro Sociedades Científicas de la República Argentina: Sociedad Argentina de Infectología (SADI), Sociedad Argentina de Gastroenterología (SAGE), Sociedad Argentina de Bacteriología, Micología y Parasitología Clínica (SADEBAC) y Asociación de Enfermeros en Control de Infecciones (ADECI).
Se conformaron seis grupos de trabajo para elaborar los distintos documentos: Epidemiología, Diagnóstico,
Tratamiento, Trasplante de Microbiota Fecal, Poblaciones Especiales y Control de Infecciones. Los participantes se reunieron tanto en grupo como en forma plenaria para la preparación de los documentos durante el período 2017-2018. Se realizó una reunión general en la cual se presentaron y discutieron las conclusiones de cada uno de los grupos de trabajo. Se realizaron cuatro reuniones con los coordinadores generales y los coordinadores de cada grupo para la evaluación final y la elaboración del manuscrito. Finalmente, el documento definitivo que aquí se presenta fue revisado nuevamente por todos los participantes para su corrección y actualización final.
La metodología utilizada para la elaboración del documento consistió en la revisión de la evidencia publicada, con la aplicación del sistema para la clasificación de las recomendaciones de guías de práctica clínica utilizado por la Sociedad Americana de Enfermedades Infecciosas (Infectious Diseases Society of America) y el Servicio de Salud Pública de los EE.UU. (US Public Health Service), que considera la fortaleza de la recomendación y la calidad de la evidencia disponible (Tabla 1). A tal fin, se revisaron los estudios sobre la etiología, el diagnóstico, el tratamiento y la prevención de las ICD en diferentes poblaciones publicados en inglés y español e identificados a través de búsquedas en la base PubMed, la Biblioteca Cochrane, y la revisión de las referencias de los artículos más relevantes. Si bien en la búsqueda sistemática se incluyeron artículos publicados hasta diciembre del 2018, también se incorporaron publicaciones de relevancia posteriores a esa fecha.

Epidemiologia de las infecciones por Clostridioides difficile
Definiciones
El diagnóstico de ICD se basa en la combinación de hallazgos clínicos y de laboratorio. Un caso confirmado de ICD incluye:
1) La presencia de síntomas, usualmente diarrea (definida como tres o más deposiciones con heces no formadas en 24 h)
2) Una prueba de materia fecal (MF) positiva para cepas toxigénicas de C. difficile o la presencia de toxinas o el hallazgo de pseudomembranas en una colonoscopía o en la histopatología 14.
Muy raramente (< 1% de los casos) puede presentarse como íleo paralítico con distensión colónica y sin diarrea.
En estos casos, el diagnóstico es más difícil.
ICD recurrente: nueva ICD dentro de las ocho semanas posteriores al inicio del episodio previo.
ICD refractaria: ICD que no responde al tratamiento convencional.
Respuesta terapéutica: disminución del número de deposiciones diarias (< 3 deposiciones no formadas por día, durante 2 días consecutivos) o mejoría de la consistencia de las mismas, acompañadas de mejoría en los parámetros clínicos (ausencia de fiebre y/o de síntomas abdominales), de laboratorio (normalización del recuento de glóbulos blancos y proteína C reactiva) y/o de imágenes en las primeras 48-72 horas de iniciado el tratamiento (BIII) 15. Debe tenerse en cuenta que la respuesta al metronidazol puede ser más lenta y demorar 3 a 5 días. La resolución completa de la consistencia de las heces puede demorar varias semanas. Cura sostenida o global: se refiere a la cura inicial de la infección, y no recurrencia hasta la semana 12 de vigilancia.
Factores de riesgo
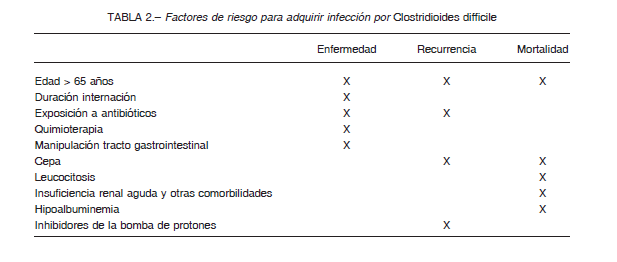
El principal factor de riesgo para adquirir diarrea asociada a C. difficile es el uso de antibióticos; principalmente amoxicilina-clavulánico, cefalosporinas, clindamicina y quinolonas, pero, prácticamente todos pueden asociarse. La hospitalización, la residencia en instituciones de cuidados crónicos y la colonización ambiental son otros factores de riesgo importantes1. La edad (> 65 años) se ha asociado a mayor riesgo de adquirir la infección y a formas más graves 2. La inmunosupresión, la insuficiencia renal y otras comorbilidades también se han asociado a mayor frecuencia de ICD. En relación al uso de inhibidores de la bomba de protones la evidencia es controvertida.
En 2012, la FDA publicó una comunicación al respecto, y alertó acerca de que la diarrea por C. difficile podría estar asociada al uso de inhibidores de la bomba de protones. Si bien no hay datos provenientes de estudios aleatorizados, varios estudios observacionales sugieren esta asociación 16,17. Aunque parece haber una asociación epidemiológica entre inhibidores de la bomba de protones e ICD, la evidencia actual es insuficiente como para discontinuar los inhibidores de la bomba de protones como una medida de prevención de la ICD, ya que los resultados de otros estudios bien controlados, sugieren que esta asociación es el resultado de confundidores, como la gravedad de la enfermedad de base, diarrea no asociada a C. difficile y duración de la internación (Tabla 2).
Situación en Latinoamérica
Existe escasa información sobre la epidemiología de C. difficile en Latinoamérica. En 2008 se publicó el primer informe en Costa Rica y en 2010 la presencia de la cepa BI/NAP1/027 en Latinoamérica 18,19. Esta cepa se detectó luego en Chile y en México 20.
Situación en Argentina
Los datos sobre la frecuencia y la relevancia de la ICD en Argentina son escasos y heterogéneos. La mayoría de los estudios epidemiológicos de laboratorio expresan la incidencia en relación al total de muestras de materia fecal y la calculan en relación a diferentes denominadores.
Dos trabajos que evaluaron la prevalencia de C. difficile en muestras de MF de internados con sospecha de ICD describieron valores muy diferentes, 6.5% y 38.5% de positividad 21,22. En un estudio retrospectivo realizado por la Red de Bacteriología del Gobierno de la Ciudad Autónoma de Buenos Aires entre 2010 y 2015 se diagnosticó ICD en 20.9% de las muestras enviadas por sospecha, y se encontró una incidencia global de 26.5/10 000 admisiones, evidenciando una amplia variabilidad entre los centros, que fue de 0 a 33 casos/10 000 admisiones. Solo el 4.9% de los casos correspondió a pacientes de la comunidad (Rollet R, Kaufman S, Flaibani M, et al. Aspectos epidemiológicos de la infección por Clostridium difficile en Hospitales del GCABA durante el lustro 2011-2015. XXIII Congreso Latinoamericano de Microbiología. XIV Congreso Argentino de Microbiología. Rosario, septiembre 2016).
Entre 2000 y 2005 se demostró la expansión clonal de C. difficile con un marcado aumento anual en la incidencia (37 a 84/10 000 admisiones). La biología molecular mostró que las cepas A+B+, pertenecientes a los ribotipos 01 y 012 fueron desplazadas por las cepas A-B+, pertenecientes al ribotipo 017, toxinotipo VIII23 (Legaria MC, Lumelsky G, van den Berg RJ, et al. Recognition of TcdA-negative Clostridium difficile as an important cause of hospital-acquired diarrhea in a general hospital in Argentina.
ICAAC K-1273-2005 en The 45th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC). Washington, DC. USA, 16-19 de diciembre de 2005. Washington, DC., USA).
Lopardo y col. posteriormente describieron una incidencia de ICD de 6.4 por 1000 días/paciente durante la internación y de 2.6 por 1000 días/paciente a los 30 días del alta. En este trabajo se encontró el mismo ribotipo 017, toxina A-B+24. Datos más recientes describen una incidencia de diarrea por C. difficile creciente en los últimos años, con valores de 0.14 y 0.67/1000 días/paciente en 2012 y 2016, respectivamente 25. La misma tendencia se observó en pacientes con trasplante de células hematopoyéticas entre 2003 y 2017 26.
Recientemente, en dos hospitales de alta complejidad de Buenos Aires, se detectó la presencia de los genes de la toxina binaria (cdtA y cdtB) en 4/31 (13%) aislamientos, de los cuales sólo 2 correspondieron al secuenciotipo 1 de la cepa hipervirulenta NAP1/BI/027 27.
En 2017 este grupo de trabajo realizó una encuesta sobre la situación local de la ICD. Respondieron 55 centros, 65% de CABA y provincia de Buenos Aires y 35% de provincias del interior. En el 96% de los casos
completaron la encuesta médicos infectólogos socios de la Sociedad Argentina de Infectología (SADI). Este último dato demuestra que la encuesta refleja los datos de una franja no representativa de la realidad de todo el país. El 93% de los centros eran de alta complejidad, dos tercios con más de 100 camas. En relación a la capacidad de realizar diagnóstico, el 91% refirió contar con al menos un método de diagnóstico de laboratorio; el 71% utilizó detección de toxina en MF. Sin embargo, en una encuesta electrónica voluntaria realizada en 2015 por Cané et al., sólo el 40% de los encuestados respondieron tener acceso al diagnóstico de ICD (Physician knowledge of Clostridium difficile: A Latin American Survey, Cane A, European Congress of Clinical Microbiology & Infectious Diseases 6739).
Vigilancia y sitio de adquisición
Vigilancia
La vigilancia de los episodios de ICD brinda la información necesaria para conocer la frecuencia, los efectos y la gravedad de esta afección, además de ser una herramienta fundamental para evaluar los resultados de una intervención implementada para su control 28, 29. Permite caracterizar las cepas productoras de enfermedad, su virulencia y distribución 4. La falta de estandarización en las definiciones de vigilancia dificulta realizar una estimación de la importancia de la ICD en Argentina o comparar datos entre instituciones o poblaciones.
Recomendamos realizar vigilancia de ICD nosocomial en las áreas donde los datos del numerador y el denominador de las tasas puedan recolectarse con precisión.
Deben poder diferenciarse los casos nuevos de las recurrencias (ver definiciones de recurrencia en el texto).
Las unidades que asisten menores de dos años deben ser excluidas.
Sugerimos las definiciones de vigilancia utilizadas por el National Healthcare Safety Network (NHSN) 14, 30.
Caso de ICD: Diarrea o evidencia de megacolon o íleo grave y test diagnóstico de laboratorio en MF con resultado positivo o evidencia de pseudomembranas por endoscopía o histopatología.
Definición de caso según sitio de adquisición (o inicio de síntomas)
A. Hospitalario (DACD-IH)
– Diarrea por C. difficile que se presenta en un paciente hospitalizado, más allá de las 72 horas del ingreso B. De inicio en la comunidad asociado al ámbito sanitario (DACD-C-AAS):
– Diarrea por C. difficile que se presenta en un paciente que estuvo hospitalizado y fue dado de alta durante los últimos 28 días
C. Comunitario (DACD-IC):
– Diarrea por C. difficile de inicio en la comunidad en un paciente que no se encontraba hospitalizado en los 28 días previos al comienzo de los síntomas
– Diarrea de inicio en un paciente hospitalizado, durante las primeras 72 horas de internación (Fig. 1)
El numerador serán los casos de ICD, el denominador variará según se trate de casos hospitalarios, de inicio comunitario y asociado al ámbito sanitario de la comunidad. Para la ICD nosocomial el denominador es días/paciente y los resultados deben expresarse como casos cada 10 000 días/paciente. Para ICD comunitario asociado al ámbito sanitario, el denominador serán las admisiones y deben expresarse cada 100 admisiones14.
Cada institución evaluará los indicadores propios en función de sus datos previos.
Recomendaciones sobre tipo de muestra y oportunidad del diagnóstico de laboratorio
¿Cuál es la población susceptible para estudiar la presencia de infección por C. difficile?
Recomendación:
– Paciente con diarrea aguda, que no pueda ser explicada por otras condiciones/causas y asociada a factores
de riesgo (BII)
– Paciente con íleo paralítico y/o megacolon tóxico relacionado a ICD (BII)
¿Cuáles son las características de las muestras para estudiar infección por C. difficile?
Recomendación:
– Heces desligadas o líquidas que adopten la forma del recipiente (BII)
– Heces formadas o hisopado rectal solo en pacientes con íleo (BII)
– No realizar prueba de control de tratamiento (BII)
¿Es útil repetir la prueba diagnóstica?
Recomendación:
– No repetir la prueba durante el mismo episodio (dentro de los siete días de realizada) ante un resultado negativo (BII)
– No realizar prueba de control de tratamiento (BII)
Revisión de la evidencia (1-3):
La detección de C. difficile en MF no siempre indica enfermedad.
La frecuencia de colonización por C. difficile en adultos asintomáticos sin contacto reciente con el sistema de salud es < 3% y en hospitalizados es 20-50% 14, 31-34.
En menores de 3 años las tasas de colonización son altas. Aún se discute si puede existir ICD en menores de 1 año. En esta población la tasa de colonización oscila entre 50 y 70% 34. A los 2 años las tasas se mantienen entre 35 y 46% y hacia los 3 años los valores se equiparan a los de adultos no hospitalizados 32. Dada la alta tasa de colonización en niños (sobre todo entre 1 y 3 años), se debe ser más estricto aún en la selección del paciente a estudiar 32-35.
Se deberán procesar muestras de heces desligadas o líquidas 36. No se recomienda la búsqueda del microorganismo en personas asintomáticas, excepto en el contexto de una investigación epidemiológica o en el contexto de evaluación de potencial donante para trasplante de materia fecal (TMF) 14,32,37. Solo en los casos de íleo se pueden estudiar muestras obtenidas con hisopo, preferentemente de material sintético, en especial si se va a utilizar un método diagnóstico molecular.
Recolectar un volumen ≥ 5 ml de MF de reciente emisión en un recipiente estéril. Procesar la muestra en un lapso ≤ 2 h, de lo contrario conservar a 4-8 °C hasta 48 h; por períodos mayores congelar a -20/-70 °C. Esta etapa es crítica, sobre todo para la detección de toxinas, debido a que las mismas sufren proteólisis a temperatura ambiente 12.
Diferentes autores coinciden en que la repetición de las pruebas dentro de los siete días no aporta datos relevantes a la clínica 14, 38-41. Las pruebas de alta sensibilidad utilizadas como tamizaje tienen valores predictivos negativos (VPN) elevados, que permiten descartar la ICD. Por otro lado, los estudios realizados con detección de toxinas por enzimoinmunoanálisis (EIA) o con métodos moleculares, mostraron que la repetición sólo aumenta la probabilidad de diagnóstico hasta en un 2% 42, 43. Únicamente se sugiere repetir el muestreo en un lapso menor a 7 días cuando los síntomas empeoran 14.
El único “test de cura” es la resolución de la diarrea 32,39. C. difficile y sus toxinas pueden ser detectados durante períodos prolongados luego de la desaparición de los síntomas. La excreción de toxinas varía entre 13 y 24% a las dos semanas postratamiento y es de aproximadamente 6% al llegar a las 4 semanas 14, 44, 45. Asimismo, las pruebas moleculares permanecen positivas por varias semanas en más del 60% de los casos 46, 47.
¿Cuál es el rédito de los métodos diagnósticos disponibles?
Recomendación:
– Las pruebas de EIA para las toxinas A y B (EIA TOX) confirman el diagnóstico por su elevada especificidad (AI)
– No utilizar los EIA TOX como única prueba diagnóstica por su baja sensibilidad (AI)
– Realizar la prueba de detección de la enzima glutamato deshidrogenasa (GDH) como método de tamizaje para descartar ICD por su elevado VPN (AI)
– Un resultado positivo de GDH debe ser confirmado con un método de mayor especificidad (AI)
– Las pruebas de amplificación de ácidos nucleicos comerciales (real-time PCR) pueden ser utilizadas como
método de tamizaje para descartar ICD por su elevado VPN (AI)
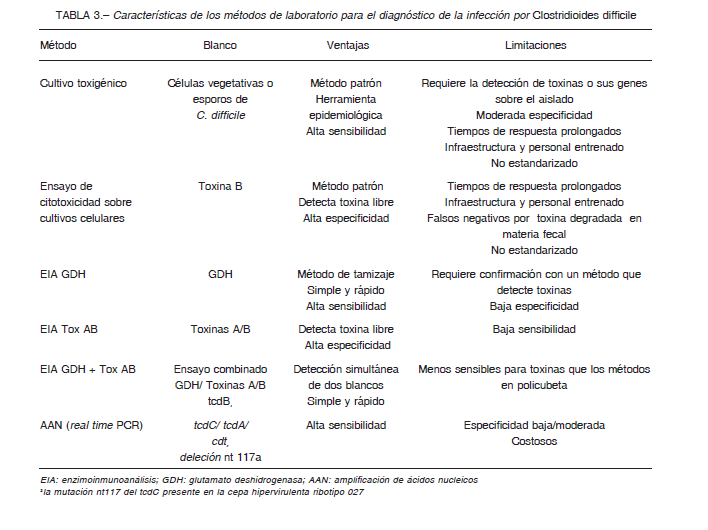
– No utilizar pruebas de amplificación de ácidos nucleicos como único ensayo para realizar el diagnóstico ya que el valor predictivo positivo (VPP) es bajo especialmente cuando la prevalencia es baja (< 10%) (BII) Revisión de la evidencia: Existen dos métodos de referencia para evaluar ensayos para el diagnóstico de la ICD que detectan distintos blancos, el ensayo de citotoxicidad celular y el cultivo toxigénico (Tabla 1)41, 45, 48. Un estudio prospectivo multicéntrico diseñado para validar clínicamente los métodos patrones, mostró que la mortalidad era significativamente mayor en el grupo con ensayo de citotoxicidad celular + frente al grupo que solo presentó el cultivo toxigénico + (16.6% vs. 9.7%, p = 0.044). Planche y col., en concordancia con otros autores, concluyeron que la detección de toxina libre en MF correlacionó mejor con la evolución clínica y los casos verdaderos de ICD 49, 50. Al igual que los métodos que detectan los genes de las toxinas de C. difficile, el cultivo toxigénico puede detectar pacientes colonizados (excretores toxigénicos) que no están cursando una infección activa 49-51. El cultivo toxigénico también es útil para efectuar estudios epidemiológicos y eventuales pruebas de sensibilidad 41. Los EIA TOX dirigidos a la detección de las toxinas A y B en MF son utilizados como alternativa al ensayo de citotoxicidad celular. En un metaanálisis que incluyó 56 trabajos, Crobach et al., observaron una especificidad de 96-98% y una sensibilidad de 79-83% de los EIA TOX comparados con el ECC 41. Cuando se utilizan equipos que detectan a las toxinas en forma independiente, los resultados A+B+ o A-B+ deben ser considerados clínicamente relevantes. Estos últimos corresponden a toxinotipos que pueden producir brotes como se demostró, incluso en nuestro país 22, 23, 45, 52. C. difficile produce GDH, una enzima muy conservada en la especie, tanto en las cepas toxigénicas como en las no toxigénicas 53. Varios estudios, incluidos dos metaanálisis, demuestran su utilidad como prueba de tamizaje por su elevada sensibilidad y VPN (94-100%) aunque carece de especificidad 22, 41, 45, 54-56. En un estudio multicéntrico prospectivo de la Subcomisión de Bacterias Anaerobias SADEBAC-AAM, se obtuvo una razón de verosimilitud negativa de 0.11 para GDH, lo cual demuestra su capacidad para descartar la enfermedad, en tanto que los EIA TOX mostraron una razón de verosimilitud positiva >10 que avala su utilidad para confirmar el resultado de la ICD, pero la sensibilidad < 60% no permite descartarla 57.
Los métodos de amplificación de ácidos nucleicos detectan genes que codifican la síntesis de las toxinas de C. difficile 58, 59-61 (Tabla 3). La guía de la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID) de 2016, las recomendaciones de la Infectious Diseases Society of America (IDSA) 2018 y numerosos trabajos concuerdan en que la sensibilidad (93-98%), especificidad (93-95%) y VPN (96-100%) de estos métodos son elevados 14, 41, 49, 58, 62, 63. No hay consenso en la bibliografía con respecto al uso de los métodos de amplificación de ácidos nucleicos como única prueba o como parte de un algoritmo diagnóstico 14, 45-49, 64-67. Si bien no hay estudios aleatorizados que demuestren los beneficios de una estrategia de diagnóstico sobre la otra, hay evidencia de que la utilización de la amplificación de ácidos nucleicos como única prueba puede conducir al sobrediagnóstico de ICD porque puede detectar a los excretores sin enfermedad 68-71. En un estudio prospectivo de más de 1000 pacientes, Polage y col. demostraron que aquellos con muestras EIA TOX-/PCR+ tuvieron síntomas más leves, menos complicaciones y menor mortalidad que aquellos que resultaron EIA TOX +/PCR+ (p < 0.001)51. En un estudio de cohorte prospectivo, Longtin et al. arribaron a conclusiones similares; los pacientes positivos para toxinas padecían más complicaciones que aquellos que solamente presentaban las pruebas de amplificación de ácidos nucleicos positivas (39% vs. 3%, p < 0.001)72. Si tenemos en cuenta poblaciones con baja prevalencia, el VPP de la amplificación de ácidos nucleicos puede ser menor al 60% 41 (Tabla 3).
¿Cuál es el algoritmo recomendado para el diagnóstico de laboratorio?
Recomendación:
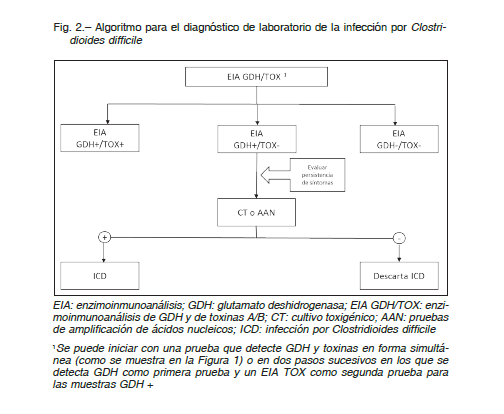
– Utilizar un algoritmo, en lugar de una única prueba, para mejorar la precisión diagnóstica (BII) (Fig. 2)
– Los algoritmos que comienzan con GDH o amplificación de ácidos nucleicos tienen elevados VPN, por lo cual un resultado negativo descarta la enfermedad (AI)
– Utilizar un algoritmo que inicie con GDH seguido, o en simultáneo, con la detección de las toxinas A/B.
Las muestras con resultados concordantes no requieren otra prueba, un resultado positivo o negativo confirma o descarta la ICD, respectivamente (BII)
– Las muestras con resultados discordantes (GDH+/EIA TOX-), se deben resolver con una tercera prueba de mayor sensibilidad como cultivo toxigénico o amplificación de ácidos nucleicos (BII)
– En caso de sospecha de ICD en sujetos con íleo paralítico, la muestra de hisopado rectal se puede procesar con métodos de alta sensibilidad, como cultivo toxigénico, amplificación de ácidos nucleicos o GDH (BII)
Revisión de la evidencia:
En un trabajo multicéntrico que incluyó 12 420 muestras, Planchey col. demostraron que la utilización de algoritmos de dos o tres pasos que incluyen la detección de toxinas permiten mejorar los VPP de las pruebas diagnósticas individuales. El algoritmo GDH/EIA TOX mejoró el VPP de este último solo, comparado con el ensayo de citotoxicidad celular (VPP 91.6% y 81.2%, respectivamente); sin embargo, la sensibilidad fue semejante (~82%)49. En concordancia, la guía europea41 y otros autores, proponen la utilización de algoritmos para el diagnóstico de ICD 48, 55, 57, 67, 71, 73, 74.
El desempeño del algoritmo propuesto dependerá de la sensibilidad del EIA TOX41, 49, 51. En nuestro medio, los métodos disponibles muestran una sensibilidad menor al 60%, por lo tanto, los resultados discordantes (GDH positivo/EIA TOX negativo) deben ser complementados con un tercer ensayo (cultivo toxigénico o amplificación de ácidos nucleicos) para alcanzar una sensibilidad aceptable (~80%), especialmente en centros con baja prevalencia (<10%) 22, 57, 67, 75 (Fig. 2).
Tratamiento
¿Existen escenarios en donde se impone iniciar tratamiento empírico ante la sospecha de infección por C. difficile?
En pacientes con alta sospecha de ICD grave y/o complicada o con factores riesgo para su desarrollo, cuando no se disponen de métodos rápidos parece oportuno iniciar tratamiento empírico hasta la confirmación microbiológica (BII).
Clasificación de las infecciones por C. difficile según su gravedad ICD leve/moderada: diarrea como único síntoma, con o sin leucocitosis y creatinina normal ICD grave: diarrea con al menos dos de los siguientes signos/síntomas:
• fiebre ≥ 38.5 °C.
• dolor y/o distensión abdominal sin criterio de ICD complicada
• ≥ 15 000 leucocitos/mm3
• creatinina sérica >1.5 mg/dll
• albúmina sérica < 3 g/dl
• lactato sérico > 2.2 mmol/l
alguna de las siguientes características:
– Íleo
– Hipotensión
– Shock séptico
– Evidencias claras o fuerte sospecha de perforación colónica, megacolon tóxico y/o peritonitis
– Admisión a UTI
– Deterioro del sensorio
– Ascitis sin otra causa
– Fallo de órgano
– Criterio endoscópico: colitis pseudomembranosa
– Criterios de imágenes: distensión colónica (> 6 cm), engrosamiento de la pared colónica, inflamación de la grasa pericolónica.
También es razonable considerar el inicio de tratamiento empírico en aquellos pacientes con alta sospecha de ICD y coexistencia de factores de riesgo para el desarrollo de formas graves/complicadas (BIII) (Tabla 4).
Revisión de la evidencia:
La decisión de instituir tratamiento empírico para la ICD se apoya en criterios clínicos (factores de riesgo, presentación, gravedad, complicaciones) y epidemiológicos.
En un estudio observacional y prospectivo, Vasa y col. estudiaron 67 pacientes con sospecha de ICD que trataron con metronidazol; sólo el 25% tuvo diagnóstico definitivo. Los autores concluyeron que debe iniciarse tratamiento empírico solo en aquellos con alto riesgo de ICD y formas graves, para evitar el uso excesivo de antibióticos76. Una revisión sistemática reciente arriba a conclusiones similares 77. Sin embargo, no existe consenso en la literatura respecto a la definición de las formas graves y complicadas, y tampoco se ha establecido el valor predictivo de los factores de riesgo, solos o combinados.

Las guías de IDSA/SHEA 2010 y 2017 y la Guía de la World Society of Emergency Surgery (WSES) 2015 recomiendan iniciar tratamiento empírico en todos los casos de sospecha fuerte de ICD con demora en el diagnóstico. El primer documento sugiere además considerar la posibilidad de ICD en pacientes hospitalizados con leucocitosis sin causa aparente, aún sin diarrea 14, 32, 78. Las Guías del American College of Gastroenterology (ACG) de 2013, recomiendan completar el tratamiento en pacientes con elevada sospecha y adecuada respuesta clínica, aún con pruebas diagnósticas negativas 39. Algunos autores hacen extensiva esta recomendación a aquellos con enfermedad inflamatoria intestinal y fuerte sospecha clínica de ICD 79.
¿En qué situaciones clínicas es razonable esperar la confirmación diagnóstica para iniciar tratamiento?
Recomendación:
En casos de diarrea leve o moderada, fuera de situación de epidemia o brote, pueden suspenderse los antibióti-cos y realizar únicamente observación clínica durante 48 h (CII)
Revisión de la evidencia:
Siempre que sea posible, se recomienda inicialmente suspender los antibióticos sospechados de inducir la ICD o sustituirlos por otros con menor efecto antianaerobio, ya que 15-33% de los pacientes con formas leves responden a esta única medida, pero deben ser controlados estrictamente en busca de signos de empeoramiento que obliguen a iniciar tratamiento antibiótico específico 14, 32, 39, 76-85.
¿Cuál es el tratamiento antibiótico recomendado para el primer episodio de infección por C. difficile
documentada?
Recomendación:
• Se recomienda vancomicina 125 mg VO c/6 h por 10 días (AI).
• Alternativa, metronidazol 500 mg c/8 h VO por 10 días, sólo en episodio inicial leve/moderado en escenarios de difícil acceso a vancomicina (BI)
• En mujeres embarazadas o en período de lactancia está contraindicado el metronidazol (BII)
• Cuando el tratamiento oral es imposible, se sugiere utilizar metronidazol parenteral (AII), preferentemente combinado con vancomicina intracolónica o por sonda nasogástrica (BIII)
Revisión de la evidencia:
El antibiótico ideal para el tratamiento de la ICD debería ser activo frente a C. difficile, alcanzar buenas concentraciones luminales colónicas, producir mínimo efecto sobre la microbiota fecal, tener pocos efectos adversos, ser bien tolerado y de bajo costo. Metronidazol y vancomicina han sido los principales antibióticos disponibles en Argentina para el tratamiento de la ICD.
Estudios aleatorizados controlados previos al año 2000 no hallaron diferencias en la resolución de la diarrea 85-94; sin embargo, estudios adicionales han demostrado la superioridad de vancomicina sobre metronidazol 94,95.
En un estudio aleatorizado controlado, Zar y col. evaluaron 150 pacientes con ICD, donde la cura clínica global fue superior en los que recibieron vancomicina (97%) comparada con metronidazol (84%, p < 0.006); pero el beneficio estaba limitado a las formas graves 87. En otro estudio controlado se comparó la eficacia de tolevamer, vancomicina y metronidazol. Tolevamer mostró menor eficacia en comparación a ambas drogas y la respuesta clínica de vancomicina fue superior a metronidazol, sin diferencias en la gravedad de los casos (81.1% vs. 72.7%, p = 0.02)88.
En una evaluación retrospectiva de 168 pacientes con ICD leve/moderada, Siegfried y col. observaron menor respuesta al tratamiento con metronidazol comparado con vancomicina (82% vs. 97%, p = 0.002)89.
En una revisión sistemática que incluyó 22 estudios y 3215 participantes, la mayoría con ICD leve a moderada, vancomicina fue más efectiva que metronidazol para alcanzar cura sintomática (79% vs. 72%, RR 0.90, 95%; IC 0.84-0.93), con una evidencia de calidad moderada. La diferencia de eficacia entre estos antibióticos no fue muy marcada, con el beneficio del menor costo de metronidazol 90.
Un metaanálisis reciente que incluyó 24 estudios aleatorizados controlados evaluó la eficacia de 13 intervenciones terapéuticas para alcanzar cura sintomática sostenida. El uso de vancomicina fue la intervención más frecuente investigada en 21 estudios aleatorizados controlados. Vancomicina mostró superioridad sobre metronidazol (RR 0.73, 95%; IC 0.56-0.95)91.
El uso de metronidazol VO debería limitarse a un episodio inicial, leve/moderado, ambulatorio. Se recomienda emplear esta droga en un solo curso de tratamiento, para evitar la neurotoxicidad por el uso prolongado o repetido 14.
No está recomendada la exposición a metronidazol durante el primer trimestre del embarazo, debido a que atraviesa la placenta y se lo ha asociado a anomalías faciales en niños expuestos. Está presente en la leche materna y se la ha encontrado en el plasma de niños cuyas madres fueron tratadas con metronidazol 39.
No existe evidencia para prolongar el tratamiento más allá de 10 días aunque las guías de IDSA sugieren de 10 a 14 días 14, 39.
¿Cuál es el tratamiento indicado en la infección por C. difficile complicada?
Recomendación:
• El tratamiento de la ICD complicada, especialmente en el paciente crítico, debe hacerse con vancomicina (500 mg c/6 h VO) + metronidazol (500 mg c/8 h IV) (AII)
• En caso de íleo o intolerancia oral, la vancomicina puede ser administrada por sonda nasogástrica o a través de enemas de retención en dosis de 500 mg diluida en 100 ml de solución salina isotónica, pinzando la sonda durante 30 minutos c/6 h, durante 10 días (BIII)
Revisión de la evidencia:
La absorción digestiva de vancomicina es escasa, por lo que alcanza altos niveles endoluminales sin
grandes efectos adversos sistémicos. El metronidazol se absorbe a nivel del tracto gastrointestinal, pero su secreción activa parietal disminuye a medida que mejoran la inflamación y la diarrea 92, 93. La vancomicina es considerada superior al metronidazol en el tratamiento de la ICD 87-96. No hay evidencia suficiente que sustente el uso de vancomicina a dosis mayores de 500 mg/día en ausencia de íleo 97.
La terapia combinada (metronidazol IV + vancomicina VO) se asoció a menor mortalidad que la monoterapia en pacientes críticos, pero tuvo más efectos adversos y no cambió la tasa de recurrencias 39, 93, 97. En los casos con ICD grave, complicada o refractaria, cuando no es posible el tratamiento VO, se recomienda terapia combinada con metronidazol IV + vancomicina a través de enemas de retención o por sonda nasogástrica 39, 93, 98.
La fidaxomicina oral tiene un espectro antimicrobiano estrecho, lo que provoca una menor disrupción en la microbiota colónica. Tiene similar eficacia que vancomicina en el tratamiento de un episodio inicial de ICD pero faltan datos en las formas graves y complicadas. Los estudios comparativos con vancomicina demostraron una menor tasa de recurrencia, aunque sólo en ICD no causada por cepas NAP1/B1/027. Debido a su alto costo solo se la reserva para no respondedores a vancomicina 99, 100. No está disponible en Argentina.
En casos de falla terapéutica o enfermedad refractaria (falta de mejoría clínica o empeoramiento de la diarrea luego de 3 días de tratamiento) o ante la aparición de signos de gravedad podría considerarse asociar tigeciclina IV 101-103.
¿Cuál es el tratamiento de las recurrencias de la infección por C. difficile?
Recomendación:
a. En caso de primera recurrencia:
– Si el primer tratamiento se efectuó con metronidazol: vancomicina VO 125 mg, 4 veces por día, durante 10 días.
Si el primer tratamiento se efectuó con vancomicina: se sugiere tratamiento con vancomicina con estrategia de tapering (BI)
– Metronidazol VO 500 mg, 3 veces por día, durante 10 días (CI)
– Vancomicina VO 500 mg, 4 veces por día, durante 10 días (CIII)
b. En caso de múltiples recurrencias:
– Vancomicina VO 125 mg 4 veces por día, durante 10 días; seguida de “pulsos” de vancomicina VO 125- 500
mg/d cada 2 o 3 días, por lo menos durante 3 semanas (BII) o, alternativamente, Tapering (estrategia de disminución gradual de vancomicina) (BII). Consiste en la administración de vancomicina 125 mg c/ 6 h VO durante 14 días, seguida de vancomicina 125 mg c/12 h VO durante 7 días; luego, 125 mg VO c/24h durante 7 días; luego, vancomicina 125 mg día por medio VO durante 7 días y, finalmente, 125 mg c/72 h VO durante 7 días, hasta completar 6 semanas de tratamiento.
Revisión de la evidencia:
Luego del tratamiento del primer episodio de ICD con vancomicina VO o metronidazol VO, la incidencia de recurrencia es similar. Dos estudios de buen diseño han informado menos recurrencias secundarias con fidaxomicina vs vancomicina 28, 29.
Un análisis retrospectivo demostró menos recurrencias con fidaxomicina comparada con vancomicina, después de la primera recurrencia y una reciente revisión sistemática con 1463 pacientes concluyó que ninguna de las alternativas es claramente superior para la cura inicial, aunque las recurrencias son menos frecuentes con fidaxomicina 99, 104. La eficacia de fidaxomicina después de múltiples recurrencias no ha sido investigada 99.
En un trabajo retrospectivo, el uso de vancomicina en dosis decrecientes resultó en menor tasa de recurrencias (31%, p = 0.01). Iguales resultados se observaron con el tratamiento en pulsos (14.3%, p = 0.02), demostrando superioridad con respecto a los tratamientos más cortos.
Esto podría ser secundario al control de la forma vegetativa mientras se restaura la microbiota 105.
¿Cómo seguir si las pruebas diagnósticas dan resultados negativos pero hay respuesta clínica al tratamiento?
Recomendación:
Si todas las pruebas de laboratorio son negativas, la decisión clínica de continuar el tratamiento de la ICD debe ser individual (BIII).
Revisión de la evidencia:
La decisión de iniciar tratamiento de la ICD es clínica.
Ocasionalmente puede estar justificado completar el tratamiento de ICD en quienes presentan factores de riesgo y/o predictores de gravedad. La decisión debe ser individualizada y sostenida en el juicio clínico, una vez descartados los diagnósticos alternativos 41, 77, 106.
¿Qué criterios se deben adoptar para hablar de respuesta terapéutica?
Recomendación:
Se considera respuesta terapéutica a la disminución del número de deposiciones diarias y/o a la mejoría de la consistencia de las mismas, de los parámetros clínicos, de laboratorio y/o de imágenes en las primeras 48-72 horas (BIII).
El tiempo a la respuesta clínica depende de la gravedad de la presentación inicial y del tratamiento instituido.
Deben realizarse controles clínicos diarios y evaluar respuesta a partir de los 3 días. Si no hay mejoría o se observa progresión del cuadro, debe considerarse modificar el tratamiento (BIII).
Revisión de la evidencia:
Aunque existen diversas formas de calificar la respuesta terapéutica, todas ellas se ajustan a criterios clínicos razonables como la resolución de la diarrea (< 3 deposiciones no formadas por día, durante 2 días consecutivos y/o mejoría de la consistencia de las deposiciones) y concomitantemente, de los otros parámetros clínicos, de laboratorio y eventualmente de las imágenes 107. La respuesta al tratamiento está sujeta a la gravedad del cuadro, a la presencia de factores de riesgo así como al tratamiento implementado. Si bien las formas leves pueden resolver con la sola suspensión de los antibióticos, las graves pueden tener un curso complicado aún con tratamiento adecuado 108, 109. La respuesta clínica al metronidazol puede ser más lenta y demorar 3 a 5 días 110-112. La recuperación de la consistencia de las heces puede demorar varias semanas 111, 112. Cerca del 25% de los pacientes con ICD desarrollan síndrome de intestino irritable, tornando más tórpida la resolución de los síntomas: la duración de la ICD por más de 7 días y un score de ansiedad aumentado fueron descriptos como factores de riesgo para esta evolución 113.
¿Qué drogas se emplean para modificar el tratamiento ante la falta de la respuesta clínica esperada?
Recomendación: En la ICD que no responde al tratamiento inicial, éste debe ser modificado:
• Cuando se inicia el tratamiento con metronidazol VO, se recomienda pasar a vancomicina (AI)
• Si se inició tratamiento con vancomicina, deben descartarse complicaciones, aumentar la dosis de vancomicina a 500 mg 4 veces/día VO, por SNG y/o enema de retención y agregar metronidazol (500 mg IV c/8 h) (BIII)
• En caso de íleo, la vancomicina puede ser administrada por vía rectal (CIII)
• En los que no responden a la terapia con vancomicina + metronidazol, una alternativa es el agregado de tigeciclina por vía IV (dosis de carga 100 mg, seguido de 50 mg 2 veces por día) (CIII)
Revisión de la evidencia:
Desde el año 2000, varios ensayos aleatorizados demostraron la superioridad de vancomicina VO sobre metronidazol para el tratamiento de la ICD, en términos de cura clínica 87, 88. En caso de íleo, vancomicina puede ser administrada por vía rectal, a pesar de que no está claro si por esta vía alcanza concentración óptima en colon izquierdo 82, 98. Algunos autores sugieren incluir metronidazol vía IV junto con vancomicina 97. Dada la buena actividad in vitro de tigeciclina frente a C. difficile y su capacidad para disminuir la producción de toxinas, algunos autores proponen el tratamiento con esta droga por vía IV 35, 114, 115.
¿Monodroga o combinación?
¿En qué situaciones?
Recomendación:
– Monodroga para las formas leves-moderadas-graves (AI)
– Terapia combinada para las formas complicadas (CIII)
Revisión de la evidencia:
En un metaanálisis que incluyó 2501 pacientes, Li y col. No encontraron diferencias entre cualquier monoterapia y el tratamiento combinado 116.
El fundamento racional para el uso de combinación de drogas estaría en que, en presencia de íleo, no se lograría una adecuada concentración de vancomicina administrada por VO en el intestino, pero sí se lograría con metronidazol IV. En un estudio retrospectivo sobre sujetos críticos, Rokas y col. Describieron una menor mortalidad entre los que recibieron terapia combinada respecto a los que recibieron monoterapia (15.9% vs. 36.4%, p = 0.03) y no hallaron diferencias en el tiempo de internación 95. Tanto en las guías europeas (ESCMID 2016), como en las de EE.UU. (IDSA 2018), la terapia combinada se sustenta en la opinión de expertos 14, 41.
¿Cuáles son las medidas adicionales de tratamiento recomendadas?
Recomendación Suspender todos los antibióticos en la medida de lo posible (AII)
• Probióticos: no existen datos suficientes para recomendarlos como prevención de ICD primaria ni para las recurrencias (no recomendación) (CIII)
• Inmunoterapia: no existen datos suficientes para recomendarla para la prevención de ICD recurrente (no recomendación) (CIII)
• Resinas de intercambio aniónico: no existen datos suficientes para recomendarlas, por lo que se desaconseja su uso (CIII)
• Agentes antiperistálticos y opiáceos: deben evitarse (BII)
• Sales de bismuto: podrían ser empleadas junto con el tratamiento antibiótico (CIII)
• Sales biliares: podrían ser una opción en la prevención y el tratamiento (CIII)
Revisión de la evidencia:
a. Probióticos: la eficacia de los probióticos, tanto para la prevención primaria de la ICD, como de las recurrencias, es controvertida. Algunos estudios y revisiones sistemáticas sostienen el uso de probióticos asociados al uso de antibióticos; demostraron reducir la diarrea asociada a antibióticos y la ICD primaria 14, 117, 118. No fueron tan contundentes, en cambio, los resultados de los estudios realizados en la prevención secundaria de ICD (recurrencias)118. Los datos surgen de estudios de pacientes hospitalizados tratados con formulaciones que incluían Lactobacillus como principal componente para prevención primaria de ICD, pero con seguimiento inferior a 4 semanas 14, 117-119. Debe destacarse que se han informado infecciones invasivas por Lactobacillus, Saccharomyces y Bacillus clausii, entre otros, aún en pacientes inmunocompetentes 120,121. Es recomendable realizar trabajos mejor diseñados, con mayor número de pacientes, en los cuales además se analicen dosis, formas de administración y duración del tratamiento en las ICD 122-126.
b. Inmunoterapia: si bien se ha usado inmunoglobulina intravenosa para tratamiento de pacientes pediátricos con hipogammaglobulinemia e ICD, su uso no tiene un rol por sí solo en el tratamiento de la ICD recurrente. Algunos autores proponen emplear inmunoglobulinas endovenosas, basándose en los datos que demuestran que los pacientes con recidivas tienen menor concentración de IgG frente a la toxina A. El grado de evidencia en relación a su uso es débil, y se limita a algunas series de casos, en los que además, suele usarse terapia estándar 14, 127, 128.
c. Resinas de intercambio aniónico (colestipol y colestiramina): estos compuestos se unen a la toxina de C. difficile y la adsorben, aunque debe mencionarse que también pueden unirse a vancomicina. Aunque diversos autores plantean su uso como coadyuvante en el tratamiento de las recurrencias no hay evidencias suficientes para sostener que estas sustancias produzcan beneficios clínicos, ni que disminuyan las recurrencias 83, 128, 129.
d. Agentes antiperistálticos y opiáceos: el enlentecimiento del tránsito provocado por los agentes antiperistálticos permitiría la penetración y proliferación bacteriana en el epitelio, lo cual favorece la aparición de megacolon tóxico y prolonga las manifestaciones tóxicas producidas por C. difficile 84, 85, 130, 131. Los casos en los que se informaron complicaciones se refieren a quienes recibieron loperamida antes de iniciar tratamiento específico contra C. difficile. No se observaron complicaciones cuando se los utilizó ya bajo tratamiento con vancomicina o metronidazol 126. Estos datos, sin embargo, han sido cuestionados 120. Tampoco se observaron complicaciones con el uso concomitante de vancomicina/metronidazol y loperamida en una población con mieloma múltiple 121.
e. Sales de bismuto: han demostrado tener efecto antibacteriano frente a C. difficile in vitro. Las guías de IDSA recomiendan utilizarlas siempre y cuando se haya iniciado el tratamiento antibiótico para C. difficile. No existen estudios que evalúen el uso concomitante de vancomicina o metronidazol y sales de bismuto 14, 85.
f. Sales biliares: los ácidos biliares han sido recientemente identificados con un rol clave en el control de la proliferación de C. difficile y el posterior desarrollo de ICD por diversas razones 132. Dadas sus características fisiológicas, las sales biliares podrían ser consideradas para prevención o tratamiento de la ICD y pueden ser empleadas junto con los antimicrobianos administrados para evitar la germinación de los esporos de C. difficile. Estudios recientes han observado que la producción de sales biliares secundarias como el ácido ursodeoxicólico inhibe la replicación de C. difficile 132, 133. El ácido ursodeoxicólico está disponible en una forma farmacéutica para el tratamiento de enfermedades de la vía biliar. Recientemente Webb y col. lo emplearon en dosis de 300 mg c/8 o 12 h en un grupo de 16 pacientes, tanto para tratamiento como para prevención de la ICD. La duración fue variable (media: 107 días (IQI: 29-235); 14/16 (87.5%) quedaron libres de recurrencias (seguimiento medio: 264 días (IQI 152-406)133. Aunque se requieren más estudios para su recomendación, los resultados parecen promisorios.
¿Cuál es el rol de otras opciones terapéuticas?
Recomendación:
Existen otras opciones de tratamiento de la ICD en situaciones especiales, a saber:
• Fidaxomicina para ICD con alto riesgo de recurrencia (BI)
• Nitazoxanida (500 mg c/12 h durante 10 días) (CI)
• Tigeciclina (50 mg c/12 h durante 10 días) como tratamiento de la ICD refractaria, cuando no pueden usarse antibióticos VO (CIII); quizás podría considerarse como medida previa al TMF (CIII).
• Rifaximina (400 mg c/8 h durante 10 días) después del tratamiento estándar, luego de múltiples recurrencias (CI)
• Anticuerpos monoclonales: con el tratamiento estándar de la ICD para evitar recurrencias (CI).
• Teicoplanina (100-200 mg c/12 h durante 10 días) como tratamiento del episodio inicial o en recurrencias (BII)
Revisión de la evidencia:
a. La fidaxomicina es un antibiótico de espectro reducido y con escasa absorción intestinal, que inhibe la esporulación y la producción de toxinas 65-67, 134. Dos estudios fase III demostraron la no inferioridad frente a vancomicina (para el endpoint cura clínica) en episodio inicial de ICD y en las recurrencias 99, 100. Además, se observó menor tasa de recurrencias con fidaxomicina (7.8% vs. 25.5%) excepto en los casos provocados por la cepa 027 99, 100, 135. Algunas series describen superioridad de fidaxomicina, o no inferioridad frente a vancomicina, en pacientes con mayor riesgo de recurrencias 136-141.
b. La nitazoxanida es un nitrotiazol de amplio espectro habitualmente utilizado como antiparasitario. Un estudio aleatorizado doble ciego comparó nitazoxanida (500 mg c/12 h VO) en dos regímenes de 7 o 10 días contra metronidazol (250 mg c/6 h VO durante 10 días). La respuesta a 7 días fue similar. Las tasas de respuesta sostenida a los 31 días fueron 58%, 66% y 74% para las ramas metronidazol, nitazoxanida 7 días y nitazoxanida 10 días, respectivamente 142. En otro estudio aleatorizado con 50 pacientes, no se halló inferioridad de nitazoxanida en comparación con vancomicina. Nitazoxanida 500 mg c/12 horas vía oral puede ser una opción de tratamiento 143.
c. Tigeciclina: no existen estudios prospectivos randomizados que evalúen su eficacia para el tratamiento de la ICD. Un estudio retrospectivo comparó la tigeciclina con la terapia doble (metronidazol y vancomicina) en formas graves. Se observó mejor respuesta clínica con tigeciclina (75.6% vs. 53.3%, p: 0.02)114. Tigeciclina es una opción para el tratamiento de la ICD refractaria, cuando no pueden usarse antibióticos por vía oral; podría ser considerada como medida previa al TMF.
d. La rifaximina es un antibiótico de amplio espectro con escasa absorción. Un estudio evaluó recurrencia en tratados con rifaximina (400 mg c/8 h durante 20 días) vs. placebo, inmediatamente después de 10 días de tratamiento estándar 144. Se observaron menores tasas de recurrencia con rifaximina durante 20 días (21% y 49%, respectivamente, p: 0.018). Pocos estudios han informado eficacia en formas recurrentes de ICD 115, 145. Rifaximina (400 mg c/8 h) podría estar indicada inmediatamente después del tratamiento estándar luego de múltiples recurrencias. Cabe destacar que se han publicado casos de ICD asociados al uso de rifaximina 146.
e. Actoxumab y bezlotoxumab son anticuerpos monoclonales humanizados contra las toxinas A y B, respectivamente 147, 148. Se demostró que el uso de anticuerpos monoclonales reduce la tasa de recurrencias comparado con placebo. En este estudio se incluyeron pacientes que recibieron terapia estándar para infección primaria o recurrente y se evaluó la tasa de recurrencia a 12 semanas. Fueron divididos en tres grupos: placebo, bezlotoxumab y bezlotoxumab más actoxumab. Se observó menor tasa de recurrencias en los grupos que recibieron bezlotoxumab que en el grupo placebo y su uso demostró ser beneficioso en términos de reducción en las recurrencias, reinternación o necesidad de tratamiento con TMF, en aquellos con ≥ 3 factores de riesgo o cepas hipervirulentas. No está disponible en Argentina 147-151.
f. Teicoplanina: probada para la ICD en la década de los 90, mostró no inferioridad en relación a la vancomicina y menor tasa de recurrencia. Fue aprobada en 2013 para uso en el tratamiento de la ICD 83. Un estudio prospectivo observacional reciente en ICD grave y complicada demostró mayor índice de cura clínica con teicoplanina oral vs vancomicina oral (90.7%s vs. 79.4%,p = 0.013), y menor tasa de recurrencia, con la ventaja adicional de la facilidad en la administración (c/12h). Las dosis empleadas varían entre 100 y 200 mg c/12 h, por al menos 10 días 90, 152-154. Otras drogas −tales como cadazolid, surotomicina, ridinilazol– están siendo evaluadas en estudios fase III cuyos resultados se aguardan para determinar su eficacia y seguridad como tratamientos alternativos. Otras terapias inmunes están en desarrollo con resultados promisorios 147.
¿Cuál es el tratamiento recomendado en pacientes que no pueden recibir el antibiótico por vía oral?
Algunos pacientes no pueden recibir tratamiento para ICD por vía oral por alteración estructural intestinal (ej.: proctosigmoidectomía, pouch ileal, etc.). Recomendación: Se recomienda el tratamiento de acuerdo a la gravedad con la administración de vancomicina en enemas, hasta la mejoría (CIII) Revisión de la evidencia: Solo el 14% de una dosis de metronidazol EV se excreta en la materia fecal; la excreción ocurre, fundamentalmente en los sectores proximales del tubo digestivo, y en el íleo y el megacolon tóxico las concentraciones en los sectores distales del colon son impredecibles98. Por otro lado, la administración de vancomicina únicamente por VO no logrará alcanzar las porciones distales del tracto gastrointestinal. Varios autores informaron la utilidad de la administración intracolónica de vancomicina. Sin embargo, estos datos no provienen de estudios de pacientes con alteraciones estructurales del tránsito intestinal sino de series retrospectivas donde la mayoría tenía imposibilidad clínica para ser tratada por VO y era tratada exitosamente por vías alternativas 18, 39, 98, 155. Las guías de tratamiento de la ICD de la Sociedad Americana de Gastroenterología proponen también el uso de vancomicina intracolónica en pacientes con alteraciones estructurales del tránsito35.
¿En qué casos se recomienda evaluación quirúrgica y en cuáles tratamiento quirúrgico?
Recomendación:
La evaluación quirúrgica está indicada en enfermedad grave-complicada con uno o más de los siguientes signos (II A):
• Inestabilidad hemodinámica
• Cambios en el estado mental
• Sepsis clínica con falla orgánica
• Lactato > 45 mg/dl
• Leucocitos > 50 000 /mm3
• Falla del tratamiento médico
• Uso de vasopresores
• Evidencias de isquemia en la colonoscopía
Revisión de la evidencia:
Si bien el tratamiento quirúrgico se impone en ciertas situaciones (megacolon tóxico y perforación colónica), también resulta razonable considerar una evaluación quirúrgica en los casos de shock, requerimiento de vasopresores, fallo multiorgánico y necesidad de asistencia respiratoria mecánica 158-161.
Debido a la elevada mortalidad de la cirugía de emergencia en las formas complicadas (35-80%), es necesario definir parámetros que acerquen la decisión quirúrgica más precozmente. Hay falta de consenso acerca de cuál es el mejor momento quirúrgico 89, 90, 92, 93. El análisis de la literatura muestra reducción de la mortalidad con cirugía temprana 95, 162.
La colectomía subtotal con conservación de recto e ileostomía es la intervención de elección. No obstante, otras estrategias quirúrgicas, como la Ileostomía en asa + lavado colónico intraoperatorio con polietilenglicol a través de ileostomía + instilación postoperatoria intracolónica anterógrada de vancomicina a través de ileostomía x 10 días + tratamiento con metronidazol IV x 10 días, aparecen como una nueva opción, en estudios comparativos con cirugía convencional96. Esta modalidad presentó menor mortalidad que los controles históricos (19% vs. 50%; p = 0.006) y permitió preservar el colon en el 93% de los casos. Se destaca que el 90% de los pacientes del estudio se encontraba en grave estado en UTI y que en el 83% la intervención fue por vía laparoscópica.
¿La conducta es diferente en población pediátrica?
Recomendación:
Las recomendaciones acerca del tratamiento de la ICD en niños se basan en experiencias en adultos, principalmente (B III)
Revisión de la evidencia:
En los niños, el diagnóstico y tratamiento de la ICD son los mismos que en adultos 98,99,164-166. No existen estudios clínicos, revisiones sistemáticas ni metaanálisis específicos en este grupo etario, que ofrezcan evidencia de alta calidad.
A los factores de riesgo reconocidos para adquirir la enfermedad por C. difficile se agregan algunos propios de este grupo etario, como el uso de pañales.
El tratamiento de la ICD demanda la suspensión de los antimicrobianos que estuviera recibiendo el paciente, siempre que sea seguro y razonable, lo que muchas veces es suficiente para mitigar o resolver la ICD.
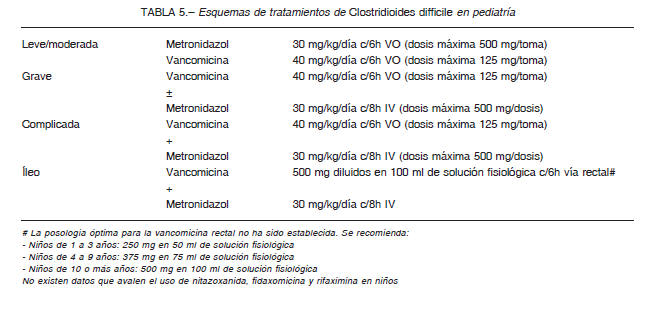
La Academia Americana de Pediatría y las guías de IDSA recomiendan el esquema descrito en la Tabla 5 14, 164.
Trasplante de microbiota fecal A pesar del tratamiento, una alta proporción de pacientes con ICD recidiva 167-169. El principal factor de riesgo es la disbiosis intestinal y su recuperación evita las recurrencias al restablecerse los mecanismos protectores 170-172. El TMF se utiliza desde hace años, y se publicó por primera vez en 1958 173, 174. En 2013, van Nood y col. publicaron un estudio aleatorizado controlado con alta eficacia; otros estudios también demostraron eficacia en ICD y en otras situaciones tales como descolonización de organismos multirresistentes 175-186.
¿Cuáles son las indicaciones del trasplante de microbiota fecal?
Recomendación:
• ICD recurrente (≥ 2 recurrencias) (AI)
• ICD refractaria (BII)
Revisión de la evidencia:
En un estudio aleatorizado controlado que incluyó pacientes con infecciones recurrentes, el TMF mostró una tasa de resolución significativamente mayor que la vancomicina (90% vs. 26% (p = 0.0001)186. Similares resultados obtuvieron van Nood y col., con una tasa de resolución del 81.3% para una única infusión de TMF y del 93.8% para infusiones múltiples vs. vancomicina sola 31% o vancomicina con lavado intestinal 23% (p = 0.001)175.
Ambos estudios incluyeron pocos sujetos y fueron discontinuados en el análisis interino por la mayor eficacia demostrada del TMF.
Similar eficacia se observó en otro estudio aleatorizado doble ciego que comparó TMF congelado vs. TMF fresco, con respuesta de 83.5% y 85.1%, respectivamente; en este estudio un pequeño grupo con ICD refractaria (10 pacientes) fue tratado con éxito, tanto con TMF congelado como con TMF fresco 184. Otros estudios, revisiones y metaanálisis observaron tasas superiores al 80-85% 188-191.
En cuanto a ICD refractarias, una revisión sistemática reciente encontró siete estudios no aleatorizados observacionales en los que se utilizó TMF, ninguno de ellos comparó TMF con otras terapias y las tasas de eficacia variaron ampliamente entre los estudios (0%-100%, tasa de resolución global 55%)189. La enfermedad refractaria a menudo se comporta como una ICD grave y el TMF parece ser un una opción terapéutica. Sin embargo, se necesitarán otros estudios para consolidar esta evidencia 175, 186, 187.
¿Qué evidencia hay sobre trasplante de microbiota fecal en inmunocomprometidos?
Recomendación:
Inmunocomprometidos graves (BIII)
Revisión de la evidencia:
En huéspedes inmunocomprometidos surge preocupación por el riesgo potencial de complicaciones del TMF.
Algunas guías recomiendan evitarlo en pacientes con trasplante de órgano sólido y en aquellos tratados con corticoides, inhibidores de calcineurina, agentes biológicos que producen linfopenia, anti-factor de necrosis tumoral, antineoplásicos, cirrosis descompensada, trasplante de células progenitoras hematopoyéticas reciente y otros estados de inmunosupresión grave por la probabilidad de un mayor riesgo de complicaciones192, 193.
En un estudio retrospectivo de 80 huéspedes inmunocomprometidos, el TMF fue exitoso en más del 80% con
15% de efectos adversos 194. Alrabaa y col. observaron 42% de recidivas 195. Otros estudios fueron exitosos en más del 80% y sin complicaciones 196-199. Se necesitan estudios adicionales para confirmar la seguridad y eficacia del TMF en esta población.
Evaluación del donante ¿Cuáles son los estudios de laboratorio recomendados?
Recomendación:
Recomendaciones de estudios CIII
Debe realizarse un cuestionario inicial sobre factores de riesgo dentro del mes previo y reinterrogar el día del TMF Laboratorio:
– Sangre:
• Hemograma, creatinina, glucemia, hepatograma, eritrosedimentación, proteína C reactiva
• VDRL cualitativa, HAV IgM, HBsAg, Anti HBc, ELISA para HCV, HIV, HTLV 1-2 (donantes de áreas endémicas),
Chagas (ELISA y hemoaglutinación)
– Materia fecal:
• C. difficile por PCR o GDH/Toxina
• Coprocultivo (Salmonella, Shigella, Campylobacter)
• Parasitológico fresco y seriado, Microsporidium, Giardia, Cryptosporidium e Isospora, Cyclospora, Strongyloides y Entamoeba
• Queda a criterio de cada centro la búsqueda de gérmenes multirresistentes
• En TMF para huéspedes inmunocomprometidos: Adenovirus, Norovirus, Rotavirus (EIA o PCR)
Revisión de la evidencia:
¿Cuáles son las recomendaciones para evaluar un potencial donante de materia fecal?
En 2016, la FDA reguló el TMF como droga de investigación.
El donante debe completar un cuestionario análogo al utilizado para los donantes de sangre. El formulario debe incluir un apartado sobre riesgo de exposición a Strongyloides y Schistosoma, enfermedades metabólicas, inflamatorias, reumatológicas y/o tumorales 186, 194, 195, 200-206 (Tabla 6).
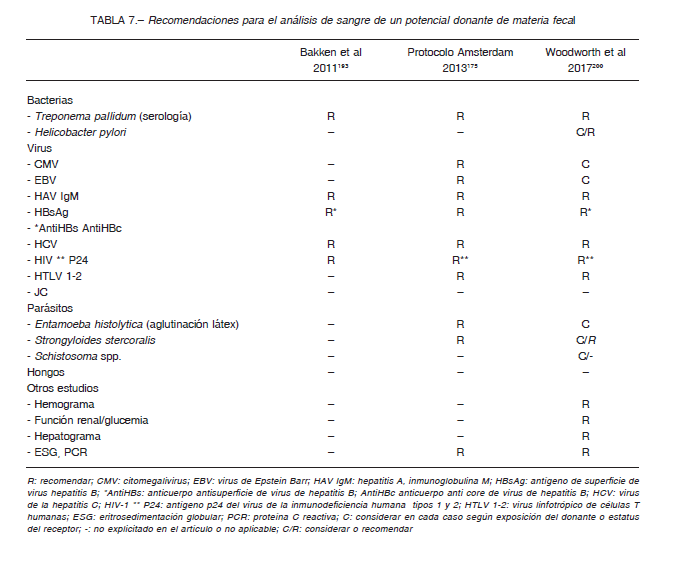
Los análisis tienen validez por 30 a 60 días y algunos autores recomiendan repetirlos a los 60 días para detectar seroconversiones 186, 200, 202, 205 (Tabla 7).
Si bien las técnicas de PCR se utilizan para la búsqueda de virus y parásitos en materia fecal, no están validadas para la detección en donantes 200, 201. En donantes para receptores inmunocomprometidos se recomienda búsqueda de CMV, virus JC, adenovirus y virus BK 200, 205 (Tabla 8). No se recomienda la búsqueda de hongos 200-201.

¿Cuáles son las contraindicaciones para ser donante?
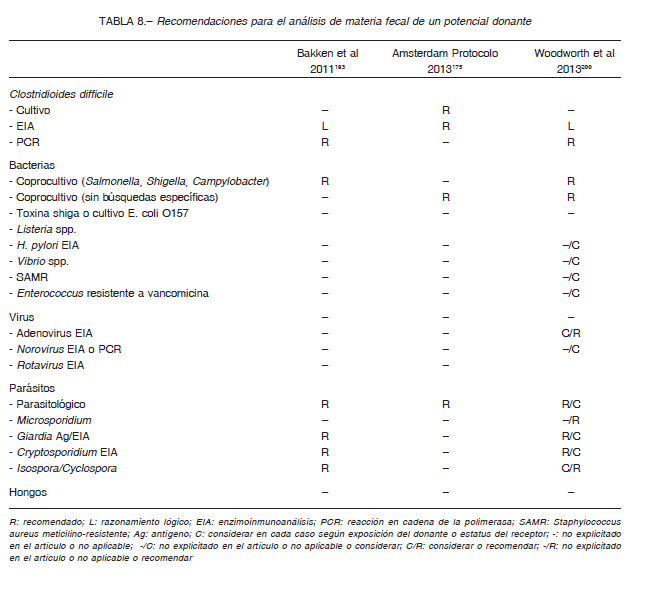
Recomendación:
Contraindicaciones: C III
• Edad <18 y >65 años (relativa)
• Infección por HIV, hepatitis B o C
• Factores de riesgo para HIV o hepatitis virales (últimos 12 meses):
• Enfermedad gastrointestinal crónica clínicamente significativa o que altere la inmunidad (diarrea crónica, enfermedad inflamatoria intestinal)
• Historia de cáncer intestinal, poliposis hereditaria, o riesgo hereditario aumentado
• Cirugía gastrointestinal mayor (bypass, colectomía, etc.)
• Uso de antibióticos (últimos 3 a 6 meses)
• Conviviente con enfermedad gastrointestinal de probable origen infeccioso
• Enfermedad autoinmune
• Atopía
• Síndrome metabólico, obesidad (índice de masa corporal > 30), desnutrición moderada-grave
• Historia de síndrome de dolor crónico (fibromialgia, fatiga crónica) o trastornos neurológicos
• Historia de tumores malignos
• Síndrome depresivo
Revisión de la evidencia:
Se contraindica ante infecciones virales activas (HIV, HBV, HCV) o en infecciones activas gastrointestinales o factores de riesgo durante el periodo de screening 186, 194, 195, 200, 201, 203-205.
Se excluye también a los potenciales dadores con presencia de Dientamoeba fragilis, Blastocystis hominis, C. difficile, Rotavirus, Strongyloides; algunos recomiendan excluir también a aquellos con riesgo de Strongyloides 186, 194, 195, 200, 203-205.
Se excluyen aquellos con desórdenes metabólicos, neurológicos, viajes a áreas de diarrea endémica (6 meses previos), antibióticos (últimos 3 a 6 meses), enfermedades gastrointestinales, huéspedes inmunocomprometidos 85, 200-202, 204, 205 (Tabla 9).
¿Cuáles serían las condiciones adecuadas de recolección, preparación y almacenamiento de la suspensión de heces del donante?
Recomendación:
• Puede utilizarse MF fresca o congelada (-80 °C) (AI)
• La MF fresca debe ser diluida, homogeneizada y filtrada (BIII)
• Debe mantenerse entre 2 y 8 °C hasta su procesamiento (BIII)
• El TMF fresco debe realizarse dentro de las 6 h de emitida la MF (BIII)
Revisión de la evidencia:
No hay estudios que comparen diferentes protocolos de preparación, pero los utilizados son consistentes entre ellos y proveen buena/moderada evidencia para la preparación. La mayoría de los datos provienen de guías internacionales 187, 201, 202, 207.
El donante debe recolectar la muestra en un contenedor limpio, transportarla en una caja hermética con un pack de hielo, dentro de la hora y la muestra debe ser procesada dentro de las 6 h. Se debe mantener refrigerada hasta su procesamiento (2 a 8°C), ya que estudios in vitro demostraron alteración de la MF luego de 8 h a temperatura ambiente 208-211. Se cree que la probabilidad del éxito de un trasplante de microbiota fecal se relaciona con la presencia de mayor cantidad de microorganismos viables en la muestra. Se recomienda utilizar ≥ 50 g de MF, ya que se observó menor eficacia con menor cantidad 212.
Debe procesarse en cabinas de seguridad biológica nivel 2, para evitar contaminación y aerosolización idealmente en un ambiente de anaerobiosis (flujo laminar con nitrógeno). Debe ser diluida con solución fisiológica (relación MF: SF de 1:3 a 1:5), homogeneizada manualmente o con mezcladora y, si se va a congelar, se debe agregar glicerol al 10% como crioprotector 202, 203, 213, 214.
El filtrado con gasas o tamiz (malla 300 micrones) reduce partículas que pueden obstruir los canales del instrumental para infusión; este proceso no es necesario en caso de colonoscopía o enemas si se utilizó mezcladora.
El volumen del sobrenadante a utilizar dependerá de la vía elegida. Por vía alta se recomienda volúmenes
≤ 100 ml, por riesgo de aspiración, por vía baja pueden utilizarse volúmenes mayores.
La MF congelada (–80 °C) es igualmente eficaz que la MF fresca y puede permanecer almacenada hasta por 2 años. Una pequeña alícuota de MF sin procesar y 2 ml de suspensión deben almacenarse bajo un código único
de donante 187, 215.
La MF almacenada a –80 °C se descongelará en un baño de agua tibia; no debe volver a congelarse ya que el microbioma se altera después de este procedimiento 216, 217.
¿Cuál es la adecuada preparación del paciente para el trasplante de microbiota fecal?
Recomendación:
• Debe administrarse vancomicina durante al menos 3 días antes del procedimiento (CIII)
• Se recomienda suspender la vancomicina 12-48 h previas, pero puede continuarse en formas refractarias o graves (CIII)
• Independientemente de la vía elegida deben administrarse 4 litros de polietilenglicol en las 24 h previas
(CIII)
• No se recomienda el uso previo de inhibidores de la bomba de protones en TMF por vía alta (D)
Revisión de la evidencia:
En la mayoría de las series, los pacientes recibieron vancomicina 2 a 5 días previos para reducir la carga de C. difficile y se recomendó suspenderla 12-48 h antes para no alterar la composición de la MF 35, 175, 190, 201, 218.
El día previo deben administrarse no menos de 4 litros de polietilenglicol, independientemente de la vía elegida (alta o baja), para reducir la carga de C. difficile. Algunos no lo recomiendan por intolerancia; sin embargo, se observó menor eficacia del TMF cuando no se administró; está contraindicada en caso de íleo 175, 186, 219.
Los inhibidores de la bomba de protones pueden provocar disbiosis intestinal, por lo que no se recomienda su administración 201, 218, 220-223.
¿Cuál es la vía de administración de preferencia del trasplante de microbiota fecal?
Recomendación:
• Tanto la vía alta (a través de sonda nasogástrica, nasoduodenal, nasoyeyunal o cápsulas) como la vía baja son eficaces (AII)
• La elección de la vía debe adecuarse a las posibilidades de cada Institución y a los aspectos clínicos del receptor (BIII)
• En los casos graves se prefiere la vía colonoscópica (CII)
• Por la vía colonoscópica, el objetivo es depositar el material en el colon derecho. Ante riesgo de complicaciones puede administrarse en el colon izquierdo (AIII)
• La ubicación correcta de la sonda nasogástrica o nasoduodenal, debe corroborarse radiológicamente (AIII)
• Se recomienda ayuno previo de 6 h (BIII)
• Mantener una posición supina de 45° durante 4 h pos TMF por vía alta (CIII)
• No se recomienda administrar volúmenes > 90 ml en menos de 5 minutos por vía alta (BIII)
• Al finalizar debe lavarse la sonda con solución fisiológica (AIII)
Revisión de la evidencia:
La ruta óptima no está definida. Un estudio comparó la eficacia del TMF fresco por sonda nasogástrica (SNG) vs colonoscopía; se observó que las tasas de cura inicial eran mayores con esta ultima 215. Otras revisiones arribaron a conclusiones similares mientras que otros estudios observaron eficacias equivalentes con ambas vías 175, 203, 223-225.
La vía alta tiene ventajas tales como no requerir sedación, la posibilidad de repetirlo y el bajo costo, pero tiene posibles complicaciones como reflujo, vómitos y riesgo de aspiración. Para disminuir el riesgo de complicaciones, se recomienda el control radiológico de la sonda, un tiempo de ayuno no menor a 6 h, un volumen bajo, el purgado de la SNG antes de retirarla y mantener al paciente a 45º durante 4 h posteriores al procedimiento 201, 226.
El TMF puede ser usado en casos de afectación del pouch ileal por C. difficile; pero es menos eficaz (60%), aunque la falta de mejoría se debería a otras causas (isquemia)227.
Las cápsulas de MF permiten la administración ambulatoria, deben administrarse alrededor de 30 cápsulas en 1 a 3 días 228-232. La eficacia es similar al TMF por vía baja229.
Una revisión sistemática observó una eficacia del 92% 233.
El TMF por enema es menos invasivo, puede realizarse ambulatoriamente, tiene bajo costo y puede repetirse fácilmente.
Alcanza únicamente el colon izquierdo y tiene menor eficacia comparado con los dos métodos anteriores.
La vía colonoscópica es recomendada en enfermedad grave. Tiene la ventaja de depositar la MF en una localización más fisiológica, evitando el efecto de la acidez gástrica y la acción enzimática intestinal; también permite observar la mucosa y tomar biopsias; pero es invasiva, tiene riesgo de perforación y sangrado, requiere sedación y es más costosa. El objetivo es depositar la MF en el colon derecho, en casos de colitis grave, con riesgo de complicaciones puede disponerse en el colon izquierdo 186, 188, 206, 234-238. En una revisión de 19 trabajos de TMF, la media de volumen infundido por esta vía fue de 450 ml (rango 100-1000 ml); se recomendó entre 200 y 500 ml 201, 223. Mantener posición de Trendelemburg posterior favorece la retención del material. El megacolon tóxico, la insuficiencia respiratoria y las coagulopatías son contraindicaciones para el TMF por esta vía.
Complicaciones
Las reacciones adversas más frecuentes son dolor abdominal, meteorismo, diarrea, fiebre y aumento transitorio de la PCR. Habitualmente estas alteraciones son autolimitadas.
En una revisión de 1089 casos, los efectos adversos más frecuentes fueron gastrointestinales (dolor y distensión abdominal, aumento de diarrea) y con mayor frecuencia de efectos adversos leves por vía alta (43.6% vs. 17.7%); los efectos adversos graves fueron más frecuentes por vía baja (6.1% vs. 2%). Una muerte fue atribuida al TMF 239.
A largo plazo, hay informes de beneficios en púrpura trombocitopénica y esclerosis múltiple; y desarrollo de obesidad y autoinmunidad 240. Se necesitan más estudios sobre efectos a largo plazo 240, 241. Proponemos la creación de una base de datos prospectiva nacional de seguimiento a largo plazo de pacientes que van a someterse a un TMF.
Cabe destacar que aún no se ha regulado en nuestro país el procedimiento del TMF.
Infecciones por C. difficile en poblaciones especiales
Para la presente revisión fueron definidos como poblaciones especiales los siguientes grupos de pacientes:
• Infectados con el virus de la inmunodeficiencia humana adquirida (HIV/Sida)
• Trasplantados con células hematopoyéticas
• Trasplantados con órganos sólidos
• Bajo terapias con moduladores de la respuesta biológica
• Con tumores sólidos y oncohematológicos
• Con enfermedad inflamatoria intestinal (colitis ulcerosa, enfermedad de Crohn)
• Con otras causas de inmunosupresión.
Generalidades
¿Hay diferencias respecto de factores de riesgo, incidencia, prevalencia y mortalidad en poblaciones especiales respecto de la población general?
Recomendación:
Hay evidencias de mayor incidencia y morbimortalidad en la mayoría de los subgrupos de poblaciones especiales (BII)
Revisión de la evidencia:
El subgrupo de poblaciones especiales presenta aumento en incidencia y morbimortalidad de ICD.
La inmunosupresión es un factor de riesgo para el desarrollo de ICD. Se postula que los huéspedes inmunocomprometidos fallan en presentar una respuesta inmune adecuada frente a la toxina de C. difficile 242. La inmunidad mediada por linfocitos B, particularmente la respuesta de tipo IgG frente a la toxina A es crucial para contener la ICD 243. Ciertas terapias inmunosupresoras usadas en pacientes con EII (en especial análogos de las purinas, metotrexate y corticoides) se asociaron a la aparición de ICD 242.
En cuanto a la quimioterapia, algunas drogas específicas, como los agentes basados en platino, taxanos e
inhibidores de la ADN-topoisomerasa se han asociado a mayor riesgo de ICD. Sin embargo, esta diferencia entre los agentes no se documenta en todos los estudios.
De todas maneras, continúan teniendo una fuerte influencia los factores habituales como la edad, la
exposición a antimicrobianos de amplio espectro o la hospitalización prolongada, muy frecuentes en esta población 243-247. Entonces, los factores de riesgo asociados a mayor incidencia de ICD en esta población son: uso previo de antibióticos por disrupción de flora endógena; contaminación ambiental en ámbito hospitalario, tratamientos utilizados en huéspedes inmunocomprometidos que también se asocian a diarrea (por ej. mucositis por quimioterapia), y tiempo prolongado de estadía hospitalaria, en cuyo caso la mortalidad puede llegar a 30% 244.
En pacientes con trasplante de órgano sólido la incidencia de ICD es variable según el tipo de órgano: es menor en trasplante renal (0.77% –11.3%) y mayor en trasplante hepático y pulmonar (0.63% –19%). Pero en promedio es 5 veces mayor que en la población general, y los factores de riesgo son comunes a otras poblaciones de HIC 243-247.
También se informaron como factores de riesgo el uso de inhibidores de la bomba de protones, el uso de dispositivos invasivos (sonda nasogástrica, tubo endotraqueal), uremia y antecedentes de cirugía gastrointestinal 245.
En un metaanálisis de 30 estudios publicados entre 1991 y 2014, sobre una población total de 21 683 pacientes sometidos a trasplante de órganos sólido, la prevalencia total de ICD fue 7.4 % y ascendió a 12.7% cuando el trasplante era multiorgánico 245. El estudio Nation Wide Inpatient Sample Database realizado en 2009 informó una incidencia de ICD de 2.7% en 49 198 trasplantes de órganos sólidos 248.
En el estudio de Donnelly y col., los pacientes con trasplante de órgano sólido e ICD tuvieron mayor tasa de readmisiones (44 vs. 29%), mayor frecuencia de complicaciones del injerto (42.9 vs. 24.5%) y mayor incidencia de infección por CMV (6 vs 2.4%), así como mayor frecuencia de estadía hospitalaria prolongada (25 vs. 7%) con respecto a trasplante de órganos sólidos sin ICD. La mortalidad global fue 6.8% en este estudio 249.
En pacientes con trasplante renal, el riesgo de desarrollar ICD fue tres veces mayor en pacientes colonizados por Enterococcus resistentes a vancomicina, seis veces en receptores de donantes con alto riesgo de ICD y hasta siete veces con el uso previo de antibióticos 243.
En pacientes con HIV-Sida las hospitalizaciones frecuentes y la exposición a antimicrobianos son predictores independientes de la adquisición de ICD 250. El riesgo de ICD fue mayor con recuento de CD4 < 200 células/mm3 y aún mayor con < 50 células/mm3, con incidencia de 4.1 casos por 1000 pacientes/año, disminuyendo a medida que mejoraba el recuento de CD4 en la era TARV 250.
Se ha demostrado que la infección por HIV altera la microbiota fecal, la función inmunitaria de la mucosa
intestinal y la inmunidad humoral. Estos factores facilitan el desarrollo de ICD en estos pacientes 251. C. difficile es la principal causa de diarrea bacteriana en HIV 252, 253-256.
Una revisión reciente comunica una incidencia de 7.1 a 8.3 por 1000 pacientes/año evaluada en estudios con diagnóstico de ICD basado en ensayos de citotoxicidad celular o pruebas de amplificación de ácidos nucleicos 247.
En 2016, el estudio retrospectivo de Imlay y col. demostró los mismos factores de riesgo en esta población que en otras poblaciones de pacientes inmunocomprometidos 250.
En cáncer, a los mencionados factores, se suman los antecedentes de infecciones recurrentes, nutrición
enteral y/o parenteral, la presencia de neutropenia y el efecto inmunosupresor de los tratamientos indicados (quimioterapia, radioterapia, etc.)244.
En pacientes oncohematológicos la incidencia de ICD es mayor (6 a 33%) y ocurre con mayor frecuencia dentro de los 30 días del trasplante de células hematopoyéticas.
Se relaciona a enfermedad injerto contra huésped gastrointestinal, mucositis y hospitalización prolongada 247.
En esta población, los factores estimulantes de colonias, las cefalosporinas de 3ra y 4ta generación, la diabetes, y encontrarse en el período pre-injerto fueron factores asociados a la ICD 246, 257. La incidencia total informada fue cercana al 10%, con mayor afectación en trasplantes alogénicos 257-261.
La colonización por Enterococcus resistentes a vancomicina fue descripta como nuevo factor de riesgo para
ICD 258.
En pacientes con enfermedad inflamatoria intestinal, los factores de riesgo particulares son la disminución de la diversidad de la microbiota y la presencia de especies bacterianas proinflamatorias. El uso previo de antibióticos está discutido como factor de riesgo en enfermedad inflamatoria intestinal. Algunos autores mencionan el uso de antiinflamatorios no esteroideos, corticoides, inmunomoduladores e inhibidores de la bomba de protones como factores de riesgo, pero no existen fuertes evidencias que lo confirmen.
Los pacientes que han sido sometidos a una colectomía con anastomosis íleoanal con pouch aún están en riesgo de ICD, presentándose en estos casos como pouchitis. Se ha comunicado que la incidencia en este grupo puede ser de hasta 34%. Se demostró que la enfermedad inflamatoria intestinal en sí misma es un factor de riesgo independiente tanto en población adulta como pediátrica 262-264. En cuanto a la quimioterapia, algunas drogas específicas, como los agentes basados en platino, taxanos e inhibidores de la ADN-topoisomerasa se han asociado a mayor riesgo de ICD. Sin embargo, esta diferencia entre los agentes no se documenta en todos los estudios.
¿El cuadro clínico es diferente en poblaciones especiales respecto de la población general?
Recomendación:
No hay evidencia de diferencia en el cuadro clínico aunque sí hay mayor incidencia de complicaciones y
recurrencias (BII)
Revisión de la evidencia:
En todos los subgrupos de poblaciones especiales, la ICD se define y clasifica de igual manera que en la
población general. La gravedad, las complicaciones y recurrencias del cuadro clínico son mayores en este grupo respecto de la población general 14, 246, 248.
En un metaanálisis de 30 estudios publicados entre 1991 y 2014, sobre una población total de 21 683 pacientes con trasplante de órganos sólidos, la recurrencia fue superior a la de la población general, la prevalencia de colitis grave fue 5.3 veces mayor y la prevalencia de colectomía por colitis grave fue 2.7 veces mayor respecto de la población general246.
Sobre 49 198 casos con trasplante de órgano sólido, la ICD demostró mortalidad casi 3 veces mayor, estadía más prolongada, costos más elevados, más complicaciones del injerto y mayor necesidad de colectomía, versus la población sin trasplante 248.
La incidencia de ICD en trasplante de órgano sólido varía según el órgano trasplantado: es menor en trasplante renal (0.77% a 11.3%), intermedia en trasplante cardíaco (1.23% a 8%) y la mayor incidencia está comunicada en trasplante hepático y pulmonar (0.63%-19% y 1.93-22.9%, respectivamente)253.
Independientemente del órgano trasplantado, la incidencia de ICD en trasplante de órgano sólido es menor
que la descripta en pacientes oncohematológicos, pero mayor que en la población general.
En la población de receptores de trasplante de células hematopoyéticas, la presencia de enfermedad injerto contra huésped intestinal se asocia a mayor incidencia de ICD y recurrencia, incluso cuando la enfermedad injerto contra huésped aparece con posterioridad a la ICD 248. Si bien la presencia de ICD en
enfermedad oncohematológica aumenta el riesgo de bacteriemia, insuficiencia renal aguda, requerimiento
de nutrición parenteral y admisión a la unidad de cuidados intensivos, no está claro que el pronóstico y la tasa de complicaciones atribuibles a la ICD difiera de otras poblaciones 14, 248.
En la enfermedad inflamatoria intestinal, especialmente colitis ulcerosa, el riesgo de recurrencia y de
morbimortalidad es mayor. El riesgo de ICD dentro de los 5 años de diagnóstico de colitis ulcerosa puede superar el 3% y el pronóstico es peor por el riesgo incrementado de colectomía, complicaciones posoperatorias y muerte14. Los pacientes con enfermedad inflamatoria intestinal presentan un 33% más de recurrencias que la población general.
¿Los algoritmos diagnósticos son diferentes en las poblaciones especiales?
Recomendación:
No hay evidencias que avalen algoritmos diferentes para el diagnóstico en las poblaciones especiales (BII).
Revisión de la evidencia:
En pacientes con diarrea no relacionada claramente a su enfermedad de base (ej.: enfermedad intestinal inflamatoria, alimentación enteral, quimioterapia o laxantes), debe indicarse un test diagnóstico para ICD, al igual que si los síntomas persisten luego de finalizar terapias que pudieron provocar la diarrea (ej.: laxantes, inmunosupresores).
La sensibilidad de los EIA TOX para el diagnóstico de ICD en la población inmunocomprometida es baja al igual que en la población general. En un estudio realizado por Erb y col., sobre 12 000 muestras enviadas al laboratorio con presunción de ICD, detectaron por EIA TOX solo un 57% con criterios de ICD. Los factores predictores de toxina negativa con cultivo toxigénico positivo fueron el uso de corticoides en altas dosis, leucopenia y formas leves de ICD 265.
En pacientes con enfermedad inflamatoria intestinal, en quienes la clínica de reactivación de la misma puede interpretarse como ICD, se recomienda tener en cuenta el hallazgo endoscópico como elemento adicional, permitiendo obtener muestras para diagnóstico. Las pseudomembranas no siempre se visualizan en este grupo y el envío de materia fecal para el estudio de C. difficile es la regla para diferenciar reactivación de ICD 242.
Se recomienda búsqueda de C. difficile en todos los episodios de exacerbación de enfermedad inflamatoria
intestinal que se presenten con diarrea 266.
El algoritmo diagnóstico no varía respecto al de la población general, remitirse al capítulo de Diagnóstico
del presente documento.
Las poblaciones especiales ¿deben recibir el mismo tratamiento que los inmunocompetentes?
Recomendación:
No hay evidencia que avale el uso en la población inmunosuprimida de esquemas de tratamiento distintos de los empleados en la población inmunocompetente (BII).
Revisión de la evidencia:
El tratamiento de la ICD en el huésped inmunocomprometido no difiere del recomendado en la población
inmunocompetente.
En cuanto al metronidazol, si bien está informado que la tasa de resistencia in vitro en la población HIV positiva es ligeramente mayor que la de la población HIV negativa, esto no se traduce en una disminución de la respuesta clínica 253. Además, en nuestro país no se registra resistencia de C. difficile a metronidazol (Rollet R, comunicación personal).
Se recomienda el monitoreo de los niveles en plasma de tacrolimus y sirolimus durante el tratamiento de la ICD con metronidazol, dado que puede inhibir el metabolismo de las drogas mencionadas. La intensidad de esta interacción es baja 192.
Con respecto al empleo de fidaxomicina en trasplante de órgano sólido: si bien se demostró en la población general menor tasa de recurrencia de ICD comparado con vancomicina, no hay por el momento estudios que avalen su uso en la población receptora de TOS 192.
Si bien una serie de casos encontró asociación entre la presencia de hipogammaglobulinemia y el desarrollo de ICD en los que recibieron trasplante cardíaco, no hay evidencia que avale el empleo rutinario de gammaglobulina como parte de la estrategia de prevención y/o tratamiento de la ICD en esta población 267.
Aunque el empleo de probióticos ha demostrado cierto beneficio en la prevención de la ICD en población inmunocompetente, la falta de evidencia de su eficacia en la prevención de recurrencias de la ICD y el potencial riesgo de infecciones invasivas graves asociadas a su empleo – descriptas incluso en población inmunocompetente – hacen no recomendable su empleo en forma rutinaria en población inmunosuprimida39.
Respecto de la necesidad de modificar el esquema de inmunosupresión en presencia de ICD, no hay evidencia
que justifique esta modificación.
Hay cierta evidencia que avala posponer –en la medida de lo posible– el inicio o el aumento de la dosis de glucocorticoides dentro de las primeras 72 horas de diagnosticado el episodio de ICD 268.
Hay cierta evidencia que sugiere que el antecedente de exposición a glucocorticoides empeora el pronóstico
en pacientes con ICD, por lo que sería razonable evitar o retrasar el uso de estas drogas en esta población 268.
Control de infecciones
¿Cuándo se deben implementar las medidas de aislamiento para infecciones por C. difficile?
Recomendación:
A todo paciente con diarrea clínicamente significativa y sospecha de ICD se le indicará aislamiento de contacto y se le solicitará muestra de materia fecal para descartar ICD (AII)
¿Dónde se debe ubicar al paciente?
Recomendación:
• El paciente deberá ser ubicado en habitación individual con baño privado, especialmente aquel con incontinencia fecal (AII)
. En caso de no disponer de habitación individual, se recomienda aislamiento de cohorte (IB)
• Si se aplica aislamiento de cohorte, se recomienda evitar incluir pacientes infectados con otros organismos resistentes (AII)
• Colocar un cartel que indique que se encuentra en aislamiento de contacto (AII)
Recomendación:
• El personal de salud debe utilizar guantes no estériles (AI) y camisolín (AII) para el contacto con el paciente y el entorno
• Los guantes deben ser colocados antes del ingreso y retirados antes de salir de la habitación y proceder con la higiene de manos (AII)
• Los guantes deberán ser cambiados inmediatamente después del contacto con superficies o materiales contaminados con materia fecal o antes de pasar de una intervención sucia a una limpia (baño, cuidado del catéter).
Recomendación de buena práctica
• El personal de salud debe utilizar camisolín al entrar en la habitación o cubículo y retirarlo antes de abandonarla.
Recomendación de buena práctica
• Utilizar camisolín de uso único. El mismo podrá ser descartable o de tela. Luego de su uso, colocar el camisolín de tela en la bolsa de ropa o el camisolín descartable en la bolsa de residuos correspondiente
¿Qué consideraciones debemos tener con los equipos e instrumentos para el cuidado del paciente?
Recomendación:
• Los elementos para el cuidado del paciente y de limpieza de superficies deben ser de uso individual (termómetro, estetoscopio, balde, rejilla) (AII)
• Si el equipamiento se comparte entre pacientes, debe ser limpiado y desinfectado con un desinfectante esporicida compatible con el equipamiento, inmediatamente después de utilizarlo (AII)
• Estandarizar quién limpia y cómo se limpia cada pieza del equipo compartido. Recomendación de buena práctica
¿Por cuánto tiempo se debe continuar el aislamiento?
Recomendación:
• Continuar el aislamiento de contacto al menos 48 h luego de la resolución de la diarrea (CIII)
• Prolongar las precauciones de contacto hasta el alta, si las tasas de ICD son elevadas a pesar de la implementación de las estrategias de control de infecciones (CIII)
Revisión de la evidencia 1-5:
Desde el inicio de la diarrea el paciente debe ser colocado en precauciones de contacto ya que es el período de mayor eliminación de esporas 269. Estas pueden sobrevivir por meses en el hospital incluyendo superficies, equipo y artículos del paciente, con la posibilidad de transmisión a través del personal de salud o el ambiente 270, 271. Con la mejoría clínica del paciente disminuye la eliminación de esporas pero puede continuar hasta alrededor de 4 semanas.
La habitación individual favorece la adherencia a las precauciones de contacto y disminuye el riesgo de transmisión 272.
El uso de guantes ha demostrado disminuir la tasa de ICD en conjunto con otras medidas y el camisolín
disminuye la contaminación del uniforme del personal de salud y su uso reduce la transmisión de gérmenes
multirresistentes 273-275.
¿Qué medidas debe adoptar el paciente y/o la familia?
Recomendación:
• Recomendar la higiene de manos frecuente y el baño diario para reducir la cantidad de esporas de la piel del paciente. Recomendación de buena práctica
• Educar a la familia sobre la importancia de la higiene de manos principalmente luego de tocar al paciente y al salir del entorno. Recomendación de buena práctica
• No se recomienda a la familia el uso de equipo de protección personal (BII)
¿Cuál es el método de higiene de manos recomendado?
Recomendación:
• En escenarios endémicos realizar higiene de manos con agua y jabón o productos a base de alcohol antes y
después del contacto con el paciente y luego de quitarse los guantes (AII)
• Durante brotes o ICD hiperendémico (tasa elevada sostenida) realizar higiene de manos con agua y jabón
como método preferido antes de salir de la habitación (CIII)
• Luego del contacto con materia fecal o zonas altamente contaminadas (ej. periné) realizar higiene de manos con agua y jabón al retirar los guantes.
Recomendación de buena práctica
Revisión de la evidencia:
La higiene de manos es unas de las medidas más efectivas para prevenir la transmisión de C. difficile.
Las esporas son altamente resistentes a las soluciones basadas en alcohol, con la posibilidad teórica de incrementar las ICD, sin embargo, esta asociación no se ha demostrado en estudios clínicos276.
Diversos estudios han evaluado diferentes métodos de higiene de manos en la reducción de esporas de C.
difficile, y concluyeron que la higiene de manos con agua y jabón fue la más efectiva en disminuirlas277, 278.
¿Cuáles son las estrategias de limpieza hospitalaria a implementar en habitaciones de pacientes con infección por C. difficile?
Recomendación:
• Durante brotes, en entornos hiperendémicos o si hay evidencia de casos repetidos de ICD en la misma
habitación, se recomienda realizar la desinfección diaria y terminal con productos clorados en todas las habitaciones (CIII)
• Implementar auditorías del proceso de limpieza y desinfección, e informar los resultados al personal de
salud. Recomendación de buena práctica • Otras estrategias de desinfección terminal automatizada, como luz ultravioleta C (UV-C) o peróxido de hidrógeno: considerarlas en casos donde la incidencia de C. difficile permanece alta luego de haber implementado el resto de las intervenciones de control de infecciones (sin recomendación – falta de evidencia).
Revisión de la evidencia:
Las esporas de C. difficile son resistentes a los desinfectantes habitualmente utilizados en las instituciones sanitarias, como los amonios cuaternarios. Los productos clorados son los adecuados para su eliminación279-284.
Las tasas de contaminación del medioambiente hospitalario con esporas varían entre el 9.7% y el 58%, siendo mayor en las habitaciones de los sintomáticos que en las de portadores asintomáticos 279, 280, 282, 285.
La transmisión indirecta de C. difficile a través de las superficies contaminadas ha sido demostrada en diversos estudios: los que ingresan en habitaciones donde previamente se encontraban pacientes colonizados por C. difficile, tienen un riesgo mayor de infección o colonización 279,282, 285.
Las estrategias de limpieza que incluyen productos clorados han demostrado el mayor beneficio en la disminución de las tasas de ICD. Si bien existen diversas publicaciones que evalúan estrategias de desinfección con productos alternativos como el peróxido de hidrógeno y la luz UV-C, con una calidad de evidencia heterogénea, la mayoría de ellos incluyen una desinfección previa con productos clorados 277, 283-287.
Las estrategias de desinfección diaria y terminal con productos clorados controladas mediante auditorías
y posterior informe de resultados al equipo de salud, conduce a una disminución en las tasas de infecciones
286-291.
Cabe destacar que ninguna de las estrategias de desinfección antes mencionadas reemplaza la limpieza
meticulosa previa del ambiente y las superficies del entorno del paciente.
¿Cuál es el rol de los programas de uso responsable de antimicrobianos para reducir la infección por C.
difficile?
Recomendación:
• Implementar un programa de uso responsable de antimicrobianos para optimizar la indicación y administración de antibióticos. Recomendación de buena práctica
• Seleccionar los tratamientos antibióticos de menor espectro y menor duración posible para reducir el riesgo de ICD (AII)
• Considerar la restricción de fluoroquinolonas, clindamicina y cefalosporinas (excepto para la profilaxis antibiótica quirúrgica) (AII)
Revisión de la evidencia:
Los programas de uso responsable de antimicrobianos pueden optimizar el tratamiento de infecciones y el uso de antibióticos, así como lograr una reducción en las tasas hospitalarias de ICD y la resistencia a los antibióticos 292-299.
Baur y col. realizaron una revisión sistemática del efecto de los programas de uso responsable de antimicrobianos en la incidencia de infección y colonización por bacterias resistentes; observaron una disminución en bacterias gram negativas resistentes a múltiples fármacos (reducción del 51%, IR 0.49, IC 95% 0.35-0.68; p < 0.0001), así como de la incidencia de ICD (32%; 0.68, 0.53-0.88; p = 0.0029)297.
Los programas de uso responsable de antimicrobianos fueron más efectivos cuando se implementaron con medidas de control de infecciones (IR 0.69, 0.54-0.88; p = 0.0030), especialmente con intervenciones que incluyeron la adherencia a higiene de manos (0.34, 0.21-0.54; p < 0.0001), que cuando se implementaron solos297.
En Argentina, los programas de uso responsable de antimicrobianos no son obligatorios y depende de la voluntad y recursos de cada Institución para su implementación.
Por este motivo, se recomienda su implementación para reducir los eventos adversos asociados al uso de
antimicrobianos, incluida la ICD.
¿Cómo controlar un brote por C. difficile y cuáles son las medidas preventivas?
Recomendación:
• Implementar un plan de acción basado en el refuerzo de las medidas preventivas mencionadas previamente
con nivel de evidencia científica para prevención de C. difficile. Recomendación de buena práctica
Revisión de la evidencia:
Se define como brote al aumento real de casos por encima del nivel esperado y como hiperendemia a la persistencia de una tasa de ICD elevada, comparada a tasas previas o de otras instituciones con características similares 4, 271. Los brotes de ICD se presentan con un aumento de su frecuencia, mayor gravedad y mortalidad de alrededor del 5-10% 4, 271.
En varios países se ha vinculado estos brotes con la cepa «hipervirulenta»¨ NAP1/BI/027 cuya presencia se ha confirmado en la Argentina (Ducatenzeiler et al. Clostridium difficile NAP1/BI/027 en Argentina. Hospital Italiano de Buenos Aires, SADI 2015)300.
Confirmado el aumento de casos, es necesario comunicarlo a las autoridades de la institución para instaurar un plan de acción. Este plan debe proponer medidas preventivas para C. difficile basadas en la evidencia científica e implica realizar vigilancia en tiempo real, auditorías para identificar situaciones de riesgo y monitoreo del nivel de adherencia de higiene de manos, aislamiento de contacto e higiene ambiental (Tabla 10)301-303. Finalmente, es preciso realizar la devolución de datos y hallazgos al nivel de liderazgo y al personal involucrado. Las intervenciones que han demostrado ser más efectivas para el control de estas situaciones siempre incluyen como medida preventiva la higiene ambiental con productos clorados, que logra una reducción entre el 45-85% de casos de ICD 302.
Adenda
Epidemiología
En un metaanálisis reciente se revisó la prevalencia e incidencia de ICD en países en desarrollo de 4 regiones: África, Medio Oriente, Asia, Latinoamérica y China. Se encontró una prevalencia de C. difficile del 15% entre pacientes con diarrea que incluía pacientes internados y de la comunidad306. La incidencia según los 17 estudios que tenían esta información fue 8.5 por 10 000 pacientes/día (95% CI 5.83-12.46). No hubo una diferencia significativa entre las regiones estudiadas.
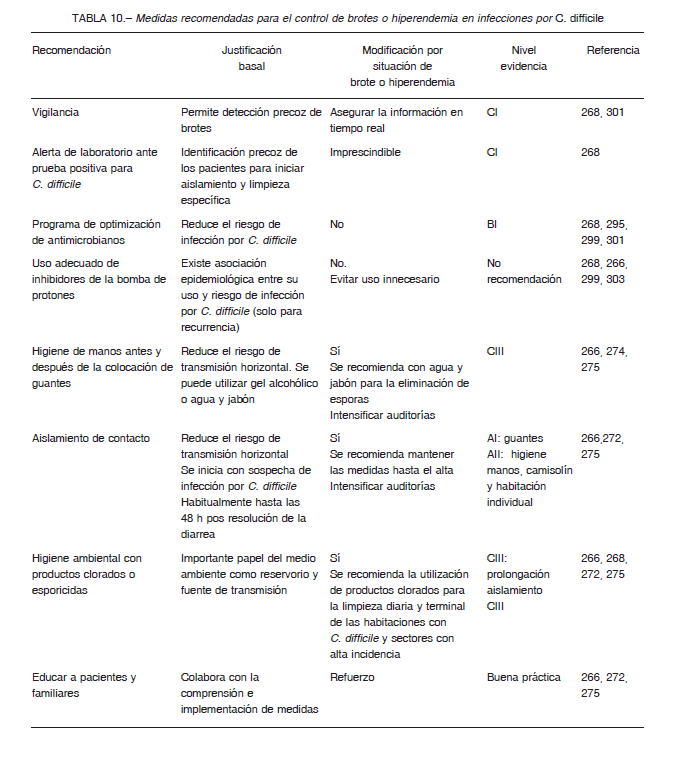
En una revisión de las publicaciones que incluyeron identificación de ribotipos prevalentes, se mostró que la cepa hipervirulenta NAP1/027 no ha sido aislada en Brasil a la fecha 307. Entre los ribotipos circulantes más prevalentes se encontraron el 014, 043, 046, 106,132-136.
La diarrea por C. difficile se identificó como la principal causa de diarrea en pacientes internados o bajo tratamiento antibiótico.
Profilaxis
Actualmente, un dilema común para la práctica clínica es si es conveniente o no la administración de profilaxis secundaria con vancomicina oral a aquellos que, una vez terminado el tratamiento por un episodio de ICD, deben continuar o reiniciar antibióticos por otro motivo. Las guías americanas IDSA/SHEA 2018 establecen que, aunque no existen trabajos prospectivos que demuestren el beneficio de su uso, vancomicina a dosis de 125 mg c/12-24 h o fidaxomicina 200 mg/d podrían ser consideradas en esta situación.
Existen por lo menos cuatro trabajos publicados entre 2016 y 2019 que tratan este tema; todos ellos son retrospectivos, y la dosis y la duración de la profilaxis son dispares.
El estudio de Carignan (retrospectivo, en un centro con 557 pacientes) encontró beneficio en la profilaxis con vancomicina oral en quienes el episodio de ICD fue una recurrencia y no el episodio inicial308. También se demostró beneficio en mayores de 75 años y en los que recibieron profilaxis con vancomicina oral más del 50% del tiempo que recibieron otros antibióticos.
El estudio de Caroff (retrospectivo, dos centros con 760 pacientes) por el contrario, demostró beneficio de la profilaxis con vancomicina oral, siguiendo al primer episodio de ICD: 8.5% vs. 10.48% = RR: 0.42 y no lo demostró siguiendo a una recurrencia: 7.8 vs. 10.9% = RR: 1.19 309.
Un tercer trabajo de Van Hise (retrospectivo, un centro con 71 pacientes) evidenció recurrencia de 4% en el grupo que recibió profilaxis con vancomicina oral vs. 27% en el grupo control: p = < 0.001, NNT: 5 310.
Por último, el trabajo de Splinter (retrospectivo, un centro) fue realizado en pacientes con trasplante renal 311.
Se administraron 36 cursos de antibióticos a 29 pacientes con trasplante renal, 12 (33%) recibieron profilaxis con vancomicina oral, y 24 no lo hicieron (grupo control). No se registró ningún episodio en el grupo profilaxis con vancomicina oral vs. 2 en el grupo control (0/12 vs. 2/24).
La diferencia no resultó significativa.
Si bien los datos disponibles en la actualidad con respecto al beneficio de la profilaxis con vancomicina oral luego del primer episodio o de las recurrencias de ICD no son concluyentes, parece una estrategia interesante para ser evaluada en estudios prospectivos.
Trasplante de microbiota fecal
Existe nueva información que demuestra que el TMF es superior al tratamiento con vancomicina y fidaxomicina en formas recurrentes de C. difficile312.
Es importante destacar que recientemente se han publicado experiencias con TMF en hepatitis alcohólica y en pacientes con trasplante de células hematopoyéticas para tratar C. difficile o para prevenir enfermedad de injerto vs. huésped 313, 314.
Un alerta de la FDA del 15 de junio de 2019 comunicó que dos adultos inmunocomprometidos que recibieron TMF de un mismo donante desarrollaron infecciones invasivas causadas por Escherichia coli productora de betalactamasa de espectro extendido, a raíz de lo cual uno de los individuos falleció 315.
Agradecimientos: A Laboratorio Pfizer , por haber contribuído con los fondos necesarios para esta publicación. Cabe aclarar que Pfizer no participó del contenido ni recomendaciones del texto.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Leffler DA, Lamont JT. Clostridium difficile infection. N Engl J Med 2015; 372: 1539-48.
2. Jump RLP. Clostridium difficile infection in older adults. Aging Health 2013; 9: 403-14.
3. Lawson PA, Citron DM, Tyrrell KL, Finegold SM. Reclassification of Clostridium difficile as Clostridioides difficile (Hall and O’Toole 1935) Prévot 1938. Anaerobe 2016; 40: 95-9.
4. Chitnis AS, Holzbauer SM, Belflower RM, et al. Epidemiology of community-associated Clostridium difficile infection, 2009 through 2011. JAMA Intern Med 2013; 173:1359-67.
5. Ruiter-Ligeti J, Vincent S, Czuzoj-Shulman N, Abenhaim HA. Risk factors, incidence, and morbidity associated with obstetric Clostridium difficile infection. Obstet Gynecol 2018; 131: 387-91.
6. Gupta A, Khanna S. Community-acquired Clostridium difficile infection: an increasing public health threat. Infect Drug Resist 2014; 7: 63-72.
7. Pépin, J, Valiquette L, Alary M, et al. Clostridium difficileassociated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. CMAJ 2004; 171: 466-72.
8. Levy AR, Szabo SM, Lozano-Ortega G, et al. Incidence and costs of Clostridium difficile infections in Canada. Open Forum Infect Dis 2015 3; 2: ofv076.
9. Barbut F, Delmee M, Brazier JS, et al. A European survey of diagnostic methods and testing protocol for Clostridium difficile. Clin Microbiol Infect 2003; 9: 989-96.
10. Barbut F, Mastrantonio P, M. Delmeé M, et al. Prospective study of Clostridium difficile infections in Europe with phenotypic and genotypic characterization of the isolates. Clin Microbiol Infect 2007; 13: 1048-57.
11. Collins DA, Hawkey PM, Riley TV. Epidemiology of Clostridium difficile infection in Asia. Antimicrob Resist Infect Control 2013; 2: 21.
12. Rollet R, Legaria MC, Carloni G. Bacterias Anaerobias. En: Lopardo H, Predari S, Vay C. Manual de Microbiología Clínica, Volumen I, Parte III. Asociación Argentina de Microbiología, 2016.
13. Furuya-Kanamori L, Marquess J, Yakob L, et al. Asymptomatic Clostridium difficile colonization: epidemiology and clinical implications. BMC Infect Dis 2015; 15: 516.
14. McDonald LC, Gerding DN, Johnson S, et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis 2018; 66: e1-48.
15. Wenisch C, Parschalk B, Hasenhündl M, Hirschl AM, Graninger W. Comparison of vancomycin, teicoplanin,
metronidazole, and fusidic acid for the treatment of Clostridium difficile-associated diarrhea. Clin Infect Dis 1996; 5: 813-8.
16. FDA Drug Safety Communication: Clostridium difficile associated diarrhea can be associated with stomach acid drugs known as proton pump inhibitors (PPIs). 02/08/2012. En: https://www.fda.gov/drugs/drug-safetyand-availability/fda-drug-safety-communication-clostridium-difficile-associated-diarrhea-can-be-associated-stomach; consultado octubre 2019.
17. Trifan A, Stanciu C, Girleanu I, et al .Proton pump inhibitors therapy and risk of Clostridium difficile infection: Systematic review and meta-analysis. World J Gastroenterol 2017; 23: 6500-15.
18. Zumbado-Salas R, Gamboa-Coronado M del M, Rodríguez-Cavallini E, Chaves-Olarte E. Clostridium difficile in adult patients with nosocomial diarrhea in a Costa Rican hospital. Am J Trop Med Hyg 2008; 79: 164-5.
19. Quesada-Gómez C, Rodríguez C, Gamboa-Coronado M del M. Emergence of Clostridium difficile NAP1 in Latin America. J Clin Microbiol 2010; 48: 669-70.
20. Camacho-Ortiz, A, López-Barrera D, Hernández-García R, et al. First report of Clostridium difficile NAP1/027 in a Mexican Hospital. PLoS ONE 2015; 10: e0122627.
21. Fernandez Canigia L, Nazar J, Arce M, Dadamio J, Smayevsky J, Bianchini H. Diarrea asociada a Clostridium difficile: frecuencia de detección en un centro médico de Buenos Aires, Argentina. Rev Argent Microbiol 2001; 33: 101-7.
22. Legaria MC, Lumelsky G, Rosetti S. Clostridium difficileassociated diarrhea from a general hospital in Argentina. Anaerobe 2003; 3: 113-6.
23. Goorhuis A, Legaria MC, van den Berg RJ, et al. Application of multiple-locus variable-number tandem-repeat analysis to determine clonal spread of toxin A-negative Clostridium difficile in a general hospital in Buenos Aires, Argentina. Clin Microbiol Infect 2009; 12: 1080-6.
24. Lopardo G, Morfin-Otero R, Moran-Vazquez I, et al. Epidemiology of Clostridium difficile: a hospital-based descriptive study in Argentina and Mexico. Braz J Infect Dis 2015; 19: 8-14.
25. Fabbro L, Cornistein W, Novau A, et al. Clostridium difficile: Donde estamos parados? XVII Congreso de la Sociedad Argentino de Infectología 2017, Mar del Plata, Argentina. Actualizaciones en SIDA e Infectología 2017; 25: supl 1: 238.
26. Valledor A, Barcan L. Clostridium difficile en una unidad de trasplante de células hematopoyéticas. XVII Congreso de la Sociedad Argentino de Infectología 2017, Mar del Plata, Argentina. Actualizaciones en SIDA e Infectologia 2017; 25: supl 1: 95.
27. Cejas D, Rios Osorio N, Quiros R, et al. Detection and molecular characterization of Clostridium difficile ST1 in Buenos Aires, Argentina. Anaerobe 2018; 49: 14-7.
28. Manual de Normas y Procedimientos de Vigilancia y Control de Enfermedades de Notificación Obligatoria. Ministerio de Salud de la Nación Argentina. En: www.snvs.msal.gov.ar/2007; consultado diciembre 2018.
29. European Centre for Disease Prevention and Control. European Surveillance of Clostridium difficile infections. Surveillance protocol version 2.3. Stockholm: ECDC; 2017. En: https://ecdc.europa.eu/en/publications-data/european-surveillance-clostridium-difficile-nfections-surveillance-protocol-1; consultado diciembre 2018.
30. Centers for Disease Control and Prevention. Multidrugresistant organism and Clostridium difficile infection (MDRO/CDI) module, 2016. En: http://www.cdc.gov/nhsn/pdfs/pscmanual/12pscmdro_cdadcurrent.pdf; consultado abril 2018.
31. Longtin Y, Frenette C, Rocher I, et al. Institut National de Santé Publique du Québec. Surveillance des diarrhées associées au Clostridium difficile dans les centres hospitaliers du Québec: protocole version 3. Protocol [Internet]. 2013; Février 20. En: https://www.inspq.qc.ca/sites/default/files/documents/infectionsnosocomiales/protocoledacd_v3.pdf; consultado diciembre 2017.
32. Cohen SH, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31: 431-55.
33. Schutze GE, Willoughby RE, Committee on Infectious Diseases, American Academy of Pediatrics. Clostridium difficile infection in infants and children. Pediatrics 2013; 131: 196-200.
34. Lees EA, Miyajima F, Pirmohamed M, Carrol ED. The role of Clostridium difficile in the paediatric and neonatal gut − a narrative review. Eur J Clin Microbiol Infect Dis 2016; 35: 1047-57.
35. Trubiano JA, Cheng AC, Korman TM, et al. Australasian Society of Infectious Diseases updated guidelines for the management of Clostridium difficile infection in adults and children in Australia and New Zealand. Intern Med J 2016; 46: 479-93.
36. Dubberke ER, Han Z, Bobo L, et al. Impact of clinical symptoms on interpretation of diagnostic assays for Clostridium difficile infections. J Clin Microbiol 2011; 49: 2887-93.
37. Longtin Y, Paquet-Bolduc B, Gilca R, et al. Effect of detecting and isolating Clostridium difficile carriers at hospital admission on the incidence of C difficile Infections: A quasi-experimental controlled study. JAMA Intern Med 2016; 176: 796-804.
38. Luo RF, Banaei N. Is repeat PCR needed for diagnosis of Clostridium difficile infection? J Clin Microbiol 2010; 48: 3738-41.
39. Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol 2013; 108: 478-98.
40. Peterson LR, Robicsek A. Does my patient have Clostridium difficile infection? Ann Intern Med 2009; 151: 176-9.
41. Crobach MJT, Planche T, Eckert C, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect 2016; 22: S63-81.
42. Aichinger E, Schleck CD, Harmsen WS, Nyre LM, Patel R. Nonutility of repeat laboratory testing for detection of Clostridium difficile by use of PCR or enzyme immunoassay. J Clin Microbiol 2008; 46: 3795-7.
43. Cardona DM, Rand KH. Evaluation of repeat Clostridium difficile enzyme immunoassay testing. J Clin Microbiol 2008; 46: 3686-9.
44. Goudarzi M, Seyedjavadi SS, Goudarzi H, Mehdizadeh Aghdam E, Nazeri S. Clostridium difficile infection: epidemiology, pathogenesis, risk factors, and therapeutic options. Scientifica (Cairo) 2014; 2014: 1-9.
45. Burnham C-AD, Carroll KC. Diagnosis of Clostridium difficile infection: An ongoing conundrum for clinicians and for clinical laboratories. Clin Microbiol Rev 2013; 26: 604-30.
46. Abujamel T, Cadnum JL, Jury LA, et al. Defining the vulnerable period for re-establishment of Clostridium difficile colonization after treatment of C. difficile infection with oral vancomycin or metronidazole. PLoS One 2013; 8: e76269.
47. Gerding DN, Meyer T, Lee C, et al. Administration of spores of nontoxigenic Clostridium difficile strain M3 for prevention of recurrent C. difficile infection. JAMA 2015; 313: 1719-27.
48. Ticehurst JR, Aird DZ, Dam LM, Borek AP, Hargrove JT, Carroll KC. Effective detection of toxigenic Clostridium difficile by a two-step algorithm including tests for antigen and cytotoxin. J Clin Microbiol 2006; 44: 1145-9.
49. Planche TD, Davies KA, Coen PG, et al. Differences in outcome according to Clostridium difficile testing method: A prospective multicentre diagnostic validation study of C difficile infection. Lancet Infect Dis 2013; 13: 936-45.
50. Polage CR, Chin DL, Leslie JL, Tang J, Cohen SH, Solnick J V. Outcomes in patients tested for Clostridium difficile toxins. Diagn Microbiol Infect Dis 2012; 74: 369-73.
51. Polage CR, Gyorke CE, Kennedy MA, et al. Overdiagnosis of Clostridium difficile infection in the molecular test era. JAMA Intern Med 2015; 175: 1792-801.
52. Legaria MC, Lumelsky G, Rosetti S, Greco G, Brazier JS, Gal M. Prevalence of toxin A-negative/B-positive Clostridium difficile in patients with gastrointestinal disease from a general hospital in Argentina. The 7th Biennial Congress of the Anaerobe Society of the Americas, Resumen PI-18. Anaerobe 2005; 11: 28.
53. Carman RJ, Wickham KN, Chen L, et al. Glutamate dehydrogenase is highly conserved among Clostridium difficile ribotypes. J Clin Microbiol 2012; 50: 1425-6.
54. Shetty N, Wren MWD, Coen PG. The role of glutamate dehydrogenase for the detection of Clostridium difficile in faecal samples: A meta-analysis. J Hosp Infect 2011; 77: 1-6.
55. Vaustat D, Rollet R. Glutamato deshidrogenasa. Su valor diagnóstico en la diarrea por Clostridioides difficile. Rev Argent Microbiol 2017; 50: 264-8.
56. Cheng J-W, Xiao M, Kudinha T, et al. The role of glutamate dehydrogenase (GDH) testing assay in the diagnosis of Clostridium difficile infections: A high sensitive screening test and an essential step in the proposed laboratory diagnosis workflow for developing countries like China. PLoS One 2015; 10: e0144604.
57. Legaria MC, Rollet R, Di Martino A, et al. Detection of toxigenic Clostridioides [Clostridium] difficile: Usefulness of two commercially available enzyme immunoassays and a PCR assay on stool samples and stool isolates. Rev Argent Microbiol 2017; 50: 36-44.
58. Deshpande A, Pasupuleti V, Rolston DDK, et al. Diagnostic accuracy of real-time polymerase chain reaction in detection of Clostridium difficile in the stool samples of patients with suspected Clostridium difficile infection: A meta-analysis. Clin Infect Dis 2011; 53: e81-90.
59. Luna RA, Boyanton BL, Mehta S, et al. Rapid stool-based diagnosis of Clostridium difficile infection by real-time PCR in a children’s hospital. J Clin Microbiol 2011; 49: 851-7.
60. Le Guern R, Herwegh S, Courcol R, Wallet F. Molecular methods in the diagnosis of Clostridium difficile infections: an update. Expert Rev Mol Diagn 2013; 13: 681-92.
61. Dalpke AH, Hofko M, Zorn M, Zimmermann S. Evaluation of the fully automated BD MAX Cdiff and Xpert C. difficile assays for direct detection of Clostridium difficile in stool specimens. J Clin Microbiol 2013; 51: 1906-8.
62. O’Horo JC, Jones A, Sternke M, Harper C, Safdar N. Molecular techniques for diagnosis of Clostridium difficile infection: systematic review and meta-analysis. Mayo Clin Proc 2012; 87: 643-51.
63. Kaltsas A, Simon M, Unruh LH, et al. Clinical and laboratory characteristics of Clostridium difficile infection in patients with discordant diagnostic test results. J Clin Microbiol 2012; 50: 1303-7.
64. Humphries RM, Uslan DZ, Rubin Z. Performance of Clostridium difficile toxin enzyme immunoassay and nucleic acid amplification tests stratified by patient disease severity. J Clin Microbiol 2013; 51: 869-73.
65. Novak-Weekley SM, Marlowe EM, Miller JM, et al. Clostridium difficile testing in the clinical laboratory by use of multiple testing algorithms. J Clin Microbiol 2010; 48: 889-93.
66. Rao K, Micic D, Natarajan M, et al. Clostridium difficile Ribotype 027: Relationship to age, detectability of toxins A or B in stool with rapid testing, severe infection, and mortality. Clin Infect Dis 2015; 61: 233-41.
67. Moon H-W, Kim HN, Hur M, Shim HS, Kim H, Yun Y-M. Comparison of diagnostic algorithms for detecting toxigenic Clostridium difficile in routine practice at a tertiary referral Hospital in Korea. PLoS One 2016; 11: e0161139.
68. Dubberke ER, Burnham C-AD. Diagnosis of Clostridium difficile infection: treat the patient, not the test. JAMA Intern Med 2015; 175: 1801-2.
69. Beaulieu C, Dionne L-L, Julien A-S, Longtin Y. Clinical characteristics and outcome of patients with Clostridium difficile infection diagnosed by PCR versus a three-step algorithm. Clin Microbiol Infect 2014; 20: 1067-73.
70. Koo HL, Ajami NJ, Jiang Z, et al. A Nosocomial outbreak of Norovirus infection masquerading as Clostridium difficile infection. Clin Infect Dis 2009; 48: e75-7.
71. Origüen J, Corbella L, Orellana MÁ, et al. Comparison of the clinical course of Clostridium difficile infection in glutamate dehydrogenase-positive toxin-negative patients diagnosed by PCR to those with a positive toxin test. Clin Microbiol Infect 2018; 240: 414-21.
72. Longtin Y, Trottier S, Brochu G, et al. Impact of the type of diagnostic assay on Clostridium difficile infection and complication rates in a mandatory reporting program. Clin Infect Dis 2013; 56: 67-73.
73. Rollet, R; Rossetti, A; Carloni G. Actualización sobre Clostridium difficile. Su Epidemiología y Diagnóstico. Segunda Parte. Boletín de la Asociación Argentina de Microbiología 2015: 9-11.
74. Fernandez Canigia L. Diagnóstico de infección por Clostridium difficile. En: Boletín de Epidemiologia Hospitalaria y Control de Infecciones del Hospital Alemán. Ed. Durlach RA, Freuler CB. Buenos Aires: Ediciones Guadalupe, 2013; 15-8.
75. Ota K V, McGowan KL. Clostridium difficile testing algorithms using glutamate dehydrogenase antigen and C. difficile toxin enzyme immunoassays with C. difficile nucleic acid amplification testing increase diagnostic yield in a tertiary pediatric population. J Clin Microbiol 2012; 50: 1185-8.
76. Vasa CV, Glatt AE. Effectiveness and appropriateness of empiric metronidazole for Clostridium difficile-associated diarrhea. Am J Gastroenterol 2003; 98: 354-8.
77. Bagdasarian N, Rao K, Malani PN. Diagnosis and treatment of Clostridium difficile in adults: A systematic review. JAMA 2015; 313-98.
78. Fehér C, Mensa J. A comparison of current guidelines of five international societies on Clostridium difficile infection management. Infect Dis Ther 2016; 5: 207-30.
79. Binion D. Clostridium difficile infection and inflammatory bowel disease. Gastroenterol Hepatol (N Y) 2016; 12: 334-7.
80. Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect 2014; 20 (Suppl. 2): 1-26.
81. Bartlett JG. Treatment of antibiotic-associated pseudomembranous colitis. Clin Infect Dis 1984; 6 (suppl 1): S235-S241.
82. Olson MM, Shanholtzer CJ, Lee JT, Gerding DN. Ten years of prospective Clostridium difficile-associated disease surveillance and treatment at the Minneapolis VA Medical Center, 1982–1991. Infect Control Hosp Epidemiol 1994; 15: 371-81.
83. Rodríguez-Pardo D, Mirelis B, Navarro F. Infecciones producidas por Clostridium difficile. Enferm Infecc Microbiol Clin 2013; 31: 254-63.
84. Kato H, Kato H, Iwashima Y, Nakamura M, Nakamura A, Ueda R. Inappropriate use of loperamide worsens Clostridium difficile-associated diarrhoea. J Hosp Infect 2008; 70: 194-5.
85. Bauer MP, Kuijper EJ, van Dissel JT. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): treatment guidance document for Clostridium difficile infection (CDI). Clin Microbiol Infect 2009; 15: 1067-79.
86. Teasley DG, Gerding DN, Olson MM, et al. Prospective randomised trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet 1983; 2: 1043-6.
87. Zar FA, Bakkanagari SR, Moorthi KM, et al. A comparison of vancomycin and metronidazole for the treatment of Clostridium difficile-associated diarrhea, stratified by disease severity. Clin Infect Dis 2007; 45: 302-7.
88. Johnson S, Louie TJ, Gerding DN, et al. Polymer Alternative for CDI Treatment (PACT) Investigators. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomized, controlled trials. Clin Infect Dis 2014; 59: 345-54.
89. Siegfried J, Dubrovskaya Y, Flagiello T, Scipione M, Phillips M, Papadopoulos J. Initial therapy for mild to moderate Clostridium difficile infection. Infect Dis Clin Pract 2016; 24: 210-6.
90. Nelson RL, Suda KJ, Evans CT. Antibiotic treatment for Clostridium difficile-associated diarrhea in adults (Review). Cochrane Database of Sistematic Reviews 2017, Issue 3. Art. No.: CD004610.
91. Beinortas T, Burr N, Wilcox M, Subramanian V. Comparative efficacy of treatments for Clostridium difficile infection: a systematic review and network meta-analysis. Lancet Infect Dis 2018 18: 1035-44.
92. Fekety R. Silva J, Kauffman C, Buggy B, Deery HG. Treatment of antibiotic-associated Clostridium difficile colitis with oral vancomycin: comparison of two dosage regimen. Am J Med 1989: 86: 15-9.
93. Carmo J, Marques S. Leaping forward in the treatment of Clostridium difficile infection: update in 2015. GE Port J Gastroenterol 2015; 22: 256-67.
94. Sailhamer EA, Carson K, Chang Y, et al. Fulminant Clostridium difficile colitis: patterns of care and predictors of mortality. Arch Surg 2009; 144: 433-9.
95. Markelov A, Livert D, Kohli H. Predictors of fatal outcome after colectomy for fulminant Clostridium difficile colitis: a 10-year experience. Am Surg 2011; 77: 977-80.
96. Al-Nassir WN, Sethi AK, Nerandzic MM, et al. Comparison of clinical and microbiological response to treatment of Clostridium difficile-associated disease with metronidazole and vancomycin. Clin Infect Dis 2008; 47: 56-62.
97. Rokas K. The addition of intravenous metronidazole to oral vancomycin is associated with improved mortality in critically ill patients with Clostridium difficile infection. Clin Infect Dis 2015; 61: 934-41.
98. Apisarnthnarak A, Razavi B. Adjunctive intracolonic vancomycin for severe Clostridium difficile colitis: case series and review of the literature. Clin Infect Dis 2002; 35: 690-6.
99. Cornely O, Crook D, Esposito R, Poirier A, Somero MS, Weiss K. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis 2012; 12: 281-9.
100. Louie T, Miller M, Mullane K, Weiss K, Lentnek A, Golan Y. Fidaxomicin versus vancomycin for Clostridium difficile infection. N Engl J Med 2011; 364: 422-31.
101. Cheng AC, Ferguson J, Gilbert GL, et al Australian Society for infectious Diseases guidelines for the diagnosis and treatment of Clostridium difficile infection. Med J Aust 2011; 194: 353-8.
102. Herpers BL, Vlaminckx B, Burkhardt O, et al. Intravenous tigecycline as adjunctive or alternative Therapy for severe refractory Clostridium difficile infection. Clin Infect Dis 2009; 48: 1732-5.
103. Larson K, Belliveau P, Spooner L. Tigecycline for the treatment of severe Clostridium difficile infection. Ann Pharmacother 2011; 45: 1005-10.
104. Drekonja DM, Butler M, MacDonald R, et al. Comparative effectiveness of Clostridium difficile treatments: a systematic review. Ann Intern Med 2011; 155: 839-47.
105. McFarland LV, Elmer GW, Surawicz CM. Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am J Gastroenterol 2002; 97: 1769-75.
106. Davies KA, Longshaw CM, Davis GL, et al. Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, point-prevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID). Lancet Infect Dis 2014; 14: 1208e19e.
107. Wenisch C, Parschalk B, Hasenhündl M, Hirschl AM, Graninger W. Comparison of vancomycin, teicoplanin, metronidazole, and fusidic acid for the treatment of Clostridium difficile-associated diarrhea. Clin Infect Dis 1996; 22: 813-8.
108. Pacheco SM, Johnson S. Important clinical advances in the understanding of Clostridium difficile infection. Curr Opin Gastroenterol 2013; 29: 42-8.
109. Sailhamer EA, Carson K, Chang Y, et al. Fulminant Clostridium difficile colitis: patterns of care and predictors of mortality. Arch Surg 2009; 144: 433 9.
110. Kuijper EJ, Wilcox MH. Editorial commentary: decreased effectiveness of metronidazole for infection? Clin Infect Dis 2008; 47: 63-5.
111. Wilcox MH, Howe R. Diarrhoea caused by Clostridium difficile: response time for treatment with metronidazole and vancomycin. J Antimicrob Chemother 1995; 36: 673-9.
112. Louie TJ, Peppe J, Watt CK, et al. Tolevamer, a novel non antibiotic polymer, compared with vancomycin in the treatment of mild to moderately severe Clostridium difficile-associated diarrhea. Clin Infect Dis 2006; 43: 411-20.
113. Wadhwa A, Al Nahhas MF, Dierkhising RA, et al. High risk of post-infectious irritable bowel syndrome in patients with Clostridium difficile infection. Aliment Pharmacol Ther 2016; 44: 576-82.
114. Szabo GB; Kadar B, Lenart S, et al. Use of tigecycline in patients with severe Clostridium difficile infection: a retrospective observational cohort study. Clin Microbiol Infect 2016; 22: 990-5.
115. El-Herte R, Baban T, Kanj S. Recurrent refractory Clostridium difficile colitis treated successfully with rifaximina and tigecyclin: A case report and review of the literature. Scand J Infect Dis 2012; 44: 228-30.
116. Li R, Lu L, Lin Y, Wang M, Liu X. Efficacy and safety of metronidazole monotherapy versus vancomycin
monotherapy or combination therapy in patients with Clostridium difficile infection: a systematic review and meta-analysis. PLoS ONE 2015; 10: e0137252.
117. Pattani R, Palda VA, Hwang SW, Shah PS. Probiotics for the prevention of anti- biotic-associated diarrhea and Clostridium difficile infection among hospitalized patients: systematic review and meta-analysis. Open Med 2013; 7: e56-67.
118. Johnson S, Maziade PJ, McFarland LV, et al. Is primary prevention of Clostridium difficile infection possible with specific probiotics? Int J Infect Dis 2012; 16: e786-92.
119. Gao X, Mubasher M, Fang C, Reifer C, Miller L. Doseresponse efficacy of a proprietary probiotic formula of Lactobacillus acidophilus CL1285 and Lactobacillus casei LBC80R for antibiotic-associated diarrhea and Clostridium difficile-associated diarrhea prophylaxis in adult patients. Am J Gastroenterol 2010; 105: 1636-41.
120. Appel-da-Silva M. Saccharomyces cerevisiae var. Boulardii fungemia following probiotic treatment. Medical Mycology Case Reports 2017; 18: 15-7.
121. Shah N, Shaaban H, Spira R, Slim J, Boghossian J. Intravenous immunoglobulin in the treatment of severe Clostridium difficile colitis. J Glob Infect Dis 2014; 6: 82-5.
122. Kulkarni HS, Khoury CC. Sepsis associated with Lactobacillus bacteremia in a patient with ischemic colitis. Indian J Crit Care Med 2014; 18: 606-8.
123. Enache-Angoulvant A, Hennequin C. Invasive Saccharomyces infection: a comprehensive review. Clin Infect Dis 2005; 41: 1559-68.
124. Sanders ME. Safety assessment of probiotics for human use. Gut Microbes 2010; 1: 164-85.
125. Valdovinos M. Consenso Mexicano sobre Probióticos en Gastroenterología. Rev Gastroenter México 2017; 82: 156-78.
126. Pillai A, Nelson RL. Probiotics for treatment of Clostridium difficile-associated colitis in adults. Cochrane Database Syst Rev 2008. CD004611. doi: 10.1002/14651858.CD004611.pub2.
127. Meyers SL, Espinoza R, Quera R. Infección por Clostridium difficile: Epidemiología, Diagnóstico y Estrategias Terapéuticas. Rev Med Clin Condes 2014; 25: 473-84.
128. González-García N, Gómez-Pavóny J, Martínez-Porras L. Diagnóstico, tratamiento y control de la infección causada por Clostridium difficile. Rev Esp Geriatr Gerontol 2005; 40: 310-9.
129. Poutanen S. Clostridium difficile-associated diarrhea in adults. CMAJ 2004; 171: 51-8.
130. Kato H, Kato H, Nakamura M, Nakamura A. A case of toxic megacolon secondary to Clostridium difficileassociated diarrhea worsened after administration of an antimotility agent and molecular analysis of recovered isolates. J Gastroenterol 2007; 42: 507-8.
131. Walley T, Milson D. Loperamide related toxic megacolon in Clostridium difficile colitis. Postgrad Med J 1990; 66: 582.
132. Cataldo MA, Granata G, Petrosillo N. Clostridium difficile infection: new approaches to prevention, non-antimicrobial treatment, and stewardship. Expert Rev Anti Infect Ther 2017; 15: 1027-40.
133. Webb BJ, Brunner A, Lewis J, Ford CD, Lopansri B. Repurposing an old drug for a new epidemic: Ursodeoxycholic acid to prevent recurrent Clostridioides difficile infection. Clin Infect Dis 2019 18; 68: 498-500.
134. Miller M. Fidaxomicin (OPT-80) for the treatment of Clostridium difficile infection. Expert Opin Pharmacother 2010; 11: 1569-78.
135. Mullane K; Gorbach S. Fidaxomicin: first-in-class macrocyclic antibiotic. Expert Rev Anti Infect Ther 2011; 9: 767-77.
136. Venugopal A, Johnson S. Fidaxomicin: A novel macrocyclic antibiotic approved for treatment of Clostridium difficile infection. Clin Infect Dis 2012; 54: 568-74.
137. Petrella L, Sambol S, Cheknis S, et al. Decreased cure and increased recurrence rates for Clostridium difficile infection caused by the epidemic C.difficile BI strain. Clin Infect Dis 2012; 55: 351-7.
138. Louie T, Miller M, Crook D, et al. Effect of age on treatment outcomes in Clostridium difficile infection. J Am Geriatr Soc 2013; 61: 222-30.
139. Mullane K, Miller M, Ewiss K, Lentnek A, Golan Y, Sears P. Efficacy of fidaxomicina versus vancomycin as therapy for Clostridium difficile infection in individuals taking concomitant antibiotics for other concurrent infections. Clin Infect Dis 2011; 53: 440-7.
140. Cornely O, Miller M, Fantin B, Mullane K, Kean Y, Gorbach S. Resolution of Clostridium difficile-associated diarrhea in patients with cancer treated with fidaxomicina or vancomycin. J Clin Oncol 2013; 31: 2493-9.
141. Mullane K, Cornely O, Crook D, et al. Renal impairment and clinical outcomes of Clostridium difficile infection in two randomized trials. Am J Nephol 2013; 31: 1-11.
142. Musher D, Logan N, Hamill R, et al. Nitazoxanide for the treatment of Clostridium difficile colitis. Clin Infect Dis 2006; 43: 421-7.
143. Musher D, Logan N, Bressler A, Johnson D, Rossignol J. Nitazoxanide versus vancomycin in Clostridium difficile infection: a randomized, double-blind study. Clin Infect Dis 2009; 48: e41-6.
144. Garey K, Ghantoji S, Shah D, et al. A randomized, double-blind, placebocontrolled pilot study to assess the ability of rifaximina to prevent recurrent diarrhea in patients with Clostridium difficile infection. J Antimicrib Chemother 2011; 66: 2850-5.
145. Mattila, E; Arkkila, P; Mattila, S; Tarkka, E; Tissari, P; Anttila, V. Rifaximin in the treatment of recurrent Clostridium difficile infection. Aliment Pharmacol Ther 2013; 37: 122-8.
146. Reigadas E, Alcalá L, Gómez J, Marín M, Martin A, Onori R. Breakthrough Clostridium difficile infection in cirrhotic patients receiving rifaximin. Clin Infect Dis 2018; 66: 1086-91.
147. Manthey C, Eckmann L, Fuhrmann V. Therapy for Clostridium difficile infection – any news beyond metronidazole and vancomycin? Expert Rev Clin Pharmacol 2017; 10: 1239-50.
148. Wilcox M, Gerding D, Poxton I, et al. Bezlotoxumab for prevention of recurrent Clostridium difficile infection. N Engl J Med 2017; 376: 305-17.
149. Gerding DN, Kelly CP, Rahav G, et al Bezlotoxumab for prevention of recurrent Clostridium difficile infection in patients at increased risk for recurrence. Clin Infect Dis 2018; 67: 649-56.
150. Johnson S, Gerding DN. Bezlotoxumab. Clin Infect Dis 2018; 68: 699-704.
151. Salavert M, Cobo J, Pascual Á, et al Cost-effectiveness analysis of bezlotoxumab added to standard of care versus standard of care alone for the prevention of recurrent Clostridium difficile infection in high-risk patients in Spain. Adv Ther 2018; 35: 1920-34.
152. Popovic N, Korac M, Nesic Z, Milosevic B, Urosevic A, Jevtovic D. Oral teicoplanin versus oral vancomycin for the treatment of severe Clostridium difficile infection: a prospective observational study. Eur J Clin Microbiol Infect Dis 2018; 37: 745-54.
153. Popovic N, Korac M, Nesic Z, Milosevic B, Urosevic A, Jevtovic D. Oral teicoplanin for successful treatment of severe refractory Clostridium difficile infection. J Infect Dev Ctries 2015; 9: 1062-7.
154. Davido B, Leplay C, Bouchand F, Dinh A, Villart M, Le Quintrec J. Oral teicoplanin as an alternative first-line regimen in Clostridium difficile infection in elderly patients: A case series. Clin Drug Investig 2017; 37: 699-703.
155. Shetler K, Nieuwenhuis R, Wren S, Triadafilopoulos G. Decompressive colonoscopy with intracolonic vancomycin administration for the treatment of severe pseudomembranous colitis. Surg Endosc 2001; 15: 653-9.
156. Malamood M, Nellis E, Ehrlich A, Friedenberg F. Vancomycin enemas as adjunctive therapy for Clostridium difficile infection. J Clin Med Res 2015; 7: 422-7.
157. Kim P, Huh H, Cohen H, et al. Intracolonic vancomycin for severe Clostridium difficile colitis. Surg Infect 2013; 14: 532-9.
158. Lamontagne F, Labbe AC, Haeck O, et al. Impact of emergency colectomy on survival of patients with fulminant Clostridium difficile colitis during an epidemic caused by a hypervirulent strain. Ann Surg 2007; 245: 267-72.
159. Synnott K, Mealy K, Merry C, et al. Timing of surgery for fulminating pseudo- membranous colitis. Br J Surg 1998; 85: 229-31.
160. Pepin J, Vo TT, Boutros M, et al. Risk factors for mortality following emergency colectomy for fulminant Clostridium difficile infection. Dis Colon Rectum 2009; 52: 400-5.
161. Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg 2002; 235: 363-72.
162. Ali SO, Welch JP, Dring RJ. Early surgical intervention for fulminant pseudomembranous colitis. Am Surg 2008; 74: 20-6.
163. Neal M, Alverdy J, Hall D, Simmons R, Zuckerbraun B. Diverting loop ileostomy and colonic lavage. An alternative to total abdominal colectomy for the treatment of severe, complicated Clostridium difficile associated disease. Ann Surg 2011; 254: 423-7.
164. Schutze GE, Willoughby RE. Clostridium difficile infection in infants and children. Pediatrics 2013; 131: 196-200.
165. Tamma P, Sandora T. Clostridium difficile infection in children: current state and unanswered questions. J Pediatr Infect Dis Soc 2012; 3: 230-43.
166. McFarland L, Ozen M, Dinleyici, et al. Comparison of pediatric and adult antibiotic associated diarrhea and Clostridium difficile infections. World J Gastroenterol 2016; 22: 3078-104.
167. Magill SS, Edwards JR, Stat M, et al. Multistate pointprevalence survey of health care-associated infections. N Engl J Med 2014; 370: 1198-208.
168. Severe Clostridium difficile-associated disease in populations previously at low risk – four states, 2005. MMWR 2005; 54: 1201-5.
169. Korman TM. Diagnosis and management of Clostridium difficile infection. Semin Respir Crit Care Med 2015; 36: 31-43.
170. Lewis BB,Buffie CG,Carter RA, et al. Loss of microbiotamediated colonization resistance to Clostridium difficile infection with oral vancomycin compared with metronidazole. J Infect Dis 2015; 212: 1656-65.
171. Buffie CG, Bucci V, Stein RR. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature 2014; 517; 7533: 205-8.
172. Weingarden AR, Chen C, Bobr A, et al. Microbiota transplantation restores normal fecal bile acid composition in recurrent Clostridium difficile infection. Am J Physiol Gastrointest Liver Physiol 2014; 306: G310-9.
173. McCune VL, Struthers JK, Hawkey PM. Faecal transplantation for the treatment of Clostridium difficile infection: a review. Int J Antimicrob Agents 2014; 43: 201-6.
174. Eiseman B, Silen W, Bascom GS, et al. Fecal enema as an adjunct in the treatment of pseudomembranous
enterocolitis. Surgery 1958; 44: 854-9.
175. van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013; 368: 407-15.
176. Van Beurden YH. Current challenges in the treatment of severe Clostridium difficile infection: early treatment potential of fecal microbiota transplantation. Therap Adv Gastroenterol 2017; 10: 373-81.
177. Manges A, Steiner T, Wright A, et al. Fecal microbiota transplantation for the intestinal decolonization of extensively antimicrobial resistant opportunistic pathogens: a review. Infect Dis 2016; 48: 587-92.
178. Crum-Cianflone N, Sullivan E, Ballon-Landa G, et al. Fecal microbiota transplantation and successful resolution of multidrug-resistant-organism colonization. J Clin Microbiol. 2015; 53: 1986-9.
179. Bilinski J, Grzesiowski P, Muszynski J, et al. Fecal microbiota transplantation inhibits multidrug resistant gut pathogens: Preliminary report performed in an inmunocompromised host. Arch Immunol Ther Exp 2016; 64: 255-8.
180. Manges AR, Steiner TS, Wright AJ. Fecal microbiota transplantation for the intestinal decolonization of extensively antimicrobial-resistant opportunistic pathogens: a review. Infect Dis (Lond) 2016; 48: 587-92.
181. Gopalsamy SN, Woodworth MH, Wang T. The use of microbiome restoration therapeutics to eliminate intestinal colonization with multidrug-resistant organisms Am J Med Sci 2018; 356: 433-40.
182. Ooijevaar RE, Terveer EM, Verspaget HW, Kuijper EJ, Keller JJ. Clinical application and potential of fecal microbiota transplantation. Annu Rev Med 2019; 70: 335-51.
183. Khanna S. Microbiota replacement therapies: Innovation in gastrointestinal care. Clin Pharmacol Ther 2018; 103: 102-11.
184. Davido B, Batista R, FessiH, et al. Fecal microbiota transplantation to eradicate vancomycin-resistant enterococcicolonization in case of an outbreak Med Mal Infect 2018; 49: 214-8.
185. Martinez JV, Raush A, Efrón ED, et al. Colitis refractaria por Clostridium difficile tratada con trasplante de microbiota fecal Medicina (B Aires) 2019; 79: 291-4.
186. Cammarota G, Masucci L, Ianiro G, et al. Randomised clinical trial: faecal microbiota transplantation by colonoscopy vs. vancomycin for the treatment of recurrent Clostridium difficile infection. Aliment Pharmacol Ther 2015; 41: 835-43.
187. Lee CH, Steiner T, Petrof EO, et al. Frozen vs fresh fecal microbiota transplantation and clinical resolution of diarrhea in patients with recurrent Clostridium difficile infection: a randomized clinical trial. JAMA 2016; 315: 142-9.
188. Kelly C, Khoruts A, Staley C, et al. Effect of microbiota transplantation on recurrence in multiply recurrent Clostridium difficile infection. Ann Intern Med 2016; 165: 609-16.
189. Drekonja D, Reich J, Gezahegn S, et al. Fecal microbiota transplantation for Clostridium difficile infection: a systematic review. Ann Intern Med 2015; 162: 630-8.
190. Kassam Z, Lee CH, Yuan Y, et al. Fecal microbiota transplantation for Clostridium difficile infection: systematic review and meta-analysis. Am J Gastroenterol 2013; 108: 500-8.
191. Hvas CL, Jørgensen SMD, Jørgensen SP, et al Fecal microbiota transplantation is superior to fidaxomicin for treatment of recurrent Clostridium difficile infection. Gastroenterology 2019; 156: 1324-32.
192. Dubberke ER, Burdette SE, et al. Clostridium difficile infections in solid organ transplantation. Am J Transplant 2013; 13: 42-9.
193. Bakken JS, Borody T, Brandt LJ, et al; Fecal Microbiota Transplantation Workgroup. Treating Clostridium difficile infection with fecal microbiota transplantation. Clin Gastroenterol Hepatol 2011; 9: 1044-9.
194. Kelly C, Ihunnah C, Fischer M, et al. Fecal microbiota transplant for treatment of Clostridium difficile in immunocompromised patients. Am J Gastroenterol 2014; 109: 1065-71.
195. Alrabaa S, Jariwala R, Seitler K, et al. Fecal microbiota transplantation outcomes in immunocompetent and immunocompromised patients: A single-center experience. Transplant Infect Dis 2017; 19: e12726
196. Friedman-Moraco R, Metha A, Lyon G. Fecal microbiota transplantation for refractory Clostridium difficile colitis in solid organ transplant recipients. Am J Transplant 2014; 14: 477-80.
197. Webb B, Brunner A, Ford C. Fecal microbiota transplantation for recurrent Clostridium difficile infection in hematopoietic stem cell transplant recipients. Transpl Infect Dis 2016; 18: 628-33.
198. Neemann K, Eichele D, Smith P. Fecal microbiota transplantation for fulminant Clostridium difficile infection in an allogeneic stem cell transplant patient. Transpl Infect Dis 2012; 14: e161-5.
199. de Castro CG, Ganc AJ, Ganc RL, et al. Fecal microbiota transplant after hematopoietic SCT: report of a successful case. Bone Marrow Transplant 2015; 50: 145.
200. Woodworth M, Neish E, Miller M, et al. Laboratory testing of donors and stool for fecal microbiota transplantation for recurrent C. difficile infection. J Clin Microbiol 2017; 55: 1002-10.
201. Cammarota G, Ianiro G, Tilg H, et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut 2017; 66: 569-80.
202. Perez E, Lee CH, Petrof EO. A practical method for preparation of fecal microbiota transplantation. Methods Mol Biol 2016; 1476: 259-67.
203. Youngster I, Sauk J, Pindar C, et al. Fecal microbiota transplant for relapsing Clostridium difficile infection using a frozen inoculum from unrelated donors: A randomized, open-label, controlled pilot study. Clin Infect Dis 2014; 58: 1515-22.
204. Edmon M. The power of poop: Fecal microbiota transplantation for Clostridium difficile infection. Trans Am Clin Climatol Assoc 2016; 127: 71-80.
205. Orenstein R, Dubberke E, Hardi R, et al. Safety and durability of RBX2660 (microbiota suspension) for recurrent Clostridium difficile infection: Results of the PUNCH CD Study. Clin Infect Dis 2016; 62: 596-602.
206. Khanna S, Pardi D, Kelly C, et al. A novel microbiome therapeutic increases gut microbial diversity and prevents recurrent Clostridium difficile infection. J Infect Dis 2016; 214: 173-81.
207. Mattila E, Uusitalo-Seppala R, Wuorela M, et al. Fecal transplantation, through colonoscopy, is effective therapy for recurrent Clostridium difficile infection. Gastroenterology 2012; 142: 490-6.
208. Costello S, Tucker E, La Brooy J, et al. Establishing a fecal microbiota transplant service for the treatment of Clostridium difficile infection. Clin infect Dis 2016; 62: 908-14.
209. Terveer E, Van Beurden Y, Goorhuis A, et al. How to establish and run a stool bank. Clin Microbiol Infect 2017; 23: 924-30.
210. Koenig J, Siebenhaar A, Hoegenauer C. Consensus Report: faecal microbiota transfer- clinical applications and procedures. Aliment Pharmacol Ther 2017; 45: 222-39.
211. Ott S, Musfeldt M, Timmis K. In vitro alterations of intestinal bacterial microbiota in fecal samples during storage. Diagn Microbiol Infect Dis 2004; 50: 237-45.
212. Gough E, Shaikh H, Manges A, et al. Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection. Clin Infect Dis 2011; 53: 994-1002.
213. Hamilton MJ, Weingarden AR, Sadowsky MJ, et al. Standardized frozen preparation for transplantation of fecal microbiota for recurrent Clostridium difficile infection. Am J Gastroenterol 2012; 107: 761-7.
214. Satokari R, Mattila E, Kainulainen V, et al. Simple faecal preparation and efficacy of frozen inoculum in faecal microbiota transplantation for recurrent Clostridium difficile infection: an observational cohort study. Aliment Pharmacol Ther 2015; 41: 46-53.
215. Gundacker N, Tamhane A, Walker J, et al. Comparative effectiveness of faecal microbiota transplant by route of administration. J Hosp Infect 2017; 96: 349-52.
216. Sleight SC, Wigginton NS, Lenski RE. Increased susceptibility to repeated freeze-thaw cycles in Escherichia coli following long-term evolution in a benign environment. BMC Evol Biol 2006; 6: 104.
217. Sokol H, Galperine T, Kapel N, et al. Faecal microbiota transplantation in recurrent Clostridium difficile infection: Recommendations from the French Group of Faecal Microbiota Transplantation. Dig Liver Dis 2016; 48: 242-7.
218. Cammarota G, Ianiro G, Gasbarrini A. Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. J Clin Gastroenterol 2014; 48: 693-702.
219. Jalanka J, Salonen A, Salojärvi J, et al. Effects of bowel cleansing on the intestinal microbiota. Gut 2015; 64: 1562-8.
220. Imhann F, Bonder MJ, Vich Vila A, et al. Proton pump inhibitors affect the gut microbiome. Gut 2016; 65: 740-8.
221. Fisher L, Fisher A. Acid-suppressive therapy and risk of infections: Pros and cons. Clin Drug Investig 2017; 37: 587-624.
222. Freedberg DE, Toussaint NC, Chen SP, et al. Proton pump inhibitors alter specific taxa in the human gastrointestinal microbiome: a crossover trial. Gastroenterol 2015; 149: 883-5.
223. Quraishi MN, Widlak M, Bhala N, et al. Systematic review with meta-analysis: the efficacy of faecal microbiota transplantation for the treatment of recurrent and refractory Clostridium difficile infection. Aliment Pharmacol Ther 2017; 46: 479-93.
224. Furuya-Kanamori L, Doi S, Paterson D, et al. Upper versus lower gastrointestinal delivery for transplantation of fecal microbiota in recurrent or refractory Clostridium difficile infection: A collaborative analysis of individual patient data from 14 studies. J Clin Gastroenterol 2017; 51: 145-50.
225. Hocquart M, Lagier JC, Cassir N, et al. Early fecal microbiota transplantation improves survival in severe Clostridium difficile infections. Clin Infect Dis 2018; 66: 645-50.
226. Ass J, Gessert Ch, Bakken J. Recurrent Clostridium Difficile colitis: case series involving 18 patients treated with donor stool administered via a nasogastric tube. Clin Infect Dis 2003; 36: 580-5.
227. Lan N, Ashburn J, Shen B. Fecal microbiota transplantation for Clostridium difficile infection in patients with ileal pouches. Gastroenterology Report 2017; 5: 200-7.
228. Youngster I, Russell GH, Pindar C, et al. Oral, capsulized, frozen fecal microbiota transplantation for relapsing Clostridium difficile infection. JAMA 2014; 312: 1772-8.
229. Kao D, Roach B, Silva M, et al. Effect of oral capsule- vs. colonoscopy-delivered fecal microbiota transplantation on recurrent Clostridium difficile infection: A randomized clinical trial. JAMA 2017; 318: 1985-93.
230. Hirsch BE, Saraiya N, Poeth K, et al. Effectiveness of fecal-derived microbiota transfer using orally administered capsules for recurrent Clostridium difficile infection. BMC Infect Dis 2015; 15: 191.
231. Youngster I, Gerding DN. Editorial: Making fecal microbiota transplantation easier to swallow: Freeze-dried preparation for recurrent Clostridium difficile infections. Am J Gastroenterol 2017; 112: 948-50.
232. Kao D, Roach B, Silva M, et al. Effect of oral capsule– vs. colonoscopy-delivered fecal microbiota transplantation on recurrent Clostridium difficile infection. A randomized clinical trial. JAMA 2017; 318: 1985-93.
233. Iqbal U, Anwar H, Karim M. Safety and efficacy of encapsulated fecal microbiota transplantation for recurrent Clostridium difficile infection: a systematic review. Eur J Gastroenterol Hepatol 2018; 30: 730-4.
234. Weingarden AR, Hamilton MJ, Sadowsky MJ, et al. Resolution of severe Clostridium difficile infection following sequential fecal microbiota transplantation. J Clin Gastroenterol 2013; 47: 735-7.
235. Brandt L, Borody T, Campbell J. Endoscopic fecal microbiota transplantation: “first-line” treatment for severe Clostridium difficile infection? J Clin Gastroenterol 2011; 45: 655-7.
236. Kelly CR, de Leon L, Jasutkar N. Fecal microbiota transplantation for relapsing Clostridium difficile infection in 26 patients: methodology and results. J Clin Gastroenterol 2012; 46: 145-9.
237. Brandt LJ, Aroniadis OC, Mellow M, et al. Long-term follow-up of colonoscopic fecal microbiota transplant for recurrent Clostridium difficile infection. Am J Gastroenterol 2012; 107: 1079-87.
238. Hamilton MJ, Weingarden AR, Sadowsky MJ, et al. Standardized frozen preparation for transplantation of fecal microbiota for recurrent Clostridium difficile infection. Am J Gastroenterol 2013; 107: 761-7.
239. Wang S, Xu M, Wang W. Systematic review: Adverse events of fecal microbiota transplantation. PLoS One 2016; 11: e0161174.
240. Baxter M, Colville A. Adverse events in faecal microbiota transplant: a review of the literature. J Hosp Infect 2016; 92: 117-27.
241. Agrawal M, Aroniadis O, Brandt LJ, et al The long-term efficacy and safety of fecal microbiota transplant for recurrent, severe, and complicated Clostridium difficile infection in 146 elderly individuals. J Clin Gastroenterol 2016; 50: 403-7.
242. Binion DG. Strategies for management of Clostridium difficile infection in immunosuppressed patients. Gastroenterol Hepatol (N Y) 2011; 7: 750-2.
243. Neofytos D, Kobayashi K, Alonso CD, et al. Epidemiology, risk factors, and outcomes of Clostridium difficile infection in kidney transplant recipients. Transpl Infect Dis 2013: 15: 134-41.
244. Cozar-Llisto A, Ramos-Martinez A, Cobo J. Clostridium difficile infection in special high-risk populations. Infect Dis Ther 2016; 5: 253-69.
245. Dubberke ER, Riddle DJ. Clostridium difficile in solid organ transplantation recipients. Am J Transplant 2009; 9 Supp 4: S35-S40.
246. Paudel S, Zacharioudakis IM, Zervou FN, et al Prevalence of Clostridium difficile infection among solid organ transplant recipients: A meta-analysis of published studies. PLoS ONE 2015; 10: e0124483.
247. Revolinski SL, Muñoz-Price LS. Clostridium difficile in inmunocompromised hosts: A review of epidemiology, risk factors, treatment, and prevention. Clin Infect Dis 2019; 68: 2144-53.
248. Pant C, Anderson MP, O’Connor JA, et al. Association of Clostridium difficile infection with outcomes of hospitalized solid organ transplant recipients: results from the 2009 Nationwide Inpatient Sample database. Transpl Infect Dis 2012; 14: 540-7.
249. Donnelly J, Wang HE, Locke JE, et al. Hospital-onset Clostridium difficile infection among solid organ transplant recipients. Am J Transplant 2015; 15: 2970-7.
250. Imlay H, Kaul D, Rao K. Risk factors for Clostridium difficile infection in HIV-infected patients. SAGE Open Medicine 2016; 4: 2050312116684295.
251. Collini PJ, Kuijper E, Dockrell DH. Clostridium difficile infection in patients with HIV/AIDS. Curr HIV/AIDS Rep 2013; 10: 273-82.
252. Raines DL, Lopez FA. Clostridium difficile infection in non-HIV-immunocompromised patients and in HIV-infected patients. Curr Gastroenterol Rep 2011; 13: 344-50.
253. Sanchez TH, Brooks JT, Sullivan PS, et al. Adult/adolescent spectrum of HIV Disease Study Group. Bacterial diarrhea in persons with HIV infection, United States, 1992–2002. Clin Infect Dis 2005; 41: 1621-27.
254. Collini PJ, Bauer M, Kuijper E, Dockrell DH. Clostridium difficile infection in HIV-seropositive individuals and transplant recipients. J Infect 2012; 64: 131-47.
255. Tumbarello M, Tacconelli E, Leone F, Cauda R, Ortona L. Clostridium difficile-associated diarrhoea in patients with human immunodeficiency virus infection: a casecontrol study. Eur J Gastroenterol Hepatol 1995; 7: 259-63.
256. Anastasi JK, Capili B. HIV and diarrhea in the era of HAART: 1998 New York State hospitalizations. Am J Infect Control 2000; 28: 262-6.
257. Dubberke ER, Reske KA, Srivastava A, et al. Clostridium difficile-associated disease in allogeneic hematopoietic stem-cell transplant recipients: risk associations, protective associations, and outcomes. Clin Transplant 2010; 24: 192-8.
258. Trifilio SM, Pi J, Mehta J. Changing epidemiology of Clostridium difficile-associated disease during stem cell transplantation. Biol Blood Marrow Transplant 2013; 19: 405-9.
259. Chopra T, Chandrasekar P, Salimnia H, Heilbrun LK, Smith D, Alangaden GJ. Recent epidemiology of Clostridium difficile infection during hematopoietic stem cell transplantation. Clin Transplant 2011; 25: E82-7.
260. Anand A, Glatt AE. Clostridium difficile infection associated with antineoplastic chemotherapy: a review. Clin Infect Dis 1993; 17: 109-3.
261. Morales Chamorro R, Serrano Blanch R, Méndez Vidal MJ, et al. Pseudomembranous colitis associated with chemotherapy with 5-fluorouracil. Clin Transl Oncol 2005; 7: 258-61.
262. Bilgrami S, Feingold JM, Dorsky D, et al. Incidence and outcome of Clostridium difficile infection following autologous peripheral blood stem cell transplantation. Bone Marrow Transplant 1999; 23: 1039-42.
263. D’Aoust J, Battat R, Bessissow T. Management of inflammatory bowel disease with Clostridium difficile infection. World J Gastroenterol 2017; 23: 4986-5003.
264. Rao K, Higgins PDR. Epidemiology, diagnosis, and management of Clostridium difficile infection in patients with inflammatory bowel disease. Inflamm Bowel Dis 2016; 22: 1744-54.
265. Erb S, Frei R, Strandén AM, Dangel M, Tschudin-Sutter S, Widmer AF. Low sensitivity of fecal toxin A/B enzyme immunoassay for diagnosis of Clostridium difficile infection in immunocompromised Clin Microbiol Infect 2015; 21: 998.e9-998.e15.
266. Bitton A, Buie D, Enns R, et al. Canadian Association of Gastroenterology Severe Ulcerative Colitis Consensus Group. Treatment of hospitalized adult patients with severe ulcerative colitis: Toronto consensus statements. Am J Gastroenterol 2012; 107: 179-94.
267. Muñoz P, Giannella M, Alcalá L, et al. Clostridium difficile- associated diarrhea in heart transplant recipients: is hypogammaglobulinemia the answer? J Heart Lung Transplant 2007; 26: 907-14.
268. Das R, Feuerstadt P, Brandt LJ. Glucocorticoids are associated with increased risk of short-term mortality in hospitalized patients with Clostridium difficile-associated disease. Am J Gastroenterol 2010; 105: 2040-9.
269. Sethi AK, Al Nassir WN, Nerandzic MM, et al Persistence of skin contamination and environmental shedding of Clostridium difficile during and after treatment of C. difficile infection. Infect Control Hosp Epidemiol 2010; 31: 21-7.
270. Carrico R. APIC Implementation Guide: Guide to Preventing Clostridium difficile Infections. Washington: Published by the Association for Professionals in Infection Control and Epidemiology, Inc. (APIC), 2013. En: http://apic.org/Resource_/EliminationGuideForm/59397fc6-3f90-43d1-9325-e8be75d86888/File/2013CDiffFinal.pdf; consultado noviembre 2018.
271. Dubberke E, Carling P, Carrico R, et al. Strategies to prevent Clostridium difficile infections in acute care hospitals. Infect Control Hosp Epidemiol 2014; 35: 628-45.
272. McFarland LV, Mulligan ME, Kwok RY. Nosocomial acquisition of Clostridium difficile infection. N Engl J Med 1989; 320: 204-10.
273. Johnson S, Gerding DN, Olson MM, et al. Prospective, controlled study of vinyl glove use to interrupt Clostridium difficile nosocomial transmission. Am J Med 1990; 88: 137-40.
274. Puzniak LA, Leet T, Mayfield J, Kollef M, et al To gown or not to gown: the effect on acquisition of vancomycinresistant enterococci. Clin Infect Dis 2002; 35: 18-25.
275. Srinivasan A, Song X, Ross T, et al. A prospective study to determine whether cover gowns in addition to gloves decrease nosocomial transmission of vancomycin-resistant enterococci in an intensive care unit. Infect Control Hosp Epidemiol 2002; 23: 424-8.
276. Boyce JM, Ligi C, Kohan C, et al. Lack of association between the increased incidence of Clostridium difficile–associated disease and the increasing use of alcoholbased hand rubs. Infect Control Hosp Epidemiol 2006; 27: 479-83.
277. Oughton MT, Loo VG, Dendukuri N, et al. Hand hygiene with soap and water is superior to alcohol rub and antiseptic wipes for removal of Clostridium difficile. Infect Control Hosp Epidemiol 2009; 30: 939-44.
278. Philippe D, Frédéric C, Léa-Laurence D, et al. Efficacy of the World Health Organization-recommended handwashing technique and a modified washing technique to remove Clostridium difficile from hands. Association for Professionals in Infection Control and Epidemiology, Elsevier Inc., 2017.
279. Anderson D, Chen L, Weber D, et al. Enhanced terminal room disinfection and acquisition and infection caused by multidrug-resistant organisms and Clostridium difficile (the Benefits of Enhanced Terminal Room Disinfection study): a cluster randomised, multicentre, crossover study. Lancet 2017; 25: 805-14.
280. Barbut F. How to eradicate Clostridium difficile from the environment. J Hosp Infect 2015; 89: 287-95.
281. Mitchell B, Dancer S, Anderson M, et al. Risk of organism acquisition from prior room occupants: a systematic review and meta-analysis. J Hosp Infect 2015; 91: 211-7.
282. Jou J, Ebrahim J, Shofer F, et al. Environmental transmission of Clostridium difficile: association between hospital room size and C. difficile infection. Infect Control Hosp Epidemiol 2015; 36: 564-8.
283. Barker A, Ngam C, Musuuza J, Vaughn V, Safdar N. Reducing Clostridium difficile in the inpatient setting: A systematic review of the adherence to and effectiveness of C. difficile prevention bundles. Infect Control Hosp Epidemiol 2017; 38: 639-50.
284. Dubberke E, Carling P, Carrico R, et al. Strategies to prevent Clostridium difficile infections in acute care hospitals: 2014 Update. Infect Control Hosp Epidemiol 2014; 35: 628-45.
285. Caroff D, Yokoe D, Klompas M. Evolving insights Into the epidemiology and control of Clostridium difficile in Hospitals. Clin Infect Dis 2017; 65: 1232-8.
286. Louh I, Greendyke W, Hermann E, et al. Clostridium difficile infection in acute care Hospitals: Systematic review and best practices for prevention. Infect Control Hosp Epidemiol 2017; 38: 476-82.
287. Pegues D, Han J, Gilmar C, et al. Impact of ultraviolet germicidal irradiation for no-touch terminal room disinfection on Clostridium difficile infection incidence among hematology-oncology patients. Infect Control Hosp Epidemiol 2016; 38: 39-44.
288. Boyce J, Havill N, Otter J, et al. Impact of hydrogen peroxide vapor room decontamination on Clostridium difficile environmental contamination and transmission in a healthcare setting. Infect Control Hosp Epidemiol 2008; 29: 723-9.
289. Manian F, Griesnauer S, Bryant A. Implementation of hospital-wide enhanced terminal cleaning of targeted patient rooms and its impact on endemic Clostridium difficile infection rates. Am J Infect Control 2013; 41: 537-41.
290. Ali S, Muzslay M, Bruce M, et al. Efficacy of two hydrogen peroxide vapour aerial decontamination systems for enhanced disinfection of meticillin-resistant Staphylococcus aureus, Klebsiella pneumoniae and Clostridium difficile in single isolationrooms. J Hosp Infect 2016; 93: 70-7.
291. Smith A, Taggart L, Lebovic G, et al Clostridium difficile infection incidence: impact of audit and feedback programme to improve room cleaning. J Hosp Infect 2016; 92: 161-6.
292. Schuts EM, Hulscher M, Mouton JW, Verduin CM, Cohen Stuart JWT. Current evidence on hospital antimicrobial stewardship objectives: a systematic review and metaanalysis. Lancet Infect Dis 2016; 16: 847-56.
293. Davey P, Brown E, Charani E, et al. Interventions to improve antibiotic prescribing practices for hospital inpatients. Cochrane Database Syst Rev 2013; 4: CD003543.
294. Bernatz JT, Safdar N, Hetzel S, Anderson PA. Antibiotic overuse is a major risk factor for Clostridium difficile infection in surgical patients. Infect Control Hosp Epidemiol 2017; 38: 1254-7.
295. Eze P, Balsells E, Kyaw MH, Nair H. Risk factors for Clostridium difficile infections – an overview of the evidence base and challenges in data synthesis. J Glob Health 2017; 7: 010417.
296. Stevens V, Dumyati G, Fine LS, Fisher SG, van Wijngaarden E. Cumulative antibiotic exposures over time
and the risk of Clostridium difficile infection. Clin Infect Dis 2011; 53: 42-8.
297. Baur D, Gladstone BP, Burkert F, et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis Lancet Infect Dis 2017; 17: 990-1001.
298. Freedberg DE, Salmasian H, Cohen B, et al. Receipt of antibiotics in hospitalized patients and risk for Clostridium difficile infection in subsequent patients who occupy the same bed. JAMA Intern Med 2016; 176: 1801-8.
299. Kwok CS, Arthur AK, Anibueze CI, et al. Risk of Clostridium difficile infection with acid suppressing drugs and antibiotics: metaanalysis. Am J Gastroenterol 2012; 107: 1011-9.
300. Smith A. Outbreak of Clostridium difficile infection in an English hospital linked to hypertoxin producing strains in Canada and the US. Euro Surveill 2005; 10: E050630.2.
301. Barker AK, Ngam C, Musuuza JS, et al. Reducing Clostridium difficile in the inpatient setting: A systematic review of the adherence to and effectiveness of C. difficile prevention bundles. Infect Control Hosp Epidemiol 2017; 38: 639-50.
302. Louh IK, Greendyke WG, Hermann EA, et al. Clostridium Difficile infection in acute care Hospitals: Systematic review and best practices for prevention. Infect Control Hosp Epidemiol 2017; 38: 476-82.
303. Vonberg RP, Kuijper EJ, Wilcox MH, et al. Infection control measures to limit the spread of Clostridium difficile. Clin Microbiol Infec 2008; 14: 2-20.
304. McDonald EG, Milligan J, Frenette C, et al. Continuous proton pump inhibitor therapy and the associated risk of recurrent Clostridium difficile infection. JAMA Intern Med 2015; 175: 784-91.
305. Azab M, Doo L, Doo DH, et al. Comparison of the hospital-acquired Clostridium difficile infection risk of using proton pump inhibitors versus histamine-2 receptor antagonists for prophylaxis and treatment of stress ulcers: A systematic review and meta-analysis. Gut Liver 2017; 11: 781-8.
306. Curcio D, Cané A, Fernández F, et al. C. difficile-associated diarrhea in developing countries: A systematic review and meta-analysis. Infect Dis Ther 2019; 8: 87-103.
307. Trindade CNR, Domingues R, Ferreira EO. The epidemiology of Clostridioides difficile infection in Brazil: A systematic review covering thirty years. Anaerobe 2019; 58: 13-21.
308. Carignan A, Poulin S, Martin P, et al. Efficacy of secondary prophylaxis with vancomycin for preventing recurrent Clostridium difficile infections. Am J Gastroenterol 2016; 111: 1834-40.
309. Caroff DA, Menchaca JT, Zhang Z, et al. Oral vancomycin prophylaxis during systemic antibiotic exposure to prevent Clostridiodes difficile infection relapses.Infect Control Hosp Epidemiol 2019; 40: 662-7.
310. Van Hise NW, Bryant AM, Hennessey EK, Crannage AJ, Khoury JA, Manian FA. Efficacy of oral vancomycin
in preventing recurrent Clostridium difficile infection in patients treated with systemic antimicrobial agents. Clin Infect Dis 2016; 63: 651-3.
311. Splinter LE, Kerstenetzky L, Jorgenson MR, et al. Vancomycin prophylaxis for prevention of Clostridium difficile infection recurrence in renal transplant patients. Ann Pharmacother 2018; 5: 113-9.
312. Hvas CL, Dahl Jørgensen SM, Jørgensen SP et al. Fecal microbiota transplantation is superior to fidaxomicin for treatment of recurrent Clostridium difficile infection. Gastroenterology 2019; 156: 1324-32.
313. Bajaj J, Kassam Z, Fagan A, et al. Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: A randomized clinical trial. Hepatology 2017; 66: 1727-38.
314. Philips CA, Phadke N, Ganesan K, et al. Corticosteroids, nutrition, pentoxifylline, or fecal microbiota transplantation for severe alcoholic hepatitis. Indian J Gastroenterol 2018; 37: 215-25.
315. U.S. Food & Drug administration. Important safety alert regarding use of fecal microbiota for transplantation and risk of serious adverse reactions due to transmission of multi-drug resistant organisms. June 13, 2019. En: https://www.fda.gov/vaccines-blood-biologics/safetyavailability-biologics/important-safety-alert-regarding-usefecal-microbiota-transplantation-and-risk-serious-adverse;
consultado julio 2019.
