Esta nota fue inducida por un artículo reciente, de afirmativo título, que relata un trabajo que con técnicas novedosas añade al pulmón una función central en la biogénesis de las plaquetas sanguíneas y aún en la hemopoiesis1. Pero antes de llegar al artículo en cuestión conviene detenerse en algunos jalones en la evolución de este conocimiento.
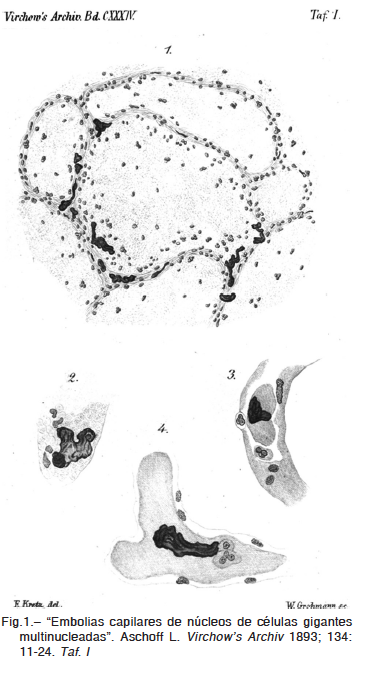
Ludwig Aschoff, en 1893, describió a los núcleos de megacariocitos alojados en los capilares pulmonares, ilustró el hecho y lo llamó embolia capilar de núcleos de células gigantes (Fig. 1). En la octava edición de su influyente tratado de patología humana dice2:
“[…] La más frecuente es la embolia de células gigantes, o, más correctamente, la embolia de núcleos gigantes. Se trata del paso de los megacariocitos de la médula ósea a la sangre. Como quiera que el citoplasma de estas células suele desintegrarse en las plaquetas al pasar al torrente circulatorio, queda el núcleo casi desnudo, el cual se atasca en los capilares pulmonares, y a veces, cuando está abierto el agujero oval, también en los glomérulos del riñón, o en los capilares del cerebro o de otro territorio cualquiera. Ya se comprende que esta forma de embolia celular no puede reconocerse nada más que al microscopio. No sabemos si en realidad tiene alguna importancia, pues es indudable que estas embolias nucleares se observan ya normalmente en los capilares del pulmón. En circunstancias patológicas (en la difteria, tras las quemaduras) puede elevarse notablemente el número de núcleos gigantes embolizados.”1
Los megacariocitos de la médula ósea fueron identificados como células gigantes por Giulio Bizzozero en 1869. Pio Foá y G. Salvioli, en 1880, interpretaron que fragmentos de estas células, cuerpos hialinos, estaban implicados en la formación de la membrana de los glóbulos rojos, y William Henry Howell, en 1890, las diferenció de los osteoclastos, les dio el nombre, e interpretó esos cuerpos hialinos como vacuolas de secreción3. Finalmente, en 1906 James Homer Wright estableció que las plaquetas, vislumbradas como cuerpos hialinos o vacuolas, se forman en el citoplasma de los megacariocitos de la médula ósea que luego se disgrega y pasan como plaquetas a la circulación4.
Lo aceptado, entonces, era que las plaquetas de la sangre circulante provenían de la fragmentación del citoplasma de los megacariocitos de la médula ósea y que los núcleos desnudos de megacariocitos exhaustos terminaban atascados en los capilares pulmonares, como describió Aschoff.
Pero en 1937 Howell y Donahue, el mismo Howell que acuñó el nombre de megacariocitos, parten de la hipótesis que las venas emergentes de un órgano u órganos que producen plaquetas deberían tener mayor número de plaquetas que la sangre venosa de otros órganos. Concluyen, tras laboriosos experimentos en gatos, algunos perros y humanos (sangre periférica venosa y arterial), que los pulmones son el sitio de producción de plaquetas puesto que el número de plaquetas de la sangre que salen (aorta) de los pulmones es mayor que el número de plaquetas que llegan (arteria pulmonar). Más aún, que si bien los megacariocitos se encuentran en la médula ósea y el pulmón, es en los pulmones donde se produce la mayor formación de plaquetas5.
En 1969 Kallinikos-Mainatis, en sangre central obtenida por cateterismos de individuos con enfermedades cardíacas, pero no hemáticas, observó la presencia y un número mayor de megacariocitos con citoplasma (seis veces más) en la sangre de la arteria pulmonar (venosa) que en la aorta (arterial), y un número mayor de plaquetas en la sangre de la aorta (arterial), que en la de la arteria pulmonar (venosa). Entran más megacariocitos con la sangre venosa y salen más plaquetas en la sangre arterial. Estima la autora que si un megacariocito produce ~4000 plaquetas, el número de los que llegan no justifica el número de plaquetas que salen; considera y descarta que tal vez haya un reservorio de plaquetas, pero no considera la posibilidad que los megacariocitos produzcan plaquetas en los pulmones6.
La trombopoiesis pulmonar vuelve al ruedo en el 2000 con un artículo de Zucker-Franklin y Phillip. Aceleran la producción de plaquetas en ratones, con flebotomía o inyección de trombopoietina, y examinan con microscopía electrónica de trasmisión los capilares pulmonares. Los resultados muestran con claridad megacariocitos intactos, con campos de demarcación de plaquetas, plaquetas y núcleos “desnudos” (apoptóticos). En todos los ratones tratados se elevó el número de plaquetas en la sangre periférica, más en los tratados con trombopoietina. Las autoras aclaran que sus observaciones no excluyen la posibilidad que en la médula ósea se formen pro-plaquetas, pseudópodos de los megacariocitos que penetran en los sinusoides, antes de la migración de los megacariocitos a los pulmones7. En síntesis, es una evidencia directa de que no solo núcleos “desnudos” llegan a los capilares pulmonares sino megacariocitos intactos que allí forman y liberan plaquetas. En una extensa revisión del 2013 no se cita el artículo de Kalinikos-Mainatis ni el de Zucker-Franklin y Philipp8.
El atractivo del trabajo mencionado al comienzo, inductor de esta nota, es que, al contrario de los anteriores, no se basa en imágenes o conteos estáticos, sino en observaciones dinámicas en vivo. Los autores utilizaron, sobre todo, la microscopía intravital de dos fotones (2PIVM), técnica que permite observar, registrar y analizar imágenes en 3D de tejidos vivos de un espesor de casi 1 mm (500-900 μm)9.
Los experimentos se hicieron en ratones transgénicos, con el genoma insertado con el gen reportero PF4-Cre, que se expresa solo en las membranas de megacariocitos y plaquetas, el gen de la proteína fluorescente verde (GFP), y el de la proteína fluorescente td-Tomato que marca las membranas de las demás células10. Resultado: membranas de megacariocitos y plaquetas con fluorescencia verde, las demás células rojo tomate.
Con esta técnica, y otras tan complejas, los autores concluyen que por los capilares pulmonares circula gran número de megacariocitos, que allí se liberan plaquetas, el 50% de las que se encuentran en la sangre, 10 millones de plaquetas por hora; y que cada megacariocito produce entre poco menos de 500 a 1000 plaquetas; confirman que la producción aumenta cuando se induce con trombopoietina, que el origen de esos megacariocitos es la médula ósea, en menor medida el bazo, ninguno del hígado; no observan que en la médula ósea se formen pro-plaquetas sino en los pulmones. Y, sorpresa, en el pulmón existe una población de megacariocitos extravasculares, el 15% del total de megacariocitos del pulmón; no solo eso, sino también una población de precursores hematopoyéticos capaces de repoblar una médula ósea dañada.
El trabajo está cargado de datos, hay que leerlo y releerlo para entender y apreciar el contenido en sus detalles. Por algo son catorce los autores, la sección Métodos ocupa casi dos páginas de letra menuda, sin contar los Extended data y videos. Los ratones transgénicos se compran, pero no se compran el trasplante ortotópico de pulmón o instalar una ventana en el díploe de los huesos del cráneo para ver la médula ósea. Con tantos métodos complicados y difíciles ¿Cómo repetir, confirmar o refutar las conclusiones? Esto no evita que el lector acostumbrado a las imágenes estáticas de los tejidos, se deslumbre con las imágenes de los accesibles videos que presentan en vivo y con los actores identificados con precisión, lo que ocurre en los capilares pulmonares.
Donde Aschoff, en 1893, encontró quietos núcleos desnudos, no todos (ver 3 en Fig. 1), restos de células gigantes multinucleadas, ahora, 124 años después, podemos ver megacariocitos que viven, se mueven y gozan de buena salud.
Juan Antonio Barcat
e-mail: jabarcat@yahoo.com.ar
1. Le François E, Ortiz-Muñoz G, Cuadrillier A, et al. The lung is the site of platelet biogenesis and a reservoir for hemopoietic progenitors. Nature 2017; 544: 105-9.
2. Aschoff L. Tratado de Anatomía Patológica. Barcelona: Labor, 1950. 2da. Edición. Traducción de la 8va. Edición alemana (1936) por Julio G. Sánchez Lucas. Tomo I, Capítulo V Trastornos circulatorios (disciclias). 6. Embolia. b) la embolia celular. p.455.
3. Tocantins LM. Historical notes of blood platelets. Blood 1948; 3: 1073-82.
4. Wright JH. The origin and nature of the blood plates. Boston Med Surg J 1906; 154: 643-5. 5. Howell WH, Donahue DD. The production of blood platelets in the lung. J Exp Med 1937; 65: 177-203.
6. Kallinikos-Maniatis A. Megakaryocytes and platelets in central venous and arterial blood. Acta haematol 1969: 42: 330-5.
7. Zucker-Franklin D, Philipp CS. Platelet production in the pulmonary capillary bed. New ultrastructural evidence for an old concept. Am J Pathol 2000; 157: 69-74.
8. Machlus KR, Italiano JE (Jr.). The incredible journey: From megakaryocyte development to platelet formation. J Cell Biol 2013; 201: 785-96.
9. Weigert R, Porat-Shliom N, Amornphimoltham P. Imaging in live animals: Ready for prime time. J Cell Biol 2013; 201: 969-79.
10. Pérez Millán MI, Becú-Villalobos D. La proteína verde fluorescente ilumina la biociencia. Medicina (B Aires) 2009; 69: 370-4.
Agradecimientos: A los Dres. Basilio A. Kotsias y Felisa A. Molinas por sus sugerencias.
