SANTIAGO REIMONDEZ, FEDERICO MOSER, PABLO S. MALDONADO, ÁLVARO ALCARAZ,
ALEJANDRO M. ROSSINI, LUCIO R. OBEIDE
Hospital Privado Universitario de Córdoba, Instituto Universitario de Ciencias Biomédicas de Córdoba, Argentina
Resumen Los tumores gastrointestinales del estroma son las neoplasias mesenquimatosas más frecuentes del
tracto gastrointestinal. Numerosas investigaciones se han dirigido al tratamiento laparoscópico de los mismos. El propósito de este estudio es evaluar la seguridad y la eficacia de las gastrectomías atípicas en un hospital de alta complejidad de nuestro medio. En el período comprendido entre enero 2009 y diciembre 2015, 24 pacientes con sospecha de GIST gástrico fueron intervenidos quirúrgicamente vía laparoscópica, considerándose criterio de inclusión la ausencia de metástasis hepáticas y peritoneales a distancia, el tamaño tumoral < 5 cm de diámetro y la positividad del antígeno CD117 en los estudios inmunohistoquímicos. Se analizaron retrospectivamente las características clínico-patológicas, los resultados quirúrgicos, las complicaciones postoperatorias y los resultados oncológicos. Fueron incluidos en el estudio estadístico 14 pacientes. La edad promedio fue 60 años (10 mujeres y 4 hombres) y la hemorragia digestiva alta fue la sintomatología de diagnóstico más frecuente. El tiempo promedio de cirugía fue 113 minutos, con necesidad de conversión en un caso. No se registraron complicaciones mayores, reintervenciones ni reinternaciones. El tamaño tumoral promedio fue 41 mm, con márgenes quirúrgicos libres de enfermedad. El promedio de internación fue 3 días y el de seguimiento 44 meses, sin registro de recidivas tumorales. El abordaje laparoscópico a través de gastrectomías atípicas del GIST gástrico resultó una técnica segura y eficaz con buenos resultados a corto y mediano plazo en manos de cirujanos con experiencia.
Palabras clave: Tumores del estroma gastrointestinal, cirugía laparoscópica, gastrectomía
Abstract Laparoscopic atypical gastrectomy in the treatment of gastric GIST. Short-term and medium-
term outcomes. Gastrointestinal stromal tumors are the most common mesenchymal neoplasms of the gastrointestinal tract. Recently, many studies have addressed the laparoscopic management of these tumors. The aim of this study was to evaluate the safety and efficacy of laparoscopic atypical gastrectomy in the resolution of these neoplasms. In the period between January 2009 and December 2015, 24 patients with suspected gastric GIST less than 5 cm in size underwent surgery under this approach. Abscense of peritoneal and liver metastases and immunohistochemistry expression of CD117 antigen were considered as inclusion criteria. We retrospectively analyzed clinical and histopathological characteristics, surgical outcomes, postoperative complications and oncological results. Statistical analysis included 14 patients. The mean age was 60 years (10 women and 4 men) and upper gastrointestinal bleeding was the chief complaint for consultation. Conversion to open surgery was necessary in one case and no major complications, readmissions or reoperations were recorded. The mean tumor size was 41 mm with negative resection margin in all samples. The mean hospital stay was 3 days and no tumor recurrences were recorded in 44 months of follow-up. Laparoscopic atypical gastrectomy for gastric GIST is a safe and effective technique with good outcomes in experienced hands.
Key words: Gastrointestinal stromal tumor, laparoscopic surgery, gastrectomy
Recibido: 16-X-2016 Aceptado: 5-V-2017
Dirección postal: Santiago Reimondez, Hospital Privado Universitario de Córdoba, Naciones Unidas 346, 5016 Córdoba, Argentina
e-mail: santi_rei@hotmail.com
Los tumores del estroma gastrointestinal (GIST, de gastrointestinal stromal tumors) son los tumores mesenquimatosos más frecuentes del tracto gastrointestinal, caracterizados por su crecimiento submucoso y su escaso potencial maligno1. Si bien pueden localizarse en distintos sitios del aparato digestivo, han sido referidos al estómago en el 50-70% de los casos2, 3. Por su semejanza histológica, se cree que derivan de las células de Cajal, diferenciándose del resto de los tumores submucosos gastrointestinales por sus características inmunohistoquímicas4-6, ya que expresan el antígeno CD117 (parte del receptor KIT tirosina-quinasa)7. El potencial maligno de estas neoplasias depende del tamaño del tumor, del número de mitosis y de la localización del mismo8.
En ausencia de metástasis hepáticas o peritoneales, la resección quirúrgica con márgenes macroscópicamente libres, sin linfadenectomía profiláctica y evitando la ruptura tumoral, continúa siendo la principal opción terapéutica9, 10. Las gastrectomías atípicas o segmentarias se definen como aquellas que se realizan sin seguir parámetros estrictos. En los últimos años, con el avance en las técnicas laparoscópicas, fueron publicadas distintas series de casos con buenos resultados en el tratamiento de tumores de pequeño y mediano tamaño3, incluso con mejoras en tiempo quirúrgico, complicaciones, estadía hospitalaria y recidiva tumoral, comparado con la técnica convencional11. Actualmente está en discusión dicho abordaje para tumores de mayor tamaño12, 13.
El objetivo del presente estudio es analizar resultados del tratamiento quirúrgico laparoscópico de gastrectomías segmentarias en GIST gástricos llevado a cabo en un hospital de alta complejidad de nuestro medio.
Materiales y métodos
Fueron evaluadas retrospectivamente las historias clínicas de pacientes intervenidos mediante gastrectomía segmentaria vía laparoscópica por sospecha de GIST gástrico primario entre enero de 2009 y diciembre de 2015. Los casos fueron estudiados con endoscopía digestiva alta y tomografía computarizada (TAC). Los criterios de inclusión fueron la ausencia de metástasis a distancia, tumores localizados sin invasión de órganos adyacentes y tamaño tumoral menor a 5 cm en evaluación previa por imágenes. Fueron excluidos tumores localizados en unión esófago-gástrica y píloro. Según resultados de anatomía patológica, se consideró diagnóstico definitivo la inmunohistoquímica positiva para antígeno CD117. Se evaluaron los márgenes quirúrgicos de seguridad y la clasificación de Fletcher14 de acuerdo al tamaño tumoral en mm y la cantidad de mitosis por campo.
Se revisaron y analizaron retrospectivamente datos demográficos, clínica de presentación, tiempo quirúrgico, necesidad de endoscopía intraoperatoria para localización tumoral, conversión a técnica convencional, ruptura intraoperatoria del tumor, tiempo de internación en días, reinternaciones, tiempo de seguimiento y recidiva tumoral. Respecto a las complicaciones, se evaluó el diagnóstico de hemorragia digestiva endo y extraluminal, fístula según los criterios de Bruce y col.15, infección de herida quirúrgica y mortalidad antes de los 30 días de postoperatorio. Luego del alta, los pacientes recibieron seguimiento periódico con endoscopía y/o TAC cada 6 meses los primeros dos años y anualmente luego de los tres años.
El análisis estadístico fue realizado utilizando como software SPSS 20® (Armonk, NY: IBM Corp.).
Técnica operatoria: Bajo anestesia general, los pacientes fueron ubicados en decúbito supino con posición de Fowler, con el cirujano entre las piernas y el primer ayudante a la izquierda. El primer trócar de 10 mm fue colocado en sitio umbilical con insuflación posterior con CO2 a 13 mmHg según técnica de Hassan. Se colocó de manera protocolar un trócar de 10 mm en hipocondrio izquierdo, y dos trócares de 5 mm en flanco izquierdo e hipocondrio derecho. Un quinto trócar de 5 mm fue colocado en epigastrio para la utilización de retractor hepático tipo Nathanson. Se llevó a cabo en todos los casos una exploración minuciosa de la cavidad abdominal a fin de descartar metástasis peritoneales o hepáticas.
La gran mayoría de los tumores pudieron ser identificados o palpados con instrumentos laparoscópicos sin dificultad, requiriéndose en dos oportunidades endoscopía intraoperatoria para su marcación.
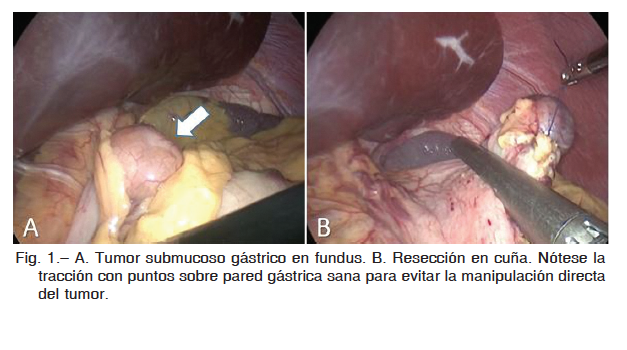
Las masas tumorales ubicadas en cara anterior o curvatura mayor fueron tratadas con resección en cuña o segmentaria, utilizando una o más recargas de engrapadora lineal endoscópica, evitando de esta manera abrir la cavidad gástrica. Se utilizó técnica de lifting, traccionando el segmento gástrico a resecar con puntos de sutura sobre tejido sano a fin de facilitar el posicionamiento de la engrapadora lineal para una resección segmentaria con márgenes libres (Fig. 1).
En todos los casos se colocó bujía de 52 French como calibración.
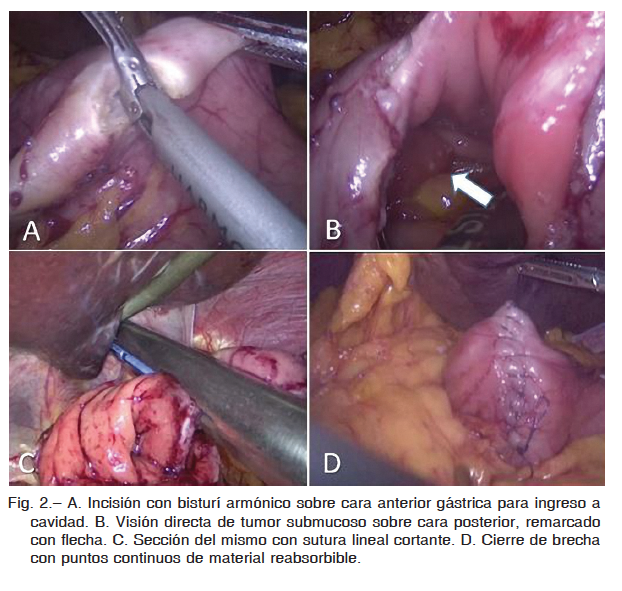
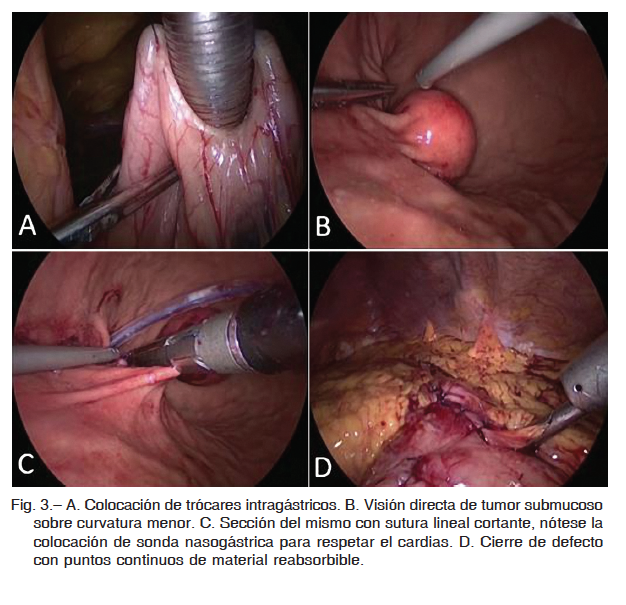
Para la presentación en cara posterior de dicho tumor, en dos casos se realizó resección transgástrica del mismo, incidiéndose la cara anterior del estómago con ultracisión y posterior resección tumoral en cuña una vez expuesta la lesión según técnica de Hepworth. Cierre con puntos continuos de material reabsorbibles (Fig. 2). En otro, se llevó a cabo resección endogástrica con insuflación a baja presión, con colocación de tres trócares intragástricos (Fig. 3).
Todos los especímenes fueron retirados bajo protección con bolsa plástica.
Resultados
Entre enero 2009 y diciembre 2015, 24 pacientes con sospecha de GIST gástrico fueron intervenidos mediante gastrectomía segmentaria por vía laparoscópica. Un paciente fue excluido por presentar tumoración de 17 cm según TAC. Presentaron positividad inmunohistoquímica 14 (10 mujeres y 4 hombres). Los casos restantes fueron
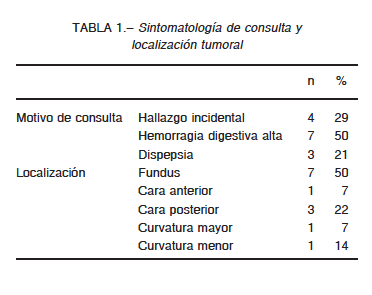
excluidos del análisis estadístico. La edad media fue 60 años (rango 47-77). La sintomatología de consulta y la localización tumoral se resumen en la Tabla 1.
Se llevaron a cabo 14 resecciones segmentarias siendo necesaria endoscopía intraoperatoria en dos oportunidades para identificación y marcación del tumor.
El tiempo medio de cirugía fue 113 min. (rango 52-172), sin ruptura de tumor en el intraoperatorio y requiriéndose conversión en un episodio.
El tiempo promedio de internación fue 3 días (rango 2 a 5), sin reinternaciones. En los primeros 30 días de postoperatorio no se registraron infecciones de herida quirúrgica, hemorragia digestiva, fístulas ni óbitos.
Según los resultados de anatomía patológica, el tamaño tumoral medio fue 41 mm (10-70), con márgenes quirúrgicos libres de enfermedad y menos de 5 mitosis por campo en todos los casos. De acuerdo a la clasificación de Fletcher se registraron 12 casos de bajo potencial maligno y 2 de moderado riesgo.
En seguimiento promedio de 44 meses no se registraron recidivas tumorales.
Discusión
El diagnóstico de GIST gástrico se torna difícil por su característico crecimiento submucoso, apareciendo en un gran porcentaje de los casos de manera incidental. Si bien la gran mayoría de ellos son detectados por TAC y/o endoscopía digestiva alta, el diagnóstico inmunohistoquímico preoperatorio se torna casi inaccesible por la dificultad de biopsiar gran cantidad de tejido de la lesión. Este problema no ha sido resuelto con la aparición de la ecoendoscopía16, probablemente debido a la heterogeneidad de estas neoplasias14, aunque el procedimiento ha demostrado ser útil en la diferenciación entre lesiones propiamente submucosas y lesiones compresivas extrínsecas del estómago. En nuestro caso, la ecoendoscopía no fue considerada un método de imagen de rutina.
La endoscopía y la laparoscopía simultánea han demostrado ser muy efectivas a la hora de ubicar estos tumores submucosos para la resección quirúrgica17. En nuestra experiencia, hemos logrado la resección de dos tumores de difícil localización mediante este método. Los restantes pudieron ser identificados fácilmente bajo visión directa por laparoscopía. En el caso de tumores ubicados en cara posterior con difícil acceso, hemos abordado dos de ellos vía gastrotomía anterior con técnica de lifting aplicando la técnica descripta por Hepworth y col.18, y un caso con resección endogástrica laparoscópica, con muy buenos resultados posteriores.
Otani y col.3 y Nakamori y col.19 demostraron que la resección laparoscópica de tumores de 2 a 5 cm es segura y con resultados oncológicos favorables a mediano y largo plazo. A partir de nuestro trabajo podemos arribar a las mismas conclusiones.
Respecto a tumores de mayor tamaño, en 2010 la National Comprehensive Cancer Network (NCCN) sugirió que tumores que superen los 5 cm podrían ser resecados vía laparoscópica o con hand-assisted laparoscopic surgery. Sin embargo, la guía práctica de la Sociedad Europea para el manejo médico oncológico en 2012, claramente cuestionó el uso de cirugía laparoscópica en GIST de gran tamaño. En nuestra experiencia, todos los casos fueron considerados preoperatoriamente menores a 5 cm según los estudios complementarios; no obstante, los resultados de la anatomía patológica demostraron que dos de ellos superaban este tamaño.
Actualmente, la comunidad científica cuenta con trabajos con buenos resultados en la resección de GIST de hasta 12 cm13, 20. Sin embargo, la técnica está en revisión por la gran laparotomía requerida para extraer el espécimen de la cavidad abdominal evitando la ruptura del mismo. Es por lo anterior que, en 2014, Chih Yang y col.12 sugirieron que la resección laparoscópica de GIST gástrico no debería extenderse a tumores de más de 8 cm para preservar las ventajas de la cirugía mínimamente invasiva.
En nuestra serie fue necesaria una conversión a cirugía convencional debido a un hallazgo de tamaño tumoral de 6.6 cm en antro gástrico con múltiples adherencias, a fin de evitar una excesiva manipulación del tumor y la posibilidad de esparcimiento de células hacia el peritoneo. No se registraron complicaciones posteriores. El índice de conversión fue 4% para tumores submucosos del estómago, resultados que consideramos esperables según la literatura internacional21. Sin embargo, este resultado puede estar sesgado por el reducido número de casos evaluados en nuestro estudio.
Las diferentes comunicaciones informan que los lugares específicos de recidiva suelen ser el sitio quirúrgico, el hígado y el peritoneo, y el tiempo promedio para la detección de los mismos es 15.5 meses22. Hasta la fecha, con 44 meses promedio de seguimiento de nuestros pacientes, no hemos detectado recidivas.

Bibliografía
1. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol 1983; 7: 507-19.
2. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinal stromal tumors (GISTs): a review. Eur J Cancer 2002; 38 Suppl 5: S39-51.
3. Otani Y, Furukawa T, Yoshida M, et al. Operative indications for relatively small (2-5 cm) gastrointestinal stromal tumor of the stomach based on analysis of 60 operated cases. Surgery 2006; 139: 484-92.
4. Graadt van Roggen JF, van Velthuysen ML, Hogendoorn PC. The histopathological differential diagnosis of gastrointestinal stromal tumours. J Clin Pathol 2001; 54: 96-102.
5. Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998; 152: 1259-69.
6. Sircar K, Hewlett BR, Huizinga JD, Chorneyko K, Berezin I, Riddell RH. Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 1999; 23: 377-89.
7. Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998; 279: 577-80.
8. Lai I-R, Lee W-J, Yu S-C. Minimally invasive surgery for gastric stromal cell tumors: intermediate follow-up results. J Gastrointest Surg 2006; 10: 563-6.
9. DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 2000; 231: 51-8.
10. Langer C, Gunawan B, Schuler P, Huber W, Fuzesi L, Becker H. Prognostic factors influencing surgical management and outcome of gastrointestinal stromal tumours. Br J Surg 2003; 90: 332-9.
11. De Vogelaere K, Hoorens A, Haentjens P, Delvaux G. Laparoscopic versus open resection of gastrointestinal stromal tumors of the stomach. Surg Endosc 2013; 27: 1546-54.
12. Hsiao C-Y, Yang C-Y, Lai I-R, Chen C-N, Lin M-T. Laparoscopic resection for large gastric gastrointestinal stromal tumor (GIST): intermediate follow-up results. Surg Endosc 2015; 29: 868-73.
13. Lee J-S, Kim J-J, Park S-M. Totally laparoscopic resection for a large gastrointestinal stromal tumor of stomach. J Gastric Cancer 2011; 11: 239-42.
14. Fletcher CDM, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol 2002; 33: 459-65.
15. Bruce J, Krukowski ZH, Al-Khairy G, Russell EM, Park KG. Systematic review of the definition and measurement of anastomotic leak after gastrointestinal surgery. Br J Surg 2001; 88: 1157-68.
16. Philipper M, Hollerbach S, Gabbert HE, et al. Prospective comparison of endoscopic ultrasound-guided fine-needle aspiration and surgical histology in upper gastrointestinal submucosal tumors. Endoscopy 2010; 42: 300-5.
17. Walsh RM, Ponsky J, Brody F, Matthews BD, Heniford BT. Combined endoscopic/laparoscopic intragastric resection of gastric stromal tumors. J Gastrointest Surg 2003; 7: 386-92.
18. Hepworth CC, Menzies D, Motson RW. Minimally invasive surgery for posterior gastric stromal tumors. Surg Endosc 2000; 14: 349-53.
19. Nakamori M, Iwahashi M, Nakamura M, et al. Laparoscopic resection for gastrointestinal stromal tumors of the stomach. Am J Surg 2008; 196: 425-9.
20. Anania G, Dellachiesa L, Fabbri N, et al. Totally laparoscopic resection of a very large gastric GIST. G Chir 2013; 34: 227-30.
21. Pelletier J-S, Gill RS, Gazala S, Karmali S. A Systematic review and meta-analysis of open vs. laparoscopic resection of gastric gastrointestinal stromal tumors. J Clin Med Res 2015; 7: 289-96.
22. Lai I-R, Chen C-N, Lin M-T, Lee P-H. Surgical treatment of gastric gastrointestinal stromal tumors: analysis of 92 operated patients. Dig Surg 2008; 25: 208-12.
