SOLEDAD PEREZ1, LORENA STEINBRECHER1, SILVINA TAVELLA2, NORMA HEINE2, EDUARDO WARLEY1, 2
1 Hospital de Morón, Morón, Buenos Aires, 2Hospital Dr. Diego Paroissien, Isidro Casanova, Buenos Aires, Argentina
Resumen La principal infección viral transmisible por sangre es actualmente la debida al virus de hepatitis C (VHC). Uno de los mayores obstáculos para el logro de su control en la Argentina se relaciona con las dificultades de acceso al diagnóstico y tratamiento oportuno de las personas infectadas. Este estudio se realizó con el objetivo de caracterizar a los pacientes infectados con VHC que iniciaron tratamiento con antivirales de acción directa (AAD) y describir la experiencia vinculada al tratamiento. Se seleccionaron las historias clínicas de 82 pacientes, 44 (53.7%) de sexo masculino, 37 (45.1%) de sexo femenino, y uno (1.2%) transgénero. La media de edad fue de 49 años. Se halló una frecuencia de cirrosis de 39%, 32 pacientes, coinfección con HIV en 48 (58.5%) y con VHB en 27 (32.9%). En 52 (63.4%) no se observó ningún factor de riesgo claramente asociado a infección. Todos completaron la terapia, de ellos 72 (87.8%) efectuaron el control para confirmar respuesta viral sostenida (RVS), que fue de 98.6%. Concluimos que el testeo universal debe implementarse por sobre el testeo con enfoque de riesgo, y que debe promoverse un criterio de atención simplificado y descentralizado, reservando la atención especializada para pacientes con cirrosis descompensada y cáncer de hígado.
Palabras clave: hepatitis C, testeo universal, tratamiento
Abstract Hepatitis C virus (HCV) infection is currently the main blood-borne viral infection. One of the main obstacles to achieving its control in Argentina is related to difficulties in accessing the diagnosis and timely treatment of infected people. We carried out this study with the aim of characterizing the HCV-infected patients who started treatment with direct-acting antivirals (DAAs) and to describe the experience related to treatment. The medical records of 82 patients, 44 (53.7%) male, 37 (45.1%) female, and one (1.2%) transgender, were selected. The mean age was 49 years. We report a frequency of cirrhosis, 39%, in 32 patients, coinfection with HIV in 48 (58.5%) and with HBV in 27 (32.9%). In 52 patients (63.4%), no risk factor clearly associated with infection was observed. All completed the therapy, of them 72 (87.8%) carried out the control to confirm sustained viral response (SVR), that attained 98.6%. We conclude that universal testing should be implemented over testing based on a risk approach, and that a simplified and decentralized care criterion should be promoted, reserving specialized care for patients with decompensated cirrhosis and liver cancer.
Key words: hepatitis C, universal screening, treatment
Dirección postal: María Soledad Perez, Dr. Monte 848, 1708 Morón, Buenos Aires, Argentina
e-mail: draperezsoledad@gmail.com
La hepatitis C (VHC) es en la actualidad la principal infección viral transmisible por sangre. Causa infección crónica que puede evolucionar a cirrosis y cáncer de hígado, y es, de acuerdo a lo informado por los centros de trasplante, una de las principales causas de trasplante hepático1.
Si bien no disponemos de datos precisos, la prevalencia estimada de hepatitis C en América Latina, de acuerdo a datos informados por los bancos de sangre, se encuentra entre 1.4 y 2.5%2, 3. La OMS considera a la Argentina como un país con prevalencia baja, menor al 2%. En algunas poblaciones, como en personas usuarias de drogas intravenosas (UDI) y en aquellas infectadas por HIV, la prevalencia es significativamente mayor, siendo para estas últimas de alrededor del 30%4, 5.
El virus de la hepatitis C se conoce desde el año 1989, y desde la aparición de los antivirales de acción directa (AAD) se cuenta con un tratamiento de alta eficacia y elevadas tasas de curación. Previo a ello, hubo un largo período donde los tratamientos disponibles eran de baja efectividad, larga duración, mal tolerados desalentando, tanto a los pacientes como a los equipos de salud, en la búsqueda de diagnóstico y tratamientos adecuados6,7.
En nuestro país, el programa nacional de Sida, infecciones de transmisión sexual y hepatitis virales, promueve el diagnóstico y tratamiento de las personas infectadas y brinda los recursos para dicho fin. Argentina además adhirió a los objetivos de la OMS de erradicar las hepatitis virales para el año 20308.
Uno de los principales obstáculos para el logro de los objetivos propuestos por el país, se relaciona con las dificultades de acceso al diagnóstico y tratamiento oportuno de las personas infectadas.
En un contexto marcado por dificultades socioeconómicas crecientes de su población, el conurbano bonaerense es una región donde los problemas de acceso son más manifiestos. Los hospitales Municipal de Morón y Diego Paroissien de Isidro Casanova son dos centros de salud ubicados en la zona oeste de dicha región. Los consultorios de infectología de esos hospitales han desarrollado espacios específicos para la atención de pacientes con hepatitis viral crónica, motivados por la idea de facilitar dicho acceso.
Realizamos este estudio con el objetivo de caracterizar a los infectados con VHC que iniciaron tratamiento con AAD y describir la experiencia del tratamiento de la misma con estos fármacos.
Materiales y métodos
Se realizó un análisis descriptivo, retrospectivo observacional, de la cohorte de 82 pacientes mayores de 18 años con VHC que iniciaron tratamiento con AAD en los consultorios de infectologia del hospital de Morón y del hospital Paroissien entre 2016 y 2019. Todos los pacientes a los que se les indicó tratamiento y les fue provista la medicación, iniciaron la terapia. Se excluyeron del análisis los pacientes que se hallaban con tratamiento en curso. Las variables utilizadas para caracterizarlos fueron: edad, género, índice de masa corporal, consumo actual de tabaco, alcohol y/o drogas ilícitas, diabetes, coinfección con virus de hepatitis B (VHB) y/o HIV, modo primario probable de infección, presencia de cirrosis, carga viral y genotipo de VHC.
Efectuamos análisis de las distintas variables de forma global y estratificada según género.
Se consideró infección por VHC a la presencia de serología reactiva confirmada por carga viral, y coinfección con VHB a la presencia de anticuerpo anticore reactivo.
Los modos primarios de infección evaluados fueron uso de drogas intravenosas actual o pasada, hombres que tienen sexo con hombres (HsxH), antecedentes de transfusiones de productos derivados de la sangre y/o exposición ocupacional a sangre o fluidos biológicos.
Previo al inicio del tratamiento se efectuó evaluación clínica incluyendo estudios de laboratorio, carga viral y genotipo para hepatitis C y ecografía en todos los casos.
Se efectuó elastografía en 42 pacientes (51.2%), las que fueron financiadas por las obras sociales de los mismos o por aportes privados. Se realizaron y analizaron desde el punto de vista anatomopatológico biopsias hepáticas en 15 (18.3%) pacientes. En todos los casos con sospecha de enfermedad hepática avanzada se solicitó video endoscopía digestiva alta. Durante el tratamiento se efectuaron controles clínicos y de laboratorio de seguridad a las 6 semanas y al final del tratamiento. En todos los casos se brindó atención personalizada y un contacto telefónico médico y de enfermería para cualquier consulta.
Se consideró con diagnóstico de cirrosis a aquellos casos que presentaron signos clínicos indirectos definitorios de la misma, o diagnóstico histopatológico por biopsia, o medición de la rigidez hepática por elastografía con un score METAVIR F4 o, de no disponer de ningún de los métodos mencionados, scores bioquímicos APRI con puntuación mayor a 1.5 o Fib 4 mayor a 3.259, 10.
La carga viral de hepatitis C y el genotipo se determinaron en el centro de referencia designado por el programa nacional de hepatitis o por cobertura social en aquellos que disponían de ella.
Para describir la respuesta al tratamiento se evaluó el esquema antiviral indicado, la finalización o no del mismo y la respuesta viral sostenida (RVS).
Definimos RVS a un resultado del estudio de ARN del VHC no detectable en sangre luego de un período de 12 semanas o mayor, una vez concluido el tratamiento.
Los datos obtenidos de las historias clínicas fueron incorporados a una base de datos y analizados con el programa Statistix 7.0. Para evaluar las características de la población se efectuó un análisis de distribución de frecuencia de las variables categóricas y estadística descriptiva de las continuas.
El sistema público de salud a través del programa nacional de hepatitis virales cubrió el costo del tratamiento en 68 (82.9%) pacientes, mientras que en los otros 14 (17.1%) fue cubierto por las obras sociales a las cuales estaban adheridos.
La presentación del presente trabajo fue autorizada por los servicios de docencia e investigación del hospital de Morón y del hospital Paroissien.
Resultados
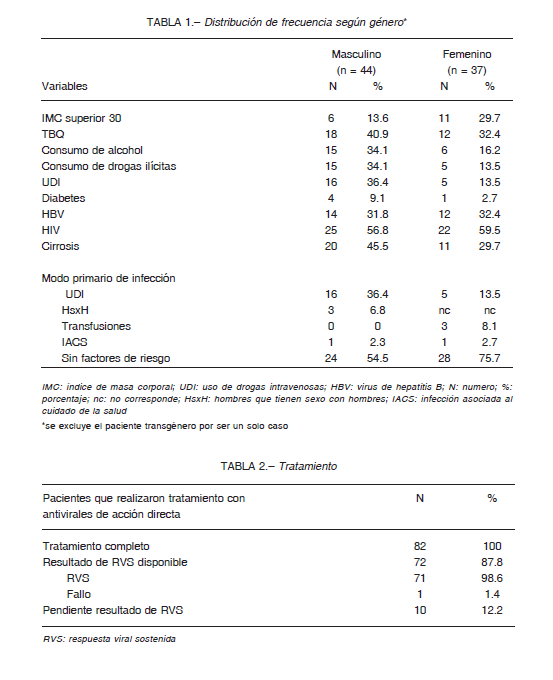
Se seleccionaron los informes de 82 pacientes, 44 (53.7%) de sexo masculino, 37 (45.1%) de sexo femenino, y uno (1) (1.2%) transgénero. La media de edad fue de 49 años (Tablas 1 y 2).
Observamos un índice de masa corporal superior a 30 en 18 pacientes (22%), diabetes en 5 (6.1%), consumo actual de tabaco en 30 (36.6%), alcohol en 21 (25.6%) y drogas ilícitas en 20 (24.4%). Se informó coinfección con HIV en 48 (58.5%) y con VHB en 27 (32.9%). De los pacientes evaluados se consideraron con diagnóstico de cirrosis 32 (39%).
El genotipo viral más frecuente fue el 1, en 65 (79.3%) pacientes, seguido en frecuencia por el genotipo 3 en 8 (9.8%). Se informaron 5 (6.1%) con genotipo 2 y 4 (4.9%) con genotipo 4.
El modo primario de infección fue por uso de drogas inyectables (UDI) en 21 casos (25.6%), transfusiones en 3 (3.7%), HsxH en 4 (4.9%) y asociado al cuidado de la salud en 2 (2.4%). En 52 (63.4%) no se observó ningún factor de riesgo claramente asociado a infección.
El 97% se definió asimismo como heterosexual. De los pacientes con antecedentes de UDI 16 (76.2%) estaban coinfectados con HIV.
En 52 (63.4%) la carga viral fue superior a 800 000 copias.
El esquema de tratamiento fue sofosbuvir + daclastavir en 61 (74.4%), sofosbuvir + daclastavir + ribavirina en 14 (17.1%), ombitasvir/ paritaprevir/ ritonavir+dasabuvir en 3 (3.7%), elbasvit/ grazaprevir en 2 (2.4%) y ledipasvir/sofosbuvir en 2 (2.4%). Presentaban fallo de tratamiento previo con interferón, 2 (2.3%).
Completaron el tratamiento 82 pacientes (100%), en 72 (87.8%) se disponen datos de respuesta virológica (RV) que fue sostenida (RVS) en 71 de ellos (98.6%), y fallo de tratamiento en 1 (1.4%). En 10 casos (12.2%), el dato de RVS no está disponible al momento actual, debido a que 7 pacientes completaron tratamiento y al corte de marzo de 2020 no habían superado el tiempo de 3 a 6 meses para realizar control y 3 no concurrieron a realizar estudios para confirmar RVS.
Ninguno debió suspender tratamiento por toxicidad o efectos adversos. Solo se observaron efectos adversos leves. No se informó ningún abandono de tratamiento.
Discusión
Los datos informados avalan, para el diagnóstico de infección por hepatitis C, la pesquisa universal de todas las personas, al menos una vez en la vida, por sobre el enfoque basado en prácticas de riesgo11 y, para su tratamiento, la factibilidad de simplificar el control y descentralizar su implementación hacia centros de menor nivel de complejidad. Aquellas personas con prácticas de riesgo elevadas deberían, por su parte, realizar estudios serológicos al menos con frecuencia anual.
Casi un 60% de la población estudiada refirió no presentar ninguna de las condiciones clásicamente asociadas a infección. Otros autores describen tasas similares en otras regiones12.
Durante años se ha discutido si la mejor estrategia para el diagnóstico de hepatitis C debía focalizarse en el estudio serológico de las denominadas poblaciones en riesgo o extenderla de manera generalizada a toda la población adulta13. El enfoque basado en factores de riesgo ha demostrado la pérdida de oportunidades diagnósticas de manera frecuente. En nuestro país el programa nacional de hepatitis recomienda que al menos una vez en la vida todas las personas mayores de 18 años se realicen el test. Es recién en abril de este año que los CDC en EE.UU. extienden la recomendación de estudio serológico a esa población y a las mujeres embarazadas, a realizarse en cada embarazo14, 15.
La eficacia y seguridad de los antivirales de acción directa (AAD) ya ha sido descripta en ensayos clínicos y en experiencias de la vida diaria16. De manera similar nuestra experiencia, desarrollada en centros de baja y mediana complejidad, en una población con predominio de infección por genotipo 1, presencia de cirrosis compensada en alrededor de 35% de los casos y un porcentaje de coinfectados con HIV cercano al 60%, mostró una elevada tasa de éxito, con muy buena adherencia por parte de los pacientes y sin efectos adversos de significación.
En el análisis según sexo observamos que la frecuencia de cirrosis, como así también la de consumo de alcohol, drogas ilícitas y UDI es de un valor cercano al 50%, más alta en personas de sexo masculino en comparación con el sexo femenino.
La simplificación y descentralización del tratamiento es promovida por distintos organismos17, 18. El estudio ECHO, coordinado por la universidad de Nueva México en EE.UU. ya describió, con los tratamientos a base de interferón, una mayor tasa de adherencia y de finalización de las terapias, descentralizando las mismas hacia el primer nivel de atención. En la actualidad dicho estudio sigue mostrando altas tasas de efectividad y se ha expandido hacia otras regiones, siendo Uruguay el primer país de la región incorporado al proyecto. Coordinado por esa universidad y con un enfoque que permite acercar el diagnóstico y tratamiento hacia lugares próximos a donde los pacientes desarrollan sus actividades, el proyecto ha logrado un éxito remarcable19.
El tratamiento de la hepatitis C carga con una historia ya superada de baja tasa de éxitos y terapias difíciles de tolerar por los efectos adversos, lo que no estimula a los pacientes ni a los médicos de cabecera a promover los estudios diagnósticos y las terapias. Una nueva visión debe ser incorporada, teniendo en cuenta el éxito de los tratamientos con los nuevos AAD.
Nuestro trabajo presenta algunas debilidades asociadas a un relativo bajo número de personas dentro de la población en estudio. En 12.2% de los pacientes no disponemos del dato de RVS, sin embargo, consideramos, ya que tenemos conocimiento que todos ellos completaron la terapia dentro de los parámetros indicados, que no existen elementos para dudar que los resultados finales sean diferentes a los del resto de ellos. Por otro lado, sus principales fortalezas se basan en la nula pérdida de seguimiento de pacientes y en la información de datos de la vida diaria de una población sub-representada en la mayoría de los estudios.
Concluimos que en la población estudiada una considerada elevada proporción (64%) no presentó factor de riesgo alguno clásicamente asociado con la infección por HCV y que los tratamientos fueron seguros, muy bien tolerados, con elevadas tasas de adherencia y logro de RVS.
Consideramos que el testeo universal debe ser promovido por sobre el basado solo en enfoque de riesgo, por lo que es necesario desarrollar actividades de capacitación y sensibilización entre los profesionales de la salud y la población en general. El testeo debe ser incorporado a los paquetes de cuidado de médicos generalistas, clínicos, obstetras y cirujanos, entre otras especialidades médicas.
Un enfoque de atención simplificado y descentralizado debe ser promovido reservando la atención especializada para pacientes con cirrosis descompensada y cáncer de hígado.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Shukla A, Vadeyar H, Rela M, Shah S. Liver Transplantation: East versus West. J Clin Exp Hepatol 2013; 3: 243-53.
2. Dirección de Sida, ETS, Hepatitis y TBC, Secretaría de Gobierno de Salud, Ministerio de Salud y Desarrollo Social. Argentina, 2019. Boletín sobre hepatitis virales en Argentina N° 1 octubre 2019. En: http://www.msal.gob.ar/sida/index.php/publicaciones/boletines-epidemiologicos; consultado noviembre 2019.
3. Angeleri P, Pando M, Solari J, Vidiella G. Hepatitis virales en Argentina. Ministerio de Salud y Desarrollo Social. Argentina. En: http://www.msal.gob.ar/images/stories/ryc/graficos/0000000865cnt-2014-09_estado-hepatitisvirales-argentina.pdf ; consultado noviembre 2019.
4. Nelson PK, Mathers BM, Cowie B, et al. The epidemiology of viral hepatitis among people who inject drugs: Results of global systematic reviews Lancet 2011; 378: 571-83.
5. Degenhardt L, Peacock A, Colledge S, et al. Global prevalence of injecting drug use and sociodemographic characteristics and prevalence of HIV, HBV, and HCV in people who inject drugs: a multistage systematic review. Lancet Glob Health 2017; 5: e1192-207.
6. Ridruejo E, Fainboim H, Villamil A. Cribado, diagnóstico y tratamiento de la hepatitis por virus C en la práctica clínica. Medicina (B Aires) 2016; 76: 390-8.
7. Organización Panamericana de la Salud. Directrices para la atención y el tratamiento de las personas diagnosticadas de infección crónica por el virus de la hepatitis C. Washington DC: Organización Panamericana de la Salud; 2018. En: https://iris.paho.org/bitstream/handle/10665.2/49680/9789275320372_spa.pdf?sequence=5&isAllowed=y; consultado enero 2020.
8. World Health Organization. Estrategia mundial del sector de la salud contra las hepatitis víricas, 2016-2021. WHO/HIV/2016.06. En: https://apps.who.int/iris/bitstream/handle/10665/250578/WHO-HIV-2016.06-spa.pdf ; consultado octubre 2019.
9. Boursier J, De Ledinghen V, Zarski JP, et al. Comparison of eight diagnostic algorithms for liver fibrosis in hepatitis C: New algorithms are more precise and entirely noninvasive. Hepatology 2012; 55: 58-67.
10. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis European Association for the Study of the Liver, J Hepatol 2015; 63: 237-64.
11. Graham CS, Trooskin S. Universal screening for hepatitis C virus infection. A step toward elimination 2020. JAMA 2020. doi: 10.1001/jama.2019.22313. Online ahead of print.
12. Deuffic-Burban S, Huneau A, Verleene A, et al. Assessing the cost-effectiveness of hepatitis C screening strategies in France. J Hepatol 2018; 69: 785-92.
13. HCV Guidance: Recommendations for testing, managing, and treating hepatitis C. The American Association for the Study of Liver Diseases. Last updated: May 24, 2018. En: www.hcvguidelines.org; consultado julio 2020
14. Hepatitis virales. Programa Nacional de Control de las Hepatitis Virales. En: https://www.argentina.gob.ar/salud/hepatitis/virus-c; consultado julio 2020.
15. Schillie S, Wester C, Osborne M, Wesolowski L, Ryerson AB. CDC recommendations for hepatitis C screening among adults – United States, 2020. MMWR Recomm Rep 2020; 69: 1-17.
16. Oluwaseun Falade-Nwulia, Suarez-Cuervo C, Nelson DR, et al. Oral direct-acting agent therapy for hepatitis C virus infection: A Systematic Review. Ann Intern Med 2017; 166: 637-48.
17. Drugs for Neglected Diseases Initiative. Un enfoque de salud pública para HCV. En:https://www.dndi.org/wpcontent/uploads/2018/09/DNDi_HCV_2018_SPA.pdf; consultado febrero 2020.
18. Kattakuzhy S, Gross C, Emmanuel B, et al. Expansion of treatment for hepatitis C virus infection by task shifting to community-based nonspecialist providers: A Nonrandomized Clinical Trial. Ann Intern Med 2017; 167: 311-8.
19. Cohen H. Proyecto ECHO. Acta Gastroent Latinoam 2019; 41: 6-10.
