FERNANDO REVOREDO REGO1, GUSTAVO REAÑO PAREDES1, JOSÉ DE VINATEA DE CÁRDENAS1, FRITZ KOMETTER BARRIOS1, SHEYLA ALFARO ITA2, JOSÉ VEREAU ROBLES3
1 Servicio de Cirugía de Páncreas, Bazo y Retroperitoneo, 2Servicio de Radiología Intervencionista, 3Servicio de Cuidados Intensivos, Hospital Nacional Guillermo Almenara Irigoyen, Lima, Perú
Resumen El tratamiento escalonado de la pancreatitis aguda necrotizante infectada consiste en el uso de antibióticos de amplio espectro, drenaje y necrosectomía mínimamente invasiva, si fuese necesaria. Esto ha reemplazado a la cirugía abierta como el estándar de tratamiento. El desbridamiento retroperitoneal video asistido (VARD), es una forma de necrosectomía quirúrgica mínimamente invasiva. Presentamos una serie de 5 casos (2 mujeres y 3 varones) con pancreatitis aguda grave y necrosis pancreática infectada tratados de forma escalonada y VARD. El rango de edad fue de 27 a 60 años. Todos los pacientes tuvieron pancreatitis de etiología biliar. El rango del APACHE II fue de 16 a 20. El rango del tiempo para el drenaje percutáneo lumbar fue de 4 a 7 semanas. Hubo una complicación del drenaje percutáneo (fistula duodenal) que se resolvió con tratamiento médico. Los cultivos de todas las necrosis fueron positivos. El tiempo para la realización del VARD tuvo un rango de 6 a 10 semanas. Un paciente requirió dos procedimientos. Hubo dos fístulas pancreáticas tipo B asociadas al VARD, que se trataron conservadoramente. No hubo mortalidad. A largo plazo, dos pacientes fueron diagnosticados de insuficiencia pancreática exocrina y endocrina. Concluimos que en los pacientes con necrosis pancreática infectada que requieran desbridamiento, el VARD es una alternativa segura, efectiva y con buenos resultados a largo plazo.
Palabras clave: pancreatitis aguda necrotizante infectada, tratamiento escalonado, desbridamiento retroperitoneal video asistido (VARD)
Abstract The step-up approach for infected necrotizing pancreatitis, consisting of broad-spectrum antibiotics, drainage followed, if necessary, by minimally invasive necrosectomy, has replaced open surgery as the standard of management. Video-assisted retroperitoneal debridement (VARD) is a surgical minimally invasive necrosectomy. This is a 5 cases series (2 female and 3 males) with severe acute pancreatitis and infected pancreatic necrosis who underwent step up approach and VARD. The age ranged from 27 to 60 years old. Al patients had biliary pancreatitis. APACHE II ranged from 16 to 20. The time to percutaneous lumbar drainage ranged from 4 to 7 weeks. There was one complication associated with percutaneous drainage (duodenal fistula) with nonoperative management. All necrotizing pancreatitis had positive cultures. The time to perform VARD ranged from 6 to 10 weeks. One patient required two procedures. There were two type B pancreatic fistulas associated with VARD, managed nonoperatively. There was no mortality. During long-term follow-up two patients were diagnosed with exocrine and endocrine pancreatic insufficiency. We conclude that VARD is a safe and effective procedure in patients with infected necrotizing pancreatitis requiring debridement, and with good long-term outcomes.
Key words: infected necrotizing pancreatitis, step-up approach, video-assisted retroperitoneal debridement (VARD)
Dirección postal: Fernando Revoredo Rego, Hospital Nacional Guillermo Almenara Irigoyen, Avenida Grau 800, La Victoria, Lima, Perú
e-mail: fernandorevoredo@hotmail.com
Aunque la gran mayoría de pacientes con pancreatitis aguda presentan un curso leve, alrededor del 10-20% desarrollarán una enfermedad moderadamente grave o grave, con necrosis del tejido pancreático o peripancreático1-3. La evolución de esta necrosis es variable, puede permanecer sólida o licuarse y permanecer estéril o infectarse1.
Aproximadamente un 30% de las necrosis se infectan3. La mortalidad de los pacientes con pancreatitis aguda grave y necrosis infectada varía entre 30-40%3.
El tratamiento tradicional de la necrosis infectada fue la necrosectomía abierta, procedimiento asociado con una morbilidad de 34-95% y una mortalidad de 11-39%4.
Probablemente debido a que estos pacientes no pueden soportar la agresión adicional del trauma quirúrgico2, durante la última década, el tratamiento escalonado (step-up approach), que consiste en antibioticoterapia de amplio espectro, drenaje percutáneo o endoscópico y necrosectomía mínimamente invasiva; ha reemplazado a la cirugía abierta como el estándar del tratamiento3, 5.
El uso de antibióticos de amplio espectro retrasa cualquier tipo de intervención, idealmente hasta la cuarta semana6.
Esto permite que la necrosis se encapsule, se forme una pared alrededor de la misma, se reblandezca y se demarque un límite entre el tejido sano y el necrótico2, 3. Si con los antibióticos no se logra mejoría clínica, el siguiente paso es el drenaje percutáneo o endoscópico3-6. Este procedimiento mitiga la sepsis y pospone o incluso puede obviar la necrosectomía en un 30-50% de los pacientes2, 4-6. Finalmente, si fuese necesario, se realiza una necrosectomía mínimamente invasiva3-6, la cual puede ser quirúrgica o endoscópica6.
Estos tratamientos de mínima invasión han demostrado que producen un menor trauma quirúrgico (injuria tisular y respuesta inflamatoria), disminuyen la aparición de nueva falla orgánica en enfermos graves y tienen menos complicaciones a largo plazo como fístulas, hernias incisionales e insuficiencia pancreática endocrina y/o exocrina5, 7.
El desbridamiento retroperitoneal video asistido (VARD: video-assisted retroperitoneal debridement) es una necrosectomía mínimamente invasiva quirúrgica, descrita por primera vez por Horvath8. Este procedimiento ha demostrado ser efectivo, fácil de realizar, no requiere de mucha tecnología, tiene bajo costo y puede ser replicable en cualquier centro especializado4, 5, 7-10.
Presentamos nuestra serie de pacientes con necrosis pancreática infectada, intervenidos mediante el tratamiento escalonado y desbridamiento retroperitoneal video asistido (VARD).
La realización del estudio fue aprobada por el Comité de Ética del Hospital Nacional Guillermo Almenara Irigoyen.
Caso clínico 1
Mujer de 47 años, obesa, con pancreatitis aguda grave (PAG) de etiología biliar. Durante la evolución de la enfermedad presentó signos clínicos y radiológicos de infección de la necrosis por lo que se inició antibioticoterapia de amplio espectro. Ante la ausencia de mejoría clínica y radiológica, se le realizó un drenaje percutáneo lumbar durante la cuarta semana y VARD durante la décima semana de evolución. La estancia hospitalaria post procedimiento fue de 9 días. La paciente tuvo una fístula pancreática tipo B que cerró espontáneamente después de 6 meses de seguimiento. Doce meses después del VARD presentó una colección residual retroperitoneal que requirió drenaje percutáneo y antibioticoterapia por catorce días. A largo plazo, tuvo insuficiencia pancreática endocrina y exocrina (Tabla 1).
Caso clínico 2
Mujer de 53 años, obesa, con PAG de etiología biliar. Durante la evolución de la enfermedad presentó signos clínicos y radiológicos de infección de la necrosis por lo que se inició antibioticoterapia de amplio espectro. Ante la ausencia de mejoría clínica y radiológica, se le realizó un drenaje percutáneo trans gástrico durante la tercera semana y un drenaje percutáneo lumbar durante la sexta semana de evolución. Este último tuvo una complicación que consistió en una fístula duodenal que se trató retirando el drenaje percutáneo 5cm y con nutrición parenteral total durante una semana, con evolución favorable.
El VARD se realizó durante la séptima semana de evolución y la estancia hospitalaria post procedimiento fue de 25 días.
No hubo complicaciones relacionadas al VARD (Tabla 1).
Caso clínico 3
Varón de 27 años, con PAG de etiología biliar. Debido a la mala evolución clínica y al aumento de la presión intraabdominal, se le realizó un drenaje percutáneo trans gástrico durante la primera semana de evolución. Además, se colocó un drenaje percutáneo lumbar durante la quinta semana y se realizó VARD durante la sexta semana de evolución. Este paciente requirió un VARD complementario (10 días después del primer VARD) debido a una colección retroperitoneal infra renal izquierda. No hubo complicaciones relacionadas al VARD y la estancia hospitalaria fue de 55 días (Tabla 1).
Caso clínico 4
Varón de 60 años, con PAG de etiología biliar. Durante la evolución de la enfermedad, presentó signos clínicos y radiológicos de infección de la necrosis por lo que se inició antibioticoterapia de amplio espectro. Ante la ausencia de mejoría clínica y radiológica, se le realizó un drenaje percutáneo lumbar durante la cuarta semana y VARD durante la sexta semana de evolución.
No hubo complicaciones relacionadas al VARD y la estancia hospitalaria post procedimiento fue de 11 días (Tabla 1).
Caso clínico 5
Varón de 45 años, con PAG de etiología biliar. Durante la evolución de la enfermedad, presentó signos clínicos y radiológicos de infección de la necrosis por lo que se inició antibioticoterapia de amplio espectro. Ante la ausencia de mejoría clínica y radiológica se le realizó un drenaje percutáneo trans gástrico durante la tercera semana y drenaje percutáneo lumbar durante la quinta semana de evolución. El VARD se realizó durante la sexta semana de evolución y la estancia hospitalaria post procedimiento fue de 19 días. El paciente tuvo una fístula pancreática tipo B que cerró espontáneamente después de 5 meses de seguimiento. A largo plazo, sufrió insuficiencia pancreática endocrina y exocrina (Tabla 1).
Discusión
Durante las últimas dos décadas se han publicado dos series de casos8, 9, un estudio multicéntrico prospectivo de un solo brazo fase 210, tres estudios aleatorizados (PANTER, PENGUIN y TENSION)4, 5, 11 y un estudio de seguimiento a largo plazo12 del PANTER4, en los que se realizó el VARD.
El número de casos varia de 48 a 244 pacientes que fueron tratados con VARD por la necrosis pancreática infectada.
El tiempo para el primer drenaje, trans gástrico o lumbar, fue de tres semanas. Actualmente se sugiere que el drenaje de las colecciones se realice cuando éstas se hayan organizado y encapsulado completamente2,3,6. Este proceso toma cuatro semanas aproximadamente, mientras tanto el paciente debe ser tratado con antibióticos de amplio espectro para reducir los efectos sistémicos de la necrosis infectada.
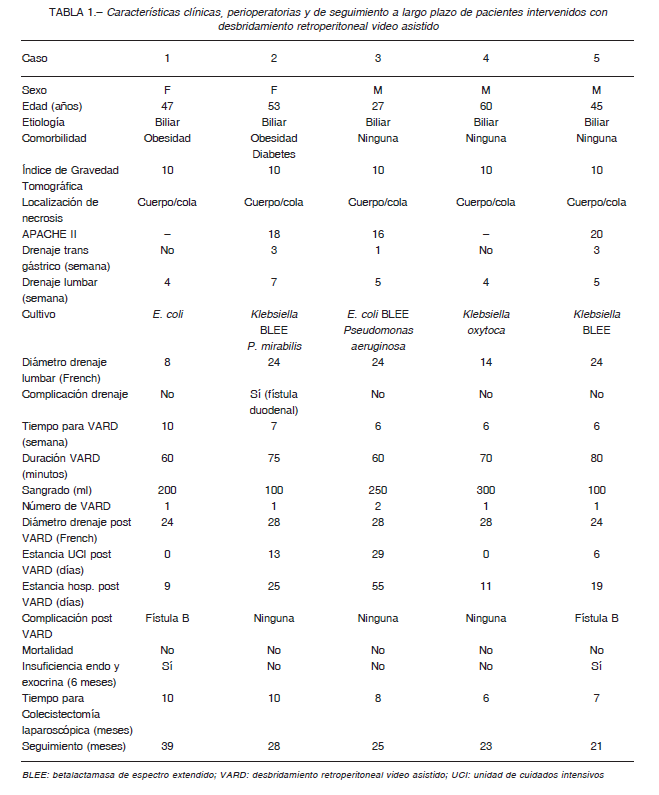
Los cultivos de nuestra serie tomados durante la colocación del primer drenaje salieron positivos. Hay que resaltar que 3 de estos pacientes tuvieron gérmenes inductores de betalactamasa de espectro extendido (BLEE), lo que justifica el uso de antibióticos de amplio espectro como los cabapenems cuando estamos frente a una necrosis pancreática infectada13, 14.
El tiempo para el VARD fue de 6 semanas, similar a lo informado en otras series (41-43 días)8, 9. La mediana del tiempo operatorio fue de 70 minutos, valor menor a la única serie que lo comunica en 135 minutos10. En cuatro pacientes se realizó un VARD y en uno se tuvo que realizar un VARD adicional, debido a una colección infrarrenal izquierda. Los trabajos revisados informan que en más del 80% de los pacientes se necesita sólo un procedimiento para realizar la necrosectomía completa4, 8, 10. Esta es una de las ventajas del VARD con respecto a otros procedimientos mínimamente invasivos como la necrosectomía endoscópica, que requiere un promedio de 3 procedimientos10, 11 o la necrosectomía percutánea que también tiene una media de 3 procedimientos10. Creemos que esta diferencia se debe a la combinación de un tratamiento agresivo de los drenajes percutáneos preoperatorios (irrigaciones periódicas, aumento paulatino del diámetro) y al retraso de la cirugía por más de 4 semanas, aunque posponer la cirugía implica un seguimiento más estrecho de los pacientes debido a que en algunas ocasiones trae consecuencias negativas. Contribuye también a esta ventaja del VARD la pequeña incisión que se hace; la cual permite remover piezas grandes de tejido necrótico a diferencia de los procedimientos puramente endoscópicos9. Otra ventaja del VARD sobre otros procedimientos mínimamente invasivos es que no requiere una tecnología muy sofisticada como fluoroscopia o eco-endoscopia. Esta técnica utiliza instrumentos básicos de la laparoscopía lo que disminuye costos y es un procedimiento que puede ser realizado por un cirujano gastrointestinal con habilidades laparoscópicas y con experiencia en necrosectomía pancreática4.
La localización distal de la necrosis (cuerpo/cola) es también un factor que ayuda a tener buenos resultados. Un trabajo demostró que la localización central de la necrosis y su extensión hacia la raíz del mesenterio constituyen factores predictores de fracaso del VARD10, 14. En estos casos se recomienda el tratamiento endoscópico transgástrico7, 10.
Las complicaciones de nuestra serie fueron dos fístulas pancreáticas tipo B, en las que se retrasó el retiro del dren hasta que cerraron espontáneamente. Las complicaciones descritas relacionadas directamente con el VARD incluyen al sangrado (13-36%)4, 10, como la complicación más frecuente, la fístula pancreática (13-18%) y las fístulas gastrointestinales (9-13%)10.
La mortalidad de nuestra serie fue nula. En los estudios revisados, la mortalidad varía de 0-19%4, 5, 8-11.
En el seguimiento de seis meses de nuestra serie, 2 pacientes fueron diagnosticados con insuficiencia pancreática endocrina y exocrina. El trabajo de seguimiento a largo plazo de los pacientes sobrevivientes del estudio PANTER12, informa una incidencia de insuficiencia pancreática exocrina de 40% y de insuficiencia endocrina de 29%12. Estudios de seguimiento a largo plazo muestran una incidencia de insuficiencia exocrina de 30% después de una pancreatitis grave, 47% si es necrotizante y 48% si la necrosis se infecta15. La incidencia de insuficiencia pancreática endocrina es de 39% después de una pancreatitis aguda grave y 37% si es necrotizante16.
Nuestros resultados ratifican que el VARD es una alternativa segura y efectiva, en los pacientes con tratamiento escalonado de la necrosis pancreática infectada y que requieran una necrosectomía.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Banks P, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis 2012 revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62: 102-11.
2. van Dijk SM, Hallensleben ND, van Santvoort HC, et al. Acute pancreatitis: recent advances through randomised trials. Gut 2017; 66: 2024-32.
3. Forsmark ChE, Vege SS, Wilcox CE. Acute pancreatitis. N Engl J Med 2016; 375: 1972-81.
4. van Santvoort HC, Besselink MG, Bakker OJ, et al. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med 2010; 362: 1491-502.
5. van Brunschot S, van Grinsven J, van Santvoort HC, et al. Endoscopic or surgical step-up approach for infected necrotising pancreatitis: a multicentre randomised trial. Lancet 2018; 391: 51-8.
6. Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence – based guidelines for the management of acute pancreatitis. Pancreatology 2013; 13(4 Suppl 2): e1-e15.
7. van Brunschot S, Hollemans RA, Bakker OJ, et al. Minimally invasive and endoscopic versus open necrosectomy for necrotising pancreatitis: a pooled analysis of individual data for 1980 patients. Gut 2018; 67: 697-706.
8. Horvath KD, Kao LS, Ali A, Wherry KL, Pellegrini CA, Sinanan MN. Laparoscopic assisted percutaneous drainage of infected pancreatic necrosis. Surg Endosc 2001; 15: 677-82.
9. van Santvoort HC, Besselink MG, Bollen TL, et al. Casematched comparison of the retroperitoneal approach with laparotomy for necrotizing pancreatitis. World J Surg 2007; 31: 1635-42.
10. Horvath K, Freeny P, Escallon J, et al. Safety and efficacy of video-assisted retroperitoneal dsebridement for infected pancreatic collections. A multicenter, prospective, single-arm phase 2 study. Arch Surg 2010; 145: 817-25.
11. Bakker OJ, van Santvoort HC, van Brunschot S, et al. Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis. A randomized trial. JAMA 2012; 307: 1053-61.
12. Hollemans RA, Bakker OJ, Boermeester MA, et al. Superiority of step-up approach vs open necrosectomy in longterm follow-up of patients with necrotizing pancreatitis. Gastroenterology 2019; 156: 1016-26.
13. Mowbray NG, Ben-Ismaeil B, Hammoda M, Shingler G, Al-Sarireh B. The microbiology of infected pancreatic necrosis. Hepatobiliary Pancreat Dis Int 2018; 17: 456–60.
14. Baron TH, DiMaio CJ, Wang AY, Morgan KA. American Gastroenterological Association Clinical Practice Update: Management of pancreatic necrosis. Gastroenterology 2020; 158: 67-75.
15. Huang W, de la Iglesia-García D, Bastón-Rey I, et al. Exocrine pancreatic insufficiency following acute pancreatitis: systematic review and meta-analysis. Dig Dis Sci 2019; 64: 1985–2005.
16. Zhi M, Zhu X, Luega A, Wladron RT, Pandol SJ, Li L. Incidence of new onset diabetes mellitus secondary to acute pancreatitis: a systematic review and meta-analysis. Front Physiol 2019; 10: 637.
