SONIA PANKL1, MILAGROS BÁEZ1, PABLO YOUNG1, JULIO E. BRUETMAN1, ASTRID RAUSCH2, IGNACIO ZUBIAURRE2, MARTÍN BOSIO3, BÁRBARA C. FINN1, FELIX VIGOVICH4, DANIELA SPEISKY4, FERNANDA VERDAGUER5, MARÍA T. GARCIA DE DÁVILA4
1 Servicio de Clínica Médica, 2Servicio de Gastroenterología, 3Servicio de Neumonología, 4Servicio de Anatomía Patológica, 5Servicio de Psiquiatría, Hospital Británico de Buenos Aires, Argentina
Resumen La enfermedad de Whipple es una enfermedad multisistémica crónica, causada por la bacteria Tropherima whipplei. Se han descripto aproximadamente 1200 casos en la literatura. La incidencia mundial se estima en 9.8 casos por millón de personas. Los datos provenientes de Sudamérica y Europa muestran que afecta a varones de mediana edad. Se cree que los factores inmunológicos del huésped son los que influyen en el curso de la infección y no el genotipo del agente. Dado que las características clínicas no suelen ser específicas y el espectro de manifestaciones en órganos individuales puede ser subestimado, el diagnóstico sigue siendo muy difícil. Presentamos un caso confirmado por histopatología con compromiso multisistémico. Consideramos importante su difusión dados los escasos casos documentados en Sudamérica y la relevancia de tener presente la sospecha diagnóstica para el abordaje terapéutico precoz que mejora el pronóstico de esta rara enfermedad.
Palabras clave: enfermedad de Whipple, Tropheryma whipplei, histopatología
Abstract Whipple’s disease is a chronic mutisystem disease caused by the bacteria Tropherima whipplei. Approximately 1200 cases have been described in the literature. The worldwide incidence is estimated at 9.8 cases per million people. Data from South America and Europe show that it affects middle-aged males. It is believed that host immunological factors rather than agent genotypic traits influence the course of the infection. Since the clinical characteristics are usually nonspecific and the wide spectrum of manifestations in individual organs may be underestimated, the diagnosis remains challenging. We present a case with multisystem compromise confirmed by histopathology. We consider its publication important given the few cases documented in South America and the relevance of bearing in mind the importance of an early diagnosis for a prompt treatment that improves the prognosis of this rare disease.
Key words: Whipple’s disease, Tropheryma whipplei, histopathology
Dirección postal: Pablo Young, Servicio de Clínica Médica, Hospital Británico, Perdriel 74, 1280 Buenos Aires, Argentina
e-mail: pabloyoung2003@yahoo.com.ar
La enfermedad de Whipple (EW) es una enfermedad multisistémica crónica causada por la bacteria Tropherima whipplei. Fue descripta por primera vez en 1907 por George Hoyt Whipple (1878-1976). En el año 2000 la bacteria fue cultivada por primera vez1-3. Se han descripto aproximadamente 1200 casos en la literatura. La incidencia mundial se estima en ≈1 por millón de personas1-4. Los datos provenientes de Sudamérica y Europa muestran que afecta predominantemente a varones de mediana edad4-6. En EE.UU., con una prevalencia de 9.8/1 000 000, afecta preferentemente a caucásicos, no hispanos, mayores de 65 años, hombres y mujeres por igual2. Se cree que los factores inmunológicos del huésped son los que influyen en el curso de la infección y no el genotipo del agente1-4.
La EW se caracteriza por una etapa prodrómica y una sistémica/clásica o gastrointestinal, las que suelen estar separadas por un período promedio de 6 años.
Puede ocurrir progresión más rápida en pacientes expuestos a terapia inmunosupresora como corticoides o fármacos antagonistas del factor de necrosis tumoral.
En los últimos años el espectro clínico de la infección se ha clasificado en la forma clásica caracterizada por síntomas gastrointestinales y/o sistémicos, la forma localizada extra-intestinal y la forma asintomática que abarca a los portadores sanos3, 4. Dado que las características clínicas de la EW no suelen ser específicas y el espectro de manifestaciones en órganos individuales puede ser subestimado, el diagnóstico sigue siendo muy difícil. Presentamos un caso confirmado de EW atendido en el Hospital Británico de Buenos Aires.
Caso clínico
Varón de 37 años tabaquista, con antecedentes de consumo de cocaína y marihuana que interrumpió a los 23 años a raíz de un trastorno psiquiátrico. Con el diagnóstico de esquizofrenia fue tratado con clozapina hasta 1 año previo a la internación. Refirió artritis de rodilla a los 17 años. Viajó desde su adolescencia por Latinoamérica. Consultó al Servicio de Emergencias por dolor abdominal difuso continuo, incluso nocturno, asociado a hiporexia, registros febriles, pérdida progresiva de 14 kg de peso y diarrea no disentérica (una deposición diaria) de 6 meses de evolución. Se lo encontró adelgazado, apático, con presión arterial de 80/50 mm Hg, taquicárdico, febril, con hipoventilación con matidez bibasal, abdomen blando con molestias generalizadas, sin defensa.
Los valores de laboratorio se resumen en la Tabla 1. La radiografía de tórax mostró leve derrame pleural bilateral a predominio izquierdo. La ecografía abdominal objetivó escaso líquido libre. La tomografía axial computarizada (TAC) de tórax, abdomen y pelvis con doble contraste mostró derrame pleural bilateral, adenomegalias mediastinales, mesentéricas, retroperitoneales e inguinales bilaterales, y engrosamiento parietal difuso del íleon distal. Recibió 2000 ml de solución fisiológica e inició tratamiento con ceftriaxona y metronidazol.
Se internó en sala general. Evolucionó con dolor precordial de intensidad 8/10 opresivo, sin irradiación, con ingurgitación yugular 3/3 sin colapso inspiratorio y reflujo abdominoyugular positivo. El electrocardiograma evidenció taquicardia sinusal de 140 latidos por minuto y T negativas de V1 A V6. La gasometría mostró acidosis metabólica con acidosis láctica. Las troponinas T arrojaron 43 y 46 ng/l con 6 horas de diferencia (VN: < 14 ng/l).
Los valores obtenidos con catéter de Swan Ganz confirmaron el diagnóstico de hipertensión arterial pulmonar (HTP) (Tabla 1). La TAC de tórax con protocolo para tromboembolismo pulmonar fue negativa y un centellograma de ventilación perfusión evidenció baja probabilidad de tromboembolismo pulmonar. La espirometría sugirió restricción leve (Tabla 1).
Un ecocardiograma transesofágico mostró leve dilatación del VD, FSVI normal, no se observó derrame pericárdico, el septum interauricular sin flujo a través del Doppler color tras la inyección de solución salina agitada, IM leve, IT leve, PSAP 55 mm Hg, velocidad pico de regurgitación tricuspídea de 3.2 m/s (VRT). Se decidió no tratar al paciente con drogas vasodilatadoras específicas a la espera del diagnóstico final.
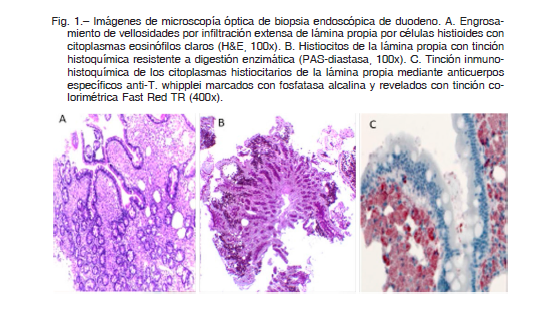
Se realizó videoendoscopía digestiva alta y baja, que mostraron mucosa congestiva, grisáceo-rosada con pliegues engrosados en la segunda y tercera porción del duodeno, con mucosa colónica normal. Se tomaron biopsias escalonadas de colon y duodeno. Se realizó biopsia de ganglio inguinal derecho que mostró extensa fibroesclerosis e histiocitosis sinusoidal, con acúmulos corticales focales de histiocitos epitelioides con ocasionales células gigantes multinucleadas, con tendencia granulomatosa. La población linfoide y plasmocitaria fue de aspecto maduro. Se identificaron inclusiones citoplasmáticas PAS (Periodic Acid Schiff) positivas y PAS diastasa-resistentes en histiocitos. En las biopsias duodenales se observó ensanchamiento de las vellosidades y expansión de la lámina propia a expensas de numerosos histiocitos con citoplasmas eosinófilos claros con inclusiones de material PAS positivo resistente a la diastasa (Fig. 1), epitelio de revestimiento conservado, ribete en cepillo y células caliciformes sin alteraciones. Las tinciones de Giemsa y Ziehl-Neelsen resultaron negativas.
Con el diagnóstico presuntivo de EW, continuó el tratamiento con ceftriaxona 2 gramos/día por vía endovenosa. La PCR específica fue negativa para T. whipplei en la muestra de biopsia duodenal pero su presencia en el citoplasma de histiocitos de la lámina propia se confirmó por inmunohistoquímica y microscopia electrónica (Fig. 1).
Para evaluar compromiso neurológico se solicitó resonancia magnética de cerebro, punción lumbar, evaluación oftalmológica y electroencefalograma que no presentaron hallazgos de significación. El Servicio de Psiquiatría informó que el paciente presentaba una actitud indolente, poco comunicativa.
No tenía perturbación en el manejo de la realidad pero describió un trastorno psicótico en el pasado sugestivo de psicosis confusa, con episodios de alucinaciones e ideas perturbadoras. Aunque refirió el antecedente de consumo patológico de alcohol, cannabis y en menor frecuencia cocaína, aseguró haber interrumpido su uso a partir del primer episodio psicótico. El desorden psíquico habría presentado una evolución independiente del consumo de sustancias y habría sido objeto de tratamiento sostenido durante 13 años.
El comportamiento durante la internación carecía de elementos para avalar el diagnóstico de esquizofrenia.
Se interpretó que el cuadro clínico gastrointestinal con malabsorción, sumado al aumento de transaminasas, las adenomegalias mesentéricas, retroperitoneales e inguinales, fiebre, la HTP y la analítica alterada eran manifestaciones de la EW.
Egresó luego de 23 días de internación con un peso de 46 kg, luego de completar 14 días de tratamiento con ceftriaxona endovenosa. Continuó con trimetoprima 160 mg y sulfametoxazol 800 mg (TMP-SMX) por vía oral en forma ambulatoria.
Un ecocardiograma transtorácico realizado cuatro meses post-alta mostró presiones normales de la arteria pulmonar.
Diez meses post-alta refirió menos astenia y desaparición de los síntomas digestivos. Recuperó el apetito y aumentó 20 kg de peso. Los parámetros de laboratorios se normalizaron, la videoendoscopía digestiva alta presentó franca mejoría, así como también las imágenes histopatológicas.
Discusión
Muchas personas están expuestas a T. whipplei pero solo una minoría contrae la enfermedad. En África y Asia son más comunes los portadores no enfermos. Probablemente, en el desarrollo de la enfermedad intervengan factores inmunes predisponentes aún no definidos y cierta susceptibilidad genética1, 3.
La infección por T. whipplei ocurre por vía gastrointestinal, resultando en el reclutamiento extensivo de macrófagos con posterior absorción de bacterias y producción de citoquinas proinflamatorias como IL-1b e IL-16. La incapacidad de degradar los antígenos bacterianos debido a la disminución de la producción de IL-12 y la apoptosis de los macrófagos reclutados desencadena una diseminación bacteriana adicional y el compromiso multiorgánico2.
La etapa clínica prodrómica está marcada por síntomas inespecíficos, principalmente artralgias y artritis. Las características más comunes de la forma clásica son el compromiso gastrointestinal con pérdida de peso, dolor abdominal, diarrea y artralgias hasta en el 80% de los casos, asociado a fiebre y adenopatías periféricas1, 3, 4.
Menos frecuente es el compromiso hepático con hepatitis y ascitis; articular con artralgia migratoria intermitente, poliartritis seronegativa crónica, mialgias y calambres; linfático con conglomerado adenomegálico en región mesentérica y retroperitoneal, adenomegalias periféricas; cardíaco con pericarditis, miocarditis, endocarditis con hemocultivos negativos, arritmias, signos de insuficiencia cardíaca; pulmonar con derrame pleural, infiltrados pulmonares, adenopatías mediastinales, hipertensión pulmonar; y neurológico con trastornos cognitivos, demencia, signos psiquiátricos, cambios en la personalidad, apatía y depresión. Son signos patognomónicos la oftalmoplejía supranuclear progresiva con miorritmia oculomasticatoria u oculofacioesquelética3, 4.

El diagnóstico se basa en la sospecha clínica y laboratorio con reactantes de fase aguda elevados, anemia, leucocitosis, trombocitosis y marcadores de malabsorción1-4.
La videoendoscopía digestiva alta muestra mucosa pálida amarillenta, eritematosa, friable, con atrofia vellositaria4, 5.
El diagnóstico de probabilidad se realiza por anatomía patológica mediante la presencia de macrófagos con estructuras PAS positivas diastasa-resistentes y tinción de Ziehl-Neelsen para diagnóstico diferencial con micobacterias negativa. El diagnóstico definitivo se confirma con la PCR específica para T. whipplei en biopsias duodenales o de distintos tejidos o fluidos; o con la detección de la pared celular característica de T. whipplei mediante microscopía electrónica1, 3-6.
La elección del antibiótico y la duración óptima del tratamiento es un tema controvertido. No existe consenso sobre tipo y duración, ni tampoco ensayos controlados que permitan fundamentar las decisiones1, 3-5. La primera opción es ceftriaxona 2 gramos endovenoso por día, seguido de TMP-SMX 160/800 mg vía oral dos veces al día durante 1 a 2 años3, 4. Como alternativa al esquema TMP-SMX, los europeos sugieren doxiciclina e hidroxicloroquina1.
Se recomienda el seguimiento clínico durante 1 a 2 años con exámenes de laboratorio trimestrales, seguidos de un control semestral en pacientes asintomáticos. El control endoscópico con biopsia duodenal debe realizarse a los 6, 12, 24 y 36 meses post-diagnóstico y cada 3 años por el resto de la vida del paciente1-6. Con tratamiento antibiótico eficaz la PCR se negativiza en forma precoz, mientras que la técnica de PAS disminuye la intensidad en forma gradual y al quedar restos de la pared celular puede persistir positiva durante años3, 4.
El pronóstico es fatal sin tratamiento, pero es favorable con tratamiento antibiótico completo. El compromiso neurológico y psiquiátrico se asocia al mayor número de recaídas. En los últimos años se han descripto casos de síndrome inflamatorio de reconstitución inmune, con fiebre y artralgias como complicación, hasta en el 10% de los pacientes luego del inicio del tratamiento antibiótico3.
Volviendo a nuestro paciente, se interpretó que la HTP reversible y los cambios electrocardiográfícos estuvieron relacionados a la EW. Existen solo diez casos publicados de HTP asociada a EW7-15. Se la describe en etapas tardías de la enfermedad. La asociación no es completamente reconocida ya que no figura en la reciente clasificación de HTP16. Los mecanismos propuestos comprenden un estado proinflamatorio mediado por citoquinas (factor de crecimiento transformante ß), infiltración directa de la vasculatura pulmonar por T. whipplei o embolia pulmonar con células PAS positivas7-15.
Los estudios neurológicos no han podido confirmar compromiso del SNC en este caso; aun así, dado el desarrollo del antecedente psiquiátrico y su excelente evolución con el tratamiento de la EW, no podemos descartar su asociación con dicha enfermedad.
Consideramos importante la publicación del caso debido a la baja frecuencia de su presentación con HTP, y la relevancia de su sospecha para un diagnóstico y tratamiento precoz que mejore el pronóstico.
Agradecimientos: Al Dr. Sherif A. Zaki, del Servicio de Enfermedades Infecciosas, Centers for Disease Control and Prevention (CDC), USA, por confirmar la presencia de T. whipplei por inmunohistoquímica y microscopia electrónica.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Lagier JC, Lepidi H, Raoult D, Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center. Medicine (Baltimore) 2010; 89: 337-45.
2. Elchert JA, Mansoor E, Abou-Saleh M, Cooper GS. Epidemiology of Whipple’s Disease in the USA Between 2012 and 2017: A Population-based national study. Dig Dis Sci 2019; 64: 1305-11.
3. Lagier JC, Raoult D. Whipple’s disease and Tropheryma whipplei infections: when to suspect them and how to diagnose and treat them. Curr Opin Infect Dis 2018; 31: 463-70.
4. Bai JC, Mazure RM, Vazquez H, et al. Whipple’s disease (Review). Clin Gastroenterol Hepatol 2004; 2: 849-60.
5. Bai JC, Crosetti EE, Mauriño EC, Martínez CA, Sambuelli A, Boerr LA. Short-term antibiotic treatment in Whipple’s disease. J Clin Gastroenterol 1991; 13: 303-7.
6. Ferrari M de L, Vilela EG, Faria LC, et al. Whipple’s disease. Report of five cases with different clinical features. Rev Inst Med Trop Sao Paulo 2001; 43: 45-50.
7. Morrison DA, Gay RG, Feldshon D, Sampliner RE. Severe pulmonary hypertension in a patient with Whipple’s disease. Am J Med 1985; 79: 263-7.
8. Riemer H, Hainz R, Stain C, et al. Severe pulmonary hypertension reversed by antibiotics in a patient with Whipple’s disease. Thorax 1997; 52: 1014-5.
9. Peschard S, Brinkane A, Bergheul S, et al. Whipple disease associated with pulmonary arterial hypertension. Jarisch-Herxheimer reaction after antibiotic therapy. Presse Med 2001; 30: 1549-51.
10. Lyle PL, Weber RD, Bogarin J, Kircher T. Reversible pulmonary hypertension in Whipple disease: a case report with clinicopathological implications, and literature review. BMJ Case Rep 2009; 2009: bcr06.2008.0095.
11. Najm S, Hajjar J, Nelson RP Jr, Moorthy RS, Wolf KM, Lahm T. Whipple’s disease-associated pulmonary hypertension with positive vasodilator response despite severe hemodynamic derangements. Can Respir J 2011; 18: e70-2.
12. Villa A, Nucera G, Kostihova A, Mazzola A, Marino P. Reversible pulmonary hypertension associated with Whipple’s disease. Case Rep Pulmonol 2012; 2012: 382460.
13. Baloira A, Núñez M, Tumbeiro M, Parente-Lamelas I, Bastos M, Gutiérrez M. Pulmonary hypertension associated with Whipple disease. Eur Respir Rev 2014; 23: 533-6.
14. Hoskote SS, Georgescu A, Ganjhu L, Zeizafoun N, Polsky B. Resolution of Whipple disease-induced pulmonary hypertension following antibiotic therapy. Am J Ther 2014; 21: e143-7.
15. Lochouarn M, Lagier JC, Raoult D, Pulcini C. A case of Whipple’s disease evolving over 30 years. Med Mal Infect 2014; 44: 331-3.
16. Simonneau G, Montani D, Celermajer DS, et al. Haemodynamic definitions and updated clinical classification of pulmonary
hypertension. Eur Respir J 2019; 53. pii:1801913.
