EMMANUEL E. SADAVA, ANA L. CAMPOS ARBULÚ, MANUEL E. MAYA, NORBERTO A. MEZZADRI
Sector Cirugía de Paredes Abdominales, Servicio de Cirugía General, Hospital Alemán, Buenos Aires, Argentina
Resumen La falla en la reparación de los defectos de la pared abdominal se relaciona con una alteración en la integración del material protésico. El objetivo de este trabajo fue evaluar el comportamiento biológico de mallas utilizadas en cirugía de paredes abdominales en un modelo animal. Luego de la confección de un defecto parietal se colocó una malla intraperitoneal, utilizando 4 grupos de 10 ratas; 1) ProleneR (polipropileno microporo de alto peso), 2) UltraproR (polipropileno + poliglecaprone, macroporo de bajo peso), 3) ProceedR (polipropileno + polidoxanona + celulosa oxidada regenerada, macroporo de peso intermedio), y 4) PhysiomeshR (polipropileno + poliglecaprone, macroporo de bajo peso). Se realizó análisis macroscópico y microscópico a los 30 días y los resultados fueron evaluados por dos observadores independientes. Al examen macroscópico, la integración de la prótesis fue > 75% en todos los grupos. El análisis microscópico mostró mayor inflamación global y número de células gigantes multinucleadas en ProleneR (p < 0.01) y menor cantidad de células inflamatorias en la interface músculo-malla en PhysiomeshR < UltraproR (p < 0.05). La organización de las fibras de colágeno fue similar para todas las mallas, aunque hubo mayor depósito de colágeno en los espacios inter-filamento para las mallas macroporosas (p < 0.01). Concluimos que las mallas de polipropileno microporo y alto peso producen mayor reacción inflamatoria y de cuerpo extraño. Por lo tanto, las mallas compuestas tendrían una mejor biocompatibilidad y serían mejor toleradas por el huésped.
Palabras clave: hernia, malla, respuesta inflamatoria, biocompatibilidad, integración
Abstract An adequate integration of the prosthetic materials used to repair abdominal wall defects is necessary for satisfactory outcomes. We aimed to evaluate, in an animal model, the biological behavior of meshes used for abdominal wall surgery. Four groups of 10 rats were separated. After laparotomy, intraperitoneal prostheses were placed: 1) ProleneR (polypropylene microporous, heavy-weight), 2) UltraproR (polypropylene + poliglecaprone, macroporous low-weight), 3) ProceedR (polypropylene + polidoxanone + regenerated oxidized cellulose, microporous medium-weight), 4) PhysiomeshR (polypropylene + poliglecaprone, macroporous lowweight). Macroscopic and microscopic analyses were performed at 30 days. The results were evaluated by two independent observers and expressed in means with standard deviation. For statistical analysis p < 0.05 was considered significant. On macroscopic examination, mesh integration was greater than 75% in all cases. Microscopic analysis showed greater global inflammation and more multinucleated giant cells in ProleneR (p < 0.01). Less inflammatory cells were observed at the muscle-mesh interface in PhysiomeshR vs. UltraproR (p < 0.05). Collagen fibers disposition was similar in all meshes, although, microporous meshes had higher collagen deposit in the interfilamentous spaces (p < 0.01). In conclusion, in our animal model, microporous and heavy-weight polypropylene meshes produce greater inflammatory and foreign body reaction. Thus, composite meshes would have greater biocompatibility and better tolerance by the host.
Key words: hernia, mesh, inflammatory response, biocompatibility, integration
Dirección postal: Emmanuel E. Sadava, Hospital Alemán, Av. Pueyrredón 1640, 1118 Buenos Aires, Argentina
e-mail: esadava@hospitalaleman.com
Conocimiento actual
• Existen numerosos tipos de mallas con diferentes características para la cirugía de la pared abdominal, aunque no se ha determinado aún cuál es la malla ideal.
Contribución del artículo al conocimiento actual
• Las mallas de baja densidad y macroporo presentan menor respuesta inflamatoria con igual organización del colágeno que las de alto peso y microporo, por lo que presentarían mejor biocompatibilidad.
La reparación de los defectos de la pared abdominal es uno de los procedimientos más frecuentes en cirugía general. Así, se ha informado una tasa de eventraciones de 11-20% luego de una laparotomía primaria y se estima que se realizan aproximadamente 250 000 eventroplastias anuales en EE.UU.1, 2. En la Argentina, en una encuesta nacional realizada entre 2016 y 2017 a 590 cirujanos, se observó que los cirujanos generales operaron en promedio 30 eventraciones anuales, mientras que los especialistas en cirugía de las paredes abdominales operaron más de 503.
La utilización de mallas no absorbibles para la reconstrucción de defectos en la pared abdominal está ampliamente aceptada, dada la significativa reducción en la tasa de recidiva que han demostrado4. Sin embargo, la mayoría de los materiales protésicos (mallas) generan reacción de cuerpo extraño (RCE) que podría causar complicaciones como infección, seroma y/o recidiva4. Además, se ha observado que una intensa reacción inflamatoria puede manifestarse como sensación de cuerpo extraño, incomodidad y limitación en los movimientos de la pared abdominal5. Esto sucedería con las mallas que tienen alta densidad y microporo (Ej.: polipropileno, poliéster, politetrafluoroetileno) que son las utilizadas en forma estándar5.
Un material protésico con rápida y adecuada integración (penetración del tejido del huésped entre las fibras de la malla) mostraría una mayor biocompatibilidad y posiblemente mejor evolución clínica. En respuesta a esto, se han creado mallas con la intención de reducir la RCE y mejorar la interacción malla-huésped. Las mallas presentan dos características fundamentales que influyen en esta interacción: el peso o densidad y el tamaño del poro entre los filamentos. Dentro de las modificaciones
realizadas en los últimos años, se ha reducido la cantidad de material protésico, generando mallas de media y baja densidad (por ejemplo: ProceedR y UltraproR, respectivamente), y se ha aumentado el espacio entre filamentos (poro) en las mallas macroporo (Ej.: UltraproR). A su vez, se han creado mallas compuestas, formadas por más de un polímero, y mallas separadoras de tejidos, las cuales tienen una barrera que permite su colocación en contacto con órganos intraabdominales.
Aún así, no se ha encontrado el material protésico ideal y su búsqueda es objeto de numerosas investigaciones.
Paralelamente, existe una tendencia a la utilización de prótesis compuestas y/o de menor peso, dado que presentarían mejor biocompatibilidad, aunque hay escasa información en la literatura con respecto a la interacción malla-huésped de estos materiales. El objetivo de este trabajo fue evaluar el comportamiento biológico de las mallas utilizadas para la reconstrucción de paredes abdominales en un modelo animal.
Materiales y métodos
Un total de 40 ratas Sprague-Dowley macho de 300 gramos aproximadamente fueron aclimatadas bajo condiciones estándar.
Todos los cuidados y procedimientos fueron realizados de acuerdo a Guide for the care and use of laboratory animals6.
La investigación fue aprobada por el Comité de Ética del Hospital Alemán de Buenos Aires.
El abdomen de los animales fue rasurado y preparado con solución antiséptica bajo anestesia general intraperitoneal (tiopental sódico, 40 mg/kg), reproduciendo el estándar de quirófano. Luego de una laparotomía de 4 cm se realizó la resección de una pieza de 0.5 × 4 cm del músculo recto abdominal de cada lado, conformándose un defecto de 1 × 4 cm. El mismo fue reparado con una malla de 5 × 2 cm según la técnica bridging repair, dejando una brecha de 0.5 cm sin cobertura muscular. La malla se fijó por medio de 12 puntos transparietales de polipropileno 4-0 en forma coronal. Luego, la piel se cerró con puntos separados de poliglactina 910 4-0.
No se administraron antibióticos en forma sistemática.
Se utilizaron 4 mallas: 1) ProleneR (Ethicon, Johnson & Johnson do Brasil, Brasil); 2) UltraproR (Ethicon, Johnson & Johnson Medical GmbH, Alemania); 3) ProceedR (Ethicon, Johnson & Johnson Medical GmbH, Alemania) y 4) PhysiomeshR (Ethicon, Johnson & Johnson International Company, Bélgica).
Las mallas UltraproR, ProceedR y PhysiomeshR son mallas compuestas (formadas por más de un polímero, por ejemplo polipropileno + poliglecaprone 25), y las dos últimas son mallas separadoras de tejidos (tienen una barrera de un material que permite el contacto con las vísceras). En la Tabla 1 se especifican las características técnicas de cada malla.
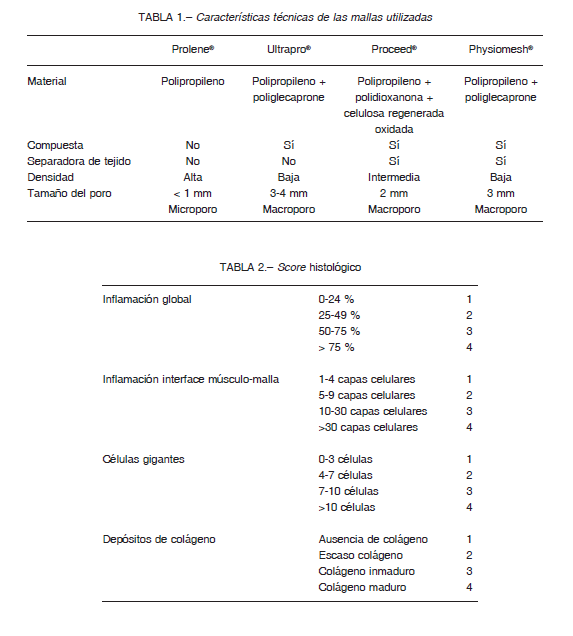
Los animales se sacrificaron a los 30 días con sobredosis de tiopental sódico intraperitoneal. Se realizó el explante de la pared abdominal y valoración macroscópica con fotografía digital de adherencias (porcentaje de la malla que presenta adherencias y órganos afectados, en una escala de 1 a 4), integración (porcentaje de la malla incorporada a la pared muscular), reducción del tamaño de la malla (comparación de la malla con una plantilla de 5 x 2 cm), presencia de desgarros en la malla y complicaciones como seroma o infección (Tabla 2). Posteriormente, los tejidos fueron fijados en formol 10% y cortados para su análisis microscópico.
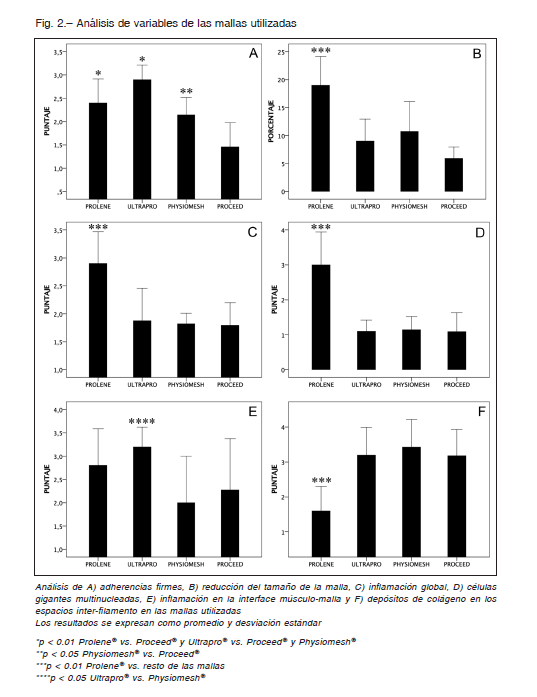
Para la evaluación histológica se realizaron cortes de 5 μm con tinciones hematoxilina y eosina, tricrómico de Gomori y Sirius Red. Se utilizó hematoxilina y eosina para evalución de los componentes celulares y matriz extracelular del tejido conectivo y el tejido muscular. La tinción tricrómica y Sirius Red se utilizaron para mejor caracterización de las fibras de colágeno. Los preparados fueron observados al microscopio óptico y con luz polarizada (Eclipse E400, Nikon, equipado con cámara Nikon ds-Fi1, Japón) y se tomaron fotografías a 10x y 40x con el software NIS-Elements F 2.30. Se evaluó la respuesta inflamatoria global, cantidad de capas celulares en la interface músculo-malla y organización del colágeno, basado en el score de acuerdo a Hallers y col.7 (Tabla 2).
Cada categoría fue graduada de 1-4 (respuesta inflamatoria leve = 1 a grave = 4). Para la evaluación de la inflamación se seleccionaron 4 campos de aumento 400x en relación a la interface músculo-malla y se tomaron fotografías para realizar análisis comparativos. Los resultados fueron evaluados a ciegas por dos observadores independientes.
Los datos fueron expresados como promedios con desviación estándar. Para el análisis estadístico se utilizó el test ANOVA de un factor (análisis de varianza) y el test post hoc Tukey HSD, con el paquete SPSS Statistics v.22 (IBM). Se consideró significativo p < 0.05.
Resultados
Al examen macroscópico, todas las mallas tuvieron una integración mayor al 75%. El órgano más frecuentemente afectado por adherencias fue el hígado, seguido por el epiplón mayor, siendo en su mayoría firmes (necesidad de liberación con tijera) (Fig. 1). Se observó mayor índice de adherencias firmes en ProleneR > ProceedR, en UltraproR > ProceedR y PhysiomeshR, y en PhysiomeshR > ProceedR (Fig. 2A). Todas las mallas redujeron su tamaño, siendo mayor la reducción en ProleneR que en el resto de las mallas (Fig. 2B). No se constataron recidivas, desgarros ni infecciones.
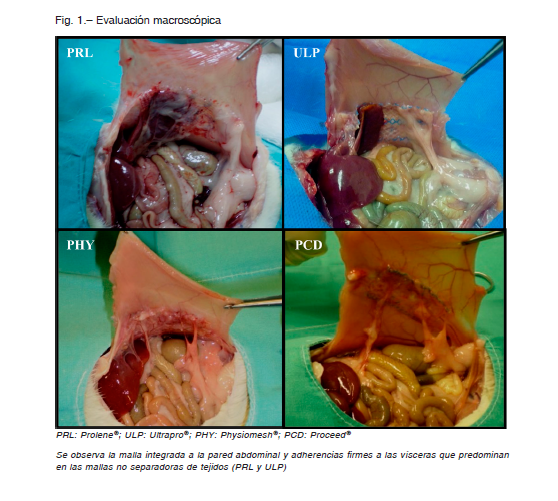
En cuanto al análisis microscópico, ProleneR mostró mayor índice de inflamación global en forma significativa en comparación con las otras mallas (Fig. 2C). Se observó mayor número de células gigantes multinucleadas en ProleneR (Fig. 2D). Con respecto al número de células inflamatorias a nivel de la interface músculo-malla, las mallas separadoras de tejidos (ProceedR y PhysiomeshR) presentaron menor cantidad comparadas con ProleneR y UltraproR, observándose una diferencia significativa cuando se comparó PhysiomeshR < UltraproR (Fig. 2E).
Por otro lado, la organización de las fibras de colágeno fue similar para todas las mallas, aunque hubo mayor depósito de colágeno en los espacios inter-filamento (poro) para las mallas compuestas: UltraproR, PhysiomeshR y ProceedR (Fig. 2F). La Figura 3 muestra la respuesta inflamatoria y depósitos de colágeno en los diferentes tipos de mallas.
Discusión
Se ha observado que la biocompatibilidad o interacción malla-huésped podría influenciar los resultados de la cirugía de pared abdominal. Así, el desarrollo tecnológico ha permitido en los últimos años la optimización de los materiales protésicos no absorbibles utilizados para la reparación de hernias8. En este trabajo evaluamos el comportamiento de diferentes mallas, que tienen al polipropileno como material principal, con el fin de evidenciar cuál de ellas presenta una mejor interacción malla-tejido.
Observamos que: 1) UltraproR presentó mayor porcentaje de adherencias firmes que ProceedR y Physiomesh, y ProleneR mayor que ProceedR, 2) ProleneR mostró una mayor reducción de tamaño, mayor inflamación global y mayor cantidad de células gigantes multinucleadas que el resto de las mallas, 3) UltraproR presentó más capas de células inflamatorias en la interface músculo malla que PhysiomeshR y 4) las mallas macroporosas presentaron mayor depósito de colágeno en los espacios inter-filamento.
El uso del polipropileno en las mallas para la reparación de la pared abdominal está ampliamente aceptado, siendo uno de los materiales más frecuentemente utilizados9.
En respuesta al implante de la malla, el huésped genera una compleja cascada de factores y células. Si dicha respuesta es exagerada, induce la formación de un granuloma a cuerpo extraño10, y puede conducir a la encapsulación fibrótica (“fagocitosis frustrada”) o incluso la degradación del material11. Por lo tanto, una reducción en la intensidad de la reacción inflamatoria generada por las mallas podría disminuir la tasa de complicaciones asociadas como seroma, infección, dolor y/o recidiva4, 12. En concordancia, en nuestra serie se observó que las mallas con menor densidad y mayor tamaño del poro presentaron menor respuesta inflamatoria, y esto podría explicar la menor reducción de tamaño y en la menor cantidad de adherencias firmes que presentaron.
Dentro de las características que influyen en la interacción malla-huésped, el peso y el espacio interfilamento juegan un rol fundamental13-15. Una posible explicación sería que al reducir la densidad de material protésico y, a su vez, incrementar el tamaño del poro se generaría una inflamación “modulada” que permitiría una adecuada integración16. En contraste, de acuerdo a Marois y col., una mayor respuesta inflamatoria luego del implante estimularía mayor integración17. Además, está establecido que la formación de colágeno se relaciona con el grado de inflamación18, 19. En nuestra serie, las diferentes mallas evaluadas presentaron distintos grados de inflamación, aunque los depósitos de colágeno fueron similares.
Además, las mallas compuestas presentaron mayores depósitos de colágeno en los espacios interfilamento, lo que implicaría mayor integración de la prótesis. Sin embargo, un aumento en el depósito de colágeno no implicaría mayor fuerza ni una reparación más efectiva, dado que puede reducir la complacencia tanto del sitio de la hernia como de la pared abdominal, con la consiguiente falla de la reparación20.
Las mallas separadoras de tejidos presentaron los menores índices de adherencias. También en estas mallas, al igual que UltraproR, hubo mayor depósito de colágeno e inflamación en el espacio interfilamento.
Estos hallazgos han sido observados por otros autores y se ha hipotetizado que, al haber mayor penetración de células y colágeno en el espacio inter-filamento, se produciría una mejor integración13. En resumen, nuestros resultados muestran que las mallas separadoras de tejidos presentan menor reacción inflamatoria cuando se las compara con las no separadoras de tejidos. Una posible explicación sería que las primeras cuentan con una capa de material reabsorbible que se interpone entre el tejido y el polipropileno. Esto llevaría a pensar que este tipo de prótesis tiene una menor integración, sin embargo, no se evidenciaron diferencias con respecto a la organización del colágeno. Así, podríamos decir que las mallas separadoras de tejidos generan una reacción inflamatoria moderada logrando resultados comparables con potencial beneficio en la reducción de las complicaciones.
La importancia de estos hallazgos radica en que, aunque se requiere una combinación de factores para lograr una prótesis ideal, las mallas con menor densidad y mayor tamaño del poro han mostado una mejor biocompatibilidad estando esto en relación a los hallazgos histológicos A pesar de ser un estudio en un modelo animal y que los resultados pueden ser difíciles de extrapolar al uso en la práctica clínica, este tipo de investigaciones permitiría interpretar los resultados observados en los pacientes.
Además, es necesario el seguimiento de los pacientes y el registro de complicaciones para evaluar la biocompatibilidad de las mallas a largo plazo.
Concluimos que las mallas de polipropileno microporo y de alto peso presentan mayor reacción inflamatoria y mayor reacción de cuerpo extraño. Por lo tanto, las mallas compuestas, en especial las separadoras de tejido, tendrían una mejor biocompatibilidad y serían mejor toleradas por el huésped.
Agradecimientos: Al Dr. Jorge Toblli, por aportar su amplia experiencia y conocimiento. Falleció en 2018, luego de una gran trayectoria profesional, durante la cual montó el laboratorio experimental donde se realizó este trabajo, que constituye parte de su legado.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Mudge M, Hughes LE. Incisional hernia: A 10-year prospective study of incidence and attitudes. Br J Surg 1985; 72: 70-1.
2. Millennium Research Group. U.S. markets for soft tissue repair 2009. Toronto: Millennium Research Group, Inc., 2008.
3. Madeo SD. Cirugía de la patología de la pared abdominal en Argentina. Historia y actualidad. Rev Hispanoam Hernia 2018; 6: 115-7.
4. Leber GE, Garb JL, Alexander AI, Reed WP. Long-term complication associated with prosthetic repair of incisional hernias. Arch Surg 1998; 133: 378-82.
5. Bellon JM, Rodríguez M, García-Honduvilla N, Gomez-Gil V, Pascual G, Bujan J. Postimplant behavior of lightweight polypropylene meshes in an experimental model of abdominal hernia. J Invest Surg 2008; 21: 280-7.
6. National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals, 8th edition. Washington (DC): National Academies Press (US), 2011.
7. Hallers EJO, Jansen, JA, Marres HAM, Rakhorst G, Verkerke GJ. Histological assessment of titanium and polypropylene fiber mesh implantation with and without fibrin tissue glue. J Biomed Mater Res 2007; 80A: 372-80.
8. Lak KL, Goldblatt MI. Mesh selection in abdominal wall reconstruction. Plast Reconstr Surg 2018; 142: 99S-106S.
9. Luijendijk RW, Hop WCJ, van den Tol MP, et al. A comparison of suture repair with mesh repair for incisional hernia. N Engl J Med 2000; 343: 392-8.
10. Sogabe Y, Abe M, Yokoyama Y, Ishikawa O. Basic fibroblast growth factor stimulates human keratinocyte motility by Rac activation. Wound Repair Regen 2006; 14: 457-62.
11. Jansen PL, Mertens Pr P, Klinge U, Schumpelick V. The biology of hernia formation. Surgery 2004; 136: 1-4.
12. Klinge U, Klosterhalfen B, Müller M, Schumpelick V. Foreign body reaction to meshes used for the repair of abdominal wall hernias. Eur J Surg 1999; 165: 665-73.
13. Klinge U, Klosterhalfen B, Birkenhauer , Junge K, Conze J, Schumpelick V. Impact of polymer pore size on the interface scar formation in a rat model. J Surg Res 2002; 103: 208-14.
14. Cobb WS, Kercher KW, Todd Heniford B. The argument for lightweight polypropylene mesh in hernia repair. Surg innov 2005; 12: 63-9.
15. Harrell AG, Novitsky YW, Cristiani JA, et al. Prospective histologic evaluation of intra-abdominal prosthetics four months after implantation in a rabbit model. Surg Endosc 2007; 21: 1170-4.
16. Sadava EE, Krpata DM, Gao Y, Rosen MJ, Novitsky YW. Wound healing process and mediators: Implications for modulations for hernia repair and mesh integration. J Biomed Mater Res A 2014; 102: 295-302.
17. Marois Y, Cadi R, Gourdon J, et al. Biostability, inflammatory response and healing characteristics of a fluoropassivated
polyester-knit mesh in the repair of experimental abdominal hernias. Artif Organs 2000; 24: 533-43.
18. Gonzalez R, Ramshaw BJ. Comparison of tissue integration between polyester and polypropylene prostheses in the preperitoneal space. Am Surg 2003; 69: 471-7.
19. Klosterhalfen B, Klinge U, Schumpelick V. Functional and morphological evaluation of different polypropylene-mesh modifications for abdominal wall repair. Biomaterials 1998; 19: 2235-46.
20. Novitsky YW, Harrell AG, Cristiano JA, et al. Comparative evaluation of adhesion formation, strength of ingrowth, and textile properties of prosthetic meshes after long-term intra-abdominal implantation in a rabbit. J Surg Res 2007; 140: 6-11.
