JOSÉ M CERESETTO1, CRISTINA DUBOSCQ1, JORGE KORIN2, CARLOS FONDEVILA3, PATRICIA CASAIS4, ANDREA ROSSI5, ALEJANDRA SCAZZIOTA6, MARTA MARTINUZZO7, MARÍA ESTHER ARIS CANCELA8, CLAUDIO ROSA8, GONZALO POMBO9, CARLA GUIMELLI10, YOLANDA ADAMCZUK11, ALEJANDRA MARTÍ12, DIANA PENCHASKY7, DARDO RIVEROS13, DOLORES PUENTE5, LUCÍA CELEBRIN11, SOLEDAD MOLNAR14, SUSANA MESCHENGIESER4, MIGUEL CASTRO RÍOS15, ALICIA BLANCO16, HÉCTOR HENDLER17, ANDRÉS BRODSKY6, ANALÍA SÁNCHEZ LUCEROS16, PEDRO NEGRI ARANGUREN18, JOSÉ LUIS FEDELE19, CLAUDIO MERLO20, PABLO RAÑA21, CARINA GUMPEL22, CECILIA COLORIO5, BEATRIZ GRAND23, VIRGINIA CANÓNICO24, ELEONORA ROSSI25, PAULO COLIMODIO26, SERGIO ORLANDO27, DANIEL FASSI28, MIRTA ARIAS29, LAURA VIUDEZ30, ROBERTO FARRERAS31, PABLO MARTÍNEZ32, HUGO FERRO33, CLAUDIA CASALI34, ALEJANDRA BAQUES35, GUILLERMO ARBESÚ36, SUSANA VIÑUALES7, FERNANDA MEDINA10, VERÓNICA CORTÉS37, MARÍA DEL CARMEN GALLO38, LUDMILA EHELOU39, LUIS BARRERA7, IRENE REY20, GABRIELA DE LARRAÑAGA40, FLAVIA FIGUEROA41, ALICIA VILASECA42, ISABEL KURI30, ALBERTO MANEYRO43, MARÍA OTARAN20, DAVID LUIS XAVIER44, SUSANA GARBIERO32, JULIETA SALVIÚ4, PATRICIA FONTENLA45, ANDREA ECKHARDT46, CAROLINA BOMPAROLA47, LAURA FORNASIERO22
1Hospital Británico de Buenos Aires, 2Consultorios Hematológicos, Buenos Aires, 3Sanatorio Bazterrica, Buenos Aires, 4Centro de Hematología Pavlovsky, Buenos Aires, 5Fundación Favaloro, Buenos Aires, 6Hospital de Clínicas José de San Martín, Buenos Aires, 7Hospital Italiano de Buenos Aires, 8Hospital Universitario Austral, Pilar, Provincia de Buenos Aires, 9Sanatorio Mater Dei, Buenos Aires, 10Instituto de Cardiología de Corrientes Juana Francisca Cabral, Corrientes, 11Hospital General de Agudos Dr. Enrique Tornú, Buenos Aires, 12Hospital El Cruce – Néstor Kirchner, Florencio Varela, Provincia de Buenos Aires, 13Centro de Educación Médica e Investigaciones Clínicas Norberto Quirno (CEMIC), Buenos Aires, 14Clínica Universitaria Reina Fabiola, Córdoba, 15Clínica Privada de San Isidro, Provincia de Buenos Aires, 16IIHEMA-Academia Nacional de Medicina, Buenos Aires, 17Sanatorio Trinidad Mitre, Buenos Aires, 18Instituto Privado Hematología y Hemoterapia, Paraná, Entre Ríos, 19Hospital Privado de Rosario, Santa Fe, 20Hospital General de Agudos José María Ramos Mejía, Buenos Aires, 21Clínica Dr. Roberto Raña, Neuquén, 22Laboratorio LAHT SRL, Rosario, Santa Fe, 23Hospital General de Agudos Dr. Juan A. Fernández, Buenos Aires, 24Hospital Rawson, San Juan, 25Laboratorio de Salud Pública, San Miguel de Tucumán, 26Instituto Cardiovascular de Buenos Aires, 27Hospital Interzonal General de Agudos Dr. Rodolfo Rossi, La Plata, Provincia de Buenos Aires, 28Clínica de la Esperanza, Buenos Aires, 29Hospital Dr. César Milstein, Buenos Aires, 30Hospital Central, Mendoza, 31Hospital Interzonal General de Agudos Dr. Oscar E. Alende, Mar del Plata, Provincia de Buenos Aires, 32Hospital Interzonal Dr. José Penna, Bahía Blanca, Provincia de Buenos Aires, 33Clínica Suizo Argentina, Buenos Aires, 34Hospital Alemán, Buenos Aires, 35Hospital Militar Central Cirujano Mayor Dr. Cosme Argerich, Buenos Aires, 36Instituto Privado Arbesú, Godoy Cruz, Mendoza, 37Instituto de Investigaciones Médicas Alfredo Lanari, Buenos Aires, 38Sanatorio Juncal, Temperley, Provincia de Buenos Aires, 39Fundación de la Hemofilia, Buenos Aires, 40Hospital de Infecciosas Francisco Javier Muñiz, Buenos Aires, 41Hospital de Día Pte. Néstor C. Kirchner, San Miguel de Tucumán, 42Clínica San Camilo, Buenos Aires, 43Complejo Médico Churruca Visca, Buenos Aires, 44Clínica Privada Monte Grande, Monte Grande, Provincia de Buenos Aires, 45Hospital San Juan de Dios, Ramos Mejía, Provincia de Buenos Aries, 46Hospital Privado Universitario de Córdoba, Córdoba, 47Sanatorio de la Trinidad Palermo, Buenos Aires, Argentina
Resumen El tratamiento de un paciente anticoagulado con antagonistas de la vitamina K (AVK) sigue siendo un desafío, especialmente en regiones donde, por el costo, los dicumarínicos son todavía la alternativa más buscada a la hora de elegir un anticoagulante oral. Las clínicas de anticoagulación han demostrado ser la forma más eficiente y segura de evitar complicaciones trombóticas y hemorrágicas y de mantener al paciente en rango óptimo de tratamiento. Sin embargo, requieren de una adecuada infraestructura y personal capacitado para que funcionen eficientemente. En este consenso argentino se propone una serie de parámetros para la gestión efectiva de una clínica de anticoagulación. El objetivo es lograr una elevada calidad desde el punto de vista clínico-asistencial a través de un laboratorio de hemostasia de excelencia. Los criterios desarrollados en el documento fueron consensuados por un amplio grupo de expertos especialistas en hematología y en bioquímica de todo el país. Estos criterios deben adaptarse a la irregular disponibilidad de recursos de cada centro, pero
siempre se los debe tener en cuenta a la hora de indicar el tratamiento anticoagulante con estas drogas. Tener en consideración estas premisas nos permitirá optimizar la atención del enfermo anticoagulado con AVK y de esta forma minimizar las intercurrencias trombóticas y hemorrágicas a las que está expuesto, para así honrar nuestra promesa de no dañar al paciente.
Palabras clave: clínica de anticoagulación, antagonistas de la vitamina K, razón internacional normatizada (RIN), indicadores de calidad, consenso
Abstract Treating an anticoagulated patient with vitamin K antagonists (VKA) remains a challenge, especially in areas where dicoumarins are still the first drug of choice due to the cost of other oral anticoagulants. Anticoagulation clinics have proven to be the most efficient and safe way to avoid thrombotic and hemorrhagic complications and to keep patients in optimal treatment range. However, they require adequate infrastructure and trained personnel to work properly. In this Argentine consensus we propose a series of guidelines for the effective management of the anticoagulation clinics. The goal is to achieve the excellence in both the clinical healthcare and the hemostasis laboratory for the anticoagulated patient. The criteria developed in the document were agreed upon by a large group of expert specialists in hematology and biochemistry from all over the country. The criteria presented here must always be considered when indicating VKA although they had to be adapted to the unequal reality of each center. Taking these premises into consideration will allow us to
optimize the management of the anticoagulated patient with VKA and thus minimize thrombotic and hemorrhagic intercurrences, in order to honor our promise not to harm the patient.
Key words: anticoagulation clinic, vitamin K antagonists, international normalized ratio (INR), quality indicators, consensus
Dirección postal: José M. Ceresetto. Servicio Hematología, Hospital Británico de Buenos Aires, Perdriel 74, 1280 Buenos Aires, Argentina
e-mail: jceresetto@intramed.net
Los dicumarínicos o antagonistas de la vitamina K (AVK) como el acenocumarol y la warfarina, son todavía la forma más frecuente de tratamiento anticoagulante oral (ACO) en nuestro medio. Estos anticoagulantes han demostrado por años ser drogas muy eficientes para prevenir eventos trombóticos, incluyendo la enfermedad tromboembólica venosa, prevención de embolia sistémica y de accidente cerebro vascular (ACV) en pacientes con fibrilación auricular (FA), infarto de miocardio y reemplazos valvulares1. Luego de más de 70 años de uso siguen vigentes, algo similar a lo que pasa con la aspirina.
En un registro actual se calcula que en el mundo, aproximadamente el 1% de la población se encuentra recibiendo tratamiento anticoagulante con AVK2. Es probable que esta cifra aumente en las próximas décadas, ya que la población añosa es la que está más expuesta a trombosis y enfermedades que requieren el uso de anticoagulantes, como la FA y el tromboembolismo venoso (ETV)3, 4.
A pesar del advenimiento de los anticoagulantes orales directos (AOD) en la última década, que cuentan con un perfil de seguridad y facilidad de manejo superior a los AVK, los AOD no han logrado desplazar a los dicumarínicos en nuestro medio, posiblemente por su mayor costo.
Es por esto que la educación y búsqueda de excelencia con los AVK no debería menguar, sino por el contrario estimularse, tratando de obtener los mejores resultados con una alta calidad médica5, 6.
En Argentina, la FA representa el 60% de las indicaciones de anticoagulación, seguida por la ETV (30%), el reemplazo valvular mecánico (4%) y otra miscelánea de enfermedades (6%)7.
Sin embargo, los AVK están lejos de ser la droga anticoagulante ideal. Por el contrario, tienen un perfil farmacodinámico impredecible y también la necesidad de un monitoreo eficiente, con cambios frecuentes en la dosis y sin mucho margen para el error por su estrecha ventana terapéutica8. Esta característica de comportarse como una droga en la que cada paciente necesita una dosis diferente o “individual”, depende de múltiples factores, como la farmacodinamia y farmacocinética particular de los AVK, factores genéticos y ambientales como la dieta, u otros medicamentos, enfermedades preexistentes como insuficiencia cardíaca o enfermedad hepatobiliar, variabilidad en el laboratorio y grado de adherencia y persistencia del paciente con el cumplimiento del tratamiento, también denominado compliance3. Poder prescribir correctamente la dosis de AVK en un paciente individual, requiere entrenamiento adecuado de quien lo prescribe y conocimiento de las múltiples variables de la farmacología de estos medicamentos1-5, 8, 9.
Así, los AVK son medicamentos potencialmente riesgosos si no se manejan en forma adecuada. Esto hace que en muchos casos se subutilice la anticoagulación por temor al sangrado por dicumarínicos. En el registro reciente GARFIELD-AF, el 30% de los pacientes con FA y criterio de anticoagulación no recibían tratamiento alguno10 y en el registro PINNACLE, de EE.UU., (2018), el 42% no recibía anticoagulación11. En población de pacientes añosos y frágiles el uso de AVK con criterio de tratamiento es 50% menor al uso en los más jóvenes, a pesar del mayor riesgo tromboembólico que ellos presentan11-13.
Las complicaciones relacionadas a los AVK son el motivo de consulta más frecuente en los servicios de emergencia por toxicidad de un medicamento. En países con adecuada fármacovigilancia los AVK son la principal causa de muerte por drogas. En un informe donde se buscó en certificados de defunción la relación entre muerte y efecto adverso de un medicamento en EE.UU., los AVK fueron la droga más reportada, principalmente por hemorragias que provocan la muerte14. Es por esto que diferentes grupos de expertos y hasta el departamento de Salud Pública del Reino Unido consideran a los dicumarínicos como “medicamentos de alto riesgo”. Estos medicamentos requieren medidas adicionales de control y monitoreo, dada su estrecha ventana terapéutica y gran inestabilidad, con alto riesgo de daño cuando son usados en forma incorrecta15-17. Por otro lado, la Joint Commission International, que evalúa y acredita a hospitales y centros de salud con alta calidad médica, recomendó que mejorar el uso de la anticoagulación con AVK era uno de los objetivos fundamentales para disminuir el daño6.
Debido al alto efecto social y la repercusión en la salud de cada paciente que tiene el correcto control de la anticoagulación, posiblemente éste no debería dejarse solamente a cargo de las buenas intenciones de médicos no especialistas en la materia. El monitoreo de los AVK debería más bien estar supervisado como parte de la estructura de seguimiento del sistema de salud del Estado, o eventualmente, estar controlado por las sociedades científicas dedicadas al campo de la hematología y la hemostasia16, 18, 19.
La anticoagulación con AVK requiere especialmente de un laboratorio capacitado, que cumpla con los requisitos para generar resultados clínicamente confiables en la determinación de la razón internacional normatizada (RIN).
También necesita de un médico hematólogo entrenado en ajustar la dosis después de cada control, sopesando los riesgos de hemorragia y de trombosis, y de la educación continua del paciente.
Existen tres modelos para realizar el monitoreo de los AVK1, 5, 8, 19.
A) Lugares donde el laboratorio y la atención médica están integrados, denominados clínicas de anticoagulación (CAC) en las que al paciente le realizan el control de RIN y ajuste de dosis en un mismo lugar y en un corto período de tiempo, con un equipo médico experimentado y disponible para la consulta espontánea.
B) Laboratorio clínico independiente del centro médico, en el que el especialista o médico generalista realiza el ajuste de la dosis. En algunas ocasiones, en este modelo, el entrenamiento médico o la competencia del laboratorio en el control del nivel de anticoagulación pueden no ser apropiados.
C) La alternativa de auto monitoreo con dispositivos point of care (POC) por parte del paciente en su domicilio, con o sin supervisión del hematólogo. Aún poco implementado en nuestro medio. El paciente debe concurrir a la CAC para registrar los autocontroles y evaluar el funcionamiento del equipo. Algunas de las limitaciones de este método son la falta de registro de cada control y posiblemente, la falta de soporte legal para el procedimiento.
Los pasos propuestos que se deberían seguir al empezar un tratamiento anticoagulante con AVK son3, 6, 8, 15, 18, 19:
1) Indicación de anticoagulación correcta según la afección del paciente.
2) Elección del rango de RIN deseado según el motivo de anticoagulación y características del paciente.
3) Estratificación del riesgo de sangrado.
4) Educación inicial del paciente.
5) Elección del dicumarínico a utilizar y la dosis de comienzo.
6) Explicación al paciente sobre la duración aproximada del tratamiento y frecuencia de los controles.
7) Se debe plantear en cada institución la posibilidad de la firma de un consentimiento informado (CI) según lo recomendado por la Ley de derechos del paciente (N° 26.529) que garantiza a toda persona el derecho al CI para recibir información adecuada y comprensible (a través de los medios y tecnologías que sean necesarias) acerca del estado de salud y el tratamiento y las alternativas de atención (Anexo 1).
8) Elección del método apropiado para la determinación de RIN y citar al paciente para control.
9) Se debe asegurar la comunicación efectiva de la dosis del AVK teniendo en cuenta las características del paciente. La dosis del anticoagulante debería ser indicada idealmente en forma escrita; en modalidad presencial o por un medio electrónico previamente consensuado con el paciente o responsable, y del cual quede algún respaldo (sea físico o electrónico); o en una consulta médica de telemedicina que cumpla con los requerimientos regulatorios establecidos por la ley.
10) Rápida identificación de la dosis de mantenimiento.
11) Establecer normativas para el manejo de anticoagulación excesiva, suspensión perioperatoria, interferencia medicamentosa y ante situaciones de sangrado. Estas normas deben estar redactadas por escrito en la CAC para homogeneizar la conducta médica en la institución entre los diferentes profesionales.
12) Definición del momento en que se completa el tratamiento anticoagulante y su suspensión, según el riesgo de sangrado según el riesgo de sangrado y de trombosis individuales y el riesgo de trombosis.
Diversos trabajos han demostrado que la atención integral del paciente en clínicas de anticoagulación mejora no solo su predisposición para concurrir a los controles del RIN, sino que también el tiempo en rango terapéutico (TRT), probablemente por una mayor adherencia al tratamiento.
El TRT es uno de los parámetros que permite medir la calidad de la anticoagulación en cierto período de tiempo y que se ha relacionado con la presencia de complicaciones trombóticas, hemorrágicas, internaciones y muerte6, 20-25.
El objetivo de este consenso es revisar los parámetros que se pueden usar para implementar el modelo de una clínica de anticoagulación de alta calidad, mencionando conceptos prácticos sobre los AVK, sus características farmacológicas y el manejo de circunstancias prácticas asociadas a su empleo.
Las recomendaciones que figuran en un recuadro al final de cada tema son los estándares mínimos de calidad para cualquier clínica de anticoagulación que maneja AVK, ya sea que se trate de un hematólogo en su consultorio o de un centro que atienda cientos de anticoagulados por día. Esto permitirá a los profesionales de la salud profundizar sus conocimientos para desarrollar un modelo de atención sanitaria sustentable, costo-efectivo y que mejore la calidad de vida de los anticoagulados.
Este documento no incluye la terapia anticoagulante en niños.
Mecanismo de acción de las drogas antagonistas de la vitamina K
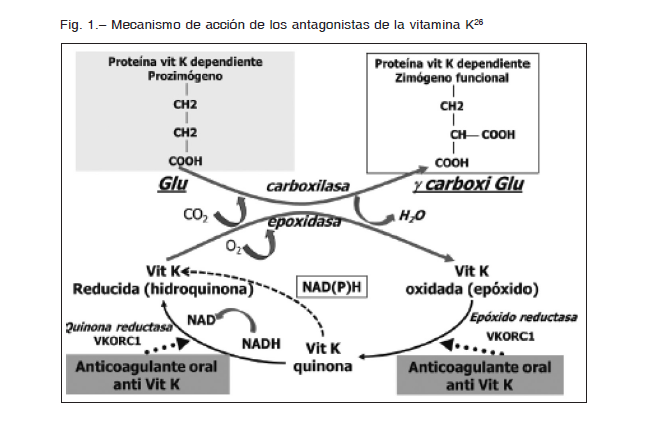
La vitamina K de la dieta, en su forma de hidroquinona, actúa como cofactor para la gamma-carboxilación de los factores de la coagulación denominados vitamina K dependientes (FII, FVII, FIX y FX). La dicarboxilación permite la unión, mediada por iones calcio, de estas proteínas a las superficies lipídicas donde ocurre la activación de los factores. Los AVK bloquean el ciclo de óxido-reducción de la vitamina K (Fig. 1) y por lo tanto previenen la producción de los factores de coagulación K dependientes biológicamente activos26.
La velocidad de descenso de los factores vitamina K dependientes se correlaciona con la vida media de cada factor de coagulación. Así, el FVII es el primero en descender por su vida media corta de 6 horas, junto con la proteína C. Luego desciende el FIX con una vida media de 24 horas, el FX de 36 horas y finalmente el FII cuya vida media es de 72 horas. Se considera que el paciente está anticoagulado cuando el RIN está en el rango elegido y el nivel de FII está entre 25-30%.
Factores que afectan a las drogas antagonistas de la vitamina K
Existen diferentes variables que afectan el nivel de anticoagulación con los AVK, algunas con mayor relevancia clínica y otras que se han descripto en la literatura, pero no son trascendentes en el manejo cotidiano:
Variaciones en la dieta
Según su contenido en vitamina K1 o filoquinona. Entre los alimentos con alto contenido de vitamina K (mayor a 50 μg/100g) se deben mencionar1, 8.
– Coles como brócoli, repollo, repollito de Bruselas, coliflor.
– Algunas verduras de hoja (cocida o natural) como acelga, endivias, espinaca, rúcula, lechuga morada, berro.
La lechuga de hoja verde, radicheta, espárragos y apio, solo tienen moderada cantidad de vitamina K y pueden ingerirse regularmente.
– Nabo.
– Remolacha, brotes de alfalfa.
– Kiwi.
– Algunas bebidas a base a hierbas (Amargo Serrano u otros similares) jugo de arándanos o de frutos rojos.
– Sushi (por el alga Nori).
– Hígado.
– Té verde (sin hervir), infusiones con hierbas medicinales (cola de caballo y hierba de San Juan) y yerba mate con hierbas serranas o mezcla de hierbas. El cannabis puede potenciar a los AVK.
– Soja y leche o aceite de soja.
– Productos hipercalóricos que contienen vitamina K
(Ej.: Ensure®) y la nutrición parenteral total que generalmente viene suplementada con vitamina K.
De estos alimentos, los que mayor concentración de vitamina K tienen son las coles como: repollo verde cocido, coliflor, repollitos de Bruselas y brócoli. También la espinaca cocida. Sin embargo, no debemos prohibir el consumo de las verduras de hoja verde, sino recomendar que los pacientes no tengan grandes variaciones en su ingesta, manteniendo la dieta habitual. En los casos con menor consumo habitual de vitamina K, una ingesta alimentaria inusualmente rica de esta vitamina incrementa más la variación del RIN respecto de aquellos con dietas usualmente ricas en vitamina K.
Interferencia medicamentosa
Existen más de 250 drogas que interfieren con los AVK, algunos de ellos de uso habitual y que muchas veces no son considerados por el médico general (Tabla 1). Puede ocurrir que algunos medicamentos potencien el efecto anticoagulante y que otros lo inhiban1.
Situaciones clínicas especiales
Enfermedades que afectan la función del hígado y de la vía biliar (hepatitis aguda o crónica, descompensación de una insuficiencia cardíaca con congestión hepática o colestasis). También una simple gastroenteritis en donde se altere la flora intestinal que sintetiza vitamina K2 (menaquinona) puede modificar el RIN. La edad es otro factor para tener en cuenta: los ancianos requieren una menor dosis de dicumarínicos para mantenerse adecuadamente anticoagulados9, 16. La ingesta excesiva de alcohol puede afectar al hígado y aumentar el riesgo de sangrado.
Factores genéticos
Existen mutaciones que producen variaciones en el gen del citocromo hepático P450 o CYP2C9, responsables de una mayor o menor sensibilidad a los AVK. Uno de los polimorfismos, que se presenta en el 2 a 15% de la población de origen europeo-caucásico, solo permite catabolizar el 10% de la warfarina y podría determinar mayor riesgo de sangrado por la alta sensibilidad a la dosis de carga de la droga. El fenprocumon, no utilizado en nuestro medio, tiene menor afectación en su metabolismo por CYP2C927.
Otro polimorfismo de la enzima vitamina K epóxido reductasa (VKORC1) puede hacer que se necesite una dosis de AVK menor. Estas mutaciones podrían explicar hasta un 30% de la variabilidad en la dosis entre pacientes, que ocurre con los AVK1, 8, 28.

Particularidades de los diferentes antagonistas de la vitamina K
En el mundo existen diversas drogas que poseen la aptitud de inactivar la síntesis de los factores vitamina K dependientes biológicamente activos. En Argentina se emplean dos agentes que actúan como antagonistas de la vitamina K que tienen características diferentes, la warfarina y el acenocumarol. El más utilizado en nuestro medio es el acenocumarol, en casi el 80% de los casos.
Según la bibliografía, el acenocumarol es tan efectivo y confiable como la warfarina; pero existen diferencias entre ambas drogas que conviene tener en cuenta al momento de elegir la terapéutica anticoagulante1, 8.
Uso y sostén bibliográfico
El acenocumarol se indica mayoritariamente en Latinoamérica y parcialmente en España, Francia y Holanda. La warfarina, por el contrario, se usa en países con ascendencia anglosajona como el Reino Unido, EE.UU., Alemania, Australia y Canadá. El fenprocumon es empleado en Alemania, Holanda y Brasil. Casi toda la bibliografía mundial que respalda el uso de los AVK se basa en publicaciones de origen anglosajón que utilizaron warfarina. Si bien la mayoría de los estudios farmacocinéticos y farmacodinámicos se han realizado sobre ella, por la información existente sobre el acenocumarol, se infiere que la interferencia medicamentosa y posiblemente los efectos tóxicos, son muy similares a los de la warfarina. Sin embargo, la dosis de inicio y el manejo perioperatorio, es diferente. En el caso de un paciente que deba realizar viajes frecuentes a lugares donde el anticoagulante habitual es la warfarina, posiblemente sea más prudente anticoagularlo con esta droga, para evitar inconvenientes en el extranjero.
Vida media diferente
El acenocumarol tiene una vida media corta de 9 horas, la warfarina de 36 horas y el fenprocumon de 216 horas.
Si bien hay trabajos donde la permanencia en el rango buscado de anticoagulación fue equiparable entre los AVK, la diferencia en la vida media determina que el efecto de la warfarina y el fenprocumon en sangre sea más duradero que el del acenocumarol.
• Los pacientes con warfarina necesitan un mayor período de suspensión antes de una cirugía, de al menos 5 días contra 3 del acenocumarol. La trascendencia de este dato es tal, que en más de una oportunidad se ha suspendido o pospuesto una cirugía porque al día del procedimiento el RIN está aún elevado, si no se suspendió a la warfarina por un tiempo mayor1, 8. Por otro lado, si el paciente debe suspender con frecuencia la anticoagulación o si tiene mayor riesgo de sangrado, podría optarse por un AVK de vida media más corta como el acenocumarol.
• Dada la vida media corta del acenocumarol, si se mide el RIN el día después de una suspensión de dosis (ya sea programada o por olvido del paciente) el RIN obtenido puede estar en niveles sub terapéuticos. Puesto que en tratamientos crónicos como la anticoagulación oral el olvido de la toma de la medicación es relativamente frecuente, no se debería considerar como válido un control, si éste se hizo luego de no haber tomado la dosis del AVK prescripta. Por otro lado, esto mismo ocurre si se determina el RIN luego de la suspensión de dosis en el esquema semanal (día de descanso). Hay experiencias que muestran que los niveles del RIN estuvieron en valores sub terapéuticos en el 55% de los pacientes si estaban medicados con acenocumarol vs. 28% de los que tomaban warfarina luego del día de descanso de dosis29. Se debe considerar a la warfarina en aquellos que requieran muy bajas dosis de AVK con múltiples días de descanso u olvidos frecuentes para lograr un mejor TRT. En el caso de preferir la indicación de acenocumarol en estos individuos muy sensibles, se recomienda emplear los comprimidos de 1 mg para lograr un nivel más constante.
• Posiblemente, dada la mayor vida media de la warfarina, se consiga en algunos casos mayor estabilidad en los niveles de anticoagulación.
Dosis de tratamiento
El acenocumarol es aproximadamente 40-50% más potente que la warfarina. Así la dosis promedio de acenocumarol en un estudio fue 3.8 mg/día contra 5.6 mg/día de warfarina16. Por lo tanto, si se va a pasar de una droga AVK a otra, se debe calcular esta diferencia en la dosis. Por otro lado, los comprimidos de acenocumarol son de 1 y 4 miligramos y los de warfarina en nuestro medio de 1, 2 y 5 miligramos. A los fines prácticos 1 mg de acenocumarol (1/4 del comprimido de 4 mg) suele corresponder a 2-2.5 mg de warfarina (1/2 comprimido de 5 mg). De todas maneras, siempre es aconsejable medir el RIN tempranamente si se intercambian diferentes AVK, para verificar el nivel de anticoagulación.
El médico hematólogo debe personalizar el tipo de anticoagulante según las características individuales del paciente y eventualmente rotar de uno a otro para optimizar el TRT adecuado, según la edad, dosis promedio, estabilidad y riesgo de sangrado.
Obtención de un RIN correcto
La prueba de elección para controlar la terapia anticoagulante con AVK es el tiempo de protrombina (TP) expresado como RIN.
Se define RIN como:
[TP del paciente (seg)/media geométrica de TP normales (seg)]ISI.
La sigla ISI es el índice de sensibilidad internacional de la tromboplastina que se utilice para el ensayo. Es recomendable que el ISI sea específico para el coagulómetro que se esté utilizando. Para el cálculo de la media geométrica se recomienda procesar al menos 20 muestras de plasma de individuos normales cada vez que se cambie el lote de tromboplastina. En algunas situaciones especiales donde hay incertidumbre acerca del valor del RIN (cirróticos, deficitarios de factores V y VII, los que reciben heparina), se puede determinar la actividad del FII de la coagulación para evaluar si el paciente está bien anticoagulado.
Todas las guías señalan la necesidad de un RIN confiable y destacan el rol central del laboratorio para el éxito de la terapia anticoagulante. El personal entrenado de laboratorio realizará la determinación del RIN garantizando la identificación inequívoca del paciente, la seguridad, el confort y la privacidad en la toma de muestra, procesamiento y gestión de los resultados.
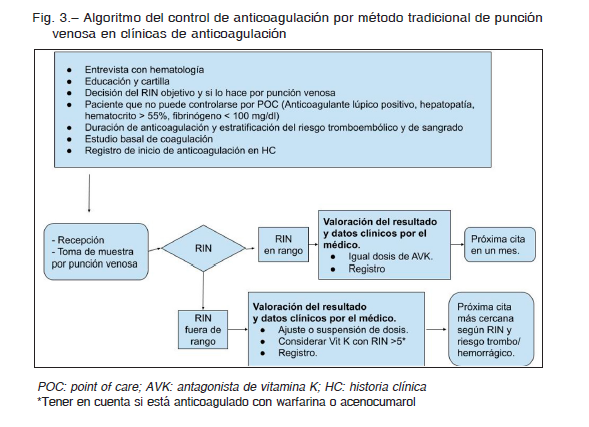
Según cual sea la metodología de monitoreo, se puede hacer el control del RIN por punción de dedo medido con un coagulómetro portátil, también llamado dispositivo POC donde se obtiene un valor de RIN POC (Fig. 2) o control por punción de vena que es el método del RIN tradicional (Fig. 3).
Si bien en Argentina no es un requisito legal que un laboratorio se encuentre certificado o acreditado por alguna norma como por ejemplo la ISO 15189 u otras similares, se recomienda seguir los lineamientos de las mismas, lo que permitirá mantener un sistema de gestión adecuado. Debe utilizar un sistema de control estadístico interno de la calidad de dos niveles (uno con nivel normal y otro nivel bajo cercano al punto de decisión médica).
También debe participar en un programa externo de evaluación de la calidad que incluya la determinación de RIN (Anexo 3).
En el paciente ambulatorio, el laboratorio debe informar el resultado del estudio en el menor tiempo posible para lograr un rápido ajuste de dosis y una mejor adherencia al tratamiento.
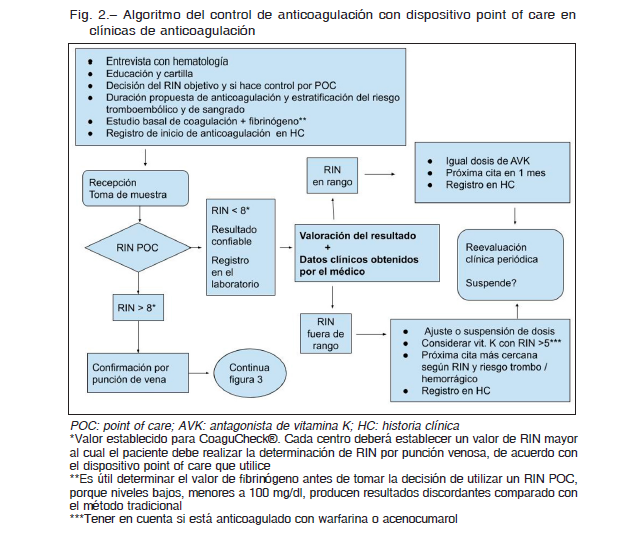
El laboratorio debe establecer valores comunicables o reportables (aquel valor de RIN que debe informarse al médico antes de la toma de la siguiente dosis del AVK) y valores críticos (aquel que pone en riesgo la vida del enfermo y que se debe informar con premura al médico tratante) tanto en pacientes internados como ambulatorios. Se sugiere considerar como valor crítico a un RIN mayor a 8 y se debería comunicar al médico antes de 4 horas de obtenido el resultado. Como valor reportable se sugiere utilizar un RIN mayor a 4.5 y menor a 1.5 en anticoagulados con AVK, exceptuando aquellos que han suspendido transitoriamente el tratamiento anticoagulante. Antes de informar los valores críticos se deben excluir errores preanalíticos en la muestra. Si bien en esta guía se sugieren valores críticos y comunicables, cada institución debe consensuar entre los médicos y los bioquímicos estos valores y la política de comunicación de los mismos.
Requisitos para realizar la determinación del RIN por el método tradicional, por punción de vena, en forma correcta (Fig. 3)30-34.
a) En primer lugar deben cumplirse estrictamente las variables pre analíticas30, 31.
• La muestra debe ser extraída aplicando el lazo por un corto período (en lo posible no mayor a un minuto).
En el caso de pacientes con tratamiento de hemodiálisis la muestra debe extraerse antes de conectar al paciente.
• Utilizar un tubo con citrato trisódico 105 a 109 mmol/l (3.13% a 3.20%) (1 parte de anticoagulante + 9 partes de sangre). No utilizar citrato trisódico al 3.8% que produce valores de RIN más elevados.
• Se debe rechazar tubos mal enrasados (rango de tolerancia 90-110%).
• Corrección del volumen de citrato para aquellos con Hto > 55%. Se sugiere NO corregir el volumen de citrato cuando el hematocrito del paciente sea menor a 25%30, 31.
• Rechazar muestras hemolizadas y/o coaguladas total o parcialmente.
• Las muestras deben ser mantenidas tapadas a temperatura ambiente hasta la centrifugación que debería realizarse como máximo 1-2 horas después de extraída la muestra.
• Si bien las guías internacionales dicen que la muestra para la determinación de RIN es estable hasta 24 horas luego de extraída, en el contexto de las CAC la muestra se debe procesar lo antes posible30, 31.
• Si se conserva el plasma congelado, descongelar 3-5 minutos en baño a 37°C antes de la medición del RIN
• En caso de que la muestra se obtenga de un catéter central o de un acceso vascular, considerar la posible interferencia de heparina o de una hemodilución como causa de error.
b) Utilizar tromboplastinas sensibles, con ISI lo más cercano a 1 (rango entre 0.9 a 1.4). Se recomienda incluir en el informe el valor del ISI con el que se realizó la determinación del RIN.
c) Utilizar la media geométrica de normales propia del laboratorio para cada lote de tromboplastina. Para el cálculo de la media geométrica se recomienda procesar al menos 20 plasmas normales en distintas jornadas de trabajo (más de tres) para evitar desviaciones, aunque se postula que un pool comercial con 100% de actividad de factores de vía extrínseca y de la vía final común podría cumplir el mismo rol33-36.
d) Utilizar tromboplastinas que informen el ISI para el equipo que se utiliza, es decir ISI sistema-reactivoinstrumento específico. En caso de no tener acceso, usar ISI genérico para sistema de detección. Esto último requiere verificación local del ISI a través de plasmas certificados33-36.
e) Respetar los tiempos de reconstitución de los reactivos liofilizados señalados en el inserto de la tromboplastina.
f) Se recomienda verificar el valor del RIN al menos una vez al año, con verificadores de RIN o cada vez que cambia el lote de tromboplastina. Si los valores de RIN obtenidos no concuerdan (±15%) con los valores objetivos de los plasmas informados para los controles, se deben tomar acciones correctivas. En primer lugar, recalcular la media geométrica poblacional y volver a procesar los plasmas verificadores de RIN. Si a pesar de la nueva media los nuevos valores de RIN de los plasmas verificadores no alcanzan los valores objetivos, se debería recalibrar el ISI de la tromboplastina localmente33-36.
La heparina no fraccionada (HNF) en rango terapéutico no afecta el RIN porque la mayoría de los reactivos de tromboplastina cálcica neutralizan a la HNF hasta una concentración de 0.8-1 UI/ml. Si la concentración de heparina en la muestra supera este nivel, el valor de RIN podría verse afectado. Las heparinas de bajo peso molecular en concentraciones menores a 2 U anti Xa/ml no afectan el valor del RIN.
Utilidad del tiempo de tromboplastina parcial activado en el control de la terapia anticoagulante con antagonistas de la vitamina K
Para un valor del RIN determinado, el grado de prolongación del tiempo de tromboplastina parcial activado (APTT) depende del par sistema de reactivo/sistema de detección. Recordar que si se va a procesar el APTT se debe realizar antes de 4 horas de extraída la muestra si no contiene HNF y antes de una hora si la contiene30.
El APTT no es indispensable en el control del nivel de anticoagulación por AVK, pero podría ser útil en algunas circunstancias que se detallan a continuación:
a) En el estudio basal, antes de iniciar la anticoagulación, para conocer si el paciente tiene alguna enfermedad hemorrágica por déficit de factores o si es portador de un anticoagulante lúpico.
b) Para excluir la presencia de HNF en concentraciones superiores a 0.8-1 UI/ml. Por ejemplo, cuando hay sospecha de contaminación de la muestra con heparina o cuando el paciente está anticoagulado con HNF.
c) Cuando se realiza la suspensión del AVK previo a una cirugía o procedimiento, el control debe incluir TP y APTT.
d) Cuando se duda de la calidad pre analítica de la muestra, ya que un APTT por debajo del límite inferior del valor de referencia podría indicar activación de la muestra.
Dispositivos point of care para la determinación de RIN
Los POC son dispositivos para realizar un determinado ensayo al lado del paciente por personal capacitado y fuera del laboratorio, como fue definido por las guías que determinan la calidad y la competencia para dispositivos POC37. En los últimos años se han desarrollado distintos dispositivos POC para el control del RIN, totalmente automáticos, en los que el reactivo está contenido en una tira y la muestra es sangre entera capilar o de punción venosa no citratada. Existen distintos métodos para la detección del RIN POC: a) por movimiento de partículas de metal en campo magnético; b) movimiento de sangre en un tubo capilar; c) medida de la impedancia por cambios electroquímicos; d) monitoreo de la trombina generada por un sustrato cromogénico; e) monitoreo de la trombina generada por una detección electroquímica.
El software del equipo convierte la señal observada en un valor de RIN mediante una fórmula establecida por el fabricante para hacer el resultado del ensayo comparable con el método tradicional de la OMS. Esta calibración se logra midiendo la misma muestra de individuos normales y anticoagulados estables, con estudios basales normales con los POC y con un sistema de detección/reactivo predefinido trazable con el método manual de la OMS.
La ecuación de conversión se coloca en el software del equipo. Diversos estudios han demostrado que el RIN obtenido por el método tradicional a través del tiempo de protrombina es comparable al obtenido con los dispositivos POC realizado por punción digital. Los programas de evaluación externa de la calidad han reportado entre un 10 y 20% de desacuerdo entre los valores de RIN por el método tradicional y los POC, que es similar a los CV reportados con las diferentes combinaciones reactivo/ coagulómetro del método tradicional37-41. La guía de CLSI POCT 14 A Point of care monitoring of Anticoagulation Therapy, (2004), menciona que los resultados obtenidos mediante POC por encima de RIN > 5.0 tienen menor exactitud, precisión y linealidad, al igual que el RIN obtenido por el método tradicional39, 40. Sin embargo, desde un punto de vista clínico, si el paciente no tiene sangrados la conducta médica no será diferente entre un valor de RIN medido por POC o por punción de vena.
Las principales ventajas de los dispositivos POC para el control de RIN son37, 41:
a) Menor tiempo en obtener el resultado, lo que impacta en la adherencia a los controles.
b) Escaso volumen de muestra.
c) Menor molestia para el paciente, especialmente si tiene malos accesos venosos.
d) Menor complejidad en la realización del RIN y en la necesidad de un operador calificado (extraccionista en lugar de técnico especializado).
e) Aumenta la capacidad de procesamiento del laboratorio.
La mayoría de los dispositivos pueden almacenar los resultados y los transmiten mediante una interfase a los diferentes sistemas de información del laboratorio (LIS).
Es de vital importancia establecer un protocolo de registro de los resultados si no está informatizado.
El RIN POC no se puede utilizar en algunas poblaciones que requieren anticoagulación, como: pacientes con anticoagulante lúpico positivo, en cirrosis o hepatopatía crónica, valor de fibrinógeno < 100 mg/dL o déficit de factores, o si está recibiendo alguno de los anticoagulantes orales directos42-44. Si bien en la mayoría de los dispositivos RIN POC se desaconseja su uso en aquellos pacientes con hematocrito superior a 55% y menor a 25%, algunos dispositivos están aprobados incluso para usar en quienes tienen un hematocrito menor a 15%. Debe prestarse atención a las limitaciones de cada dispositivo mencionadas en el inserto.
En resumen, todas las normas internacionales coinciden en que los dispositivos POC deberán ser aptos para el propósito y cumplir con las especificaciones técnicas; deben tener material de control de calidad; los resultados de los ensayos deben registrarse en forma apropiada y consistente; los equipos y las tiras reactivas deben mantenerse de acuerdo a las especificaciones del fabricante; se debe evitar el uso descontrolado e inapropiado del dispositivo; los operadores deben tener las habilidades para desarrollar los ensayos y los mismos deben realizarse en un entorno seguro para el paciente. En el caso de utilizar estos dispositivos debe haber una persona (coordinador de point of care) que se ocupe de la realización de los controles de calidad interno y externo, del estado de conservación de las tiras y de establecer la política de utilización del mismo.
Inicio de tratamiento anticoagulante con antagonistas de la vitamina K
Las dosis altas o “de carga” no son recomendadas al comienzo del tratamiento, ya que provocan niveles supra terapéuticos de RIN y aumentan el riesgo de sangrado. Se deben tener en cuenta algunas variables en el momento de comenzar el tratamiento para no exponer al paciente a mayor riesgo de sangrado1-3, 8.
a) La edad y sexo del paciente: Los pacientes añosos son especialmente sensibles a los dicumarínicos y se sabe que requieren entre 30 y 50% menos de la dosis que uno más joven. Así, un paciente de 50 años recibe una dosis promedio de warfarina de 6 mg/día, pero para un paciente mayor de 70 años la dosis será 3.5 mg/día16. Por otro lado, las mujeres generalmente requieren una dosis algo menor que los hombres. En un trabajo reciente la dosis de comienzo de 5 mg de warfarina por día resultó ser excesiva en el 82% de las mujeres mayores de 70 años y en el 65% de los hombres. En un paciente mayor de 70 años o con alto riesgo de sangrado, probablemente la dosis inicial debería ser la mitad de la utilizada en un paciente joven6.
b) Laboratorio basal que incluya hemograma con plaquetas, hepatograma, creatinina y estudio basal de coagulación (TP y APTT): un paciente con hepatopatía, con alguna predisposición al sangrado como la falla renal o con insuficiencia cardíaca, cuyo estudio basal es anormal, requiere obviamente una dosis menor.
c) La droga anticoagulante utilizada: La dosis en mg de acenocumarol y la forma de fraccionamiento es diferente a la de la warfarina. Se debe prestar atención al anticoagulante que se usa para el inicio del esquema de tratamiento con AVK para evitar confusiones. Si existe alguna duda sobre la calidad del anticoagulante, en el caso de un genérico, eventualmente se puede rotar a otro agente AVK y siempre tener un estrecho monitoreo del RIN.
d) La indicación para la que se requiere anticoagulación: Si se trata de una FA se puede comenzar más lento y con una dosis baja con un monitoreo entre el tercer y séptimo día. Pero en pacientes con una TVP aguda o una válvula mecánica con alto riesgo embólico (Tabla 2), que requieren una rápida anticoagulación, se puede utilizar un esquema de dosis más agresivo3,19.
e) El riesgo de sangrado: si es elevado obliga a ser más prudente en la dosis de inicio (Tabla 2). Para su evaluación se requiere una cuidadosa historia clínica y el laboratorio basal.
f) Polimorfismo genético predisponente: Los portadores de ciertos polimorfismos del citocromo CYP2C9 y de la VKORC1 requieren una dosis significativamente diferente de AVK. Lamentablemente, no es posible en nuestro medio estudiar en forma rápida los diferentes polimorfismos antes de iniciar el tratamiento, por lo cual la mejor prevención es comenzar con una dosis menor de AVK y controles más frecuentes. De todas formas, las guías actuales no recomiendan el estudio fármaco genético para ajustar la dosis de inicio de los AVK1,3,19.
g) El paciente internado: Posiblemente requiera una dosis menor que el paciente ambulatorio porque está más expuesto a otras variables que afectan a los AVK, como: menor ingesta oral, cirugía reciente, desnutrición, menor actividad física, insuficiencia cardíaca descompensada, compromiso hepático y polimedicación. Además, la mayor actividad física se correlaciona con una necesidad de mayor dosis de AVK1. Se debe citar al paciente para que concurra a la CAC no más allá de una semana luego del alta, según cada caso individual.

Existen nomogramas para ajuste de dosis diseñados para la warfarina que pueden utilizarse al comenzar el tratamiento con AVK45.
El período de mayor riesgo de eventos adversos asociados a los AVK son los primeros tres meses de tratamiento, por lo que el monitoreo en esta etapa debe ser frecuente y riguroso, como mínimo cada 15-20 días.
Para el control habitual a largo plazo las guías internacionales recomiendan hacer el control del nivel de anticoagulación con el RIN al menos cada 4 semanas1-3, 5, 8, 46. Cuando el RIN es > 4.5 o < 1.5, citar en forma temprana, no más allá de la semana, y cuando el RIN esté entre 3 y 4.5 o entre 1.5 y 2, citar en las próximas 2 o 3 semanas, dependiendo del riesgo trombótico o hemorrágico. En pacientes adherentes al tratamiento que permanecen en rango por períodos prolongados (4 a 6 meses sin cambios en la dosis), se podría extender el control a 6-8 semanas, si no hay modificaciones en la enfermedad subyacente o en la medicación concomitante3, 5. Pequeñas desviaciones aisladas del RIN en ± 0.2, sobre todo si el AVK es acenocumarol y/o en visitas que correspondan al día siguiente al de la suspensión de dosis, no ameritan cambiar el tratamiento ni volver a citar al paciente anticipadamente.
A partir de distintos estudios se demostró que cuanto más frecuente es el control, mayor tiempo permanece el paciente en el rango terapéutico. Es preferible hacer controles al menos cada 15 días en pacientes de alto riesgo hemorrágico y con antecedente de sangrado mayor. También se recomienda monitorizar el nivel de anticoagulación 3 a 5 días después del inicio de una nueva medicación, si la misma interfiere con los AVK1-3, 6, 8.
Si bien en muchos casos se puede identificar un factor determinante de la variación en el RIN, como cambios en la dieta, medicamentos, enfermedades comórbidas y mala adherencia, en el 50% de los casos no se puede identificar una causa para la variación del RIN entre controles sucesivos de anticoagulación3-6.
En casos extremos de gran variabilidad del RIN, que obligue a visitas permanentes en un paciente adherente, deberá considerarse el cambio a AOD, siempre que estos últimos no estén contraindicados (reemplazo valvular mecánico, embarazo, falla renal terminal, etc.). En este caso se suspende el AVK en forma brusca y se inicia el anticoagulante directo cuando el RIN sea menor a dos.
Efecto clínico del nivel de la anticoagulación
El objetivo del tratamiento anticoagulante es mantener la hemostasia en un estado hipocoagulable medido como un valor de RIN predeterminado y que cumpla con los dos objetivos de eficacia antitrombótica y seguridad adecuada manteniendo un tiempo en rango terapéutico47.
Este valor de equilibrio no ha sido fácil de hallar. Debido al riesgo de sangrado siempre se ha intentado buscar el rango efectivo más bajo posible. Inicialmente se consideró que, en algunos casos, un RIN entre 1.5 y 2 podía ser igualmente eficaz y más seguro, especialmente en los pacientes añosos con FA y con comorbilidades, o para el mantenimiento a largo plazo de la anticoagulación en TVP luego de tres meses iniciales de tratamiento (estudio PREVENT)48. Pero diversos trabajos posteriores demostraron que el RIN por debajo de 2 tenía mayor incidencia de eventos trombóticos, sin lograr menor sangrado16,49.
Con estos resultados se ha establecido en la mayoría de los casos, que el objetivo del tratamiento anticoagulante debe ser fijado en un RIN entre 2 y 31-3, 6, 8.
Las indicaciones para un RIN más alto, con un rango terapéutico entre 2.5 y 3.5 que se recomiendan en las guías internacionales actualmente son1, 8:
a) Reemplazo valvular mecánico en posición mitral.
b) Reemplazo valvular mecánico aórtico de modelo monodisco y con alto riesgo embólico, como las válvulas de tipo jaula/bola.
c) En algunos casos en que se presente un evento trombótico bajo anticoagulación con un adecuado valor de RIN y TRT.
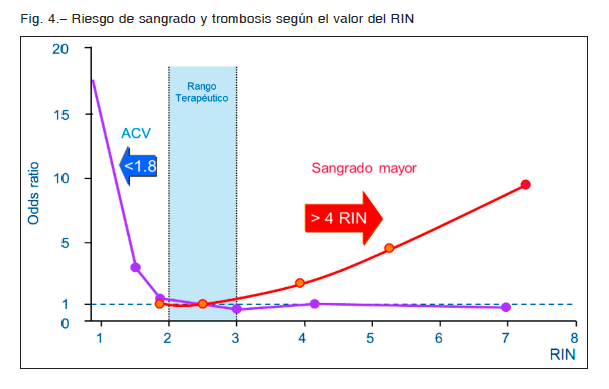
Para el ajuste de la dosis, considerando la ventana terapéutica de los AVK, se nota que la curva de eventos adversos es más pronunciada cuando se tiende a valores de RIN menores que 2 y mayores que 4 (Fig. 4)1, 15, 46, 49, 50.
En estos pacientes, el riesgo tromboembólico se incrementó exponencialmente cuando los niveles de RIN estaban por debajo de 1.8. Un estudio de casos y controles en FA con ACV isquémico mostró que, comparados con RIN 2-3, un RIN de 1.9 tiene 20% más riesgo de padecer trombosis y un RIN de 1.8 incrementa el riesgo de embolia 50% en el curso de un año21. Al menos 50-60% de todos los eventos trombóticos ocurrirán cuando el RIN es menor que 2 en pacientes con FA y con ETV51. En un estudio más reciente, en una población numerosa, se observó que la incidencia anual de ACV fue 0,6% por año con un RIN entre 2-3 y que se incrementaba 3 veces cuando estaba entre 1.5 y 1.9. En un registro canadiense, 90% de los 600 pacientes admitidos con ACV y FA estaban con un RIN menor a 2 o habían suspendido la anticoagulación25.
Un RIN < 2 aumentó entre 6 y 8 veces el riesgo de ACV y embolia periférica con el doble de costos para el sistema de salud51. Por lo tanto, un RIN < 2 debería obligarnos a un rápido ajuste de dosis.
Por otro lado, al observar la pendiente de riesgo de sangrado, en la primera parte con un RIN 3-4 la curva de eventos no es tan pronunciada y solo cuando el RIN es mayor que 4 el riesgo de sangrado aumenta en forma significativa. Por ejemplo, solo por subir un punto el RIN por encima de 4, el riesgo de sangrado supera al 40%52, 53.
Para ajustar la dosis de los AVK se debe ser entonces más enérgicos ante un RIN bajo (menor que 1.8), aumentando la dosis y haciendo un nuevo control a la semana, especialmente si tiene alto riesgo trombótico (Tabla 2). En algunos casos puntuales de pacientes con elevado riesgo trombótico y con RIN menor a 1.5 las guías de la American Hematology Association 2018 sugieren indicar un curso corto de heparina de bajo peso molecular en dosis anticoagulante, aunque esto no ha sido apropiadamente evaluado en la literatura19. En los de riesgo moderado alcanzaría con ajustar la dosis de AVK.
En el paciente que tiene un RIN entre 3 y 4, como el riesgo de sangrado no es tan alto, se puede bajar levemente la dosis y hacer un control más alejado a las 2-3 semanas, considerando que no hay riesgo inmediato de sangrado3, 46.
Al comenzar un tratamiento con dicumarínicos, el descenso del RIN se debe en primera instancia a la caída brusca del factor VII, cuya vida media corta (de 6 horas) alarga el tiempo de protrombina. Pero el descenso aislado del FVII no da adecuada protección antitrombótica.
Solo luego de la primera semana, cuando se produce el descenso de los otros factores de la coagulación vitamina K dependientes, se consigue el efecto antitrombótico buscado (al alcanzar un nivel de FII entre 25 y 30%). Por esto la medición temprana del RIN a 24-48 horas del comienzo del tratamiento puede confundirnos y no se recomienda para ajustar la dosis inicial de los AVK5.
El ajuste de dosis, una vez estabilizado el paciente, rara vez debe implicar grandes aumentos o descensos del AVK. Bastan pequeños cambios de dosis para que el control subsiguiente esté en rango. En algunas ocasiones, alcanza con instar al paciente a que incremente la ingesta de alimentos ricos en vitamina K para estabilizar la dosis1, 5.
Un valor aislado fuera de rango es esperable hasta en pacientes muy regulares, y no genera riesgo inmediato de un evento trombótico o hemorrágico54. Una modificación aleatoria del RIN puede deberse a variaciones tanto biológicas como analíticas de la determinación del RIN. Estas variaciones se estiman en aproximadamente el 10% por encima o por debajo del valor buscado y permiten considerar si un cambio en el RIN requiere ajuste de la dosis55.
Cada laboratorio puede calcular el valor de referencia del cambio mediante una fórmula matemática que considera las variaciones intra-individuales y pre analíticas, así como la imprecisión analítica del ensayo en cuestión56, 57.
La posibilidad de tener un sangrado mayor en un paciente con RIN entre 5 y 9, es menor que 1% al mes49-51. Por lo tanto, si bien es importante corregir el valor del RIN, si no hay un sangrado no se debería asustar al paciente, internarlo o tomar medidas heroicas como transfusión de plasma. Tan solo ajustar la dosis, eventualmente darle vitamina K por vía oral si tiene alto riesgo de sangrado y RIN mayor a cinco y volver a citar al paciente al día siguiente, como sugieren las recientes guías de la American Hematology Association46. Cuando el anticoagulante es acenocumarol, por su vida media corta, es suficiente suspender el anticoagulante para bajar el rango en el control del día siguiente58. Siempre se debe investigar una enfermedad subyacente ante un sangrado por AVK (aparato genitourinario, tubo digestivo, buco-nasofaríngeo) y una vez resuelta la causa reinstituir el tratamiento anticoagulante, si corresponde.
En cuanto a los predictores de alto riesgo de sangrado, ninguno de los evaluadores desarrollados (HAS-BLED, ATRIA, ABC, HEMORR2HAGES) se han logrado correlacionar en forma fehaciente con eventos clínicos, por lo que no se recomienda implementarlos para decidir si el paciente debe estar o no con tratamiento anticoagulante13- 15, 46. Aún la población con FA en riesgo de tromboembolismo y HAS-BLED > 3, como marcador de alto riesgo de sangrado, sigue resultando un beneficio clínico neto positivo al mantener el tratamiento con AVK15.
Todos los episodios relevantes de trombosis y de sangrado que ocurren bajo tratamiento anticoagulante deben registrarse en la historia clínica y en la cartilla del paciente como un antecedente clínico relevante.
Debido a que la condición de riesgo de sangrado o de trombosis puede cambiar en el tiempo, se recomienda en cada paciente revisar regularmente los parámetros de riesgo, así como los datos de laboratorio general al menos cada 6 meses.
Parámetros para evaluar la calidad del tratamiento anticoagulante
En los últimos años se ha documentado que uno de los principales marcadores de riesgo de complicaciones trombóticas y hemorrágicas del tratamiento anticoagulante se relaciona en forma directa con la calidad de la anticoagulación13, 15, 47, 59. Para la evaluación de la calidad del control de la anticoagulación existen diferentes métodos:
a) el porcentaje de RIN en rango medido en toda una población, en una fecha determinada, b) el porcentaje de valores de RIN en rango terapéutico de cada paciente individual durante un período (anual) y c) el tiempo en rango terapéutico (TRT) medido por la interpolación entre fechas, propuesto por Rosendaal. También existe otro método muy complejo denominado cálculo de la variabilidad del RIN pero que no se utiliza en la práctica.
De ellos, el que utiliza la fórmula de Rosendaal se ha propuesto como método patrón1. Según cuál de los tres métodos se utilice, los resultados que se obtienen son diferentes, obviamente relacionados entre sí, pero cuantitativamente dispares 1, 7. Por ejemplo, en el registro ANFAGAL, hubo una discrepancia de 20% entre los pacientes en rango medidos por TRT según Rosendaal o el método de porcentaje de aquellos en rango, considerando 65% como un valor adecuado de TRT20:
A continuación se describen los métodos para evaluar la calidad del tratamiento anticoagulante con AVK.
a) Porcentaje de pacientes con un valor de RIN en rango medido en una sola fecha: permite obtener información solo en un momento determinado, pero no da una perspectiva más dinámica de cómo se comporta un paciente en el tiempo.
b) Porcentaje de visitas en rango: simplemente hay que ver cuántos de los últimos 10 controles tenían un RIN en rango terapéutico y calcular su proporción. Pero este método, si bien es el más fácil de realizar, puede no valorar adecuadamente el tiempo en rango terapéutico.
Existe una gran dispersión en el paciente individual al no considerar el tiempo transcurrido entre un control y otro.
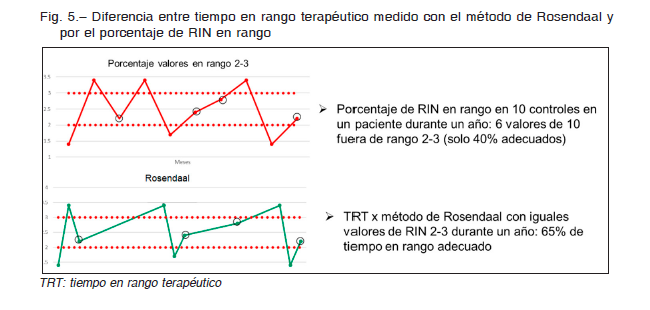
Así, si el tiempo entre dos controles fuera de rango es breve, el promedio del tiempo fuera de rango será menor comparado con el paciente que pasa todo un mes con un RIN inadecuado (Fig. 5). Tampoco tiene en cuenta en cuánto se desvió el RIN del rango terapéutico buscado.
Así, por ejemplo, consideramos a un paciente bien anticoagulado con valores de RIN de 3.1 o de 1.9 a pesar de que el cero por ciento de las visitas estén en el rango correcto entre 2-3.
c) Método de interpolación lineal descripto por Rosendaal: es el que mejor interpreta la calidad del tratamiento anticoagulante. Este método permite estimar el valor diario de RIN y el número de días en los que el paciente está fuera de rango y expuesto a un evento, tanto trombótico como hemorrágico (Fig. 5). Para calcular el TRT y que sea representativo se deben excluir los primeros tres meses de tratamiento anticoagulante con AVK y el tiempo entre cada medición de RIN no debe superar los tres meses. Se considera como TRT adecuado a un valor mayor a 65%. Una de las limitaciones de este método es que asume que la variación en el nivel de anticoagulación entre dos fechas es constante y que cada día el RIN cambió un x-avo, lo que en la mayoría de los casos no es verdad. El método de Rosendaal es de utilidad, tanto para la evaluación del tratamiento con AVK en un paciente individual, como para la estimación del TRT en grupos de pacientes, que nos informa globalmente como
funciona nuestra clínica. Se ha demostrado que el riesgo de sangrado y de ACV isquémico se correlaciona con la adecuación de los niveles de anticoagulación evaluados en los ensayos clínicos a través del TRT, medido con el método de Rosendaal47. Una planilla de cálculo del TRT medido por Rosendaal con acceso libre al público está disponible en http://acomed.app.
La evaluación de algún método para documentar la calidad del tratamiento anticoagulante se considera hoy como una prioridad en las clínicas de anticoagulación, porque está asociado con eventos clínicos de sangrado, de trombosis y de mortalidad. Además, se debe considerar que el antecedente de un sangrado, muchas veces ligado a la mala calidad en la anticoagulación, es la principal causa de abandono del tratamiento con AVK19. Los que se dejan de tratar tienen generalmente mayor riesgo de eventos trombóticos y de muerte si no continúan anticoagulados, a pesar del antecedente hemorrágico15.
En cuanto a la trascendencia clínica del TRT, un análisis de los estudios SPORTIF III y V que comparó a un antitrombínico oral directo contra warfarina en FA, halló una significativa asociación entre el TRT inadecuado y muerte, eventos vasculares y sangrado en la rama warfarina. Así la mortalidad aumentó de 1.7% a 4.2% cuando el TRT era <65%, la trombosis aumentó de 1.69% a 3.48% y el sangrado mayor pasó de 1.6% a 3.8%60.
En el estudio ACTIVE-W la warfarina fue mejor que la combinación clopidogrel más aspirina para prevenir un ACV en pacientes con FA solo cuando el TRT fue mayor que 65%61. Los sujetos con TRT menor resultaron con una protección para la embolia semejante a la rama de antiagregantes y significativamente inferior al grupo que permaneció más tiempo en rango. Según otros estudios, tener un TRT 12% más bajo que el TRT óptimo (65%) aumentaría hasta un 1% el riesgo de ACV en FA. Por otro lado, en el tratamiento inicial de una TVP, un inadecuado TRT en los tres primeros meses parece predecir mayor recurrencia y reinternaciones26.
Con esta evidencia se ha propuesto que uno de los estándares de calidad para aquellos bajo tratamiento con AVK sea tener al menos más del 65% del tiempo un rango adecuado de anticoagulación, con un RIN ± 0.5 del nivel buscado19,51. Este, por supuesto, es un marcador subrogado de las complicaciones clínicas del tratamiento anticoagulante, pero la relación entre ambos parece bien documentada.
La incorporación del TRT a la práctica clínica habitual podría ayudar a mejorar los resultados de la anticoagulación oral y la calidad en las CAC. Así, tener muchos pacientes con un TRT inapropiado (menor al 50%) se ha relacionado con problemas en el desempeño de la CAC 54. Entre los factores institucionales potencialmente corregibles, asociados a un mal TRT, se puede mencionar el hecho de que el personal a cargo de la clínica no tenga experiencia ni formación en el manejo de la anticoagulación.
También que el número de pacientes atendidos sobrepase la capacidad de asistencia del establecimiento, lo que obliga a citarlos en forma más espaciada, sin importar el valor de RIN obtenido62.
Conseguir un adecuado TRT no es nada sencillo. Un metaanálisis, publicado en 2008, halló que el TRT de estudios poblacionales con diseño de cohortes era de 59% (rango 29-75%) en clínicas de anticoagulación del hemisferio norte22. A pesar de que el Registro Nacional Sueco reporta un TRT cercano a 75%, esto está muy por encima de lo que se observa en la mayoría de los estudios aleatorizados, que tienen un TRT promedio de 60%. Por otro lado, en España, en el estudio ANFAGAL, hecho en pacientes con FA, el 43% tenía un TRT < 65%20. En el registro prospectivo GARFIELD-AF de anticoagulación con AVK o AOD en 10 000 pacientes de 35 países con fibrilación auricular, el TRT promedio fue de 55%. Pero en Latinoamérica, el 78% tenía TRT < 60%16. Otros informes de la región también muestran valores sub óptimos de TRT63.
En Argentina el único estudio multicéntrico publicado hasta la fecha sobre la calidad de la anticoagulación es el TERRA7. Este fue un estudio observacional que involucró 14 instituciones (7 hospitales públicos y 7 privados). Cada uno de estos centros reclutó los primeros 100 pacientes consecutivos con FA no valvular tratados con AVK y seguidos por más de un año, con un mínimo de 8 visitas en los últimos 12 meses. Se registró la medición del RIN de cada visita y se calculó el TRT utilizando el método de Rosendaal. Los primeros 3 meses de inicio de AVK fueron excluidos del estudio ya que los valores en esta etapa son muy dispares hasta lograr la dosis adecuada. Se reclutaron 1190 pacientes que fueron incluidos en el análisis. El promedio de edad fue 75 años. La media de TRT fue 66.6% ± 19.4% (mediana 67.5%, IQI 56-80). La variabilidad interinstitucional fue importante, pero dentro de los parámetros mínimos para definir un adecuado funcionamiento de la CAC. Solo dos centros obtuvieron un TRT menor a 60% (TRT de 56 y 55%). Con estos resultados se pudo concluir que la media de TRT en pacientes con FA tratados con AVK en este estudio de especialistas en hemostasia de Argentina fue alta, con valores similares a los vistos en ensayos clínicos internacionales y equivalente, por ejemplo, al TRT recientemente publicado por la Federación Italiana de Clínicas de Anticoagulación4.
Conductas para mejorar la calidad de la anticoagulación
Si un paciente está fuera de rango sin una causa que lo justifique puede ser de ayuda64,65:
– Instruir nuevamente en la CAC al paciente y su familia. Citarlos y reorganizar la forma en que toma el anticoagulante. Muchas veces son útiles medidas simples, como revisar toda la medicación que ingiere el paciente, evaluar la dieta, conseguir un pastillero con cada día de la semana separado, programar una alarma en el celular, asignar un responsable del tratamiento en el entorno familiar o simplemente cambiar el horario de la toma (tomar la medicación a la noche con la cena o antes de dormir) cuando el paciente pueda ser supervisado.
– Aumentar la frecuencia de los controles. Está demostrado que hacer los controles del RIN con más frecuencia mejora el TRT, al menos una vez por semana o cada 15 días en los muy inestables. Siempre citar antes del mes al que está fuera de rango2, 8.
– Rotar el AVK de acenocumarol a uno de vida media más prolongada, como la warfarina, puede generar mayor estabilidad en los controles, especialmente en pacientes con olvidos frecuentes o ante bajas dosis de AVK.
– Diversos trabajos demuestran que programas computarizados de ajuste de dosis logran mejorar el TRT y disminuir la cantidad de ajustes de dosis, ahorrando costos al sistema de salud54. Estos programas automáticos de cálculo de dosis deberían estar supervisados por un hematólogo.
– En casos especiales el auto control con POC es útil, para minimizar riesgos, siempre supervisado por el hematólogo tratante.
Si con todas estas medidas no se logra mejorar el TRT y la adherencia al tratamiento anticoagulante es buena, tal vez la mejor estrategia sea rotar, en algunos casos, al paciente a uno de los anticoagulantes directos, como recomiendan las guías internacionales3, 21, 46.
Los AOD están siendo indicados por una variedad de médicos generales, emergentólogos, cardiólogos y cirujanos vasculares sin una adecuada supervisión e instrucción a los pacientes. Las clínicas de anticoagulación, con muchos años de experiencia en el manejo de AVK en situaciones de inestabilidad clínica como cirugías, exodoncias, sangrados, procedimientos endoscópicos, etc., deben ser un centro de referencia para todos los pacientes a los que se prescriban las nuevas drogas anticoagulantes,
más allá de que requieran controles mucho más espaciados, especialmente de la función renal.
Cuidados generales para el paciente anticoagulado
Se mencionan a continuación algunas de las instrucciones que se deben dar al paciente como parte de su educación al inicio del tratamiento con AVK6, 8, 19, 64:
1) Tome el anticoagulante todos los días a la misma hora. Es preferible que sea por la tarde o a la noche, para que cuando concurra al control del nivel de anticoagulación esté a tiempo de modificar la dosis ese mismo día. Si se olvida una dosis NO la duplique al día siguiente, pero si se da cuenta más tarde en ese mismo día, puede tomar el medicamento.
2) Recuerde siempre el nombre del anticoagulante que usa y la dosis en miligramos para que no ocurran errores, especialmente al retirarlo de la farmacia. Los diferentes anticoagulantes orales no son intercambiables, por lo tanto, consulte siempre al hematólogo ante un cambio de la medicación.
3) Concurra regularmente a los controles de monitoreo de anticoagulación. No hacer el chequeo por períodos prolongados podría ser peligroso. El ajuste en la dosis debe ser efectuado por un médico hematólogo con experiencia en estos medicamentos. No necesita estar en ayunas para el análisis del RIN, basta con evitar los lácteos y grasas, según el requerimiento del laboratorio.
4) No se debe aplicar inyecciones intramusculares, por el riesgo de hematoma local. En caso de requerir una inyección intramuscular se debe comprimir en el sitio de la inoculación durante 20 minutos.
5) Los cambios en su dieta habitual pueden hacer variar los niveles del anticoagulante, especialmente si son productos ricos en vitamina K. Pero estos alimentos, como los vegetales de hoja o las coles, no están prohibidos. Le sugerimos una dieta estable, tratando de evitar grandes fluctuaciones en la ingesta de comidas con vitamina K. Es preferible que mantenga su dieta habitual y que ajuste la dosis del anticoagulante para que la dosis de AVK se acomode a su dieta.
6) Debe evitar la ingesta excesiva de alcohol.
7) Si padece de hipertensión arterial es fundamental que ésta se mantenga bien controlada, de lo contrario podría aumentar considerablemente el riesgo de sangrado cerebral.
8) No consuma hierbas medicinales, laxantes oleosos, polivitamínicos, alimentos hipercalóricos y medicamentos homeopáticos sin consultar al médico. Si le dan nueva medicación o si hay cambios en su tratamiento habitual con otros fármacos, consulte con su hematólogo dentro de las 24-48 horas pues muchos medicamentos afectan a los AVK.
9) Siempre tiene que consultar ante extracciones dentarias, biopsias o cirugías para, eventualmente, suspender la anticoagulación y saber cuándo reiniciarla. Recuerde que estos medicamentos tardan entre 3 y 5 días en dejar de actuar, por lo que siempre debe consultar con su hematólogo al menos una semana antes del procedimiento.
Siempre avise al cirujano u odontólogo que toma medicación anticoagulante.
10) En caso de tener que hacer un viaje, el control debe realizarse antes de la partida. Además, debe llevar al viaje la cartilla, el medicamento y un número de contacto con el médico, en caso de urgencia.
11) Debe evitar deportes de contacto o con alto riesgo de traumatismos como boxeo, motocross, karate, esquí, rugby, etc. Tenga especial cuidado con las caídas y con las escaleras. Si sufre un traumatismo en la cabeza debe consultar a la guardia de inmediato, aun si no tuvo pérdida de conocimiento, porque existe riesgo de un hematoma interno.
12) Se puede aplicar cualquier tipo de vacuna por vía subcutánea. Eventualmente podría aplicarse intramuscular en el deltoides con adecuada compresión.
13) Tiene que acudir al hospital en caso de un sangrado espontáneo como hematomas en la piel o si tiene sangrado por encías o ante un traumatismo grave, especialmente en la cabeza. Si nota que la materia fecal se pone negra o si tiene sangre en la orina también debe consultar de inmediato.
14) Siempre lleve con usted la cartilla o una tarjeta que lo identifique como paciente anticoagulado donde figure su diagnóstico, cuál es el medicamento que toma y el valor del último control. Muéstresela al médico, odontólogo o farmacéutico antes de recibir cualquier medicamento.
15) No tome aspirina o medicamentos con ácido acetilsalicílico a menos que su hematólogo o cardiólogo lo autoricen. En caso de fiebre o dolor puede tomar paracetamol.
16) Para las mujeres jóvenes en edad fértil se debe tener especial cuidado si quedan embarazadas, pues los AVK pueden pueden provocar daño en el embrión. Si sospecha que está embarazada debe consultar de inmediato a su hematólogo para cambiar el anticoagulante. No hay riesgo para la lactancia.
17) Mantenga este medicamento fuera del alcance de los niños.
Rol de las clínicas de anticoagulación para el manejo de los antagonistas de la vitamina K
El monitoreo del paciente anticoagulado con AVK es un desafío. El concepto de las CAC para mejorar el control de anticoagulación surge en 1949 en Holanda y se basa en hacer los controles mediante un equipo de profesionales dedicados especialmente al cuidado de estos pacientes complejos18. Una CAC implica un cuidado coordinado y de alta calidad, monitoreado por un grupo de profesionales de la salud que recibe sujetos bajo tratamiento anticoagulante.
Implica un cambio de paradigma en términos de educación al paciente, involucrando un equipo de salud que está presente y colabora. Su función es lograr el manejo organizado y sistemático de esta población lábil para evitar complicaciones trombóticas y/o hemorrágicas.
Los pacientes son derivados a la CAC por clínicos, cardiólogos, neurólogos, flebólogos y médicos a cargo de servicios de emergencia.
Se ha demostrado que las CAC que tratan gran número de pacientes en forma rutinaria, con médicos hematólogos con experiencia y un sostén especial, tienen significativamente menos episodios de sangrado o trombosis, comparado con el control realizado en forma individual por un médico de cabecera1-5, 48, 66. Uno de los primeros estudios en investigar esta ventaja de las CAC en 271 pacientes anticoagulados por un reemplazo valvular mecánico, demostró una reducción de las complicaciones hemorrágicas de 4.9% a 1% por año y de los eventos trombóticos de 6.6% a 0.6%67. En una revisión reciente de un panel de expertos de EE.UU. se determinó que una CAC tiene 25 eventos trombóticos menos cada 1000 pacientes con ETV, un mejor TRT y 6 casos menos de sangrado mayor por año5.
El objetivo de una CAC es proporcionar atención integral y sistematizada al paciente bajo anticoagulación oral, organizando las diferentes etapas del tratamiento con AVK18, 19, 68.
En Argentina existen centros exclusivos de atención para pacientes anticoagulados que poseen elevados estándares de calidad7. Son un modelo de atención sanitaria integral que brinda educación para pacientes, impartida por médicos hematólogos con formación continua y experiencia en manejo de los AVK; que además cuentan con un laboratorio que utiliza metodología confiable, reactivos calibrados y controles de calidad internos y externos.
Una de las ventajas de las CAC es que consiguen un considerable ahorro en recursos destinados a la salud.
Otro aspecto que ha tomado gran importancia en el último tiempo es el concepto de calidad de vida y su relación con el grado de satisfacción y reducción del estrés. Se ha considerado que una percepción negativa sobre el tratamiento anticoagulante, especialmente si no se siente cómodo con su atención médica, repercute en la estabilidad de la anticoagulación y en la calidad de vida59.
En este aspecto las CAC, por ser más amigables y eficientes, han mostrado un beneficio al generar confianza, sensación de bienestar y mayor contención del paciente anticoagulado18, 24, 69-70.
Las CAC dependen de cuatro aspectos para su éxito:
a) Seguimiento cuidadoso y personalizado del paciente, con registros adecuados. Idealmente debería contactarse con quien deja de concurrir a los controles planeados, tal vez mediante un software diseñado con este fin. Existe la posibilidad en algunas instituciones de que el paciente anticoagulado tenga una alerta en la historia clínica electrónica para detectarlo tempranamente ante una consulta de urgencia o en el caso de una internación y que se avise al servicio de hematología.
b) Educación continua del paciente con compromiso de su entorno para formar un vínculo co-responsable.
c) Comunicación permanente con otros especialistas.
Posibilidad de contacto con el centro de salud en todo momento para resolver la urgencia en caso de un evento hemorrágico o trombótico. Posibilidad de concurrir a un control como demanda espontánea para atención de emergencia.
d) Normas de manejo y adecuado monitoreo del RIN.
Estas normas deben estar por escrito e incluir el modelo de inicio del tratamiento, suspensión transitoria por un procedimiento (bridging) y cómo proceder en caso de un sangrado o de un valor de RIN elevado, y deben figurar en el Manual de Procedimientos Institucional.
Requerimientos sugeridos para una clínica de anticoagulación con adecuados estándares de calidad
La CAC debe contar con una serie de características para optimizar el tratamiento anticoagulante4-6, 9, 18-21. Estas propiedades pueden estar presentes en forma completa o parcial, según sea la disponibilidad del prestador de salud:
1) Personal idóneo: deben contar con personal de salud suficiente y con capacitación en el tratamiento anticoagulante.
– Personal administrativo para organizar el control del nivel de anticoagulación ordenada y eficientemente. En algunos centros la secretaria le puede enviar al paciente un recordatorio de la cita programada de control del RIN el día previo a la extracción.
– Técnico o extraccionista calificado para la toma de muestras de sangre, ya sea por punción de vena o digital.
– Bioquímicos o especialistas del laboratorio en hemostasia que realicen las pruebas de coagulación de manera confiable y rápida, con los estándares de calidad imprescindibles para esta actividad.
– Profesionales de la salud con experiencia y conocimiento sobre el tratamiento anticoagulante con AVK, sus complicaciones y riesgos, para asesorar al paciente en forma personalizada. Si es posible, estos profesionales deben ser hematólogos y con instrucción en hemostasia y trombosis.
2) Estructura de servicio adecuada:
– Boxes de extracción de sangre en cantidad acorde con el flujo esperado de pacientes.
– Capacidad de hacer las pruebas de coagulación para el monitoreo en forma inmediata y con equipamiento confiable, con reactivos adecuados ya sea con un sistema tradicional o POC.
– Posibilidad de realizar la prestación (control del RIN) en un tiempo promedio breve.
– Disponibilidad para la consulta de urgencia para resolver posibles complicaciones del tratamiento anticoagulante, ya sea presencial o telefónica.
– Guías o normas por escrito sobre los procedimientos que se realizan en la clínica de anticoagulación. Por ejemplo, guías para la suspensión por cirugía, manejo de valores de RIN elevado en caso de viajes o de mala adherencia al tratamiento. Se recomienda para la suspensión perioperatoria consultar las guías de la Sociedad Argentina de Hematología71.
– Evaluar necesidad o no de puenteo con heparina de bajo peso molecular en caso de suspensiones transitorias de anticoagulación oral.
– Registro del resultado de los controles del nivel de anticoagulación y de la dosis. Este punto es importante, en especial si se utilizan dispositivos POC, ya que muchas veces el hecho de que no estén conectados al sistema de información de laboratorio (LIS) hace que no quede registrado el resultado del RIN. En nuestro medio, la mayoría de las instituciones utiliza registros en papel o fichas preestablecidas, de tal manera que la evaluación del adecuado desempeño de la CAC es difícil de realizar.
La transición a formas electrónicas de registro permite un acceso más fácil a mediciones de evaluación objetivas como el TRT, que puede ayudarnos en el paciente individual y en la CAC, aportando un parámetro de calidad.
– Contacto del médico permanente y fluido con diferentes especialidades que interactúan con el paciente anticoagulado como dentista, cardiólogo, neurólogo, cirujano, clínico o médico de emergencias.
– En algunas instituciones existen programas automáticos para el cálculo de dosis de los AVK. Estos sistemas inteligentes de monitoreo usan algoritmos prefijados y han demostrado ser superiores a los expertos locales de anticoagulación72. Se pueden utilizar en la medida que el programa esté supervisado por un hematólogo con experiencia.
3) Lograr un tiempo en rango terapéutico mayor a 60-65%. Esto aseguraría que se exponga al paciente al menor riesgo posible de complicaciones trombóticas y hemorrágicas13-15. En algunos reportes, el TRT de las CAC es 10% mejor que el del manejo clínico no especializado e independiente del laboratorio, que fue solo de 50%4. Esta ventaja del control a través de centros especializados se ha puesto de manifiesto en guías y consensos internacionales1, 5, 6, 8. Un metaanálisis de 8 estudios, realizado en los EE.UU., que incluyó 22 237 pacientes con FA tratados con warfarina halló un promedio de TRT superior en las clínicas de anticoagulación (63%) comparado con el manejo clínico aislado (51%)22.
De ser posible, se debería instrumentar un software que permita el cálculo del TRT en cada consulta para poder intervenir en caso de valores inadecuados con controles más frecuentes, re-instrucción o soporte familiar más cercano.
4) Educación permanente del paciente. Es fundamental que tenga en claro por que está anticoagulado y la necesidad de los controles periódicos. Debe comprender los beneficios del tratamiento anticoagulante y sus eventuales complicaciones en un lenguaje claro y accesible. Todas las guías y consensos internacionales recomiendan implementar un sistema de educación suplementaria para el paciente anticoagulado, puesto que se ha demostrado que al hacerlo puede disminuir la mortalidad y las complicaciones trombóticas y hemorrágicas del tratamiento con AVK2, 16, 54.
Para la educación del paciente se podrían usar los siguientes elementos:
– La cartilla del paciente anticoagulado, con indicaciones claras y simples de cómo proceder ante una urgencia.
En la cartilla debe constar el nombre del anticoagulante que utiliza y su dosis, junto con el valor del RIN, el diagnóstico por el que está anticoagulado y el rango buscado de tratamiento. Debe tener también el tiempo estimado de duración de la anticoagulación, si tiene alto riesgo tromboembólico o de sangrado y alguna forma de contacto con el médico en caso de urgencia (Fig. 6).
– Obtener un consentimiento informado firmado por el paciente al explicarle en qué consiste el tratamiento anticoagulante y sus implicancias. Debe comprender los riesgos y beneficios de este tratamiento y ser corresponsable del mismo, junto con el equipo de salud que lo asiste (Anexo 1).
– Eventualmente entregarle elementos que lo ayudarán a mejorar su adherencia al tratamiento como pastilleros, pulseras o tarjetas de identificación como paciente anticoagulado y la cartilla con instrucciones por escrito de cómo debe recibir la dosis diaria de AVK. Se puede colocar un cartel autoadhesivo en el carnet de la obra social o documento personal que lo identifique como paciente anticoagulado.
– Las recomendaciones para la educación del paciente se pueden brindar en forma de folleto, en la cartilla o como un video, que pueden ver mientras espera el resultado del control del nivel de anticoagulación.
Este es un resumen de los puntos más relevantes que debe comprender un paciente durante el tratamiento con dicumarínicos19, 64. En el caso de los pacientes muy añosos o con dificultades para la comprensión, se debe identificar a una persona responsable en el entorno familiar para ser instruida y que se haga cargo del tratamiento anticoagulante:
a) Conocer por que recibe el tratamiento anticoagulante, cuál es el diagnóstico, y la duración del tratamiento planeado.
b) Familiarizarse con la droga anticoagulante que se indica, cómo funciona, la dosis y otras alternativas terapéuticas. Es fundamental que el paciente reconozca el nombre del medicamento y los miligramos del mismo que debe tomar cada día.
c) Saber para qué necesita controles de coagulación y cuál es el rango terapéutico buscado (RIN) y su relación con complicaciones del tratamiento.
d) Entender el riesgo de hemorragias con los dicumarínicos y conocer los signos de alerta, formas de presentación de los sangrados y cómo consultar de urgencia en el caso de que se presenten.
e) Conocer los síntomas de trombosis y el riesgo de suspender el tratamiento anticoagulante.
f) Recomendarle una dieta balanceada, sin restricciones particulares teniendo en cuenta cuáles son los alimentos ricos en vitamina K.
g) Entender la importancia del manejo perioperatorio y la necesidad de consulta temprana en la CAC.
h) Advertir sobre el riesgo de interferencia con otros medicamentos. Explicar que NO debe ingerir aspirina y antiinflamatorios no esteroides. Solo está permitido el uso de aspirina con el consentimiento del cardiólogo en quienes padecen síndrome coronario agudo, los pacientes sometidos a angioplastia con stent o en algunos casos de reemplazo valvular mecánico y siempre acompañado de gastro protectores.
i) Referir al paciente a un centro o a un médico con experiencia en anticoagulación.
Se recomienda realizar una encuesta a los pacientes anticoagulados en forma regular para evaluar el nivel de comprensión del tratamiento con AVK por parte ellos (Anexo 2).
Indicadores de la calidad en las clínicas de anticoagulación
Hoy el tratamiento con AVK ha cambiado, introduciendo el concepto del manejo anticoagulante de alta calidad con el objetivo de mantener la máxima eficacia para prevenir la trombosis y al mismo tiempo la máxima seguridad evitando complicaciones hemorrágicas.
La evaluación permanente de la calidad de los servicios que se prestan en una clínica de anticoagulación permite el mejoramiento continuo de la misma. Para esta evaluación se utilizan indicadores de la calidad que son instrumentos de medición de carácter objetivo y cuantificable, que permiten medir la calidad de los procesos, productos y servicios para asegurar el cumplimiento de las especificaciones preestablecidas y evitar eventos de sangrado o de trombosis por AVK5, 6, 47, 62, 70, 72, 73.
Para poder definir los indicadores de la calidad se debe hacer un esquema descriptivo del proceso de atención del paciente anticoagulado con AVK. El mismo se debe realizar siguiendo el recorrido que realiza el paciente desde el momento en que se le indica iniciar anticoagulación, recibe la información para anticoagulados con AVK, se le realizan las pruebas de laboratorio, se le prescribe el tratamiento, los controles y el alta. En este esquema se deben identificar los puntos críticos de seguridad para el paciente.
Los indicadores de la calidad sugeridos por la bibliografía4, 9, 62, 68-70, 72 con AVK permiten evaluar:
a) Si el paciente está correctamente educado sobre el tratamiento anticoagulante.
b) La frecuencia de eventos adversos (muerte, hemorragia mayor y clínicamente relevante o recurrencia de eventos trombóticos) relacionados a la anticoagulación.
c) El tiempo que transcurre hasta que logra entrar y permanecer en el rango terapéutico del tratamiento anticoagulante.
d) El tiempo que demora en el monitoreo del RIN (permanencia dentro de CAC).
e) La frecuencia de valores extremos de RIN (valores < 1.5 y > 8).
f) El nivel de satisfacción del paciente con el tratamiento anticoagulante y la CAC.
Se recomienda tener al menos una vez por año medidos estos parámetros de la calidad para determinar si se cumple con los estándares internacionales propuestos.
En cuanto a la estructura del laboratorio, todas las guías resaltan la importancia de contar con un laboratorio confiable, que cumpla con las normas preanalíticas para la obtención de las muestras de sangre y su procesamiento; que exprese correctamente los resultados y que utilice controles internos de calidad y participe en un programa de evaluación externa que garantice la veracidad del RIN obtenido en el tiempo apropiado. Los indicadores para monitorear el comportamiento del laboratorio son los habituales que mide un centro comprometido con la calidad de sus resultados. Se debe, además, establecer un tiempo estimado de entrega de resultados, tanto para el RIN tradicional como para el RIN-POC y tener un indicador que permita evaluar si ese tiempo estimado se cumple.
Hay que tener en cuenta que el tiempo de permanencia en la CAC es una de las variables de mayor efecto en la adherencia al tratamiento del paciente anticoagulado5.
Indicadores de la calidad propuestos en una clínica de anticoagulación
A continuación, se enumeran algunos indicadores de calidad propuestos para implementar en una clínica de anticoagulación. No es necesario que se utilicen todos estos indicadores simultáneamente.
INDICADOR 1: Pacientes con cartilla
• Definición: Se define como la entrega al paciente de la cartilla donde están las instrucciones, consta el RIN del día, la dosificación detallada diariamente y la fecha del próximo control.
• Naturaleza estadística: proporción.
• Cálculo: N° pacientes con cartilla/N° pacientes ACO atendidos ese día.
• Fuente: corte transversal, realizado una vez cada tres meses donde se verifica el número de pacientes a los que se entrega la cartilla.
• Evidencia: bibliografía.
• Umbral recomendado: 100%.
INDICADOR 2: Eficiencia de comunicación y cantidad de valores críticos
• Definición: Se debe establecer el valor crítico de RIN para la CAC (por ejemplo, RIN > 8). El parámetro se define como cantidad de valores críticos y tiempo que se demora en comunicarlos, que debe ser inferior a las 4 horas, según el protocolo de comunicación de valores críticos del centro. El tiempo en notificar al médico es indispensable cuando el laboratorio está separado del lugar donde se entrega la dosis.
• Naturaleza estadística: Proporción.
• Cálculo: Número de valores críticos comunicados en tiempo y forma/ Número total de valores críticos del mes.
• Fuente: Política Institucional de valores críticos.
• Evidencia: Bibliografía.
• Umbral recomendado: Menos de 1% de valores críticos y el 100% comunicados antes de 4 horas.
INDICADOR 3: Tiempo transcurrido entre la llegada del paciente a la CAC y la recepción del plan terapéutico
Cada CAC debe fijar un tiempo estimado acorde al método de determinación de RIN.
Tiempo máximo sugerido con RIN tradicional por punción venosa: 2 horas.
Tiempo máximo sugerido con RIN POC: 40-45 minutos.
• Definición: Se define como el tiempo transcurrido desde que se realiza la determinación de RIN hasta que el paciente recibe la dosificación.
• Naturaleza estadística: proporción.
• Cálculo: Número de pacientes controlados con RIN POC o tradicional que reciben el plan terapéutico en el tiempo máximo fijado por la CAC/ Número total de pacientes controlados.
• Fuente: Historia Clínica.
• Umbral recomendado: El 80% de los pacientes deben recibir la dosificación en el tiempo propuesto.
INDICADOR 4: Pacientes con TRT o porcentaje de visitas en rango terapéutico apropiado
• Definición: Se define como el valor de TRT calculado por método Rosendaal o porcentaje de visitas en rango terapéutico apropiado.
• Naturaleza estadística: proporción.
• Fuente: Historia Clínica Electrónica.
• Umbral recomendado: mayor a 65%.
INDICADOR 5: Pacientes que reciben instrucción sobre el tratamiento anticoagulante
• Definición: Se define como número de pacientes que recibieron instrucción acerca de qué es el tratamiento anticoagulante y de sus cuidados, antes de iniciar el tratamiento
• Naturaleza estadística: proporción.
• Cálculo: Número de pacientes instruídos antes de iniciar tratamiento/ Número total de anticoagulados.
• Fuente: Historia Clínica Electrónica.
• Umbral recomendado: 100%.
INDICADOR 6: Pacientes anticoagulados con complicaciones hemorrágicas significativas
• Definición: Se define como la incidencia anual de eventos hemorrágicos moderados o graves.
• Naturaleza estadística: proporción.
• Cálculo: Número de pacientes que presentaron hemorragia mayor o clínicamente relevante en el año/total pacientes anticoagulados.
• Fuente: Historia Clínica.
• Umbral recomendado: menor a 5% por año.
INDICADOR 7: Pacientes anticoagulados que sufrieron eventos tromboembólicos
• Definición: Se define como la incidencia anual de eventos trombóticos.
• Naturaleza estadística: proporción.
• Cálculo: Número de pacientes que presentaron. trombosis/total pacientes anticoagulados.
• Fuente: Historia Clínica.
• Umbral recomendado: menor a 3% por año.
Recomendaciones finales
Si bien los AVK tienen limitaciones, no hay droga en este momento que pueda reemplazar a los dicumarínicos, desde el punto de vista de volumen de anticoagulados en nuestro medio. De hecho, los nuevos agentes orales directos no han logrado desplazar a AVK como droga anticoagulante más utilizada en Argentina, a pesar de las ventajas de estabilidad y de no necesitar el control de los niveles de anticoagulación. Además, se debe considerar que los AOD están contraindicados en algunos grupos, como en los reemplazos valvulares mecánicos, embarazo e insuficiencia renal grave.
Es muy importante tener normas bien establecidas para controlar correctamente a los pacientes que utilizan AVK. La alta calidad en la atención de los pacientes anticoagulados debería ser una prioridad en el sistema de salud, que no solo evita un daño individual, también ahorra costos al Estado y mejora la calidad de vida de un amplio sector de la población. A pesar de que en muchos lugares la CAC es solo un médico y un laboratorio no especializado en hemostasia, los estándares mínimos de la calidad deben siempre respetarse.
Uno de los pilares para tener buenos resultados en el tratamiento anticoagulante con AVK es considerar que es probable que en algún momento ocurra una complicación trombótica o hemorrágica. Estas complicaciones son las que condicionan la calidad de vida de los pacientes anticoagulados.
Solo son los servicios con alta calidad de gestión donde se puede reducir la posibilidad de error y mantener al paciente sin eventos clínicos y sin internaciones relacionadas con el uso de AVK. Es fundamental asumir que, al ser cuidadosos en la educación del paciente y monitorear adecuadamente la hemostasia, se pueden obtener mayores ventajas con un beneficio clínico neto positivo, aún en los casos con alto riesgo hemorrágico, como en los pacientes añosos y frágiles. Además, con una considerable reducción en los costos de atención médica.
Si bien este consenso intenta fijar pautas de gestión de la calidad en el uso de los anticoagulantes orales AVK, queda claro que las CAC tienen la obligación y responsabilidad de educar y evaluar también a los pacientes tratados con anticoagulantes orales directos. Sin duda el enfoque será diferente y las consideraciones de educación, controles y asesoramiento ante complicaciones, tendrán otros matices, pero utilizar la infraestructura y conocimiento de la CAC es una ventaja que se debería aprovechar.
Las clínicas de anticoagulación son estructuras diseñadas para contener y educar a estos pacientes complejos.
Hay muchas formas de enfrentarnos con la difícil tarea de generar una clínica de anticoagulación con una gestión adecuada y eficaz. Una de ellas es establecer marcadores de alta calidad como estándares mínimos y objetivables para poder medirlos y, con los resultados, reevaluar en nuestro medio cotidiano de trabajo qué cosas se pueden mejorar. Organizar una CAC con elevados estándares de calidad debería ser uno de los principios básicos en la asistencia hospitalaria.
Se debe considerar que conseguir estos parámetros de alta calidad en cada centro que realiza el control del nivel de anticoagulación no es una alternativa, sino más bien una obligación para con los pacientes y para con los colegas que derivan a sus enfermos para el control cotidiano de la anticoagulación.
Agradecimientos: A la Pontificia Universidad Católica Argentina en cuyo marco se desarrolló este Consenso y especialmente a la directora del Posgrado de alta gestión de Calidad en Servicios de Salud de la Facultad de Medicina, Dra. María Cristina Ferrari.
A Roche Diagnóstica Argentina por haber contribuido con los fondos necesarios para esta publicación. Cabe aclarar que Roche no participó del contenido ni de las recomendaciones del texto.
Conflictos de intereses: Ninguno para declarar
Bibliografía
1. Ageno W, Gallus AS, Wittkowsky A, Crowther M, Hylek EM, Palareti G. Oral anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9thed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e44S-e88S.
2. Sterne JA, Bodalia PN, Bryden PA, et al. Oral anticoagulants for primary prevention, treatment and secondary prevention of venous thromboembolic disease, and for prevention of stroke in atrial fibrillation: systematic review, network meta-analysis and cost-effectiveness analysis. Health Technol Assess 2017; 21: 1-386.
3. Witt DM, Nieuwlaat R, Clark NP, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: optimal management of anticoagulation therapy. Blood Adv 2018; 2: 3257-91.
4. Palareti G, Antonucci E, Migliaccio L, et al. The ISCOAT 2016 study: Italian Study on Complications of Oral Anticoagulant Therapy-2016. Vitamin K antagonist therapy: changes in the treated populations and in management results in Italian anticoagulation clinics compared with those recorded 20 years ago. Intern Emerg Med 2017; 12: 1109-19.
5. Barnes GD, Kline-Rogers E, Graves C, et al. Structure and function of anticoagulation clinics in the United States: an AC forum membership survey. J Thromb Thrombolysis 2018; 46: 7-11.
6. Garcia DA, Witt DM, Hylek E, et al. Anticoagulation Forum. Delivery of optimized anticoagulant therapy: consensus statement from the Anticoagulation Forum. Ann Pharmacother 2008; 42: 979-88.
7. Tajer C, Ceresetto J, Bottaro FJ, Martí A, Casey M; TERRA Trial investigators. Assessment of the Quality of Chronic Anticoagulation Control with Time in Therapeutic Range in Atrial Fibrillation Patients Treated with Vitamin K Antagonists by Hemostasis Specialists: The TERRA Registry: Tiempo en rango en la República Argentina. Clin Appl Thromb Hemost 2017; 23: 445-53.
8. Keeling D, Baglin T, Tait C, et al. British Committee for Standards in Haematology. Guidelines on oral anticoagulation with warfarin – fourth edition. Br J Haematol 2011; 154: 311-24.
9. Done N, Roy AM, Yuan Y, Pizer SD, Rose AJ, Prentice JC. Guideline-concordant initiation of oral anticoagulant therapy for stroke prevention in older veterans with atrial fibrillation eligible for Medicare Part D. Health Serv Res 2019; 54: 128-38.
10. Jerjes-Sanchez C, Corbalan R, Barretto ACP, et al. GARFIELD-AF Investigators. Stroke prevention in patients from Latin American countries with non-valvular atrial fibrillation: Insights from the GARFIELD-AF registry. Clin Cardiol 2019; 42: 553-60.
11. Lubitz SA, Khurshid S, Weng LC, et al. Predictors of oral anticoagulant non-prescription in patients with atrial fibrillation and elevated stroke risk. Am Heart J 2018; 200: 24-31.
12. Oqab Z, Pournazari P, Sheldon RS. What is the Impact of Frailty on Prescription of Anticoagulation in Elderly Patients with Atrial Fibrillation? A Systematic Review and Meta-Analysis. J Atr Fibrillation 2018; 10: 1870.
13. Garcia DA, Schwartz MJ. Warfarin therapy: tips and tools for better control. J Fam Pract 2011; 60: 70-5.
14. Wysowski DK, Nourjah P, Swartz L. Bleeding complications with warfarin use: a prevalent adverse effect resulting in regulatory action. Arch Intern Med 2007; 167: 1414-9.
15. Seelig J, Pisters R, Hemels ME, Huisman MV, Ten Cate H, Alings M. When to withhold oral anticoagulation in atrial fibrillation – an overview of frequent clinical discussion topics. Vasc Health Risk Manag 2019; 15: 399-408.
16. Garcia D, Regan S, Crowther M, Hughes RA, Hylek EM. Warfarin maintenance dosing patterns in clinical practice: implications for safer anticoagulation in the elderly population. Chest 2005; 127: 2049-56.
17. How-to Guide: Prevent Harm from High-Alert Medications Institute for Healthcare Improvement Cambridge, Massachusetts, USA. En: www.ihi.org; consultado marzo 2020.
18. Berrettini M. Anticoagulation clinics: The Italian experience. Haematologica 1997; 82: 713-7.
19. Pengo V, Denas G. Optimizing quality care for the oral vitamin K antagonists. Hematology Am Soc Hematol Educ Program 2018; 1: 332-8.
20. Cinza-Sanjurjo S, Rey-Aldana D, Gestal-Pereira E, Calvo- Gómez C. Assessment of Degree of Anticoagulation Control in Patients with Atrial Fibrillation in Primary Health Care in Galicia, Spain: ANFAGAL Study. Rev Esp Cardiol (Engl Ed) 2015; 68: 753-60.
21. Optimal Warfarin Management for the Prevention of Thromboembolic Events in Patients with Atrial Fibrillation: A Systematic Review of the Clinical Evidence Ottawa: Canadian Agency for Drugs and Technologies in Health, 2011. En: http://www.ncbi.nlm.nih.gov/books/NBK169490/; consultado marzo 2020.
22. Baker WL, Cios DA, Sander SD, Coleman CI. Meta-analysis to assess the quality of warfarin control in atrial fibrillation patients in the United States. J Manag Care Pharm 2009; 15: 244-52.
23. Budnitz DS, Shehab N, Kegler SR, Richards CL. Medication use leading to emergency department visits for adverse drug events in older adults. Ann Intern Med 2007; 147: 755-65.
24. Bungard TJ, Barry AR, Jones C. Patient satisfaction with services provided by multidisciplinary anticoagulation clinics. Pharmacotherapy 2013; 33: 1246-51.
25. Gladstone DJ, Bui E, Fang J, et al. Potentially preventable strokes in high-risk patients with atrial fibrillation who are not adequately anticoagulated. Stroke 2009; 40: 235-40.
26. Martinuzzo M. Sistema de coagulación en fisiología de la hemostasia Hematología 2017; 21: 31-42.
27. Kirchheimer J, Ufer M, Walter EC, et al. Effects of CYP2C9 on the pharmacocinetics of R and S- phenprocoumon in healthy volunteers. Pharmacogenetics 2004; 14: 19-26.
28. Witt DM, Clark NP, Kaatz S, Schnurr T, Ansell JE. Guidance for the practical management of warfarin therapy in the treatment of venous thromboembolism. J Thromb Thrombolysis 2016; 41: 187-205.
29. Ceresetto JM, Rabinovich O, Stemmelin G, et al. Warfarin is superior to acenocumarol in the management of patients requiring low doses of oral anticoagulants. Pathophysiology of Haemostasia and Thrombosis 2004; Poster 1455 18º Int. Congress on Thrombosis, Ljubljana, Slovenia.
30. Clinical and Laboratory Standards Institute (CLSI). Collection, transport and proceesing of blood specimens for testing plasma based coagulation assay and molecular hemostasis assays. App Guideline-Fifth Edition CLSI document H21-5; USA 2008.
31. Gosselin RC, Marlar RA. Preanalytical Variables in Coagulation Testing: Setting the Stage for Accurate Results. Thromb Hemost 2019; 45: 433-48.
32. Guidelines for thromboplastins and plasma used to control oral anticoagulant therapy with vitamin K-antagonists. WHO Exper/BS/2011.2165 Expert Comitte on Biological Standarization, Geneva, 2011.
33. Clinical and Laboratory Standards Institute (CLSI). Procedures for validation of INR and local calibration of PT/INR Systems: App Guideline-First Edition. CLSI document H54-A; USA 2005.
34. Clinical and Laboratory Standards Institute (CLSI). One stage prothrombin time and activated partial thromboplastin time test. App Guideline- second Edition. CLSI document H47-A2; USA 2008.
35. Duboscq C. Pruebas globales de Hemostasia. Tiempo de protrombina, consumo de protrombina, Tiempo de tromboplastina parcial activado, Tiempo de trombina. Fundamentos para el Manejo Práctico del Laboratorio de Hemostasia. Grupo CAHT. Kordich L, Blanco A (ed), 2da. Ed., 2013.
36. Martinuzzo M. Calibración de la tromboplastina. Fundamentos para el Manejo Práctico del Laboratorio de Hemostasia. Grupo CAHT. Kordich L, Blanco A (ed), 2da. Ed., 2013.
37. Guidance on the use of point of care testing of international normalized ratio for patients on oral anticoagulant therapy. Canadian Agency for Drugs Technologies in Health July 2014, vol 3.
38. Perry DJ, Fitzmaurice DA, Kitchen S, Mackie IJ, Mallett S. Point-of-care testing in haemostasis. Br J Haematol 2010; 150: 501-14.
39. Kitchen DP, Jennings I, Kitchen S, Woods TA, Walker ID. Bridging the gap between point-of-care testing and laboratory testing in hemostasis. Semin Thromb Hemost 2015; 41: 272-8.
40. Bonar R, Mohammed S, Favaloro EJ. International normalized ratio monitoring of vitamin K antagonist therapy: comparative performance of point-of-care and laboratoryderived testing. Semin Thromb Hemost 2015; 41: 279-86.
41. Duboscq C, Ceresetto JM, Stemmelin G, et al. Evaluación del desempeño de un dispositivo portátil para la determinación de la razón internacional normatizada en una clínica de anticoagulación. Hematología 2014; 18: 204-10.
42. Duboscq C, Ceresetto J, Shanley C, et al. Utilización de un dispositivo portátil para monitorear la relación internacional normalizada en pacientes con anticoagulante lúpico positivo”. Acta Bioquím Clín Latinoam 2019; 53: 539-43.
43. Barcellona D, Fenu L, Vannini ML, Piras M, Marongiu F. Antiphospholipid syndrome patients: the performance of Coagucheck XS in the monitoring of Vitamin K-Antagonists. Thromb Res 2012; 129: e168-70.
44. Isert M, Miesbach W, Schüttfort G, et al. Monitoring anticoagulant therapy with vitamin K antagonists in patients with antiphospholipid syndrome. Ann Hematol 2015; 94: 1291-9.
45. Lazo-Langner A, Monkman K, Kovacs MJ. Predicting warfarin maintenance dose in patients with venous thromboembolism based on the response to a standardized warfarin initiation nomogram. J Thromb Haemost 2009; 7: 1276-83.
46. Wann LS, Curtis AB, January CT, et al. ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (updating the 2006 guideline): a report of the American College of Cardiology Foundation American Heart Association Task Force on Practice Guidelines. Circulation 2011; 123: 104-23.
47. Rosendaal FR, Cannegieter SC, van der Meer FJ, et al. A method to determine the optimal intensity of oral anticoagulation therapy. Thromb Haemost 1993: 69: 236-9.
48. Ridker PM, Goldhaber SZ, Danielson E, et al. PREVENT Investigators. Long-term, low-intensity warfarin therapy for the prevention of recurrent venous thromboembolism. N Engl J Med 2003; 348: 1425-34.
49. Li-Saw-Hee FL, Blann AD, Lip GY. Effects of fixed lowdose warfarin, aspirin-warfarin combination therapy, and dose-adjusted warfarin on thrombogenesis in chronic atrial fibrillation. Stroke 2000; 31: 828-33.
50. Korin J. Bleeding during anti-vitamin K treatment. Incidence, risk factors and comparison with the new oral anticoagulants. Medicina (B Aires) 2012; 72: 419-24.
51. Schein JR, White CM, Nelson WW, Kluger J, Mearns ES, Coleman CI. Vitamin K antagonist use: evidence of the difficulty of achieving and maintaining target INR range and subsequent consequences. Thromb J 2016; 14: 14.
52. Casais P, Sánchez Luceros A, Meschengieser S, Fondevila C, Santarelli MT, Lazzari MA. Bleeding risk factors in chronic oral anticoagulation with acenocoumarol. Am J Hematol 2000; 63: 192-6.
53. Van der Meer FJ, Rosendaaal FR, Vandenbrouk Jp, Briét E. Bleeding complications in oral anticoagulant therapy. An Analisys of risk factors. Arch Int Med 1993; 153: 1557-62.
54. Oake N, Fergusson DA, Forster AJ, van Walraven C. Frequency of adverse events in patients with poor anticoagulation: a meta-analysis. CMAJ 2007; 176: 1589-94.
55. Lassen JF, Brandslund I, Antonsen S. International normalized ratio for prothrombin times in patients taking oral anticoagulants: critical difference and probability of significant change in consecutive measurements. Clinical Chemistry 1995; 41: 1171-76.
56. Lippi G, Adcock D, Simundic A, Tripodi A, Favaloro E . Critical Laboratory Values in Hemostasis: Toward Consensus. Ann Med 2017; 49: 455-61.
57. Aguirre S, Monserrat V, Raimondi R, Scazziota A. Reference change value for INR: a simple tool for management of patients on oral anticoagulation. Res Pract Thromb Haemost 2018: 2(S1): 288. Poster 591. 64th Annual Scientific and Standardization Committee meeting. ISTH, Dublin.
58. Fondevila CG, Grosso SH, Santarelli MT, Pinto MD. Reversal of excessive oral anticoagulation with a low oral dose of vitamin K1 compared with acenocoumarine discontinuation. A prospective, randomized, open study. Blood Coagul Fibrinolysis 2001; 12: 9-16.
59. Meschengieser SS, Casais P, Sánchez Luceros A, Lazzari MA. Present and future of oral anticoagulants. Medicina (B Aires) 2000; 60: 139-42.
60. White HD, Gruber M, Feyzi J, et al. Comparison of outcomes among patients randomized to warfarin therapy according to anticoagulant control: results from SPORTIF III and V. Arch Intern Med 2007; 167: 239-45.
61. Connolly SJ, Pogue J, Eikelboom J, et al. ACTIVE W Investigators. Benefit of oral anticoagulant over antiplatelet therapy in atrial fibrillation depends on the quality of international normalized ratio control achieved by centers and countries as measured by time in therapeutic range. Circulation 2008; 118: 2029-37.
62. Bartoli-Abdou JK, Patel JP, Xie R, et al. Associations between illness beliefs, medication beliefs, anticoagulationrelated quality of life, and INR control: Insights from the Switching Study. Res Pract Thromb Haemost 2018; 2: 497-507.
63. Ceresetto JM. Venous thromboembolism in Latin America: a review and guide to diagnosis and treatment for primary care. Clinics (Sao Paulo) 2016; 71: 36-46.
64. Nelson WW, Wang L, Baser O, Damaraju CV, Schein JR. Out-of-range INR values and outcomes among new warfarin patients with non-valvular atrial fibrillation. Int J Clin Pharm 2015; 37: 53-9.
65. Hawes EM. Patient Education on Oral Anticoagulation. Pharmacy (Basel) 2018; 6: E34.
66. Fihn SD. Aiming for safe anticoagulation. N Engl J Med 1995; 333: 54-5.
67. Cortelazzo S, Finazzi G, Viero P, et al. Thrombotic and hemorrhagic complications in patients with mechanical heart valve prosthesis attending an anticoagulation clinic. Thromb Haemost 1993; 69: 316-20.
68. Hasan SS, Sunter W, Ahmed N, et al. A comparison of warfarin monitoring service models. Res Social Adm Pharm 2019; 15: 1236-42.
69. Casais P, Meschengieser SS, Sanchez-Luceros A, Lazzari MA. Patients’ perceptions regarding oral anticoagulation therapy and its effect on quality of life. Curr Med Res Opin 2005; 21: 1085-90.
70. Veeger NJ, Piersma-Wichers M, Tijssen JG, Hillege HL, van der Meer J. Individual time within target range in patients treated with vitamin K antagonists: main determinant of quality of anticoagulation and predictor of clinical outcome. A retrospective study of 2300 consecutive patients with venous thromboembolism. Br J Haematol 2005; 128: 513-9.
71. Penchasky D, Gallo M, Ceresetto JM, et al. Recomendaciones para el manejo de la terapéutica anticoagulante en el perioperatorio y procedimientos invasivos. En las Guías Argentinas de SAH, edición 2020, p 293-300.
72. Poller L, Keown M, Ibrahim S, et al. An international multicenter randomized study of computer-assisted oral anticoagulant dosage vs. medical staff dosage. J Thromb Haemost 2008; 6: 935-43.
73. Blanco Molina A, Dotor Gracia M, Guerrero García FJ, et al. Indicadores de calidad y seguridad para la atención a pacientes con tratamiento anticoagulante oral. Informe técnico 2, 2012. Sociedad Andaluza de Calidad Asistencial. En: http://www.sspa.juntadeandalucia.es/agenciadecalidadsanitaria/observatorioseguridadpaciente/gestor/sites/PortalObservatorio/es/galerias/descargas/SADECA_-_Indicadores_de_calidad_y_seguridad_TAO.pdf; consultado abril 2020.




