COVID-19 es la enfermedad causada por el coronavirus SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2). Los primeros casos se registraron a fines de 2019 en Wuhan, China. Debido a la rápida expansión de la enfermedad en el mundo, la Organización Mundial de la Salud (OMS-WHO) la declaró pandemia el 11 de marzo de 2020 1. Siendo este virus un nuevo patógeno humano, no existen aún vacunas y los tratamientos aplicados son de índole experimental, incluyendo diversas drogas utilizadas previamente contra otros patógenos y otras enfermedades 2. Hasta ahora (junio 1, 2020), no se dispone de tratamientos que demuestren evidencia concluyente de eficacia clínica en pacientes con neumonía grave. Esto explica la necesidad urgente de investigar nuevos tipos de terapias que cuenten con suficiente justificación científica.
Una de estas opciones es la seroterapia, que consiste en la utilización de suero o plasma para tratamiento de enfermedades infecciosas. El primer uso documentado de esta terapia nos remonta al siglo XIX, cuando el fisiólogo alemán Emil von Behring (1854-1917) y el bacteriólogo japonés Kitasato Shibasaburo (1853-1931) utilizaron suero de animales infectados con toxina diftérica para tratar niños enfermos con difteria, enfermedad que por entonces causaba la muerte a un alto número de infantes 3.
Este descubrimiento le valió a von Behring ser laureado con el Premio Nobel de Fisiología o Medicina en 1901. Una estrategia similar se utilizó años después, durante la epidemia de influenza española (1918-1920) 4. En esa oportunidad, se empleó el suero de individuos convalecientes para tratar a los sujetos con infección activa. Durante las siguientes décadas, se continuó utilizando esta metodología terapéutica en distintos tipos de infecciones, incluyendo la fiebre hemorrágica argentina causada por el virus Junín. Fue el científico y médico argentino Julio Maiztegui quien realizó, a partir de 1976, un ensayo doble ciego en pacientes con fiebre hemorrágica argentina, transfundiéndoles plasma de convalecientes de la enfermedad. Este ensayo demostró una disminución significativa en la mortalidad de los tratados, comparados con aquellos que recibieron plasma de donantes no expuestos al virus 5. Más recientemente, se ha utilizado plasma de convalecientes con variable eficacia en otras epidemias o pandemias (i.e. MERS, H1N1). Es también importante destacar que, durante la pandemia originada por SARS-CoV-1 (2003), un estudio demostró la eficacia del uso de plasma de convalecientes, basada en la tasa de alta hospitalaria más temprana, en aquellos que fueron tratados en los 14 días iniciales de la enfermedad 6.
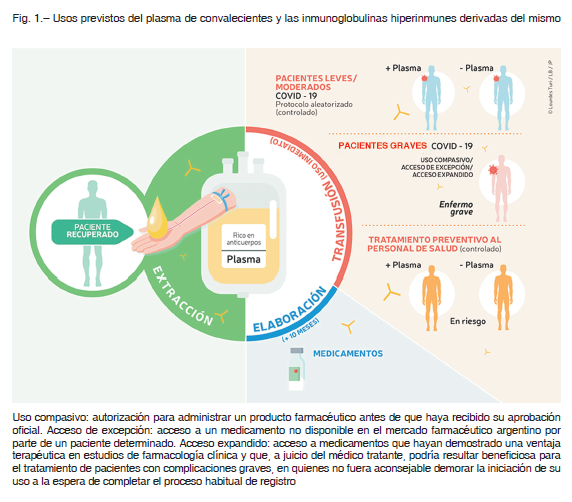
La explicación científica que justifica el uso de plasma de convalecientes se basa en la presencia de anticuerpos específicos y neutralizantes contra el virus en el plasma de personas recientemente infectadas y recuperadas de COVID-19, los que pueden ser transferidos a pacientes con una infección activa en curso. Los anticuerpos contra coronavirus aparecen generalmente 2-3 semanas después del comienzo de los síntomas 7-9. Los primeros estudios publicados en China sobre uso de plasma de convalecientes de COVID-19 −series de casos no controlados realizados sobre 5, 6 y 10 pacientes– documentaron recuperación en la mayoría de los tratados 10-12. Actualmente, hay ensayos en marcha en todo el mundo sobre la utilidad del plasma de convalecientes para tratamiento de COVID-19, con más de 100 estudios clínicos registrados en clinicaltrials.gov, 11 de ellos desarrollados en Latinoamérica 13, 14. Estos estudios incluyen ensayos clínicos aleatorizados, en su mayoría para aquellos con COVID-19 leve o de moderada intensidad; también incluyen estudios en personal de salud en riesgo y en sujetos expuestos, mientras que, en los casos graves, se utilizan protocolos de uso compasivo o acceso expandido. Otra aplicación para el plasma consiste en la obtención de inmunoglobulinas hiperinmunes que deben reunir requisitos de pureza y calidad farmacológica, hecho que asegura una reproducibilidad mayor que la obtenida con el plasma entero 15. Aunque las inmunoglobulinas hiperinmunes han sido utilizadas terapéuticamente en varias enfermedades infecciosas, su eficacia en COVID-19 no ha sido aún verificada.
La metodología de purificación de estas inmunoglobulinas es laboriosa y probablemente no estaría disponible en el corto plazo de la pandemia (Fig. 1).
El hospital Methodist de Houston, primera institución en EE.UU. en administrar plasma de convalecientes, publicó recientemente una serie de 25 casos graves con COVID-19 tratados con esta terapia16. Se informó que no se observaron efectos adversos asociados a la transfusión. En cuanto a eficacia, se comunicó que al día 7 post-transfusión, 9 (36%), mostraron algún tipo de mejoría clínica, 7 (28%) de los cuales, fueron dados de alta. Al día 14 post-transfusión, 19 (76%) mostraron al menos 1 punto de mejoría clínica y 11 (44%) fueron dados de alta. Si bien este estudio careció de controles, fue el primero en comunicar seguridad y potencial eficacia en un número reducido de pacientes.
En torno al uso de plasma de convalecientes, el gobierno de EE.UU. seleccionó la Clínica Mayo (Rochester, Minnesota) para centralizar un protocolo de acceso expandido, con el objetivo de facilitar el uso de plasma de convalecientes en instituciones de todo el país. El 14 de mayo del corriente año se publicaron los resultados preliminares de los primeros tratados bajo este protocolo 17. Un total de 14 288 enfermos fueron anotados en el programa de acceso expandido, de los cuales 8932 recibieron transfusión de plasma de convaleciente. En este primer informe, se analizó la seguridad del tratamiento en los primeros 5000 pacientes graves con COVID-19 transfundidos, 1824 mujeres y 3153 hombres, representando varias etnias: blanca (49%), asiática (6%), afroamericana (18%) y otras. De los 5000, el 81% presentaban enfermedad grave y un 66% se encontraban internados en unidades de cuidados intensivos. En las 4 h posteriores a la transfusión, se registraron 36 efectos adversos (representando < 1% de los tratados), incluyendo la muerte de 15 (0.3%), de las cuales 4 fueron atribuidas potencialmente a la transfusión. El resto de los 21 efectos adversos potencialmente relacionados al tratamiento incluyó 11 casos de injuria pulmonar aguda relacionada con la transfusión (TRALI), 7 de sobrecarga circulatoria asociada a la transfusión (TACO) y 3 de reacción alérgica grave a la transfusión. Aunque el estudio de Joyner y col. 17 no fue diseñado para evaluar eficacia clínica, la tasa de mortalidad registrada fue de 14.9% a los 7 días de iniciado el tratamiento en los que recibieron plasma, cifra relativamente baja considerando que la mayoría de los incluidos en el estudio se encontraba en unidad de terapia intensiva.
Asimismo, un tercer estudio, controlado pero no aleatorizado, fue publicado el 22 de mayo por el Hospital Mount Sinai de Nueva York, EE.UU. 18. En el mismo, se analizaron resultados de 39 pacientes graves con COVID-19 tratados con transfusión de plasma de convalecientes, comparados con una cohorte de controles que fueron identificados retrospectivamente mediante bases de datos. La edad promedio de los receptores del plasma de convalecientes fue 55 años, 54% eran obesos, y el 87% cursaba COVID-19 en estado grave, a juzgar por el requerimiento de oxígeno. Recién al día 14 comenzaron a observarse diferencias significativas, cuando la condición clínica empeoró en el 18% de los tratados con plasma y el 24.3% de los controles. Durante el tiempo del estudio, la diferencia en mortalidad también fue significativa, con una tasa del 12.8% en transfundidos versus 24.4% en el grupo control. Al analizar los subgrupos de acuerdo al requerimiento de oxígeno, se encontró que las diferencias clínicas favorables solo se sostuvieron en los no-intubados. Cabe destacar que los intubados fueron solamente 4, representando casi el 10% de la población en estudio. Este valor reducido indicaría escaso poder estadístico para estudiar este subgrupo particular. Los resultados del análisis mostraron una mejoría en los niveles de oxígeno requeridos, así como un aumento en la supervivencia de los que recibieron plasma inmune versus los de la cohorte control. El hecho de que el estudio no fuera aleatorizado y que los controles fueran asignados de modo retrospectivo limita las conclusiones e implicancias de los resultados.
Es importante destacar que, en el estudio del Hospital Mount Sinai, el título de anticuerpos contra la proteína S (spike) del virus fue ≥ 1:320 en el plasma a transfundir, mientras que ese dato no se consideró en los protocolos del Hospital Methodist o el de acceso expandido de la Clínica Mayo. En estudios futuros, se estima que el análisis del título de anticuerpos en el plasma de los donantes, así como la medición de su capacidad neutralizante y la correlación de estos valores con las respuestas clínicas, nos permitirían evaluar la utilidad de realizar estas mediciones, y potencialmente seleccionar aquellos donantes que induzcan una respuesta de anticuerpos de mayor eficacia. A su vez, el estudio exhaustivo del plasma de recuperados permitirá determinar el impacto de otros mecanismos inmunológicos resolutivos (ej. citoquinas, resolvinas u otros mediadores anti-inflamatorios) al beneficio clínico de dicho tratamiento 19, 20.
Hace pocos días se publicó el primer estudio aleatorizado y controlado sobre pacientes con COVID-19 realizado en Wuhan, China 21. El plasma de convalecientes fue seleccionado en base a la presencia de altos títulos de IgGs específicas y neutralizantes anti-SARS-CoV-2. En el mismo se incluyeron 103 pacientes aunque debió ser concluido prematuramente debido a la disminución abrupta de casos. El análisis del estudio sobre el total de los pacientes incluídos no demostró un beneficio significativo, resultado atribuíble a la carencia de suficiente poder estadístico, considerando que solo se reclutó la mitad de los pacientes. Sin embargo, realizando el análisis por subgrupos, se encontró que los pacientes internados en condición grave, aunque no estado crítico, que recibieron plasma de convalecientes tuvieron significativa mejoría clínica al ser comparados con los aleatorizados en tratamiento estándar (control) (91.3% vs. 68.2%, HR = 2.15 [95% CI, 1.07-4.32]; p = .03). No se demostró en cambio, eficacia en pacientes en estado crítico que recibieron plasma, resultado coincidente con los de experiencias anteriores. Además del cierre prematuro, otra limitación en la evaluación de los resultados fue el diseño abierto (open label), dado que el personal tratante conocía el grupo de pertenencia de cada paciente. Este estudio, aunque preliminar y con varias limitaciones, arroja resultados prometedores que continúan incentivando el uso de plasma de convalecientes.
El 29 de marzo de 2020, el grupo autodenominado CPC-19 (Convalescent plasma COVID-19), conformado por 90 médicos y científicos argentinos, residentes en su mayoría en el país, y representando múltiples especialidades, se unieron virtualmente con propósitos solidarios y educativos, poniendo a disponibilidad de Latinoamérica los lineamientos en español para la utilización de plasma de convalecientes 22.
Desde entonces, varios países latinoamericanos, incluida Argentina, han accedido a dichos lineamientos usándolos como base para generar y adaptar protocolos propios, facilitando la implementación de dicha forma de terapia contra COVID-19. En Argentina, varias instituciones en distintas provincias han iniciado transfusiones de plasma bajo uso compasivo o protocolos de acceso expandido, considerando la emergencia sanitaria. No obstante, la realización de estudios clínicos aleatorizados a futuro se plantea como un requerimiento esencial para obtener conclusiones definitivas sobre la eficacia del tratamiento por sobre otros enfoques terapéuticos. Considerando la falta de evidencia sobre la eficacia de otros tratamientos, el bajo costo relativo del plasma, la urgente necesidad de tratamientos para sujetos en estado crítico, y el hecho de que los resultados de los estudios aleatorizados no estarán disponibles en el corto plazo, sería de gran importancia la designación de una entidad que centralice un protocolo de acceso expandido a nivel nacional, para facilitar la implementación, posterior seguimiento y registro de pacientes con COVID-19 de mediana o alta gravedad. Esto permitirá que instituciones de todo el país puedan acceder a esta opción de tratamiento y generar datos y evidencia sobre esta compleja enfermedad infecciosa, sobre la cual cada día seguimos aprendiendo *.
Florencia McAllister 1, Adriana Mantegazza 2, Félix Garzón 3, Viviana Rotbaum 4, Graciela Remondino 5, Mónica Vazquez Larsson 6, Jorge Geffner 7, Gabriel A. Rabinovich 8, Laura Bover 9
1 Department of Clinical Cancer Prevention, The University of Texas MD Anderson Cancer Center, Houston, TX, USA; 2 Children’s Hospital of Philadelphia y University of Pennsylvania, Philadelphia, PA, USA; 3 FTG Biotech, NJ, USA, 4 Fundación Hemocentro Buenos Aires, Argentina; 5 Ex-Enfermedades Autoinmunes, Hospital General de Agudos Dr. Juan A. Fernández, Buenos Aires, Argentina; 6 CEI ICBA-Instituto Cardiovascular de Buenos Aires, Argentina; 7 Departamento de Microbiología, Parasitología e Inmunología, Facultad de Medicina, Universidad de Buenos Aires, Argentina; 8 Laboratorio de Inmunopatología, Instituto de Biología y Medicina Experimental (IBYME), Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Buenos Aires, Argentina; 9 Department of Genomics Medicine and Immunology, The University of Texas MD Anderson Cancer Center, Houston, TX, USA
e-mail: fmcallister@mdanderson.org
e-mail: lbover@mdanderson.org
* Nota: Al momento de la publicación de este manuscrito, el Protocolo de acceso “extendido” fue publicado por la Dirección de Sangre y Medicina Transfusional, dependiente del Ministerio de Salud de la Nación Argentina
Agradecemos a María Lourdes Turi (lourdes@lopropio.com.ar) por el diseño de la infografía
1. Coronavirus disease (COVID-19) pandemic. World Health Organization. En: http://www.who.int/emergencies/diseases/novel-coronavirus-2019; consultado mayo 2020.
2. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for coronavirus disease 2019 (COVID-19): a review. JAMA 2020. doi: 10.1001/jama.2020.6019. Online ahead of print.
3. Simon J. Emil Behring’s medical culture: From disinfection to serotherapy. Med Hist 2007; 51: 201-18.
4. Luke TC, Kilbane EM, Jackson JL, Hoffman SL. Metaanalysis: Convalescent blood products for spanish influenza pneumonia: A future H5N1 treatment? Ann Intern Med 2006; 145: 599-609.
5. Maiztegui JI, Fernandez NJ, de Damilano AJ. Efficacy of immune plasma in treatment of argentine haemorrhagic fever and association between treatment and a late neurological syndrome. Lancet 1979; 2: 1216-7.
6. Cheng Y, Wong R, Soo YO, et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis 2005; 24: 44-6.
7. Callow KA, Parry HF, Sergeant M, Tyrrell DA. The time course of the immune response to experimental coronavirus infection of man. Epidemiol Infect 1990; 105: 435-46.
8. Ko JH, Muller MA, Seok H, et al. Serologic responses of 42 MERS-coronavirus-infected patients according to the disease severity. Diagn Microbiol Infect Dis 2017; 89: 106-11.
9. Hsueh PR, Huang LM, Chen PJ, Kao CL, Yang PC. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARS-associated coronavirus. Clin Microbiol Infect 2004; 10: 1062-6.
10. Shen C, Wang Z, Zhao F, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA 2020; 323:1582-9.
11. Duan K, Liu B, Li C, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A 2020; 117: 9490-6.
12. Ye M, Fu D, Ren Y, et al. Treatment with convalescent plasma for COVID-19 patients in Wuhan, China. J Med Virol 2020; 10.1002/jmv.25882. doi: 10.1002/jmv.25882. Online ahead of print.
13. ClinicalTrials.gov.U. S. Nationa Library of Medicine. En: https://clinicaltrials.gov/ct2/results?term=plasma&cond=COVID-19; consultado mayo 2020.
14. Bloch EM, Shoham S, Casadevall A, et al. Deployment of convalescent plasma for the prevention and treatment of COVID-19. J Clin Invest 2020; 138745. doi: 10.1172/JCI138745.
15. Berry JD, Gaudet RG. Antibodies in infectious diseases: Polyclonals, monoclonals and niche biotechnology. N Biotechnol 2011; 28: 489-501.
16. Salazar E, Perez KK, Ashraf M. Treatment of COVID-19 patients with convalescent plasma in Houston, Texas. medRxiv 2020. En: http://www.medrxiv.org/content/10.1101/2020.05.08.20095471v1.full.pdf; consultado mayo 2020.
17. Joiner M, Wright RS, Fairweather D, et al. Early safety indicators of COVID-19 convalescent plasma in 5,000 patients. medRxiv 2020. En: http://www.medrxiv.org/content/10.1101/2020.05.12.20099879v1.full.pdf+html; consultado mayo 2020.
18. Liu STH, Lin H-M, Baine I. Convalescent plasma treatment of severe COVID-19: A matched control study. medRxiv 2020. En: https://www.medrxiv.org/content/10.1101/2020.05.20.20102236v1.full.pdf; consultado mayo 2020.
19. Jose RJ, Manuel A. COVID-19 cytokine storm: The interplay between inflammation and coagulation. Lancet Respir Med 2020; S2213-2600(20)30216-2.
20. Panigrahy D, Gilligan MM, Huang S, et al. Inflammation resolution: A dual-pronged approach to averting cytokine storms in COVID-19? Cancer Metastasis Rev 2020; 1-4. doi: 10.1007/s10555-020-09889-4.
21. Li L, Zhang W, Hu Y, et al. Effect of convalescent plasma therapy on time to clinical improvement in patients with severe and life-threatening COVID-19. A randomized clinical trial. JAMA 2020; 1-11. doi:10.1001/jama.2020.10044
22. CPC-19. En: http://www.groupcpc-19.com/; consultado junio 2020.
