ALBERTO TAMASHIRO 1, ANDRÉS E. DINI 1, GUSTAVO A. TAMASHIRO 1, FEDERICO M. RIOLO 1, MIGUEL O. VILLEGAS 1, LAURA V. DE CÁNDIDO 1, ANA PAULA MOLLÓN 1, MARÍA DE LOS ÁNGELES BIGOT 2
1 Servicio de Hemodinamia, 2 Servicio de Neumonología, Hospital Nacional Profesor Alejandro Posadas, El Palomar, Provincia de Buenos Aires, Argentina
Resumen Se presentan los resultados de 105 pacientes con hemoptisis amenazante tratados mediante embolización arterial por cateterismo percutáneo por vía arterial sistémica y/o arterial pulmonar. Se describe la técnica del procedimiento y los hallazgos angiográficos. Se muestra la utilidad de la fibrobroncoscopía y de la radiografía de tórax para identificar la zona sangrante como diagnóstico previo al procedimiento. Entre mayo 2000 y septiembre 2015 se admitieron en el Servicio de Hemodinamia 105 pacientes con diagnóstico de hemoptisis amenazante, 76 masculinos (72.4%); edad media: 41 (±18.65 DS) años. El 93% (98/105) fue tratado con éxito. En el 90% (88/98) se efectuó embolización por arterias bronquiales y/o no bronquiales sistémicas y en el 10% (10/98) por vía arterial pulmonar. Cuando la afección era bilateral la angiografía sola no posibilitó identificar el sitio de sangrado. Al 60% (63/98) se le hizo fibrobroncoscopía flexible y se pudo ubicar el pulmón sangrante en el 84% (56/63). Cuando la afección era unilateral, la radiografía de tórax previa al procedimiento facilitó la ubicación del área de sangrado en el 47%. No se observaron complicaciones graves ni muertes vinculadas al procedimiento. El tratamiento de la hemoptisis masiva por vía percutánea tiene alto porcentaje de éxito primario con muy baja tasa de complicaciones. El tratamiento por vía arterial pulmonar es un abordaje alternativo. La fibrobroncoscopía flexible es un importante complemento en esta entidad.
Palabras clave: hemoptisis, hemoptisis amenazante, embolización percutánea, arterias bronquiales, arterias pulmonares, fibrobroncoscopía flexible
Abstract We present the results of 105 patients with life-threatening hemoptysis who were treated with the systemic arterial and/or pulmonary artery routes. We also describe the procedure techniques and the angiographic findings. We show the usefulness of the flexible fiberoptic bronchoscopy and chest radiography to identify the bleeding zone previous to the procedure. From May 2000 to September 2015, a total of 105 patients were admitted to the Catheterization Laboratory with a diagnosis of life-threatening hemoptysis; 76 were male (72.4%) and mean age was 41 ± 18.65 years. Treatment was successful in 93% (98/105). In 90% (88/98) the approach was via the bronchial arteries and/or non-bronchial systemic arteries, and in 10% (10/98) the approach was via the pulmonary artery. In bilateral affection angiographic images alone could not identify accurately the site of the lung bleeding. Flexible fibrobronchoscopy was performed in 60% (63/98) and located the bleeding area in 84% (56/63). In unilateral affection, chest radiography previous to the procedure located the bleeding area in 47%. No complications or death were related to the procedure. The treatment of life threatening hemoptysis by a percutaneous way has a high percentage of primary success with a very low incidence of complications. Pulmonary arterial route treatment is an alternative approach. Flexible fibrobronchoscopy is an important complement to this entity.
Key words: hemoptysis, life-threatening hemoptysis, percutaneous embolization of bronchial and non-bronchial systemic arteries, embolization via the pulmonary arteries, flexible fibrobronchoscopy
Dirección postal: Alberto Tamashiro, Av. Directorio 2214, 1406 Buenos Aires, Argentina
e-mail: albertotamashiro@gmail.com
Actualmente no conocemos comunicaciones locales sobre el tema que presenten un importante número de casos con su metodología y nociones de la anatomía y fisiopatología
El presente trabajo destaca que:
– la evaluación de pre cateterismo con la fibrobroncoscopía flexible y la telerradiografía de tórax son auxiliares importantes para guiar el tratamiento de la hemoptisis
– las arterias no bronquiales sistémicas y pulmonares son la segunda causa del sangrado luego de las arterias bronquiales
– el acceso por arteria pulmonar constituye una alternativa al tratamiento endovascular
– el tratamiento por cateterismo es de preferencia en las hemoptisis amenazantes por rápida accesibilidad con altas chances de éxito, bajas complicaciones y fácil disponibilidad de materiales embolizantes como la esponja de gelatina
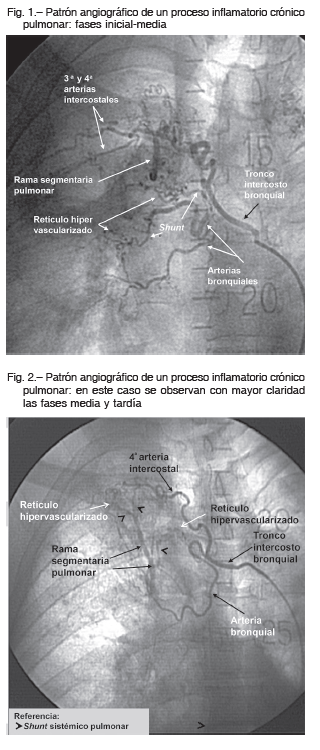
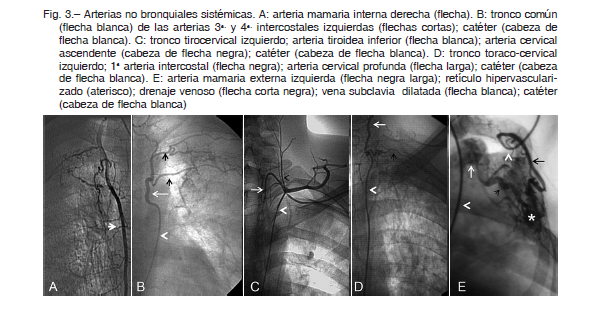
La hemoptisis es la expectoración subglótica de sangre de las vías respiratorias. Un alto volumen de sangre en corto período de tiempo o un sangrado menor con mala reserva cardiopulmonar puede generar asfixia. Es provocada por procesos inflamatorios pulmonares crónicos que se forman por fenómenos de regeneración o remodelación tisular, que inducen al desarrollo de un patrón angiográfico característico constituido, en la mayoría de los casos, por retículos hipervascularizados, hipertrofia de las arterias aferentes, shunt sistémico arterio-pulmonar y/o arteriovenoso pulmonar (Figs. 1 y 2).
La ruptura del retículo hipervascularizado expuesto a la presión arterial sistémica vascular produce la extravasación de la sangre a los bronquios provocando la hemoptisis. La finalidad terapéutica es embolizar el retículo sangrante.
El objetivo del trabajo fue presentar la experiencia en el tratamiento por medio del cateterismo percutáneo en 105 pacientes con hemoptisis amenazante, la metodología en los procedimientos por vía sistémica arterial 1, 2, o arterial pulmonar como vía alternativa 1, 3, 4, los resultados, el seguimiento, la descripción de la anatomía vascular para prevenir posibles complicaciones y el patrón angiográfico característico en los procesos inflamatorios crónicos; también evaluar la utilidad de la radiografía y la fibrobroncoscopía para guiar el tratamiento endovascular, los agentes embolizantes usados, las complicaciones, las características y la conducta terapéutica ante el resangrado.
Materiales y métodos
Se trata de un estudio descriptivo, retrospectivo y longitudinal.
Los resultados se expresan como la media y el desvío estándar para las variables continuas y el porcentaje para las categóricas.
Desde mayo de 2000 a septiembre de 2015 fueron admitidos 105 pacientes con diagnóstico de hemoptisis amenazante.
Setenta y seis eran de sexo masculino (72.4%); edad media: 41 años (± 18.6 DS).
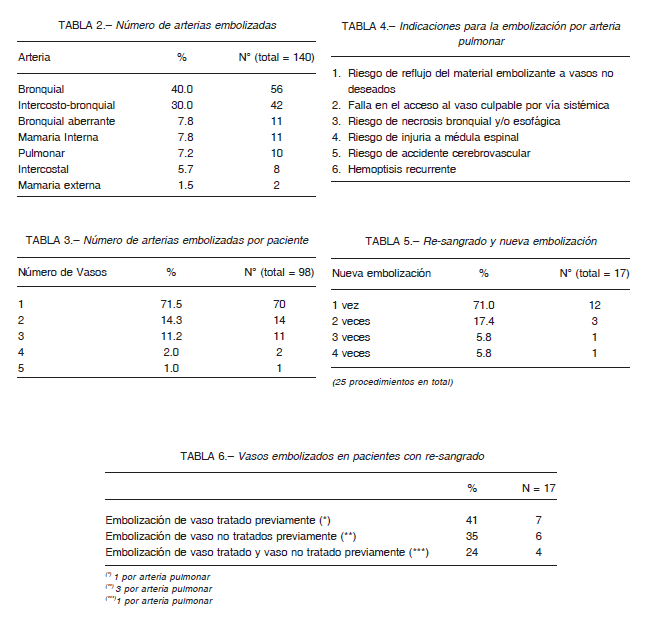
Las arterias no bronquiales sistémicas son aquellas que a través de las adherencias pleurales alimentan el retículo hipervascularizado inflamatorio pulmonar 5, 6. Principalmente son las arterias intercostales y ramas de las arterias subclavia y axilar: arteria mamaria interna, tronco tirocervical, tronco costocervical y mamaria externa (Fig. 3). Las bronquiales aberrantes son aquellas que no se originan de la aorta torácica descendente.
La hemoptisis masiva tiene múltiples definiciones: 200-1000 ml/24h1, expectoración de 200 ml/h con función pulmonar normal 7, expectoración de 50 ml/h con insuficiencia respiratoria crónica 7. Los pacientes, por sus condiciones clínicas, no pueden ser precisos para cuantificar la cantidad de sangre expulsada, por lo que se prefiere definir los sangrados como hemoptisis amenazante, la cual supone un riesgo para la vida; se determina por el volumen total estimado del sangrado, la velocidad del mismo, la reserva cardiopulmonar y sobre todo, la inestabilidad hemodinámica 1, 8.
La hemoptisis recurrente o re-sangrado consiste en episodios de sangrado mayor de 100 ml después de una embolización exitosa.
Un procedimiento es exitoso cuando el material de contraste inyectado en la arteria aferente no se lava y se detiene el sangrado.
Antes del cateterismo se procuró identificar el pulmón sangrante por radiografía de tórax y/o fibrobroncoscopía flexible. En el sangrado pulmonar activo intraprocedimiento se indicó la introducción de un balón oclusor en el bronquio sangrante o la intubación del bronquio no sangrante para asegurar la permeabilidad de la vía aérea.
Para la embolización se accedió mediante cateterismo de la arteria femoral común. Se realizó previamente la angiografía diagnóstica de las arterias aferentes bronquiales y/o arterias no bronquiales sistémicas del pulmón sangrante. Se evaluó el shunt sistémico pulmonar y el drenaje del contraste en la arteria pulmonar y/o en vena pulmonar para prevenir posible migración del material embolizante a la circulación sistémica (Figs. 1 y 2). Luego se procedió a embolizar al retículo hipervascularizado, accediendo por las arterias mencionadas.
En caso de que la embolización por vía de las arterias bronquiales o no bronquiales sistémicas no sea posible, es viable embolizar el retículo hipervascularizado sangrante accediendo por la arteria pulmonar. En este caso el cateterismo se realizó por vena femoral común hasta llegar al shunt sistémico-pulmonar (Figs. 1 y 2). La desaparición del shunt es indicativa de la finalización del procedimiento.
El material de contraste angiográfico utilizado fue de tipo hipoosmolar. Los agentes embolizantes utilizados figuran en la Tabla 1.

Resultados
El 93% de los pacientes (98/105) tuvo un tratamiento exitoso. Del 7% fallido (7/105), las causas fueron: 4.8% (5/105), no se halló o no se pudo cateterizar el/los vasos culpables, 0.9% (1/105) disfagia grave, 0.9% (1/105) paraparestesia grave de los miembros superiores.
En 53% se embolizaron vasos del pulmón derecho, en 47% del pulmón izquierdo; en un caso se embolizaron los vasos de ambos pulmones.
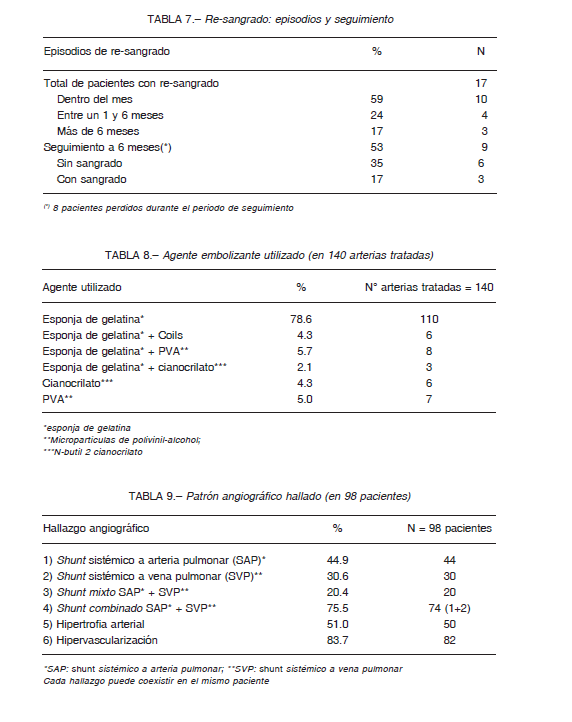
El número total de arterias embolizadas fue 140 en 98 pacientes. Las arterias bronquiales y tronco intercostobronquiales fueron las arterias más frecuentemente embolizadas (ambas corresponden al 70% de los casos) (Tabla 2).
En el 71% (70/98) se embolizó un solo vaso, mientras que el número máximo de arterias embolizadas en un solo paciente fue de 5 (Tabla 3).
En el 10% (10/98) se realizó embolización por arteria pulmonar. Las indicaciones de embolización por arteria pulmonar se muestran en la Tabla 4.
El 17% (17/98) de los pacientes re-sangraron luego de la primera embolización. Todos fueron re-tratados con éxito; algunos requirieron más de una nueva embolización (Tabla 5). Los vasos tratados y los detalles de seguimiento se aprecian en las Tablas 6 y 7, respectivamente.
En el 78% de las arterias embolizadas (110/140) se utilizó esponja de gelatina sola y en 12% (17/140) combinada con otros agentes (Tabla 8).
En el 9% (9/98) se halló arterias bronquiales aberrantes: uno con origen desde arterias del tronco celíaco, uno en arteria renal derecha, tres en mamaria interna, dos en cayado aórtico, uno en arteria subclavia y uno en tronco costocervical.
Los patrones angiográficos posibles son: hipertrofia arterial de la arteria aferente, retículo hipervascularizado, shunt sistémico a arteria pulmonar, shunt sistémico a vena pulmonar, shunt mixto combinado (Figs.1 y 2).
Estos componentes pueden no presentarse todos juntos en un mismo paciente. La hipertrofia de las arterias aferentes se presenta en alrededor del 50%, retículo hipervascularizado en más del 80%. Sumados, hubo presencia total de shunt en más del 90% (Tabla 9).
Complicaciones: un paciente presentó disfagia persistente después de una embolización exitosa de una arteria bronquial con N-butil 2 cianocrilato. La endoscopia reveló un área eritematosa en esófago que se resolvió en una semana. Otro presentó paraparestesia transitoria durante el estudio diagnóstico. No se registraron muertes ni complicaciones relacionadas al procedimiento.
Las causas de las hemoptisis fueron: tuberculosis 77.0% (81/105), bronquiectasias 8.6% (9/105), tumores 5.7% (6/105), traumatismos 0.1% (1/105), sin diagnóstico 7.6% (8/105).
En 75 pacientes, con la radiografía de tórax, se pudo identificar el pulmón sangrante; el 47% (33/75) de los casos presentó lesiones en un solo campo pulmonar, sin evidencias de lesiones en el otro campo.
Se realizó fibrobroncoscopía flexible en 64% (63/98), ubicando el área del sangrado en el 84% (56/63) con lesiones de ambos campos pulmonares. Con el auxilio de esta herramienta se colocó balón oclusor en el bronquio sangrante en 7 de 63. Se hizo intubación oro-traqueal en 6 de 63: uno por anestesia general, un paro cardiorrespiratorio, en tres protección de la vía aérea y un neumotórax.
Discusión
La ruptura del retículo vascular produce la extravasación de la sangre inundando los bronquios, con la posibilidad de producir la muerte por asfixia. La finalidad de la embolización es la oclusión del retículo inflamatorio hipervascularizado, accediendo por las arterias bronquiales y/o no bronquiales sistémicas, o en forma retrógrada por vía de la arteria pulmonar.
Las arterias bronquiales son las arterias nutricias del pulmón, nacen en su mayoría de la aorta torácica descendente a nivel de las vértebras D5-D6; miden 1.5 mm en el origen y 0.5 mm a nivel de los segmentos broncopulmonares. Irrigan la tráquea y vías aéreas extra e intrapulmonares, el tercio medio del esófago, vasa vasorum de la aorta y de las arterias y venas pulmonares.
También irrigan nervios, nódulos linfáticos regionales y la pleura visceral 1, 5, 9-11. La embolización de estas arterias puede potencialmente dañar algunos de estos órganos.
Por lo tanto el conocimiento de la anatomía arterial es importante en el momento de realizar este procedimiento.
Tienen grandes variaciones anatómicas de origen y distribución. Son bien conocidos los trabajos de Yoon W 1, Stoll y col. 5 Uflacker R 12 y Cauldwell EW 13. La distribución más constante es la del tronco intercostobronquial derecho que da origen a las 3a y 4a arterias intercostales y la arteria bronquial derecha; se observan en el 80% de los pacientes (Figs. 1, 2). En cuanto a la distribución de las arterias bronquiales izquierdas es mucho más variable; puede haber una o dos arterias, también pueden nacer desde un tronco común con la arteria bronquial derecha 1, 5, 12, 13.
Las arterias bronquiales aberrantes 1, 5, 11 pueden nacer del cayado aórtico, tronco braquiocefálico, arteria mamaria interna, arteria subclavia, tronco tirocervical, tronco costocervical, aorta abdominal o de sus ramas.
No sospechar de su existencia puede prolongar en gran medida el procedimiento.
El material embolizante más frecuentemente utilizado es la esponja de gelatina. Es un agente que dio buenos resultados a pesar de que se reabsorbe en 7-10 días 14.
Es fácilmente accesible y de bajo costo. Hay diferentes opiniones sobre los resultados comparativos entre la esponja de gelatina y otros agentes embolizantes. Se ha informado rendimiento favorable para el polivinil alcohol comparado con la esponja de gelatina 15, el cual tiene la ventaja de su efecto permanente. Otros trabajos no presentaron diferencias entre la esponja de gelatina y otros agentes no absorbibles 16, 17. Algunos autores refieren que con la esponja de gelatina el riesgo de la recurrencia es bajo 18.
Los coils se utilizaron para impedir el lavado de la esponja de gelatina y en casos de aneurismas o pseudoaneurismas sangrantes.
El N-butil 2 cianocrilato se utilizó en las hemoptisis amenazantes con episodios continuos o intermitentes durante varios días o semanas. El propósito fue obtener un efecto de mayor duración que con la esponja de gelatina.
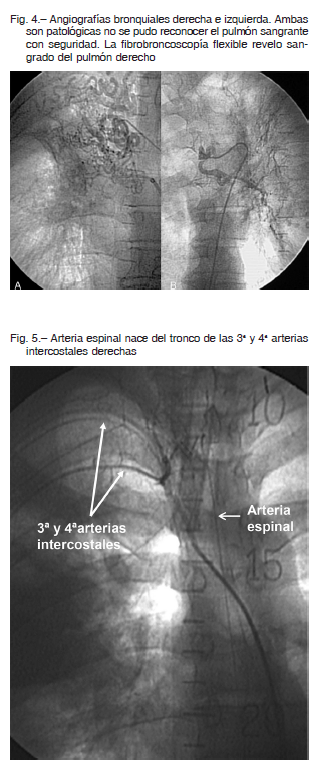
En algunos casos no se logró identificar el sitio de sangrado solo con la angiografía 19 (Fig. 3). El drenaje directo del material de contraste a los bronquios es patognomónico, pero es raro de observar: Swanson et al, 1 paciente (2%)20, Lee et al, 2 (3%) 21. Con el tiempo se fueron incorporando otros recursos.
La radiografía de tórax y la fibrobroncoscopía flexible fueron las técnicas empleadas para identificar el pulmón sangrante. La radiografía de tórax sola puede orientar el pulmón sangrante cuando presenta lesiones unilaterales.
La fibrobroncoscopía flexible de emergencia es parte del enfoque de la hemoptisis en el diagnóstico y tratamiento, permite la lateralización y localización del sangrado 21-23.
También facilita colocar balones oclusores en el bronquio sangrante y/o asistir en maniobras para mantener la vía aérea permeable. Con esta técnica fue posible ubicar el lado sangrante del pulmón en el 84%; posibilitó tratar vasos culpables y evitar embolizar vasos no involucrados.
Otros trabajos no presentaron resultados similares; después del 2010 se comunicó una localización entre 54-75% del lóbulo sangrante 24. Es importante realizar la fibrobroncoscopía flexible momentos antes del procedimiento para tener mejor correlación.
Los signos de disfagia o molestias graves en la tráquea durante el diagnóstico, indican riesgo de necrosis bronquial y/o esofágica y eventual formación de fístulas broncoesofágicas 2, 25, 26; un paciente presentó un episodio similar y se suspendió el estudio.
La frecuencia de re-sangrado es variable entre los distintos autores, está entre 10% y 57% 24. Es posible que la variación de estos resultados dependa de cómo se emprende el procedimiento. Cuando la zona inflamatoria es extensa hay varias arterias aferentes responsables, por lo que es posible que queden vasos sin embolizar. Otras causas de re-sangrado pueden ser por recanalización de los vasos tratados o por pseudoaneurismas de las arterias pulmonares, que se tratará más adelante.
En los procesos inflamatorios crónicos del pulmón pueden producirse adherencias de la pared del tórax con la pleura y el pulmón formándose un bloque inflamatorio.
Las arterias no bronquiales sistémicas (Fig. 4) además de las arterias bronquiales, son las que proveen irrigación al bloque inflamatorio donde se despliega el retículo hipervascularizado.
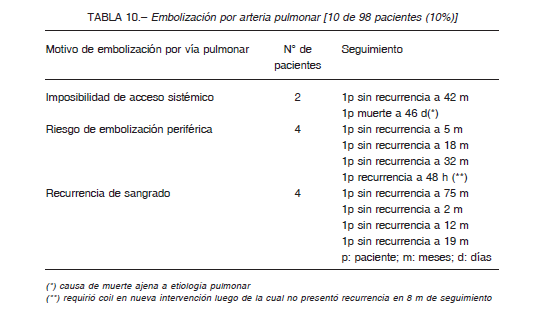
Estas arterias pueden dar origen a las arterias espinales 5, 12, 13 y podría existir riesgo de injuria de la médula espinal (Fig. 5). Diferentes informes citan complicaciones en médula espinal 27-29. Un trabajo cita 6% de complicaciones espinales, uno con secuela permanente 7.
El problema disminuyó con la experiencia y la utilización de material de contraste de baja osmolaridad. En esta serie hubo un episodio de paraparestesia grave transitoria de los miembros superiores, la arteria intercostal culpable originaba la arteria espinal. Actualmente la presencia de la arteria espinal no es contraindicación absoluta para la embolización.
El acceso por la arteria pulmonar 31-35 acrecienta la posibilidad del tratamiento por embolización percutánea: la tortuosidad y lesiones obstructivas arteroescleróticas de la aorta o sus ramas pueden ser obstáculos para el acceso al vaso culpable por vía sistémica. La vía pulmonar puede ser una indicación. La arteria pulmonar puede ser responsable de hemoptisis en 10% de casos 31-33 por la presencia de aneurismas, afecciones cavitarias como pseudoaneurismas, tuberculosis cavitarias, aspergilomas, abscesos piógenos y carcinoma bronquial, los cuales producen procesos erosivos que corroen los tejidos y vasos. En estos casos, la embolización a través de las arterias bronquiales o no bronquiales sistémicas tienen mayor frecuencia de recurrencias; la embolización por la arteria pulmonar puede ser más efectiva 31-33. Cuando el tronco arterial es corto o adelgazado como en los troncos tirocervical o tronco costo cervical (Figs. 3 C, D) puede ocurrir reflujo y migración del material embolizante a otros vasos y provocar accidentes neurológicos. También pueden ocurrir accidentes cerebrovasculares por la existencia de un retículo hipervascularizado shunt sistémico-venoso pulmonar muy desarrollado a través del cual las partículas pueden migrar a las venas pulmonares y pasar a la circulación sistémica. Hay informes de ceguera cortical con secuelas transitorias y permanentes 1, 30. En la Tabla 4 se completan las indicaciones de las embolizaciones por acceso arterial pulmonar. Motivos, número de pacientes y seguimiento de cada grupo se muestran en la Tabla 10.
En conclusión, la embolización percutánea es la primera opción terapéutica por la rápida resolución del problema, pronta recuperación del paciente y alta tasa de éxito con bajas complicaciones.
Las arterias bronquiales, no bronquiales sistémicas y arteria pulmonar suministran la sangre que llega al retículo hipervascularizado, lugar donde eventualmente se produce la ruptura y posterior sangrado.
La vía por arteria pulmonar aumenta las posibilidades del tratamiento por cateterismo constituyendo un acceso alternativo.
El entendimiento de la anatomía, distribución de las arterias y el patrón angiográfico de un proceso inflamatorio crónico facilita un tratamiento más eficaz y previene las complicaciones, en especial las neurológicas y por necrosis. Algunos autores recomiendan la realización de un aortograma torácico para la identificación de vasos responsables del sangrado 36.
La fibrobroncoscopía flexible es importante auxiliar para el tratamiento de la hemóptisis.
Agradecimientos: Agradecemos la colaboración desinteresada del personal administrativo, técnico y enfermeros.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Yoon W, Kim JK, Kim YH, Chung TW, Kang HK. Bronchial and nonbronchial systemic artery embolization for life-threatening hemoptysis: a comprehensive review. Radiographics 2002; 22: 1395-409.
2. Rémy J, Arnaud A, Fardou H, Giraud R, Voisin C. Treatment of hemoptysis by embolization of bronchial arteries. Radiology 1977; 122: 33-7.
3. Remy J, Lemaitre L, Lafitte JJ, Vilain MO, Saint Michel J, Steenhouwer F. Among Massive hemoptysis of pulmonary arterial origin: diagnosis and treatment. Am J Roentgenol 1984; 143: 963-9.
4. Rabkin JE, Astafjev VI, Gothman LN, Grigorjev YG. Transcatheter embolization in the management of pulmonary hemorrhage. Radiology 1987; 163: 361-5.
5. Stoll JF, Bettmann MA. Bronchial artery embolization to control hemoptysis: a review. Cardiovasc Intervent Radiol 1988; 11: 263-9.
6. Remy-Jardin M, Bouaziz N, Dumont P, Brillet P Y, Bruzzi J, Remy J. Bronchial and nonbronchial systemic arteries at multi-detector row CT angiography: comparison with conventional angiography. Radiology 2004; 233:741-9.
7. Mal H, Rullon I, Mellot F. Immediate and log-term results of bronchial artery embolization for life-threatening haemoptysis. Chest 1999; 111: 996-1001.
8. Cordovilla R, Bollo de Miguel E, Nuñez Ares A, Cosano FJ. Diagnóstico y tratamiento de la hemoptisis. Arch Bronconeumol 2016; 52: 368-77.
9. Bloom – Fawcett. Tratado de Histología, 11a (ed). México: Interamericana – McGraw Hill, 1991, p 757.
10. Murata K, Itoh H, Todo G, et al. Bronchial venous plexus and its communication with pulmonary circulation. Invest Radiol 1986, 21: 24-30.
11. Botenga ASJ. Selective bronchial and intercostal arteriography. Baltimore: Willams and Wilkins, 1970, p 7-82.
12. Uflacker R, Kaemmerer A, Picon PD, Rizzon CF, Neves CM, Oliveira ES. Bronchial artery embolization in the management of hemoptysis: technical aspects and longterm results. Radiology 1985; 157: 637-44.
13. Cauldwell EW, Siekert RG, Lininger RE, Anson BJ. The bronchial arteries: anatomic study of 105 human cadavers. Surg Gynecol Obstet 1948; 86: 395-412.
14. Yoon W. Embolic agent use for bronchial artery embolisation in massive haemoptysis. Expert Opin Pharmacother 2006; 5: 361-7.
15. Hahn S, Kim YJ, Kwon W, Cha SW, Lee WY. Comparison of the effectiveness of embolic agents for bronchial artery embolization: gel foam versus polyvinyl alcohol. Korean J Radiol 2010; 11: 542-6.
16. Remy-Jardin M, Wattinne L, Remy J. Transcatheter occlusion of pulmonary arterial circulation and collateral supply: failures, incidents, and complications. Radiology 1991; 180: 699-705.
17. Kim EJ, Lim JW, Oh JH, Yoon Y, Sung DW. Prognostic factors in bronchial arterial embolization for hemoptysis. J Korean Radiol Soc 1994; 31: 43-8.
18. Chung SK, Kim JK, Yoon W, Kim YH, Park JG, Kang HK. Bronchial artery and non-bronchial systemic artery embolization for the treatment in patients with hemoptysis: analysis of efficacy of gel foam single use. J Korean Radiol Soc 2003, 49: 15-22.
19. Fellows KE, Khaw KT, Schuster S, Shwachman H. Bronchial artery embolization in cystic fibrosis: technique and long term result. J Pediatr 1979; 95: 959-6.
20. Swanson KL, Johnson CM, Prakash UBS, McKusick MA, Andrews JC. Bronchial artery embolization: experience with 54 patients. Chest 2002; 121: 789-95.
21. Lee S, Chan JW, Chan SC, et al. Bronchial artery embolization can be equally safe and effective in the management of chronic recurrent haemoptysis. Hong Kong Med J 2008; 14: 14-20.
22. Ittrich H, Maximilian Bockhorn M, Klose H, Simon M. The diagnosis and treatment of hemoptysis. Dtsch Arztebl Int 2017; 114: 371-81.
23. Dweik RA, Stoller JK. Role of bronchoscopy in massive hemoptysis. Clin Chest Med 1999; 20: 89-105.
24. Ananya P, Bhalla AS, Goyal A. Bronchial artery embolization in hemoptysis: a systematic review. Diagn Interv Radiol 2017; 23: 307-17.
25. Ivanick MJ, Thorwarth W, Donohue J, Mandell V, Delany D, Jaques PF. Infarction of the left mainstem: a complication of bronchial artery embolization. AJR 1983; 141: 535-7.
26. Helrnon CH, Chatel L, Bigot JM, Brocard H. Fistuleaesophago – bronchique gauche après embolization bronchique. Nouv Presse Med 1977; 6: 4209.
27. Kardjiev V, Symeonov A, Charkov I. Etiology, pathognesis, and prevention of spinal cord lesions in selective angiography of de bronchial and intercostals arteries. Radiology 1974; 112: 81-3.
28. Di Chiro D. Unintentional spinal cord angiography: a warning. Radiology 1974; 112: 31-3.
29. Feigelson HH, Ravin HA. Adverse myelitis following selective bronchial: arteriography. Radiology 1965: 85: 663-5.
30. Liu SF, Lee TY, Wong SL, Lai YF, Lin AS. Transient cortical blindness: a complication of bronchial artery embolization. Resp Med 1998; 92: 983-6.
31. Tamashiro A, Miceli MH, Rando C, Tamashiro GA, Villegas MO, Dini AE. Pulmonary artery access embolization in patients with massive hemoptysis in whom bronchial and/or nonbronchial systemic artery embolization is contraindicated. Cardiovasc Intervent Radiol 2008; 31: 633-7.
32. Tamashiro A, Dini AE, Tamashiro GA, Riolo FM, Zamora AD. Embolización por arteria pulmonar en hemoptisis masiva: otro recurso terapéutico. Revista Argentina de Cardioangiología 2015; 6: 33-41.
33. Sanyika C, Coor P, Royston D, David F. Blyth DF. Pulmonary angiography and embolization for severe hemoptysis due to cavitary pulmonar tuberculosis. Cardiovasc Intervent Radiol 1999; 22: 427-60.
34. Sbano H, Mitchell A W, Ind P W. Peripheral pulmonary artery pseudoaneurysms and massive hemoptysis. Am J Roentgenology 2005; 184: 1253-9.
35. Ferris EJ. Pulmonary hemorrhage: vascular evaluation and interventional therapy. Chest 1981; 80: 710-4.
36. Ho JC, Jae YB, Seung-Schik Y, Byung C. Added benefit of thoracic aortography after transarterial embolization in patients with hemoptysis. AJR Am J Roentgenol 2003; 180: 1577-81.
