JOAQUÍN MARITANO FURCADA 1, RODRIGO CASTRO 1, JUAN A. PRECERUTTI 1, ALBERTO SEEHAUS 2, JAIME LÓPEZ 1, MARCOS LAS HERAS 1, LILIANA DALURZO 3, MARÍA JOSÉ LABANCA 3, HORACIO M. CASTRO 1
1 Sección de Neumonología, 2 Servicio de Diagnóstico por Imágenes, 3 Servicio de Anatomía Patológica, Hospital Italiano de Buenos Aires, Argentina
Resumen La criobiopsia transbronquial pulmonar (CBTB) ha sido introducida recientemente para el diagnóstico histológico de las enfermedades pulmonares intersticiales difusas (EPID). Nuestro objetivo fue evaluar el rédito diagnóstico y la seguridad de la CBTB para EPID en un centro de tercer nivel, en Buenos Aires, Argentina. Se efectuó una revisión retrospectiva de sujetos a los que se les realizó una CBTB en este centro desde septiembre de 2016 a noviembre de 2019. Se registró la información referida al paciente, el procedimiento y sus complicaciones, el diagnóstico histológico y multidisciplinario. Se analizaron potenciales factores asociados a diagnóstico y complicaciones por regresión logística. Se incluyeron 52 pacientes. La media de muestras fue 5.7 (DE 1.7) con una mediana de diámetro de 6 mm (rango intercuartil 6-8). Trece (25%) enfermos desarrollaron neumotórax sin encontrarse casos de sangrado grave o muerte. El rédito diagnóstico fue de 73.1% y 84.5% para la histología y la evaluación multidisciplinaria respectivamente. El número de muestras se asoció al rédito diagnóstico en el análisis multivariado (OR 2.15 –IC95% 1.16-3.99). La CBTB parece ser segura y efectiva para la evaluación de las EPID en la práctica al aplicarse en un centro con acceso a evaluación multidisciplinaria.
Palabras clave: criobiopsia transbronquial, enfermedad pulmonar intersticial, broncoscopía
Abstract Transbronchial lung cryobiopsy (TBLC) has been recently introduced for the histological assessment of interstitial lung diseases. The objectives were to assess the diagnostic yield and safety of TBLC for interstitial lung diseases in our setting. A retrospective review of subjects who underwent TBLC in a tertiary care center from September 2016 to November 2019 was performed. Data regarding subject and procedure characteristics, complications, histopathological and multidisciplinary diagnosis was recorded. Logistic regression was used to analyze potential factors associated to diagnosis and complications. A total of 52 subjects were included. Mean number of samples was 5.7 (SD 1.7) with a median sample diameter of 6 mm (interquartile range 6-8). Pneumothorax developed in 13 (25%) participants, and no cases of severe bleeding or death were registered. A 73.1% and 84.5% diagnostic yield was recorded through histology and added multidisciplinary evaluation respectively. The number of samples was associated to the diagnostic yield in a multivariate analysis (OR 2.15 –CI95% 1.16-3.99). TBLC appears to be safe and effective for the assessment of interstitial lung diseases in a real life setting when applied in a center with access to multidisciplinary evaluation.
Key words: transbronchial cryobiopsy, interstitial lung disease, bronchoscopy
Dirección postal: Joaquin Maritano Furcada, Sección de Neumonología, Hospital Italiano de Buenos Aires, Tte. Gral. Juan D. Perón 4190, 1199 Buenos Aires, Argentina
e-mail: joaquin.maritano@hospitalitaliano.org.ar
Conocimiento actual
• La criobiopsia transbronquial ha demostrado ser un método alternativo a la biopsia quirúrgica en la evaluación de las enfermedades pulmonares intersticiales difusas, con menor morbi-mortalidad a expensas de un menor rédito diagnóstico. No hay datos publicados sobre su seguridad y rendimiento diagnóstico en Argentina.
Contribución del artículo al conocimiento actual
• La criobiopsia transbronquial ha mostrado ser una herramienta útil y segura en la evaluación de las EPID, en un contexto de la vida real en un centro de Argentina con acceso a evaluación multidisciplinar
Las enfermedades pulmonares intersticiales difusas (EPID) consisten en un grupo de más de 200 condiciones pulmonares crónicas que suelen ser de curso progresivo 1.
El camino al diagnóstico es complejo, requiriendo habitualmente de múltiples estudios y de una evaluación multidisciplinaria (EMD) que incluye (al menos) a un neumonólogo, un especialista en imágenes y un patólogo 2-4.
Alrededor de un quinto de los pacientes requieren de una biopsia para incrementar la confianza en un diagnóstico de fibrosis pulmonar idiopática (FPI)5-7. La biopsia quirúrgica pulmonar (BQP) está recomendada por la guía para el diagnóstico de la FPI de ATS/ERS/JRS/ALAT de 2018 como el método de elección para la confirmación histológica de FPI cuando la tomografía computarizada de alta resolución (TCAR) no ofrece un diagnóstico definitivo de neumonía intersticial usual (NIU)1. La fortaleza principal de este método es el tamaño de la biopsia, la cual permite un rédito diagnóstico de ≈90%. Sin embargo, su aplicabilidad en pacientes con EPID se ve limitada debido a una prevalencia del 15% de fistula broncopleural, un 3% de riesgo de exacerbación, además de un 5% de mortalidad a 90 días post-procedimiento 8-11.
La criobiopsia transbronquial pulmonar (CBTB) se introdujo recientemente como una alternativa a la BQP en EPID. Esta técnica aparenta ser más segura, pero a expensas de un menor rédito diagnóstico 12, 13.
El objetivo de nuestro estudio fue comunicar las características de esta técnica y sus factores asociados en una población de pacientes con EPID de un centro de tercer nivel en Buenos Aires, Argentina.
Materiales y métodos
Desarrollamos un estudio retrospectivo basado en el registro institucional de EPIDs. Se incluyeron todos los pacientes a los que se les realizó una CBTB por un diagnóstico de EPID desde septiembre 2016 a noviembre de 2019 en un centro universitario de tercer nivel. Se obtuvo aprobación por el comité de ética institucional (N° 3734). Toda la información se recabó a través de la historia clínica electrónica y fue anonimizada previamente al análisis.
Los candidatos a CBTB fueron evaluados previamente por un neumonólogo, el cual registró la información demográfica, de exposición ambiental, manifestaciones reumatológicas y otra información clínica. El paciente se consideraba apto según su edad, características clínicas y gravedad de la enfermedad.
Aquellos con una TCAR sin un patrón definitivo para NIU y sin una causa secundaria de EPID fueron candidatos para CBTB. Se contraindicó el procedimiento ante la presencia de hipertensión pulmonar (al menos 40 mmHg estimados por ecocardiografía), trombocitopenia o diátesis hemorrágicas.
La antiagregación o anticoagulación se suspendieron previamente al procedimiento cuando esto era factible. Todos los pacientes otorgaron su consentimiento previamente al estudio.
Todos los estudios fueron realizados en quirófano, bajo anestesia general y por un broncoscopista entrenado. Los pacientes se monitorizaron por oximetría de pulso, capnografía, presurometría arterial, electrocardiograma y medición de índice bispectral. La intubación y ventilación se realizó por broncoscopía rígida (broncoscopio rígido –EFER-DUMON®– y traqueoscopio tamaño 12-13 mm –STORZ®–) o intubación endotraqueal según la preferencia del broncoscopista a cargo.
Posteriormente a la intubación se introdujo el videofibrobroncoscopio a través del broncoscopio rígido o tubo orotraqueal, según el método seleccionado. Seguido a esto, se colocó la sonda de criobiopsia por el canal de trabajo del broncoscopio flexible.
El sitio de biopsia se seleccionó según los hallazgos de TCAR en forma preoperatoria. Se eligieron dos sitios de biopsia (segmentos o lóbulos) con al menos dos muestras por sitio.
Previamente a la biopsia se tomó un lavado broncoalveolar en uno de los sitios seleccionados. Se posicionó un catéter de oclusión Fogarty 5Fr o 6Fr en forma proximal al segmento blanco a través de un broncoscopio flexible (modelo FB-18V o FB-15V, PENTAX, EE.UU.). Posteriormente, se progresó el broncoscopio al sitio de biopsia. Luego, se avanzó la sonda de criobiopsia (sonda ERBECRYO®, Turbingen, Alemania de 1.9 –en la mayoría de los casos- o 2.4 mm) al canal de trabajo del broncoscopio hasta 1-2 cm de la pleura bajo guía fluoroscópica.
La criosonda se activó durante 3-6 segundos, retirándose luego el broncoscopio flexible y la sonda en conjunto. Para prevenir el sangrado, se infló el catéter de oclusión inmediatamente a la biopsia. El volumen de sangrado se estimó por visualización broncoscópica de los bronquios segmentarios luego del desinflado del balón. La presencia de neumotórax se rastreó en quirófano por fluoroscopia y radiografía de tórax dentro de las 12 horas de la extubación. Los pacientes se observaron en el postoperatorio por al menos 12 horas.
Las muestras se descongelaron en solución salina, para transferirse y fijarse a formol posteriormente. Su medición se realizó en el departamento de anatomía patológica previamente a la inclusión en parafina. Se tiñó una filmina con al menos tres secciones en serie con hematoxilina & eosina.
Filminas adicionales eran teñidas del mismo modo, agregándose otras técnicas (tricrómicos, elastina, PAS) según los hallazgos iniciales. Las muestras fueron evaluadas por una patóloga especializada en enfermedades torácicas con más de 20 años de experiencia en el diagnóstico de enfermedades intersticiales (LD), para quien estuvo disponible la información clínica y radiológica. El diagnóstico final se determinó en la reunión de EMD que incluía a neumonólogos, patólogos y un especialista en diagnóstico por imágenes.
Se registraron las complicaciones asociadas al procedimiento (neumotórax, sangrado, hipoxia postoperatoria, intubación postoperatoria o requerimiento de pase a terapia intensiva y muerte). El sangrado fue clasificado como (a) Leve: necesidad de succión continua de la vía aérea; (b) Moderado: requerimiento maniobras broncoscópicas; (c) Grave: requerimiento de transfusión, angiografía u otro tipo de terapéutica avanzada 14.
Las variables se resumieron según sus características y distribuciones. Se analizaron en forma exploratoria los potenciales factores asociados a complicaciones y rédito diagnóstico a través de análisis univariado y luego multivariado por regresión logística. Los análisis se realizaron utilizando el programa Stata v. 13 (StataCorp. 2013. Stata Statistical Software: Release 13. College Station, TX: StataCorp LP).
Resultados
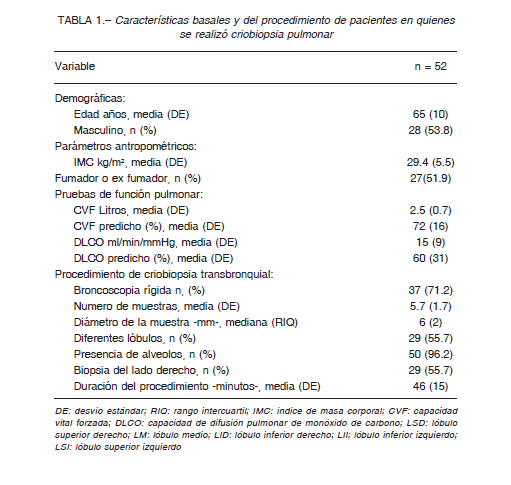
Durante el período analizado, se realizaron 52 CBTB como parte de la evaluación de enfermedades difusas del parénquima pulmonar. El promedio de edad fue de 65 años (DE 10) con un predominio de sexo masculino (54%).
La media del número de muestras fue de 5.7 (DE 1.7), en más de la mitad de los casos (56%) realizadas en más de un lóbulo. La mediana del diámetro de la muestra fue de 6 mm (RIQ 6-8). La mayoría de las muestras fueron representativas del parénquima pulmonar. Todos eran pacientes ambulatorios que fueron hospitalizados para el procedimiento por una mediana de 2 días (RIQ 1- 3).
En la mayoría la intubación fue por broncoscopía rígida. Las características de la población y del procedimiento se resumen en la Tabla 1.
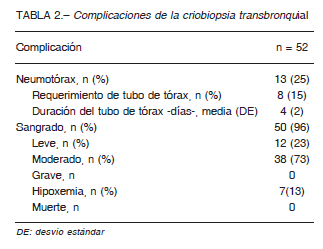
El neumotórax ocurrió en una cuarta parte de los pacientes y en la mayoría de los casos requirió la colocación de un tubo de avenamiento pleural. Esta complicación no se presentó en sujetos con menos de cinco biopsias. El sangrado fue frecuente (96%), aunque no se observaron casos graves. Tres ingresaron a cuidados intensivos por hipoxemia posterior al procedimiento, aunque ninguno requirió asistencia ventilatoria. No se registraron casos de exacerbación aguda o muerte relacionados al procedimiento.
Las complicaciones se resumen en la Tabla 2.
Se estableció un diagnóstico histopatológico específico en el 73.1% (38/52) de los sujetos. Los diagnósticos histopatológicos más frecuentes fueron la neumonía intersticial no específica (NINE) (15), baja confianza de NIU (6), alta confianza de NIU (4) y neumonía en organización criptogénica (NOC) (4). Los diagnósticos histopatológicos se muestran en la Tabla 3.
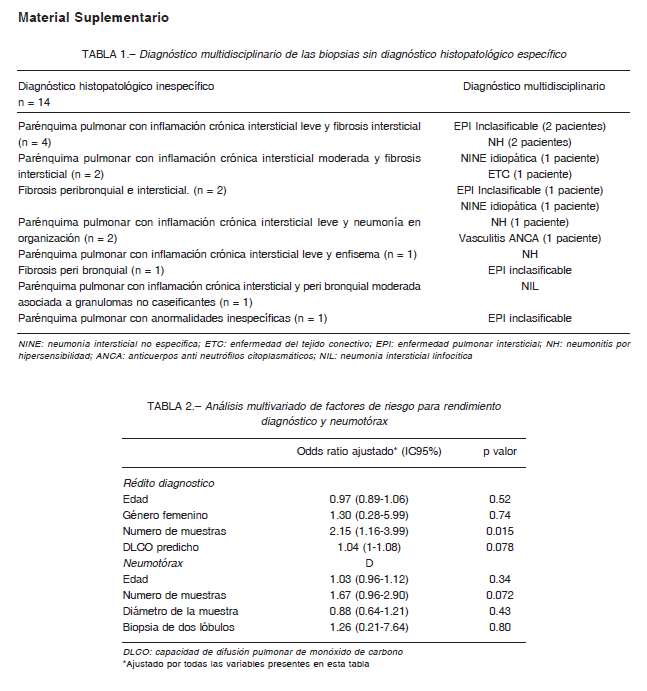
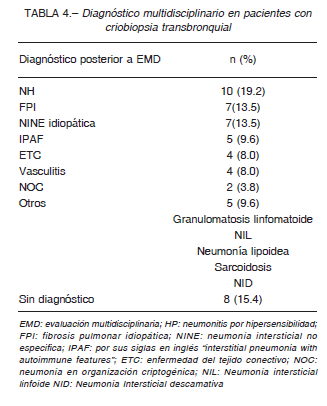
El rendimiento diagnóstico general después de la EMD fue del 84.5% (44/52). Los tres diagnósticos más frecuentes fueron neumonitis por hipersensibilidad (NH) (19%), FPI (13.5%) y NINE idiopática (13.5%). Otros diagnósticos se muestran en la Tabla 4. En el 26.5% (14/52) de los casos se obtuvo una histopatología inespecífica (14/52), pero la EMD permitió un diagnostico en 6 de ellos. La EMD no pudo establecer un diagnóstico específico en 8 (15.4%) sujetos. En cuatro de esos casos se realizó una biopsia pulmonar quirúrgica, obteniendo tres casos de FPI y uno de NH crónica. Los pacientes restantes se consideraron no adecuados para una BQP debido al alto riesgo de complicaciones (n = 2) o porque rechazaron el procedimiento (n = 2). La histología y EMD de las biopsias no diagnósticas se enumeran en la Tabla 1 del material suplementario.
El número de muestras obtenidas se asoció con el diagnostico histopatológico tanto en el análisis univariado (OR 1.59, IC95% 1.02-2.49) como en el multivariado (OR 2.15, IC95% 1.16-3.99) que incluyó género femenino, edad y valor predicho de la difusión de monóxido de carbono.
Sin embargo, el número de muestras no se asoció con la presencia de neumotórax en el análisis univariado ni en el multivariado (ajustando por diámetro de la muestra, edad, género y predicho de la difusión de monóxido de carbono) (Tabla 2 del material suplementario).

Discusión
Se obtuvo un rédito histopatológico elevado, de 73.1%, que se incrementó a 84.5% cuando se combinó con la EMD. Sumado a esto, el procedimiento fue una alternativa segura en comparación con los datos conocidos sobre la BQP. Aunque la tasa de neumotórax es significativa, no hubo eventos de sangrado grave ni muertes asociadas al estudio.
El rédito diagnóstico informado en este trabajo es consistente con otras publicaciones 12, 15. Como ha sido establecido previamente, la EMD potenció el rédito diagnóstico de la CBTB 16-18. La NH fue la condición más comúnmente diagnosticada (19.2%). Esto fue más frecuente que lo comunicado por Ravaglia y Dhooria, aunque otros autores como Wälscher y Lentz demostraron una prevalencia similar 12, 15, 17, 18. La justificación de esto parece encontrarse en el muestreo propio de la técnica, características poblacionales y la búsqueda profunda de exposiciones ambientales que permitió detectar cuatro casos de antígenos aviares y fúngicos respectivamente.
Una proporción significativa de los pacientes (13.5%) tuvieron un diagnóstico de NINE idiopática. El diagnóstico de NINE por medio de CBTB ha sido desalentado por algunos autores, sugiriendo una metodología más agresiva: la realización de una BQP en casos donde no se puede asociar este patrón a una condición secundaria 19.
Sin embargo, el realizar una BQP subsiguiente, en casos donde un patrón bien descrito y específico ya ha sido caracterizado, no fue considerado prudente en su aplicación, especialmente de manera sistemática. Igualmente, se optó por un manejo guiado por las características del paciente, la confianza en el diagnóstico y la respuesta terapéutica. Alineado con esto, dos BQP post-CBTB fueron realizadas cuando el diagnóstico histopatológico de NINE no alcanzó una confianza alta, conformando luego un diagnóstico de NH y FPI.
Según lo recomendado recientemente, el procedimiento fue realizado con guía fluoroscópica, con bloqueante bronquial y la mayoría de los estudios utilizaron una sonda pequeña (1.9 mm)20. Sumado a esto, todos los procedimientos fueron realizados por broncoscopistas experimentados, que utilizaron broncoscopía rígida en la mayoría de los casos y realizaron el estudio en quirófano con el paciente internado para una observación corta posterior al estudio. Este contexto favoreció la ausencia de episodios de sangrado grave o mortalidad asociada al estudio. El sangrado moderado ocurrió en 38 (73.1%) pacientes, conteniéndose en todos los casos. La prevalencia de neumotórax varía en la bibliografía en un rango de entre 0 y 26% 13, 19, 21, 22. En este estudio, un cuarto de los pacientes desarrolló neumotórax, requiriendo drenaje, más de la mitad de ellos. Esto podría asociarse al alto número de biopsias realizadas, que ha sido asociado a un riesgo aumentado de dicha complicación 12. Es más, en este trabajo, sujetos con un número mayor de biopsias presentaron una tendencia no estadísticamente significativa hacia un mayor riesgo de neumotórax. Aquí se plantea un dilema: más muestras pueden asociarse
tanto a un aumento en el rédito diagnóstico como al riesgo de neumotórax. El número óptimo de muestras no ha sido definido completamente en la literatura 20. Sumado a esto puede suponerse que este número puede variar según el nivel de compromiso pulmonar y estado clínico de cada enfermo.
Las hospitalizaciones duraron dos días en la mayoría de los casos, aunque algunos pacientes requirieron una estadía prolongada. El requerimiento de drenaje y monitoreo de neumotórax post-CBTB fueron las principales razones. Hay que considerar que la duración de hospitalización fue significativamente menor que la informada para BQP 23.
La naturaleza retrospectiva de este estudio tiene un riesgo inherente de sesgo de información. Sin embargo, todos los datos de los pacientes fueron registrados en forma sistemática en la historia clínica electrónica y todos los casos fueron revisados por el comité multidisciplinario al momento del diagnóstico. Este estudio fue realizado en un único centro, lo que puede reducir la generalizabilidad de nuestros hallazgos. Aunque todos los procedimiento fueron realizados por broncoscopistas entrenados, la presencia de una entendible curva de aprendizaje puede haber aumentado el riesgo de complicaciones en este estudio 24. Se utilizó la regresión logística para detectar factores asociados al rédito diagnóstico y complicaciones.
Este análisis puede padecer de una falta de poder estadístico debido a su tamaño muestral que puede llevar a un error de tipo 2. Sin embargo, el efecto del número de muestras detectado tiene valor y ha sido informado previamente 12, 18.
La CBTB parece ser una herramienta útil como un primer paso basado en histología en la evaluación de las EPID en un contexto de la vida real en un centro argentino con acceso a EMD. El rédito diagnóstico parece sopesar su riesgo de complicaciones, aunque la preferencia del paciente debe ser considerada. La EMD incrementó significativamente el rédito diagnóstico
de la CBTB.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Raghu G, Remy-Jardin M, Myers JL, et al. Diagnosis of idiopathic pulmonary fibrosis. An official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018; 198: e44-e68.
2. Walsh SLF, Wells AU, Desai SR, et al. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease: a casecohort study. Lancet Respir Med 2016; 4: 557-65.
3. Ryerson CJ, Corte TJ, Lee JS, et al. A standardized diagnostic ontology for fibrotic interstitial lung disease. An International Working Group perspective. Am J Respir Crit Care Med 2017; 196: 1249-54.
4. Jo HE, Glaspole IN, Levin KC, et al. Clinical impact of the interstitial lung disease multidisciplinary service. Respirology 2016; 21: 1438-44.
5. Jo HE, Glaspole I, Grainge C, et al. Baseline characteristics of idiopathic pulmonary fibrosis: analysis from the Australian Idiopathic Pulmonary Fibrosis Registry. Eur Respir J 2017; 49: 1601592.
6. Richeldi L, du Bois RM, Raghu G, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 2071-82.
7. King TE, Jr., Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 2083-92.
8. Lee YC, Wu CT, Hsu HH, et al. Surgical lung biopsy for diffuse pulmonary disease: experience of 196 patients. J Thorac Cardiovasc Surg 2005; 129: 984-90.
9. Bando M, Ohno S, Hosono T, et al. Risk of acute exacerbation after video-assisted thoracoscopic lung biopsy for interstitial lung disease. J Bronchology Interv Pulmonol 2009; 16: 229-35.
10. Samejima J, Tajiri M, Ogura T, et al. Thoracoscopic lung biopsy in 285 patients with diffuse pulmonary disease. Asian Cardiovasc Thorac Ann 2015; 23: 191-7.
11. Sigurdsson MI, Isaksson HJ, Gudmundsson G, Gudbjartsson T. Diagnostic surgical lung biopsies for suspected interstitial lung diseases: a retrospective study. Ann Thorac Surg 2009; 88: 227-32.
12. Ravaglia C, Wells AU, Tomassetti S, et al. Diagnostic yield and risk/benefit analysis of trans-bronchial lung cryobiopsy in diffuse parenchymal lung diseases: a large cohort of 699 patients. BMC Pulm Med 2019; 19: 16.
13. Cho R, Zamora F, Gibson H, Dincer HE. Transbronchial lung cryobiopsy in the diagnosis of interstitial lung disease: a retrospective single-center experience. J Bronchology Interv Pulmonol 2019; 26: 15-21.
14. Du Rand IA, Blaikley J, Booton R, et al. British Thoracic Society guideline for diagnostic flexible bronchoscopy in adults: accredited by NICE. Thorax 2013; 68 Suppl 1: i1-i44.
15. Walscher J, Gross B, Eberhardt R, et al. Transbronchial cryobiopsies for diagnosing interstitial lung disease: reallife experience from a Tertiary Referral Center for Interstitial Lung Disease. Respiration 2019; 97: 348-54.
16. Ussavarungsi K, Kern RM, Roden AC, et al. Transbronchial cryobiopsy in diffuse parenchymal lung disease: retrospective analysis of 74 cases. Chest 2017; 151: 400-8.
17. Lentz RJ, Taylor TM, Kropski JA et al. Utility of flexible bronchoscopic cryobiopsy for diagnosis of diffuse parenchymal lung diseases. J Bronchology Interv Pulmonol 2018; 25: 88-96.
18. Dhooria S, Mehta RM, Srinivasan A, et al. The safety and efficacy of different methods for obtaining transbronchial lung cryobiopsy in diffuse lung diseases. Clin Respir J 2018; 12: 1711-20.
19. Bondue B, Pieters T, Alexander P, et al. Role of transbronchial lung cryobiopsies in diffuse parenchymal lung diseases: interest of a sequential approach. Pulm Med 2017; 2017: 6794343.
20. Maldonado F, Danoff SK, Wells AU, et al. Transbronchial cryobiopsy for the diagnosis of interstitial lung diseases: CHEST Guideline and Expert Panel Report. Chest 2020; 157: 1030-42..
21. Kronborg-White S, Folkersen B, Rasmussen TR, et al. Introduction of cryobiopsies in the diagnostics of interstitial lung diseases – experiences in a referral center. Eur Clin Respir J 2017; 4: 1274099.
22. Marcoa R, Linhas R, Apolinario D, et al. Diagnostic yield of transbronchial lung cryobiopsy in interstitial lung diseases. Rev Port Pneumol 2017; 23: 296-8.
23. Plones T, Osei-Agyemang T, Elze M, et al. Morbidity and mortality in patients with usual interstitial pneumonia (UIP) pattern undergoing surgery for lung biopsy. Respir Med 2013; 107: 629-32.
24. Almeida LM, Lima B, Mota PC, et al. Learning curve for transbronchial lung cryobiopsy in diffuse lung disease. Rev Port Pneumol 2017; S2173-5115(17) 30148-3.