LUCIANA M. DOMÍNGUEZ 1, ESTEBAN J. FIORE 1, GUILLERMO D. MAZZOLINI 1, 2
1 Laboratorio de Terapia Génica y Celular, Instituto de Investigaciones en Medicina Traslacional, Facultad de Ciencias Biomédicas, CONICET-Universidad Austral, 2 Unidad de Hepatología, Hospital Universitario Austral, Universidad Austral, Buenos Aires, Argentina
Resumen La terapia celular y la medicina regenerativa son áreas en gran desarrollo en la investigación biomédica. En la mayoría de los tejidos existen mecanismos de auto-reparación llevados a cabo, principalmente, por células madre o progenitoras residentes con capacidad para diferenciarse y reemplazar a las células dañadas o para secretar factores tróficos que induzcan el proceso regenerativo. Dado que estos mecanismos de reparación no siempre son suficientes, se postula que la terapia celular puede contribuir a la regeneración de los tejidos sometidos a injuria. Las células madre/estromales mesenquimales (MSCs, del inglés Mesenchymal Stem/Stromal Cells) son un tipo de progenitor adulto multipotente, que tienen la capacidad de expandirse in vitro con facilidad cuando son aisladas de su nicho in vivo, migrar selectivamente a los tejidos lesionados, modular y evadir el sistema inmunológico, y secretar factores tróficos que ayudan a la reparación tisular. Asimismo, la fácil manipulación ex vivo permitiría también usarlas como vehículos de genes terapéuticos. Las principales fuentes de obtención son la médula ósea, el tejido adiposo y cordón umbilical. Los numerosos estudios pre-clínicos y clínicos han demostrado que las MSCs parecieran ser seguras tanto para uso autólogo como alogénico. En este trabajo se resumen las propiedades de las MSCs y su potencial terapéutico para una amplia gama de enfermedades, también presentamos los distintos ensayos clínicos avanzados que las posicionan en el ámbito biomédico como una herramienta interesante para la regeneración de tejidos y el tratamiento de enfermedades inflamatorias.
Palabras clave: terapia celular, medicina regenerativa, células madre/estromales mesenquimales
Abstract Cell therapy and regenerative medicine are currently active areas for biomedical research. In most tissues, there are self-repair mechanisms carried out mainly by resident stem cells that can differentiate and replace dead cells or secrete trophic factors that stimulate the regenerative process. These mechanisms often fail in degenerative diseases; thus it is postulated that exogenous cell therapy can contribute to tissue regeneration and repair. Mesenchymal stem cells (MSCs) are multipotent adult stem/progenitor cells, which could be easily expanded in vitro and have the ability to selectively migrate toward injured tissues, evade the immune system recognition, and secrete trophic factors to support tissue repair. Furthermore, MSCs could be engineered for the delivery of therapeutic genes. The main sources for MSCs are bone marrow, adipose tissue, and umbilical cord. A number of pre-clinical and clinical studies have shown that MSCs therapy is safe for both autologous and allogeneic uses. This review summarizes information about the properties of MSCs and their therapeutic potential for a broad spectrum of diseases. We also present here the last data about clinical trials that position the use of MSCs as an interesting tool for tissue regeneration and the treatment of inflammatory diseases.
Key words: cell therapy, regenerative medicine, mesenchymal stem cells
Dirección postal: Guillermo Mazzolini, Laboratorio de Terapia Génica y Celular, Instituto de Investigaciones en Medicina Traslacional, CONICET – Universidad Austral, Av. Presidente Perón 1500, 1629 Derqui-Pilar, Buenos Aires, Argentina
e-mail: gmazzoli@austral.edu.ar
• La terapia celular y la medicina regenerativa son áreas en gran desarrollo en la investigación biomédica. El uso de células madre/estromales mesenquimales (MSCs) ha mostrado un fuerte desarrollo en los últimos años ya que superan gran parte de las limitaciones de otros tipos celulares y tienen un gran potencial terapéutico.
• Este trabajo resume las propiedades de las MSCs, su potencial terapéutico como herramienta para la regeneración de tejidos y el tratamiento de enfermedades inflamatorias, y los distintos ensayos clínicos avanzados que en la actualidad se encuentran utilizando células madre de distintos tipos.
En los últimos años la investigación biomédica ha avanzado en el estudio de las terapias celulares y su uso en medicina regenerativa 1. Estos avances buscan reparar órganos y tejidos enfermos mediante la administración de células o moléculas biológicamente activas 2.
Se han propuesto diferentes tipos y fuentes celulares con potencial terapéutico para tratar diversas enfermedades.
Particularmente, la utilización de células madre/estromales mesenquimales (MSCs del inglés Mesenchymal stem/stromal cells ) como fuente de células para terapia celular y regenerativa, ha mostrado un fuerte desarrollo en los últimos años 3.
En esta revisión abarcaremos las distintas terapias con células que se encuentran en estudio para su futuro uso en medicina regenerativa. Principalmente, nos enfocamos en la potencialidad de las MSCs y presentamos los distintos ensayos clínicos avanzados que las posicionan en el ámbito biomédico como una herramienta interesante para la regeneración de tejidos y el tratamiento de enfermedades inflamatorias. Para ello realizamos una búsqueda exhaustiva de artículos científicos originales y revisiones en revistas nacionales e internacionales y utilizamos la base de datos www.clinicaltrials.gov para determinar el número de ensayos clínicos donde utilizan MSCs como terapia.
Terapia celular y medicina regenerativa
La terapia celular y la medicina regenerativa se han convertido en áreas relevantes de investigación biomédica en los últimos años 1. La medicina regenerativa tiene como objetivo reparar órganos y tejidos enfermos o dañados y abarca el empleo de diversas estrategias que incluyen desde la administración de moléculas biológicamente activas (proteínas y microARN) hasta la implantación de células aisladas de tejidos adultos que pueden dar lugar a la regeneración estructural del tejido u órgano afectado 2,4.
Por otro lado, la terapia celular incluye la aplicación tanto de células somáticas o adultas, como de progenitores, así como también de células modificadas genéticamente para facilitar la regeneración de células dañadas dentro de un órgano o tejido 5, 6.
En la mayoría de los tejidos existen mecanismos de auto-reparación llevados a cabo, principalmente, por células madre o progenitores residentes que pueden diferenciarse y reemplazar a las células dañadas, o secretar factores tróficos que induzcan el proceso regenerativo.
La característica principal de este tipo de células es la capacidad de dividirse a nivel clonal mientras mantiene un estado indiferenciado como así también de diferenciarse en uno o más tipos de células especializadas. Dado que en diversos procesos patológicos estos mecanismos de reparación no son suficientes, se postula que la terapia celular puede contribuir a la regeneración de los tejidos 7.
Muchos de los tratamientos actuales para la mayoría de las enfermedades degenerativas son paliativos o solo retrasan el progreso de la enfermedad, esto nos lleva a pensar que un enfoque combinado entre terapia celular y medicina regenerativa constituyen una alternativa prometedora que incida positivamente en el inicio y progresión de la enfermedad 5.
El trasplante de células madre hematopoyéticas (HSCs, del inglés Hematopoietic Stem Cells) para el tratamiento de neoplasias malignas de la médula ósea (MO), fue la primera terapia celular que se utilizó en la práctica clínica y desde su aprobación, se han empleado con éxito durante más de 50 años 8. Si bien hasta la actualidad este tipo de terapia con células progenitoras ha sido el único adoptado de forma rutinaria en la práctica clínica, ha alentado a médicos y científicos a desarrollar el área de estudio.
Se han propuesto diferentes tipos y fuentes de células madre para su potencial aplicación terapéutica 9, 10.
– Células madre embrionarias: se obtienen de la masa celular interna de embriones no utilizados. Son células pluripotentes que tienen una combinación única de genes de histocompatibilidad, heredados del espermatozoide y el óvulo, por lo que serían rechazadas en un trasplante alogénico histoincompatible 11-13.
– Células VSEL (del inglés, Very Small Embryonic-Like stem cells): son una población de células progenitoras con características pluripotentes que derivan de células germinales y pueden ser aisladas de tejido adulto. Además, expresan marcadores embrionarios, se depositan en los órganos en desarrollo durante la embriogénesis y desempeñan un papel como población de respaldo para las células madre comprometidas a un determinado tejido 14.
– Células madre pluripotentes inducidas (iPSC, del inglés, induced Pluripotent Stem Cells): se obtienen a partir de la reprogramación de células somáticas adultas mediante la expresión de los genes de pluripotencia Oct4, Sox2, c-Myc y Klf415. Las mismas pueden diferenciarse a células de tejidos pertenecientes a las tres capas germinales del embrión 15, 16. Esta tecnología permitió obtener células pluripotentes que son histoidénticas con la célula donante inicial utilizada para la reprogramación 17.
Todas estas células se encuentran en incesante estudio pero su potencial aplicación en la clínica presenta algunos problemas, como por ejemplo: formación de teratomas de las iPSC (lo que explica por qué se suspendieron los primeros ensayos clínicos que utilizaron estas células)18-20; cuestionamientos éticos en el caso de las células aisladas de embriones humanos; tumorigenicidad debido a la inestabilidad genómica en el caso de las VSEL; como así también la posibilidad de rechazo inmunológico en caso de uso alogénico 18, 21, 22. Actualmente, la principal aplicación de las iPSCs es para el modelado in vitro de enfermedades y para el testeo de fármacos 23-25.
En este contexto, la utilización de MSCs como fuente de células para terapia celular y regenerativa ha mostrado un fuerte desarrollo en los últimos años 3. Las MSCs son un tipo de célula progenitora adulta que supera la mayoría de las limitaciones descriptas para las células madre pluripotentes y que se han probado ampliamente en estudios preclínicos y clínicos con resultados prometedores en diversas enfermedades 5, 26, 27.
Células madre mesenquimales
En los organismos que se reproducen sexualmente, el desarrollo comienza a partir del cigoto formado luego de la unión de los gametos haploides femenino y masculino 2. Este cigoto totipotente tiene el potencial de dividirse y diferenciarse para generar todas las células especializadas del cuerpo humano adulto 28, 29. Durante la embriogénesis, las células madre pluripotentes dan lugar a las tres capas germinales (meso, ecto y endodermo) que van a desarrollar los distintos tejidos y órganos.
Asimismo, en cada tejido adulto existe una población de especializada de ellas y responsable del reemplazo de células senescentes o de las que mueren producto de una injuria 2, 30. Dentro de este último nivel jerárquico existe una población de progenitores que residen en el estroma de prácticamente todos los tejidos, denominadas células madre/estromales mesenquimales (MSCs), las mismas tienen como rol fisiológico el soporte trófico de los tejidos durante la reparación y regeneración tisular 31.
Las MSCs son multipotentes debido a que tienen la capacidad de diferenciarse a osteocitos, adipocitos y condrocitos, además pueden expandirse in vitro como cultivos adherentes y están fenotípicamente bien descriptas, expresando CD29, CD73, CD90 y CD105, mientras que son negativas para marcadores hematopoyéticos como CD14, CD34 y CD45 32, 33. Entre otras características importantes, las MSCs tienen la capacidad de autorrenovarse in vitro de forma estable por varios pasajes, de modular el sistema inmunológico, secretar factores tróficos y migrar selectivamente a los tejidos lesionados 34, 35, 36. Por esta razón, sumado al potencial de diferenciación, están siendo exploradas desde el punto de vista terapéutico para regenerar tejidos u órganos dañados. Asimismo, la fácil manipulación ex vivo permite también usarlas como vehículos de genes terapéuticos 36. Las principales fuentes para obtener MSCs de uso clínico son la médula ósea, el tejido adiposo y tejidos asociados con el nacimiento como placenta, amnios y cordón umbilical 26, 37.
Células madre/estromales mesenquimales como herramienta terapéutica
Desde su descripción y aislamiento en los años 70, numerosos estudios pre-clínicos y clínicos han demostrado que las MSCs parecieran ser seguras tanto para uso autólogo como alogénico, además, son fáciles de aislar y crecer in vitro en número suficiente para las dosis que suelen aplicarse en pacientes 27, 38-41.
Si bien en un principio se pensaba que la capacidad de diferenciación era el mecanismo principal para promover la regeneración tisular, actualmente existe un consenso general que indica que los efectos terapéuticos de las MSCs son una consecuencia de las moléculas biológicamente activas secretadas en forma soluble o a través de vesículas extracelulares (VEs) 42-44. Los factores secretados de forma soluble entre los que se encuentran HGF, IGF-I, IL-6, BNDF y NGF, tienen actividad anti-apoptótica y proliferativa; otros, como SDF-1, VEGF y PDGF tienen capacidad de inducir el proceso de neo-vascularización; y algunos actúan regulando el sistema inmunitario como IL- 10, TGF-b1, IDO-1, ILRa1 y PGE2 45. Por otro lado, las VEs son estructuras que emergen de la membrana plasmática y son generadas a partir de cuerpos multivesiculares. Tienen un diámetro entre 40 nm a 2 μm y están involucradas en la comunicación intercelular transportando una gran cantidad de proteínas (incluidos factores de crecimiento y citocinas), ADN, ARNm, microARN y ARNlnc 46, 47. En particular, los exosomas son las VEs de mayor interés y se las diferencia por su tamaño (comprendido entre 40-100 nm)47, 48. Las EVs pueden aislarse a partir del sobrenadante de cultivo celular, y dado que imitan en parte los efectos de las células de origen, aquellas derivadas de MSCs son consideradas una nueva alternativa terapéutica y un área activa de investigación en medicina regenerativa y nanotecnología 48-50.
Otra propiedad atractiva de las MSCs para la aplicación clínica es su empleo en el marco del trasplante alogénico.
Debido a que expresan bajos niveles de moléculas de HLA de clase I, no expresan moléculas de HLA de clase II y moléculas co-estimulatorias como B7-1, B7-2, CD40, o CD40 ligando, evita que sean reconocidas por linfocitos T y logran evadir la respuesta inmunitaria 51-53. Además, como se mencionó previamente, secretan citocinas con efectos inmunosupresores sobre células de la inmunidad innata y adaptativa 54, 55. Asimismo, la plasticidad funcional de las MSCs al sensar el microambiente inflamatorio en que se encuentra, es otra característica importante para su aplicación terapéutica 56. En este sentido, si el microambiente es levemente inflamatorio, estas células pueden tener un comportamiento pro-inflamatorio. Sin embargo, en un contexto altamente inflamatorio, desempeñan un importante efecto inmunoregulador 56. Esta característica es también explotada para modular su perfil funcional a través de la generación de condiciones especiales de cultivo in vitro; por ejemplo, la pre-incubación con TGF-β1 reduce su capacidad inmunosupresora 57, mientras que la incubación con INF-γ, TNF-α e IL-17 la aumenta 58.
Finalmente, debido a la capacidad de migrar a sitios de inflamación e injuria, otra potencial aplicación de las MSCs en medicina regenerativa es como vehículo de genes y factores terapéuticos 35, 36, 50, 59. Para esto, se puede inducir la sobre-expresión de genes mediante vectores virales o no virales, como así también cargarlas con ARNm o microARN mediante transfección y su posterior administración sistémica 59. Un ejemplo es el uso de MSCs modificadas genéticamente para sobreexpresar el factor de crecimiento insulínico tipo I (IGF-I) para el tratamiento de la fibrosis hepática en modelos experimentales animales 6, 50.
Las múltiples propiedades de las MSCs subrayan su potencial terapéutico en la regeneración de tejidos y el tratamiento de enfermedades inflamatorias. No obstante, es necesario generar más información acerca de los mecanismos involucrados en la regeneración tisular, la fuente óptima para aislarlas, los efectos que ejercen las distintas condiciones de cultivo en el potencial terapéutico y migratorio 60. A pesar de las preguntas abiertas que aún quedan por responder, estamos observando un aumento significativo en la investigación clínica de estas células para la regeneración de tejidos o para contribuir con la resolución de procesos inflamatorios 26, 61.
Ensayos clínicos con células madre mesenquimales
La aplicación de MSCs en un ensayo clínico en humanos se aprobó por primera vez en 1995 62. Desde entonces, la investigación clínica de MSCs tanto en el ámbito académico como de la industria farmacéutica se ha desarrollado en forma continua. En la actualidad, según la base de datos “clinicaltrials.gov”, hay 7661 ensayos clínicos donde se utilizan células madre de distintos tipos, de los cuales 1029 implican el uso de MSCs. Las principales fuentes de estas células son la médula ósea, el tejido adiposo y el cordón umbilical, siendo estas las más estudiadas en los últimos años (https://celltrials.org/public-cells-data/msc-trials-2011-2018/65). Entre las enfermedades estudiadas se destacan las cardiovasculares, neurodegenerativas, autoinmunes, trastornos músculo-esqueléticos y articulares, vasculares, hematológicas, oftalmológicas, hepáticas, renales, pulmonares, de la piel, entre otras.
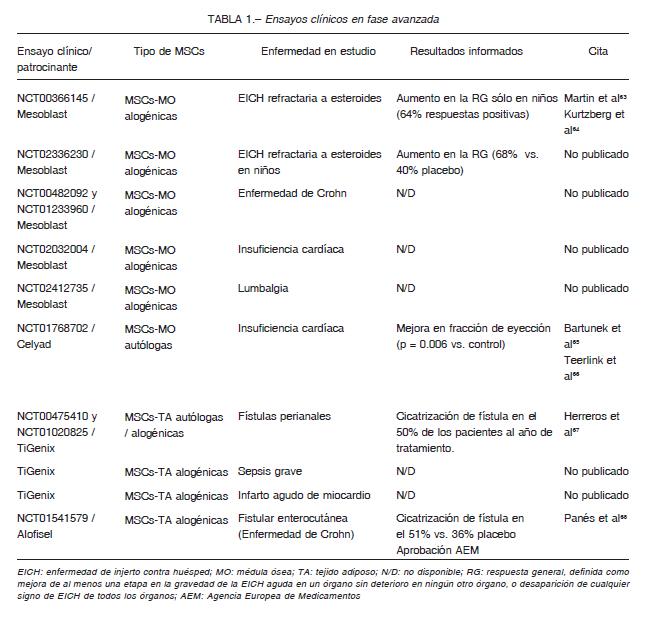
De todos estos ensayos, solo 21 se encuentran en un estadio avanzado de estudio (fase III) y, de éstos, sólo 7 han reportado resultados finales (Tabla 1) (Clinicaltrials.gov: -Stem cell/Stem cell mesenchymal/Phase III/Completed-).
En este sentido, el primer gran ensayo de fase III con MSCs de médula ósea patrocinado por la compañía farmacéutica Mesoblast (en su momento Prochymal) fue para el tratamiento de la enfermedad injerto contra huésped (EICH) refractaria a esteroides (NCT00366145). Este ensayo se completó en 2009 y los resultados mostraron una mejora significativa en la respuesta general sólo en niños, lo cual permitió aprobar la primera terapia con MSCs para el tratamiento de EICH pediátrico en Canadá y Japón. Posteriormente, Mesoblast lanzó un segundo ensayo (NCT02336230) finalizado en 2018, donde se evaluó el uso de MSCs alogénicas en niños con EICH refractaria a esteroides y también pudo observarse una mejora significativa en la respuesta general 27, 63, 64. Actualmente, esta terapia se encuentra en fase de registro en la Administración de Drogas y Alimentos (FDA) en los Estados Unidos. Asimismo, Mesoblast en este momento tiene tratamientos en fase III para la enfermedad de Crohn (NCT00482092), insuficiencia cardíaca crónica (NCT02032004), lumbalgia cronica (NCT02412735), y más recientemente, síndrome respiratorio agudo grave causado por infección con coronavirus-19 donde los resultados obtenidos muestran una mejora en la función respiratoria de los pacientes que recibieron MSCs contra placebo (http://investorsmedia.mesoblast.com/static-files/f7c1b407-e130-4190-9283-620e0fe621a5). Por otro lado, MSC autólogas de MO previamente acondicionadas in vitro para inducir regeneración cardíaca también han sido probadas en un ensayo de fase III por Celyad (Bélgica) para el tratamiento de la insuficiencia cardíaca crónica (NCT01768702) 65, 66. De forma similar, TiGenix patrocinó dos estudios con MSCs autólogas (NCT00475410) 67 y alogénicas (NCT01541579) 68 derivadas de tejido adiposo (ASC) para el tratamiento de fístulas perianales complejas en pacientes sin enfermedad inflamatoria intestinal (Tabla 1).
En ambos casos, independientemente del origen de las ASC, los que recibieron el tratamiento tuvieron remisiones significativas de las fístulas respecto al placebo. Finalmente, la Comisión Europea aprobó el primer agente farmacéutico de MSCs (Alofisel) para tratar la enfermedad fistular enterocutánea relacionada con enfermedad de Crohn 69, 70. Actualmente, además de estos estudios clínicos, TiGenix cuenta con 3 ensayos activos en fase III aplicados a enfermedad de Crohn, sepsis grave e infarto agudo de miocardio.
Conclusiones y perspectivas
Los tipos de células más relevantes estudiados como terapias celulares incluyen células adultas como MSCs, HSCs o embrionarias como VSEL e iPSCs. Las MSCs superan gran parte de las limitaciones de los otros tipos celulares y tienen un gran potencial terapéutico dado su efecto parácrino mediado por la secreción de múltiples factores, su capacidad migratoria hacia los sitios de lesión y sus propiedades inmunomoduladoras. A pesar de los avances científicos alcanzados en el área, solo un número muy limitado de aplicaciones ha llegado al mercado y están, por ende, al alcance del paciente.
La falta de procedimientos estandarizados, junto con los problemas de regulación y seguridad, presentan un obstáculo importante en la maduración de la terapia con MSCs. No hay duda de que las terapias celulares son parte del futuro de la medicina clínica pero antes de que ello sea posible, se requieren definir protocolos estandarizados para el aislamiento, manipulación, expansión in vitro y administración. Por último son necesarios estudios pre-clínicos y clínicos a gran escala que incluyan series extensas de casos generando información clínica sólida acerca del uso de las MSCs.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Suman S, Domingues A, Ratajczak J, et al. Potential clinical applications of stem cells in regenerative medicine. Adv Exp Med Biol 2019; 1201: 1-22.
2. Ratajczak MZ, Bujko K, Wojakowski W. Stem cells and clinical practice: New advances and challenges at the time of emerging problems with induced pluripotent stem cell therapies. Pol Arch Intern Med 2016; 126: 879-90.
3. Han Y, Li X, Zhang Y, et al. Mesenchymal Stem Cells for Regenerative Medicine. Cells 2019; 8: 886.
4. Liu S, Zhou J, Zhang X, et al. Strategies to optimize adult stem cell therapy for tissue regeneration. Int J Mol Sci 2016; 17: 982.
5. Buzhor E, Leshansky L, Blumenthal J, et al. Cell-based therapy approaches: The hope for incurable diseases. Regen Med 2014; 9: 649-72.
6. Fiore EJ, Bayo JM, Garcia MG, et al. Mesenchymal stromal cells engineered to produce IGF-I by recombinant adenovirus ameliorate liver fibrosis in mice. Stem Cells Dev 2015; 24: 791-801.
7. Blau HM, Brazelton TR, Weimann JM. The evolving concept of a stem cell: Entity or function? Cell 2001; 105: 829-41.
8. Kumar B, Madabushi SS. Identification and isolation of mice and human hematopoietic stem cells. Methods Mol Biol 2018, 1842: 55-68.
9. Mills JC, Stanger BZ, Sander M. Nomenclature for cellular plasticity: are the terms as plastic as the cells themselves? EMBO J 2019; 38: 1-5.
10. Kopp JL, Grompe M, Sander M. Stem cells versus plasticity in liver and pancreas regeneration. Nat Cell Biol 2016; 18: 238-45.
11. Carpenter MK, Rao MS. Concise Review: Making and using clinically compliant pluripotent stem cell lines. Stem Cells Transl Med 2015; 4: 381-8.
12. English K, Wood KJ. Immunogenicity of embryonic stem cell-derived progenitors after transplantation. Curr Opin Organ Transplant 2011; 16: 90-5.
13. O. Manilay J, L. Thompson H. Embryonic stem cellderived hematopoietic stem cells: Challenges in development, differentiation, and immunogenicity. Curr Top Med Chem 2011; 11: 1621-37.
14. Ratajczak MZ, Marycz K, Poniewierska-Baran A, et al. Very small embryonic-like stem cells as a novel developmental concept and the hierarchy of the stem cell compartment. Adv Med Sci 2014; 59: 273-80.
15. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006; 126: 663-76.
16. Wernig M, Meissner A, Foreman R, et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature 2007; 448: 318-24.
17. Villa-Diaz LG, Ross AM, Lahann J, et al. Concise review: The evolution of human pluripotent stem cell culture: From feeder cells to synthetic coatings. Stem Cells 2013; 31: 1-7.
18. Garber K. RIKEN suspends first clinical trial involving induced pluripotent stem cells. Nat Biotechnol 2015; 33: 890-1.
19. Yoshihara M, Hayashizaki Y, Murakawa Y. Genomic instability of iPSCs: Challenges towards their clinical applications. Stem Cell Rev Rep 2017; 13: 7-16.
20. Liang G, Zhang Y. Genetic and epigenetic variations in iPSCs: Potential causes and implications for application. Cell Stem Cell 2013; 13: 149-59.
21. Tapia N, Schöler HR. Molecular obstacles to clinical translation of iPSCs. Cell Stem Cell 2016; 19: 298-309.
22. Walia B, Satija N, Tripathi RP, et al. Induced pluripotent stem cells: Fundamentals and applications of the reprogramming process and its ramifications on regenerative medicine. Stem Cell Rev Rep 2012; 8: 100-15.
23. Bellin M, Marchetto MC, Gage FH, et al. Induced pluripotent stem cells: The new patient? Nat Rev Mol Cell Biol 2012; 13: 713-26.
24. Paik DT, Chandy M, Wu JC. Patient and disease-specific induced pluripotent stem cells for discovery of personalized cardiovascular drugs and therapeutics. Pharmacol Rev 2020; 72: 320-42.
25. Hung SSC, Khan S, Lo CY, et al. Drug discovery using induced pluripotent stem cell models of neurodegenerative and ocular diseases. Pharmacol Ther 2017; 177: 32-43.
26. Pittenger MF, Discher DE, Péault BM, et al. Mesenchymal stem cell perspective: cell biology to clinical progress. npj Regen Med 2019; 4: 22.
27. Galipeau J, Sensébé L. Mesenchymal Stromal Cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell 2018; 22: 824-33.
28. Mitalipov S, Wolf D. Totipotency, pluripotency and nuclear reprogramming. Adv Biochem Eng Biotechnol 2009; 114: 185-99.
29. Condic ML. Totipotency: What it is and what it is not. Stem Cells Dev 2014; 23: 796-812.
30. Musarò A, Giacinti C, Pelosi L, et al. Stem cell-mediated muscle regeneration and repair in aging and neuromuscular diseases. Eur J Histochem 2007; 51: 35-44.
31. Visvader JE, Clevers H. Tissue-specific designs of stem cell hierarchies. Nat Cell Biol 2016; 18: 349-55.
32. Lv FJ, Tuan RS, Cheung KMC, et al. Concise review: The surface markers and identity of human mesenchymal stem cells. Stem Cells 2014; 32: 1408-19.
33. Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 2006; 8: 315-7.
34. Nauta AJ, Fibbe WE. Immunomodulatory properties of mesenchymal stromal cells. Blood 2007; 110: 3499-506.
35. Bayo J, Marrodán M, Aquino JB, et al. The therapeutic potential of bone marrow-derived mesenchymal stromal cells on hepatocellular carcinoma. Liver Int 2014; 34: 330-42.
36. Fiore EJ, Mazzolini G, Aquino JB. Mesenchymal stem/stromal cells in liver fibrosis: Recent findings, old/new caveats and future perspectives. Stem Cell Rev Rep 2015; 11: 586-97.
37. Hass R, Kasper C, Böhm S, et al. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. J cell commun signal 2011; 9: 12.
38. Mushahary D, Spittler A, Kasper C, et al. Isolation, cultivation, and characterization of human mesenchymal stem cells. Cytometry Part A 2018; 93: 19-31.
39. Mahla RS. Stem cells applications in regenerative medicine and disease therapeutics. Int J Cell Biol 2016; 2016: 1-24.
40. De Miguel MP, Prieto I, Moratilla A, et al. Mesenchymal stem cells for liver regeneration in liver failure: From experimental models to clinical trials. Stem Cells Intl 2019; 2019: 1-12.
41. Wu LJ, Chen ZY, Wang Y, et al. Organoids of liver diseases: From bench to bedside. World J Gastroenterol 2019; 25: 1913-27.
42. Ratajczak MZ, Ratajczak J. Extracellular microvesicles as game changers in better understanding the complexity of cellular interactions—From bench to clinical applications. Am J Med Sci 2017; 354: 449-52.
43. Fiore EJ, Domínguez LM, Bayo J, et al. Taking advantage of the potential of mesenchymal stromal cells in liver regeneration: Cells and extracellular vesicles as therapeutic strategies. World J Gastroenterol 2018; 24: 2427-40.
44. Kusuma GD, Carthew J, Lim R, et al. Effect of the microenvironment on mesenchymal stem cell paracrine signaling: Opportunities to engineer the therapeutic effect. Stem Cells Dev 2017; 26: 617-31.
45. Harrell CR, Fellabaum C, Jovicic N, et al. Molecular mechanisms responsible for therapeutic potential of mesenchymal stem cell-derived secretome. Cells 2019; 8: 467.
46. Théry C, Zitvogel L, Amigorena S. Exosomes: Composition, biogenesis and function. Nat Rev Immunol 2002; 2: 569-79.
47. Lötvall J, Hill AF, Hochberg F, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. J Extracell Vesicles 2014; 3: 26913.
48. Ha D, Yang N, Nadithe V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges. Acta Pharm Sin B 2016; 6: 287-96.
49. Armstrong JPK, Holme MN, Stevens MM. Re-Engineering extracellular vesicles as smart nanoscale therapeutics. ACS Nano 2017; 11: 69-83.
50. Fiore E, Domínguez LM, Bayo J, et al. Human umbilical cord perivascular cells-derived extracellular vesicles mediate the transfer of IGF-I to the liver and ameliorate hepatic fibrogenesis in mice. Gene Ther 2020; 27: 62-73.
51. Prockop DJ, Youn Oh J. Mesenchymal stem/stromal cells (MSCs): Role as guardians of inflammation. Mol Ther 2012; 20: 14-20.
52. Le Blanc K, Ringdén O. Immunomodulation by mesenchymal stem cells and clinical experience. J Intern Med 2007; 262: 509-25.
53. Le Blanc K, Samuelsson H, Lönnies L, et al. Generation of immunosuppressive mesenchymal stem cells in allogeneic human serum. Transplantation 2007; 84: 1055-9.
54. Ullah I, Subbarao RB, Rho GJ. Human mesenchymal stem cells – Current trends and future prospective. Biosci Rep 2015; 35: 1-18.
55. P. De Miguel M, Fuentes-Julian S, Blazquez-Martinez A, et al. Immunosuppressive properties of mesenchymal stem cells: Advances and applications. Curr Mol Med 2012; 12: 574-91.
56. Wang Y, Chen X, Cao W, et al. Plasticity of mesenchymal stem cells in immunomodulation: Pathological and therapeutic implications. Nat Immunol 2014; 15: 1009-16.
57. Xu C, Yu P, Han X, et al. TGF-β promotes immune responses in the presence of mesenchymalstem cells. J Immunol 2014; 192: 103-9.
58. Han X, Yang Q, Lin L, et al. Interleukin-17 enhances immunosuppression by mesenchymal stem cells. Cell Death Differ 2014; 21: 1758-68.
59. Krueger TEG, Thorek DLJ, Denmeade SR, et al. Concise Review: Mesenchymal stem cell-based drug delivery: The Good, the Bad, the Ugly, and the Promise. Stem Cells Transl Med 2018; 7: 651-63.
60. Hoogduijn MJ, Betjes MGH, Baan CC. Mesenchymal stromal cells for organ transplantation: Different sources and unique characteristics? Curr Opin Organ Transplant 2014; 19: 41-6.
61. Wei X, Yang X, Han ZP, et al. Mesenchymal stem cells: A new trend for cell therapy. Acta Pharmacol Sin 2013; 34: 747-54.
62. Lazarus HM, Haynesworth SE, Gerson SL, et al. Ex vivo expansion and subsequent infusion of human bone marrow-derived stromal progenitor cells (mesenchymal progenitor cells): Implications for therapeutic use. Bone Marrow Transplant 1995; 16: 557-64.
63. Martin PJ, Uberti JP, Soiffer RJ, et al. Prochymal improves response rates in patients with steroid-refractory acute graft versus host disease (SR-GVHD) involving the liver and gut: Results Of A Randomized, Placebo-Controlled, Multicenter Phase III Trial In GVHD. Biol Blood Marrow Transplant 2010; 16: S169-70.
64. Kurtzberg J, Prasad V, Grimley MS, et al. Allogeneic human mesenchymal stem cell therapy (Prochymal®) as a rescue agent for severe treatment resistant GVHD in pediatric patients. Biol Blood Marrow Transplant 2010; 16: S169.
65. Bartunek J, Behfar A, Dolatabadi D, et al. Cardiopoietic stem cell therapy in heart failure: The C-CURE (cardiopoietic stem cell therapy in heart failURE) multicenter randomized trial with lineage-specified biologics. J Am Coll Cardiol 2013; 61: 2329-38.
66. Bartunek J, Davison B, Sherman W, et al. Congestive Heart Failure Cardiopoietic Regenerative Therapy (CHART-1) trial design. Eur J Heart Fail 2016; 18: 160-8.
67. Herreros MD, Garcia-Arranz M, Guadalajara H, et al. Autologous expanded adipose-derived stem cells for the treatment of complex cryptoglandular perianal fistulas: A phase III randomized clinical trial (FATT 1: Fistula advanced therapy trial 1) and long-term evaluation. Dis Colon Rectum 2012; 55: 762-72.
68. Panés J, García-Olmo D, Van Assche G, et al. Long-term efficacy and safety of stem cell therapy (Cx601) for complex perianal fistulas in patients with Crohn’s Disease. Gastroenterology 2018; 154: 1334-42.
69. Phinney DG, Galipeau J, Krampera M, et al. MSCs: Science and trials. Nat Med 2013; 19: 812.
70. Galipeau J. The mesenchymal stromal cells dilemma-does a negative phase III trial of random donor mesenchymal stromal cells in steroid-resistant graft-versus-host disease represent a death knell or a bump in the road? Cytotherapy 2013; 15: 2-8.
