LUCRECIA M. BURGOS 1, CRISTHIAN E. SCATULARO 1, IGNACIO M. CIGALINI 1, JUAN C. JAUREGUI 1, MAICO I. BERNAL 1, JOSÉ M. BONORINO 1, JORGE THIERER 1, EZEQUIEL J. ZAIDEL 1
1 En representación del Consejo Argentino de Residentes de Cardiología, Argentina
Resumen Se han desarrollado modelos pronósticos para guiar el tratamiento del tromboembolismo pulmonar agudo (TEP), entre ellos el Pulmonary Embolism Severity Index (PESI) y PESI simplificado (sPESI), los cuales no han sido validados en nuestro país. El objetivo fue evaluar la capacidad de los puntajes de riesgo PESI y sPESI para predecir mortalidad hospitalaria en pacientes con TEP en Argentina. Analizamos una base de datos de 75 centros académicos de Argentina que incluyeron pacientes consecutivos con TEP desde el 2016 al 2017. Las puntuaciones se calcularon de forma prospectiva y se evaluó la mortalidad hospitalaria y a 30 días. La validación de los modelos se realizó a través de discriminación mediante área bajo la curva ROC (AUC) y calibración con la prueba de Hosmer-Lemeshow (HL). La cohorte total incluyó 684 pacientes. La mortalidad hospitalaria fue 12% y a los 30 días se registró un 3.2% adicional de mortalidad. El AUC (IC 95%) para la mortalidad hospitalaria fue de 0.75 (0.69-0.81) para PESI y 0.77 (0.71-0.82) para sPESI (p = 0.25 entre puntajes). El AUC de mortalidad a los 30 días fue de 0.75 (0.68-0.8) y 0.78 (0.74-0.83) para PESI y sPESI (p = 0.2 entre puntajes). Ambos modelos presentaron buena calibración y demostraron un desempeño similar para predecir mortalidad hospitalaria y a 30 días, por lo que pueden establecerse como herramientas de predicción simples para pacientes con TEP en Argentina.
Palabras clave: tromboembolismo pulmonar, pronóstico, mortalidad, Argentina
Abstract Prognostic models have been developed to help make decisions in the treatment of pulmonary embolism (PE). Among them, the Pulmonary Embolism Severity Index (PESI) and simplified PESI (sPESI), however they have not been validated in our setting. The objective was to evaluate PESI and sPESI scores ability to predict in-hospital mortality in patients with PE in Argentina. We analyzed a database of 75 academic centers in Argentina that included consecutive patients with PE from 2016 to 2017. The scores were prospectively calculated, and in-hospital and 30 days mortality were assessed. The validation of the models was assessed through discrimination using the area under the ROC curve (AUC), and calibration with the Hosmer-Lemeshow (HL) test. The cohort included 684 patients. In-hospital mortality was 12% and at 30 days an additional 3.2% mortality was registered. The AUC (95% CI) for in-hospital mortality was 0.75 (0.69-0.81) for PESI and 0.77 (0.71-0.82) for sPESI (p = 0.2 between scores). AUC of 30-day mortality 0.75 (0.68-0.8) and 0.78 (0.74-0.83) for PESI and sPESI (p = 0.2 between scores). Both models presented good calibration. The PESI and sPESI risk scores demonstrated similar performance and good accuracy in predicting hospital and 30-day mortality. Both scores can be established as simple prediction tools for PE patients in Argentina.
Key words: pulmonary embolism, prognosis, mortality, Argentina
Dirección postal: Lucrecia M. Burgos, Sociedad Argentina de Cardiología, Azcuénaga 980, 1115 Buenos Aires, Argentina
e-mail: conarecoficial@gmail.com
Conocimiento actual
• Se han desarrollado modelos pronósticos para guiar el tratamiento del tromboembolismo pulmonar agudo (TEP), entre ellos el Pulmonary Embolism Severity Index (PESI) y PESI simplificado (sPESI), los cuales no han sido validados en nuestro país a pesar de su amplia difusión y aplicación clínica diaria en el tratamiento del TEP.
Contribución del artículo al conocimiento actual
• A partir de una gran cohorte de pacientes con TEP, se calcularon prospectivamente las puntuaciones de riesgo PESI y sPESI, presentando buena calibración y demostraron un desempeño similar para predecir mortalidad hospitalaria y a 30 días; por lo que pueden establecerse como herramientas simples de predicción para pacientes con TEP en Argentina.
La enfermedad tromboembólica venosa (ETV), incluidos el tromboembolismo pulmonar (TEP) agudo y la trombosis venosa profunda (TVP), constituye la tercera enfermedad cardiovascular más frecuente en Europa 1, con una incidencia anual de 60-70 casos por cada 100 000 habitantes 2-4. Se considera la tercera causa de muerte cardiovascular después del infarto agudo de miocardio (IAM) y el accidente cerebrovascular (ACV), la principal causa de muerte intrahospitalaria de etiología desconocida, y una de las principales durante el embarazo y puerperio 5: la mortalidad oscila entre el 8.7% y 17.4% a los 3 meses 6, 7.
El diagnóstico precoz y la estratificación de riesgo en pacientes con TEP son claves para seleccionar el tratamiento adecuado 8, 9. El TEP de riesgo bajo representa a la mayoría de los pacientes, con una baja mortalidad por lo que una estrategia conservadora con anticoagulación y egreso hospitalario precoz parece razonable 8-11. Sin embargo el TEP presenta un amplio rango de mortalidad, dado que incluye pacientes con alguna variable menor de pronóstico adverso y aquellos con inestabilidad hemodinámica incipiente, shock inminente o la suma de variables de riesgo o comorbilidades, escenario en que podría considerarse el tratamiento de reperfusión si el riesgo de sangrado no es elevado. En este sentido se vuelve imperioso contar con herramientas que mejoren la estratificación de riesgo 8, 9, 12.
Diferentes datos clínicos, electrocardiográficos, tomográficos, ecocardiográficos y bioquímicos son predictores de mortalidad en TEP 8, 12. En base a ellos se han desarrollado modelos de estratificación de riesgo 13, el puntaje del índice de gravedad de la embolia pulmonar (PESI) es el más ampliamente validado14, y además se ha desarrollado una versión simplificada del puntaje PESI (sPESI), con una precisión pronóstica similar15. Estas herramientas han sido validadas con éxito en muestras poblacionales de diferentes países 14-20, pero no aún en nuestro medio a pesar de su amplia difusión y aplicación clínica diaria en el tratamiento del TEP 8.
De esta manera, el objetivo del presente trabajo fue validar las escalas de riesgo PESI y sPESI para predecir mortalidad global hospitalaria en pacientes con TEP en la República Argentina.
Materiales y métodos
Se realizó un análisis preespecificado del registro “Tromboembolismo pulmonar agudo en la Argentina, CONAREC XX” 21, un estudio observacional que incluyó en forma prospectiva pacientes con episodio de TEP agudo admitidos en centros con residencia de cardiología afiliados al Consejo Argentino de Residentes de Cardiología (CONAREC), independientemente de si esta fuera la causa de internación o surgiera como complicación de hospitalización por otra causa.
Se incluyeron pacientes hospitalizados en la unidad coronaria, la unidad de terapia intensiva o la sala de internación general entre octubre 2016 y noviembre 2017. No se emitieron algoritmos de diagnóstico o guías para la atención de pacientes a los centros participantes.
La carga de datos se realizó en un formulario electrónico de informe de casos con acceso exclusivo para cada centro a través de una clave individual. Los miembros del comité de investigadores, expertos colaboradores y centros participantes junto con sus responsables se encuentran detallados dentro del material suplementario. Según fue pre-especificado en el protocolo 21, un comité independiente realizó auditoría cruzada al 20% de los centros seleccionados al azar, en donde se cotejaron variables aleatorias de la información remitida con la de las historias clínicas de las instituciones. Se envió el protocolo del estudio y consentimiento informado al comité de ética de cada centro para su aprobación. El protocolo del estudio, junto con las definiciones utilizadas, ha sido publicado con anterioridad 22.
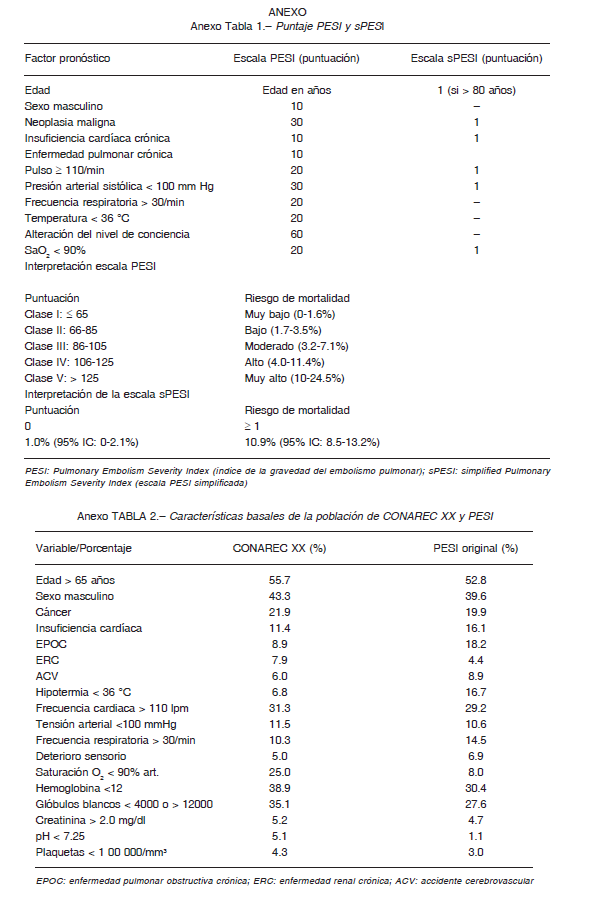
Se recolectó de forma prospectiva las variables planteadas en el estudio original que creó la escala PESI, realizado por Aujesky y col. 23: edad y sexo, comorbilidades (EPOC, falla cardiaca, cáncer), frecuencia cardíaca (FC), frecuencia respiratoria (FR), estado mental, temperatura (T), tensión arterial sistólica (TAS) y saturación de oxígeno al ingreso del servicio. Tras la recolección de dichos datos se asignó una puntuación a cada dato positivo y se realizó la sumatoria para la determinación de las categorías de riesgo (Anexo, Tabla 1). A partir de este sistema de puntuación, los pacientes se estratificaron en cinco niveles de riesgo (I-V) según la suma del puntaje total de las variables: Clase I, de muy bajo riesgo (menor de 66 puntos); Clase II, de bajo riesgo (66 a 85 puntos); Clase III, de riesgo intermedio (86-105 puntos); Clase IV, de alto riesgo (106-125 puntos); Clase V, un riesgo muy alto (mayor de 125 puntos).
El sPESI es la forma simplificada del modelo anteriormente descrito 15. Las variables que incluye fueron edad, comorbilidades (EPOC o falla cardíaca, y cáncer), FC, TAS y saturación de oxígeno al ingreso al servicio de urgencias o al momento del diagnóstico en el caso de pacientes internados. Cada una de ellas otorga un punto y se realiza la sumatoria para la determinación de las categorías de riesgo (Anexo, Tabla 1).
Un puntaje mayor o igual a 1 estratifica al paciente en TEP de alto riesgo.
Las puntuaciones de riesgo PESI y sPESI se calcularon de forma prospectiva y ciega a partir de las diferentes variables que las componen, y se evaluó la mortalidad por todas las causas hospitalaria y a 30 días. Dos investigadores analizaron en forma ciega las variables y asignaron el estrato de riesgo PESI y sPESI de cada caso a partir de los datos remitidos por los investigadores de cada centro.
Las variables continuas se expresaron con la media y desviación estándar o mediana y rango intercuartilos (RIC), según su distribución. Las variables categóricas se expresaron como números y porcentajes. Para las comparaciones entre grupos se utilizó la prueba de Student o la de suma de rangos de Wilcoxon, según correspondiese. Las comparaciones entre proporciones se realizaron mediante la prueba de Chi cuadrado o la prueba exacta de Fisher, según la frecuencia de valores esperados. En todos los casos, se asumió un error alfa del 5% para establecer la significación estadística. La validación de los modelos se evaluó a través de sus dos componentes: discriminación mediante el área bajo la curva ROC (AUC) y calibración mediante la prueba de bondad de ajuste de Hosmer-Lemeshow (HL). La diferencia estadística entre las curvas ROC se evaluó con el método de DeLong y col. Calculamos la sensibilidad, especificidad y el valor predictivo negativo y positivo para mortalidad intrahospitalaria y a 30 días, acorde a los puntos de corte de alto riesgo definidos en los trabajos de derivación de cada puntaje de riesgo, siendo ≥ 106 en el caso de PESI y ≥ 114 en sPESI15 (Anexo tabla 1).
Para comparar la mortalidad en el seguimiento a 30 días de las diferentes clases de riesgo de cada puntaje de riesgo se confeccionaron curvas de Kaplan Meier y se compararon mediante log rank test. Para el análisis estadístico se empleó los programas estadísticos SPSS 23 y Medcalc 19.1.
Resultados
La cohorte prospectiva incluyó 684 pacientes de 75 centros académicos distribuidos en 16 provincias del país internados por TEP agudo confirmado. El seguimiento a 30 días estuvo disponible en el 65% del total de dicha cohorte. Se realizó auditoría cruzada a 15 centros (20%) escogidos al azar, con un 97% de acierto en las variables evaluadas en forma aleatoria. Todos los pacientes fueron incluidos en el análisis final a partir de los resultados de la auditoría.
El promedio de edad fue de 64 años (± 17) y el 57% era de sexo femenino. El 17.5% (n = 120) presentó antecedente de ETV, de los que el 88.3% de los casos presentaba TVP y el 26.7% TEP, mientras que se describió antecedentes de síndrome procoagulante en el 33.9%, y neoplasia en el 21.9%. El 23.98% presentó como factor predisponente una cirugía reciente. Las características basales de la población evaluada se resumen en la Tabla 1 (otras características específicas de la cohorte global se detallan en la publicación del Registro CONAREC XX21).
El TEP fue el motivo de internación en el 71% de los casos, mientras que el resto desarrolló TEP durante una hospitalización por otra causa. El método diagnóstico más empleado fue la angiotomografía multicorte (81%) seguido por el centellograma ventilación/perfusión (14%) y la arteriografía pulmonar (8%). Solo 52 pacientes (8%) requirieron dos o más estudios diagnósticos específicos.
La mediana del puntaje PESI fue de 83 (47-112), siendo el 40.8% (n = 280) de los pacientes en categoría de riesgo bajo/muy bajo, 25.9% (n = 178) de riesgo intermedio y el restante 33% (n = 226) de riesgo alto/muy alto. Según la escala sPESI, el 26.1% fue catalogado como de riesgo bajo.
La mortalidad hospitalaria global fue del 12%, siendo la principal causa la atribuida al propio TEP (51%), seguida de otras causas no cardiovasculares (30%), causas cardiovasculares (16%) y sangrado (4%). A los 30 días, se registró un 3.2% adicional de mortalidad. En aquellos que presentaron el evento intrahospitalario, la mediana del puntaje PESI fue de 124 (Pc 25-75: 102-151) y 90 (Pc 25-75: 71-114) en aquellos que no lo presentaron (p < 0.001). En la Tabla 2 se describe la mortalidad hospitalaria estratificada por las diferentes categorías de riesgo.
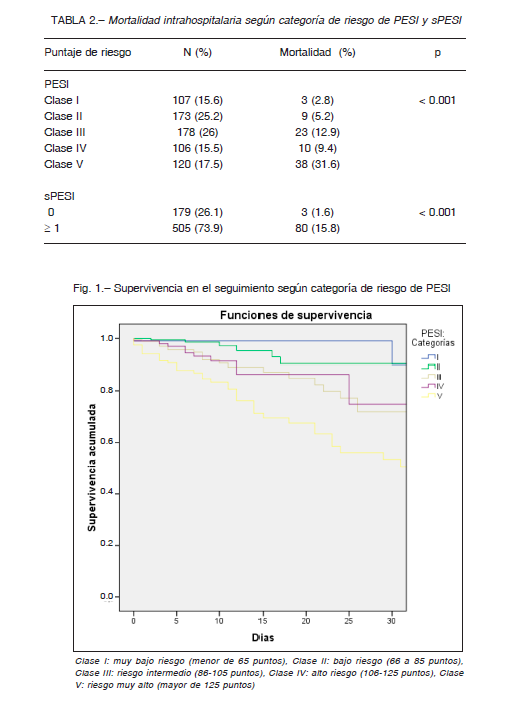
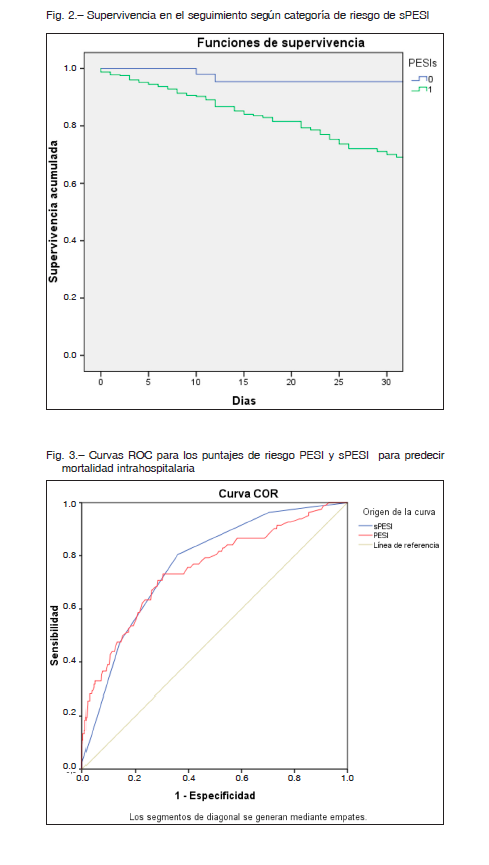
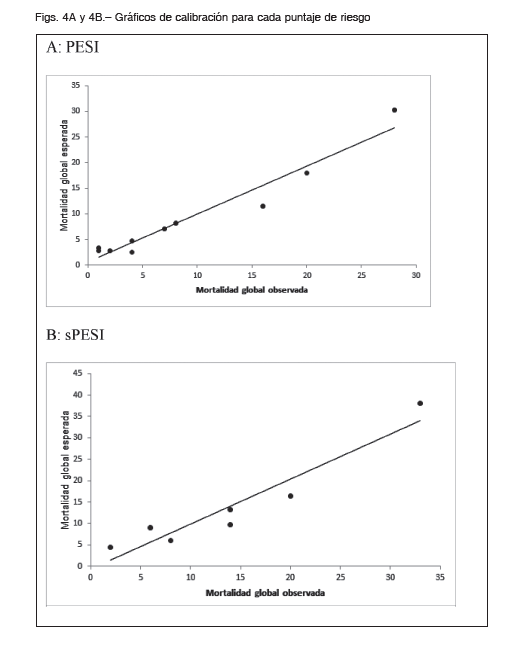
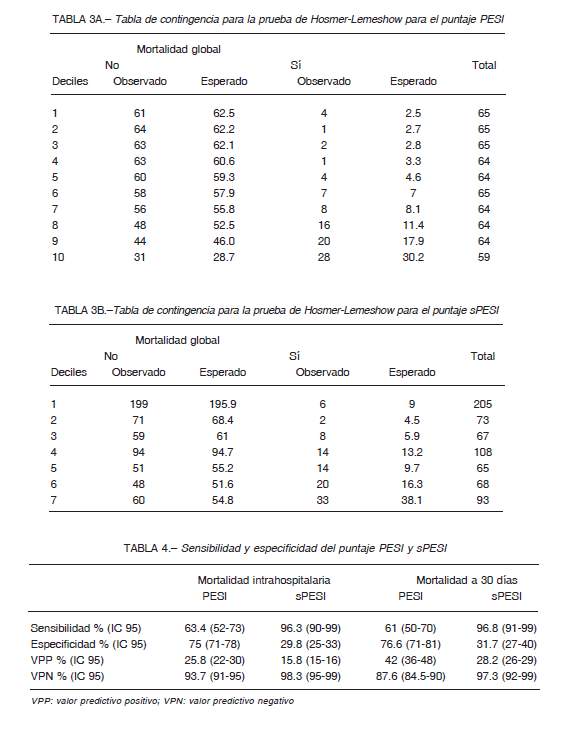
Además, se analizó la supervivencia según categoría de riesgo del puntaje PESI y sPESI, existiendo diferencias entre las mismas (log rank p <0.001) (Figs. 1 y 2). El análisis bajo la curva ROC para la mortalidad hospitalaria demostró un AUC (IC 95%) de 0.75 (0.69-0.81) para PESI y 0.77 (0.71-0.82) para sPESI, sin diferencias estadísticamente significativas entre ambos modelos (p = 0.25) (Fig. 3). El AUC de mortalidad a los 30 días fue de 0.75 (0.68-0.8) y 0.78 (0.74-0.83) para PESI y sPESI respectivamente, con una similar discriminación entre los puntajes (p = 0.2). Ambos puntajes de riesgo presentaron buena calibración acorde a la prueba de bondad de ajuste de HL, p > 0.05. En las Figuras 4A y B se resume el gráfico de calibración para mortalidad global, y en las Tablas 3A y B se encuentran los eventos observados y esperados para mortalidad global según cada puntuación de riesgo.
A partir de los puntos de corte originales, para mortalidad intrahospitalaria el puntaje de riesgo sPESI presentó una sensibilidad del 96.3% y una especificidad del 29.8%, y el puntaje PESI una sensibilidad del 63.4% y una especificidad del 75%, (Tabla 4). Y para mortalidad a 30 días, el puntaje de riesgo sPESI presentó una sensibilidad del 96.8% y una especificidad del 31.7%, y el puntaje PESI una sensibilidad del 61% y una especificidad del 76.6%.
Discusión
El registro “Tromboembolismo pulmonar agudo en la Argentina, CONAREC XX”21, es al momento el más extenso en esta temática en la Argentina, fruto de la necesidad de conocer la realidad de esta enfermedad en nuestro país. A partir de un sub análisis de esta gran cohorte de pacientes con TEP se buscó validar las puntuaciones de riesgo PESI y sPESI, y demostramos que ambas presentan buena calibración y un desempeño similar para predecir mortalidad hospitalaria y a 30 días, por lo que pueden establecerse como herramientas simples de predicción para pacientes con TEP en Argentina.

La estratificación de riesgo de los pacientes con TEP resulta fundamental para determinar el enfoque terapéutico apropiado, sin perder de vista la necesidad de individualizar cada caso en particular, especialmente cuando la evidencia científica no es clara en cuanto a los beneficios de uno u otro tratamiento.
Es por ello que se han creado múltiples herramientas para la estratificación de riesgo, entre ellas las más ampliamente utilizadas y difundidas son el puntaje PESI y el sPESI. Ambas puntuaciones combinan múltiples variables de riesgo puramente clínicas (Anexo Tabla 1) y predicen el riesgo de muerte por cualquier causa a treinta días en pacientes con TEP agudo. El puntaje PESI, es el que se ha validado más ampliamente hasta la fecha 14, 23-26. Siendo su principal fortaleza la adecuada identificación de los pacientes con bajo riesgo de mortalidad a los 30 días (PESI clases I y II). Un ensayo aleatorizado utilizó la categoría de riesgo de PESI bajo como criterio principal de inclusión para el tratamiento domiciliario del TEP, mostrando que la atención ambulatoria se puede usar de manera segura y efectiva en lugar de la atención hospitalaria 10.
En vista de la complejidad del PESI original, que incluye 11 variables, se ha desarrollado y validado una versión simplificada, sPESI 15, 27. Al igual que con la versión original del PESI, su principal ventaja reside en la adecuada identificación de pacientes con bajo riesgo de mortalidad a 30 días. El rendimiento pronóstico del sPESI se ha confirmado en estudios observacionales de cohorte 25, 26, sin embargo no se ha utilizado prospectivamente para guiar el tratamiento de los pacientes con TEP de bajo riesgo.
La población del registro CONAREC XX se asemeja en gran proporción con la del puntaje PESI original, aunque con un menor porcentaje de pacientes con insuficiencia cardíaca, enfermedad pulmonar obstructiva crónica y ACV (Anexo, Tabla 2). La mortalidad registrada en nuestra cohorte para cada estrato de riesgo PESI y sPESI resulta visiblemente mayor a la estipulada en la publicación original del PESI 14, y estadísticamente diferente entre los grupos de riesgo PESI I-II, III-IV y V (bajo, intermedio-alto y muy alto riesgo), y lo mismo ocurre en el sPESI.
Al analizar las curvas ROC de ambos puntajes, la capacidad predictiva de mortalidad intrahospitalaria y a 30 días fue adecuada, sin encontrar diferencias estadísticamente significativas entre el puntaje de riesgo PESI y sPESI, al igual que lo comunicado previamente en la literatura 14, 15, 27. Debido a que ambos modelos pronósticos fueron diseñados específicamente para identificar pacientes de bajo riesgo, es decir para descartar mortalidad a corto plazo, es esperable encontrar una sensibilidad y valor predictivo negativo elevados, y la especificidad y valor predictivo positivos bajos, como lo hallado en el presente estudio con el puntaje sPESI, y similar a lo previamente informado en la literatura 19, 28. Sin embargo, en nuestro estudio, el puntaje de riesgo PESI presentó menor sensibilidad y mayor especificidad. Probablemente en nuestra población el puntaje de corte deba ser inferior para alcanzar una mayor sensibilidad y valor predictivo negativo, y así disminuir la tasa de falsos negativos, siendo completamente relevante para no indicar el manejo ambulatorio de un paciente identificado erróneamente como bajo riesgo.
La adecuada clasificación en las categorías de riesgo tiene implicancias clínicas, las guías de práctica clínica del American College of Chest Physicians 29 y la Sociedad Europea de Cardiología8 sugieren que los médicos usen puntuaciones riesgo validadas para ayudar en la identificación y selección de pacientes de bajo riesgo. Los pacientes clasificados como de bajo riesgo acorde a las recomendaciones de la Sociedad Europea de Cardiología que combina parámetros clínicos, biomarcardores cardíacos, signos de disfunción del ventrículo derecho y el puntaje PESI dentro de los grupos I y II, o con sPESI de 0)8, este grupo de pacientes podrían ser candidatos a la atención ambulatoria 10, 30. Por el contrario, los pacientes clasificados como PESI III o IV tienen una mortalidad de hasta el 18.4% a 30 días 14, requieren internación, anticoagulación y eventualmente reperfusión pulmonar 31, 32.
Bajo estas condiciones, comprobamos que los puntajes PESI y sPESI tienen una adecuada discriminación y calibración en nuestra cohorte. Al comparar modelos predictivos, se debe establecer un equilibrio entre su capacidad predictiva y su simplicidad en términos de aplicabilidad clínica. El puntaje sPESI consta de menos variables con un sistema de puntuación simple (la presencia de cualquiera de las variables indica un paciente de alto riesgo) con lo que puede facilitar su implementación y aceptabilidad. Adicionalmente, el punto de corte establecido en los estudios originales es similar a nuestra corte. Y el puntaje PESI consta más variables, con un sistema para asignar puntajes es más complejo y además el punto de corte original no pareciera ser el apropiado en esta población.
Como limitaciones principales debemos mencionar que la inclusión de pacientes internados en centros con residencia de cardiología afiliados a CONAREC puede no ser representativa de la población general argentina al restringir la participación a centros académicos de moderada-alta complejidad. Asimismo, no se aportaron datos de pacientes con TEP de bajo riesgo con tratamiento ambulatorio. Además fue posible evaluar la mortalidad a 30 días en el 65% de los pacientes.
Sin embargo, destacamos la importancia de este registro en Argentina al tratarse del mayor registro prospectivo del país, incluyendo pacientes con diagnóstico de certeza de TEP agudo de un gran número de centros, con una auditoría externa.
Para finalizar, es importante resaltar que ambos puntajes solamente suplementan el juicio clínico, y de ninguna manera pueden reemplazarlo, en vistas de que el tratamiento del paciente con TEP agudo debe considerar múltiples aristas y no solamente el resultado de variables clínicas o de estudios complementarios aisladas.
Conflictos de intereses: Ninguno para declarar
Bibliografía
1. Cohen AT, Agnelli G, Anderson FA, et al. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality. Thromb Haemost 2007; 98: 756-64.
2. Oger E. Incidence of venous thromboembolism in a community-based study in western France. Thromb Haemost 2000; 83: 657-60.
3. Widimský J, Malý J, Eliáš P, et al. Doporučení pro diagnostiku a léčbu akutní plicní embolie. Vnitř. Lék 2008; 54: 1S25-1S72
4. Meignan M, Rosso J, Gauthier H, et al. Systematic lung scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis. Arch Intern Med 2000; 160: 159-64.
5. Pulido T, Aranda A, Zevallos MA, et al. Pulmonary embolism as a cause of death in patients with heart disease: an autopsy study. Chest 2006; 129: 1282-7.
6. Laporte S, Mismetti P, Decousus H, et al. Clinical predictors for fatal pulmonary embolism in 15,520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad Tromboembólica venosa (RIETE) Registry. Circulation 2008; 117: 1711-6.
7. Goldhaber SZ, Visani L and De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353: 1386-9
8. Konstantinides SV, Torbicki A, Agnelli G, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014; 35: 3033-69.
9. Goldhaber SZ. Assessing the prognosis of acute pulmonary embolism: tricks of the trade. Chest 2008; 133: 334-6
10. Aujesky D, Roy PM, Verschuren F, et al. Outpatient versus inpatient treatment for patients with acute pulmonary embolism: an international, open-label, randomised, noninferiority trial. Lancet 2011; 378: 41-8
11. Zondag W, Kooiman J, Klok FA, Dekkers OM, Huisman MV. Outpatient versus inpatient treatment in patients with pulmonary embolism: a meta-analysis. Eur Respir J 2013; 42: 134-44.
12. Jiménez D, Aujesky D, Yusen RD. Risk stratification of normotensive patients with acute pulmonary embolism. Br J Haematol 2010; 151: 415-24
13. Squizzato A, Donadini MP, Galli L, et al. Prognostic clinical prediction rules to identify a low-risk pulmonary embolism: a systematic review and meta-analysis. J Thromb Haemost 2012; 10: 1276-90
14. Aujesky D, Obrosky DS, Stone RA, et al. Derivation and validation of a prognostic model for pulmonary embolism. Am J Respir Crit Care Med 2005; 172: 1041-6.
15. Jimenez D, Aujesky D, Moores L, et al. Simplification of the pulmonary embolism severity index for prognostication in patients with acute symptomatic pulmonary embolism. Arch Intern Med 2010; 170: 1383-9
16. Chan CM, Woods C, Shorr AF. The validation and reproducibility of the pulmonary embolism severity index. J Thromb Haemost 2010; 8: 1509-14.
17. Donzé J, Le Gal G, Fine MJ, Roy PM, Sanchez O, Verschuren F, et al. Prospective validation of the Pulmonary Embolism Severity Index. A clinical prognostic model for pulmonary embolism. Thromb Haemost 2008; 100: 943-8.
18. Chan CM, Woods CJ, Shorr AF. Comparing the pulmonary embolism severity index and the prognosis in pulmonary embolism scores as risk stratification tools. J Hosp Med 2012; 7: 22-7.
19. Venetz C, Jiménez D, Méan M, Aujesky D. A comparison of the original and simplified Pulmonary Embolism Severity Index. Thromb Haemost 2011; 106: 423-8.
20. Lankeit M, Jiménez D, Kostrubiec M, et al. Embolism: A prospective validation study embolism severity index in hemodynamically stable patients with acute pulmonary predictive value of the high-sensitivity troponin T assay and the simplified pulmonary. Circulation 2011; 124: 2716-24.
21. Cigalini I, Igolnikof D, Scatularo C, et al. Tromboembolismo pulmonar agudo en la Argentina. Registro CONAREC XX. Rev Argent Cardiol 2019; 87: 137-45.
22. Cigalini I, Igolnikof D, Jauregui J, et al. Tromboembolismo de Pulmón en la República Argentina. Registro CONAREC XX: Protocolo. Revista Conarec 2018; 33: 244-5
23. Aujesky D, Roy P, Petit C. Validation of a model to predict adverse outcomes in patients with pulmonary embolism. Eur Heart J 2006; 27: 476-81.
24. Donze J, Le Gal G, Fine MJ, et al. Prospective validation of the Pulmonary Embolism Severity Index. A clinical prognostic model for pulmonary embolism. Thromb Haemost 2008; 100: 943-948
25. Elias A, Mallett S, Daoud-Elias M, Poggi JN, Clarke M. Prognostic models in acute pulmonary embolism: a systematic review and meta-analysis. BMJ Open 2016; 6: e010324.
26. Kohn CG, Mearns ES, Parker MW, Hernandez AV, Coleman CI. Prognostic accuracy of clinical prediction rules for early post-pulmonary embolism all-cause mortality: a bivariate meta-analysis. Chest 2015; 147: 1043-62.
27. Righini M, Roy PM, Meyer G, Verschuren F, Aujesky D, Le Gal G. The Simplified Pulmonary Embolism Severity Index (PESI): validation of a clinical prognostic model for pulmonary embolism. J Thromb Haemost 2011; 9: 2115-7.
28. Weeda ER, Kohn CG, Fermann GJ, et al. External validation of prognostic rules for early post-pulmonary embolism mortality: assessment of a claims-based and three clinical-based approaches. Thromb J 2016; 14: 7.
29. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and expert panel report. Chest 2016; 149: 315-52.
30. Jimenez D, Yusen RD, Otero R, et al. Prognostic Models for Selecting Patients With Acute Pulmonary Embolism for Initial Outpatient Therapy. Chest 2007; 132: 24-30.
31 Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension- A Scientific Statement From the American Heart Association. Circulation 2011; 123: 1788-830.
32. Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Heart J 2020; 41: 543-603.
– – – –
He tenido ocasión de constatar que la pampa no es fotografiable. Tratar de fotografiarla es casi querer fotografiar el vacío. Pero hay, sin embargo, un medio de conseguirlo, trayendo al primer plano una cosa cualquiera, animal o árbol. La inmensidad, el espacio, el horizonte inasiblemente chato, adquieren inmediatamente su relieve, por contraste.
Victoria Ocampo (1890-1979)
Contestación a un epílogo de Ortega y Gasset. Sur: revista trimestral. Año I, Otoño 1931, p 16-52
En: http://www.cervantesvirtual.com/nd/ark:/59851/bmcgn055; 17/11/2019.
