GLENDA ERNST 1, 2, MELINA SABÁN 2, 3, MIGUEL SCHIAVONE 4, MAGALÍ BLANCO 1, 5, ALEJANDRO SALVADO 1, EDUARDO BORSINI 1, 5
1 Centro de Medicina Respiratoria, 2 Comité Asesor Científico, Departamento de Docencia e Investigación, 3 Departamento de Endocrinología, Metabolismo, Nutrición y Diabetes, 4 Departamento de Cardiología, 5 Unidad de Sueño y Ventilación, Hospital Británico, Buenos Aires, Argentina
Resumen La apnea obstructiva del sueño (AOS) constituye una afección prevalente. Se define AOS muy grave cuando el índice de apneas/hipopneas (IAH) es mayor a 60 eventos/hora. Sin embargo, su prevalencia sigue siendo incierta. El objetivo de este estudio fue d escribir la prevalencia y características de pacientes con AOS según la gravedad. Se realizó un análisis retrospectivo de pacientes >18 años, evaluados mediante poligrafía respiratoria. Fueron evaluados 5670 de los cuales se incluyeron 3606 pacientes con AOS, con una media de edad de 54.4 ± 14.3 años. La prevalencia global de AOS muy grave fue de 4.8%, siendo mayor en hombres que en mujeres (6.8 vs. 1.9). Este grupo resultó más joven que los grupos de menor gravedad (54.7 ± 13.9: AOS leve; 56.5 ±12.9: AOS moderado; 57.9 ± 13.1: AOS grave vs. 51.5 ± 12.9 años en los muy graves; p < 0.0001). Los resultados mostraron un aumento significativo del índice de masa corporal en aquellos con AOS muy grave (31.6 ± 6.9: AOS leve, 32.8 ± 6.6: AOS moderado, 34.0 ± 6.8 AOS grave vs. 37.1 ± 8.5 de gravedad extrema; p < 0.0001), con resultados similares en hombres, pero no en mujeres. Finalmente, la somnolencia por ESS > 10, mostró un aumento significativo en el grupo muy graves de ambos sexos; 43.2% vs. un 31.5% (AOS grave); 26.4% (AOS moderado) y un 23.8% (AOS leve). El AOS muy grave presenta una prevalencia del 4.8% de los pacientes con AOS. En acuerdo con publicaciones previas en otras poblaciones estudiadas, encontramos que los pacientes con AOS muy graves, son más jóvenes y obesos que los grupos de menor gravedad.
Palabras clave: prevalencia, apneas obstructivas de sueño, gravedad
Abstract Obstructive sleep apnea (OSA) is a prevalent condition. OSA is defined as very severe when the apneas/hypopneas index (AHI) is greater than 60 events/hour. However, its prevalence remains uncertain. The aim of this study was to describe the prevalence and characteristics from patients with OSA according to severity. We performed a retrospective analysis of patients > 18 years, assessed by respiratory polygraph. We evaluated a total of 5670 patients with a mean of age of 54.4 ± 14.3 years old, of which 3606 were included in the OSA group. The overall prevalence of very severe OSA was 4.8%, being higher in men than in women (6.8 vs 1.9%). This group of patients was younger than the less severe groups (54.7 ± 13.9: mild OSA; 56.5 ± 12.9: moderate OSA; 57.9 ± 13.0: severe OSA vs 51.5 ± 12.9 years in the very severe patients; p < 0.0001). The results showed a significant increase in the body mass index (BMI) of patients with very severe OSA (31.6 ± 6.9: mild OSA, 32.8±6.6: moderate OSA, 34.0 ± 6.8 severe OSA vs 37.1 ± 8.5 extreme severity; p < 0.0001), with similar results in men, but not in women. Finally, drowsiness due to ESS > 10, showed a significant increase in the very severe group of both sexes; 43.2% vs 31.5% (severe OSA); 26.4% (moderate OSA) and 23.8% (mild OSA). Very severe OSA presented a prevalence of 4.8% of patients with OSA. According to previous publications in other studied populations, we found that patients with very severe OSA are younger and more obese than the less severe groups.
Key words: prevalence, obstructive sleep apneas, severity
Dirección postal: Glenda Ernst, Hospital de Británico, Perdriel 74, 1280 Buenos Aires, Argentina
e-mail: GErnst@hbritanico.com.ar
Las apneas obstructivas del sueño (AOS) se definen como la presencia de períodos de cesación o reducción del flujo de aire durante el sueño, acompañado por desaturación del oxígeno sanguíneo, asociadas a complicaciones metabólicas y/o cardiovasculares. Este trastorno es el resultado de una alteración de la anatomía, sumada a la atonía muscular que ocurre durante el sueño, que determinan el colapso repetitivo de la vía aérea superior 1. Su prevalencia en la población general en diferentes países es de cerca de 33%, siendo más frecuente en hombres y en individuos con sobrepeso u obesidad 2,3.
En AOS es habitual la presencia de somnolencia diurna; depresión, hipertensión arterial, síndrome metabólico, insulino-resistencia, isquemia cardíaca y arritmias 4-8.
Una de las formas en la que se estima la gravedad del AOS es mediante el índice de apneas e hipopneas (IAH), es decir; el número de eventos obstructivos registrados en un estudio de sueño dividido por las horas de sueño. Los puntos de corte de gravedad tradicionalmente propuestos en el IAH son; < 5 eventos (ev) por hora (ev/h): sin valor patológico; entre 5 y 15 ev/h: formas leves del trastorno, entre 15.1 y 30 ev/h: AOS moderado y más de 30 ev/h: formas graves que independientemente de la presencia de síntomas definen un síndrome con indicación inequívoca de tratamiento.
Jurcevic y col. han postulado que los pacientes con AHI≥ 60 ev/h deberían ser considerados como un grupo de mayor riesgo por sus desórdenes metabólicos y cardiovasculares e incremento de la mortalidad. Más aún, Jorge Rey de Castro y col. han comunicado resultados similares en su población de estudio. Ambos trabajos resaltan la importancia de comprender la gravedad y dificultades clínicas que enfrentan los pacientes con AOS que presentan IAH elevados por encima de 60 a 100 ev/h.
A pesar de ello, no conoce la real prevalencia de este fenotipo de gravedad extrema 9-11.
El aumento del IAH ha sido relacionado con un incremento de la mortalidad y de la prevalencia de hipertensión, sugiriendo una asociación independiente entre estos factores. Tanto las medias de la presión arterial sistólica y diastólica se elevaron de forma significativa con el aumento del IAH ajustado por variables demográficas y antropométricas que incluían el índice de masa corporal (IMC), circunferencia del cuello e índice de cintura-cadera, consumo de alcohol y tabaquismo 12, 13.
Este estudio se realizó con el objetivo de analizar la prevalencia y características de pacientes con IAH ≥ 60 ev/h en una base de datos de recolección sistemática de los pacientes del Centro de Medicina Respiratoria de 10 años.
Materiales y métodos
Estudio retrospectivo. Se incluyeron pacientes consecutivos mayores de 18 años, referidos a poligrafía respiratoria (PR) entre 09/2009 y 03/2019; por sospecha clínica de apnea del sueño debido a síntomas como ronquidos, apneas observadas por terceros y/o somnolencia diurna excesiva. Se excluyeron aquellos con movimientos periódicos de las extremidades o con sospecha de enfermedades no respiratorias del sueño.
También se excluyeron quienes tenían insuficiencia cardíaca sintomática, enfermedades neuromusculares, diagnóstico conocido de EPOC, uso de CPAP o alguna modalidad de soporte ventilatorio u oxígeno suplementario. Finalmente, aquellos con datos completos o tiempos de registro (TTR) menores a los 240 minutos en la PR no fueron considerados para el análisis.
Se analizaron los datos antropométricos, la escala de somnolencia de Epworth (ESS) y el cuestionario de Berlín que son habitualmente registrados en una base de datos del Centro de Medicina.
Los pacientes fueron entrenados en el uso, ensamblaje y encendido del equipo de poligrafía respiratoria (PR). También recibieron instrucciones impresas con información iconográfica sobre el montaje y encendido del dispositivo. Se utilizaron los dispositivos Apnea Link Plus (ResMed, Australia), Alice PDX (Philips-Respironics, USA) y ALICE Night One (Philips- Respironics, USA). Todos los dispositivos estaban equipados con un oxímetro de pulso, cinturones de esfuerzo y una cánula de alta presión sensible nasal (dispositivos de nivel III de la Academia Americana de Medicina del Sueño).
Todos los registros se analizaron manualmente. Los eventos fueron calificados por médicos neumonólogos entrenados de acuerdo con las directrices de la Academia Americana de Medicina del Sueño (AASM). Un evento respiratorio se definió como “apnea” cuando el flujo nasal se redujo al 90% durante al menos 10 segundos y se definió como “hipopnea” cuando se redujo en un 50% asociado con una desaturación ≥ 3% como mínimo durante 10 segundos 14.
El IAH se calculó como el número de apneas + hipopneas por hora de evaluación válida sobre el tiempo total de registro (TTR).
El índice de desaturación (umbral 3%) por hora de sueño se interpretó de acuerdo a los grados de severidad por los mismos puntos de corte. El tiempo de saturación debajo de 90% (T < 90%) se expresó como % del TTR y en minutos.
Este estudio fue aprobado por el Comité de Revisión Institucional del Hospital Británico (protocolo # 977).
Para realizar el estudio estadístico, los pacientes fueron agrupados según gravedad en: leves cuando el IAH estaba entre 5 y 15 ev/h, moderado entre 15.1 y 30 ev/h, grave entre 30.1 y 59.9 ev/h y muy graves cuando el IAH era ≥ 60 ev/h.
Los resultados se presentaron como porcentaje de variables categóricas o como media y error estándar para variables numéricas o como mediana e intervalo intercuartilo, según la distribución de las mismas. Se utilizaron pruebas no paramétricas de Kruskall-Wallis junto con la prueba de comparación múltiple de Dunn para comparar los resultados de tres o más grupos utilizando el software Prism 7.01 (GraphPad, La Jolla, CA). Se realizó una regresión logística multivariada utilizando R- Studio 3.6.0.
Resultados
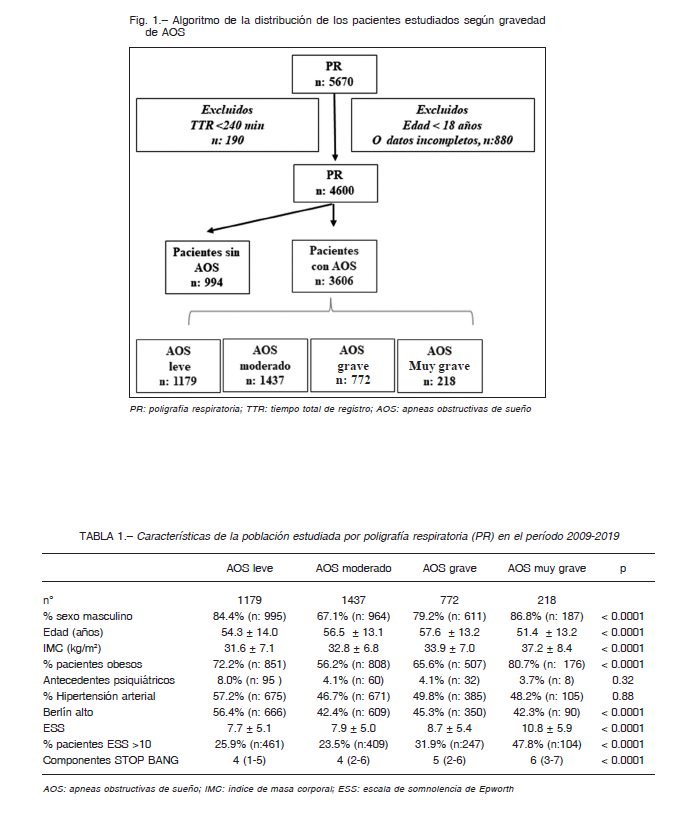
Se incluyeron en este estudio 5670 pacientes que realizaron una PR de los cuales se excluyeron 190 por presentar un estudio con un tiempo de registro menor a 240 min y 880 por tener cuestionarios incompletos. De los 4600 restantes, el 78.3% (n:3606) presentaron AOS definido por un IAH > 5 ev/h, de los cuales 1179 tenían apneas leves, 1437 moderadas, 772 graves y 218 muy graves (Fig.1).
Aquellos con AOS muy graves fueron significativamente más jóvenes y presentaron un incremento del IMC en comparación con los grupos de menor gravedad. Más aún, este grupo presentó mayores síntomas determinados por la escala de ESS y mayor cantidad de componentes de STOP BANG (Tabla 1). El porcentaje de pacientes que tomaba medicación para la hipertensión (referido por el paciente al realizar el cuestionario STOP-BANG) no fue diferente entre los grupos analizados.
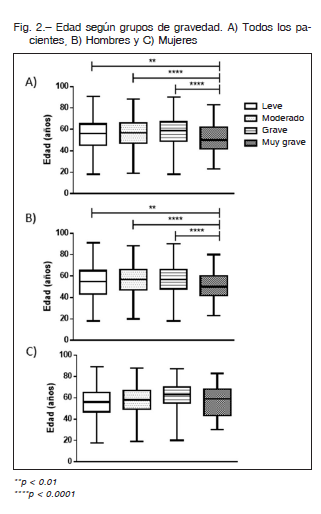
Tal como se observa en la Figura 2A; los enfermos con diagnóstico de AOS muy grave mediante PR mostraron menor edad en comparación con los demás grupos de gravedad (54.7 ± 13.9: AOS leve; 56.5 ± 12.9: AOS moderado; 57.9 ± 13.0: AOS grave vs. 51.5 ± 12.9 años en los pacientes de gravedad extrema; p < 0.0001). Estos resultados fueron similares en hombres donde la edad fue 54.1 ± 14.2; 56.1 ± 12.9; 57.0 ± 13.1 vs 50.8 ± 12.4 respectivamente; p < 0.0001. Sin embargo, en las mujeres no se observó esta diferencia: 55.4 ± 13.4; 57.5 ± 12.9; 61.9 ± 12.2 vs 56.1 ± 15.5) (Figs. 2B y C).
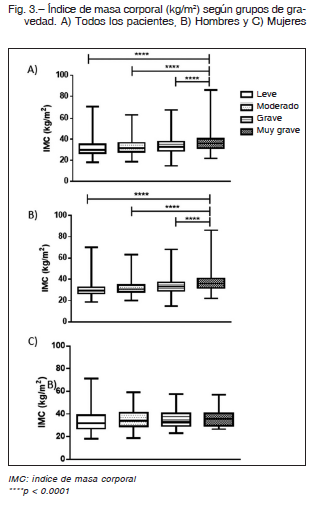
Los pacientes con AOS muy grave (IAH ≥ 60 ev/h) tuvieron un IMC (kg/m2) significativamente superior (31.6 ± 6.9: AOS leve, 32.8 ± 6.6: AOS moderado, 34.0 ± 6.8 AOS grave vs. 37.1 ± 8.5 de gravedad extrema; p < 0.0001) (Fig. 3 A). Resultados similares fueron observados en los hombres 30.3 ± 5.4, 31.7 ± 5.6, 33.7 ± 6.5 vs. 37.3 ± 8.6 respectivamente; p < 0.0001). De igual manera que en el punto anterior, estas diferencias no fueron observadas para las mujeres (33.2 ± 9.2, 35.1 ± 8.0, 35.2 ± 7.9 vs. 36.1 ± 8.2 kg/m2; p > 0.05), (Figs. 3B y C).
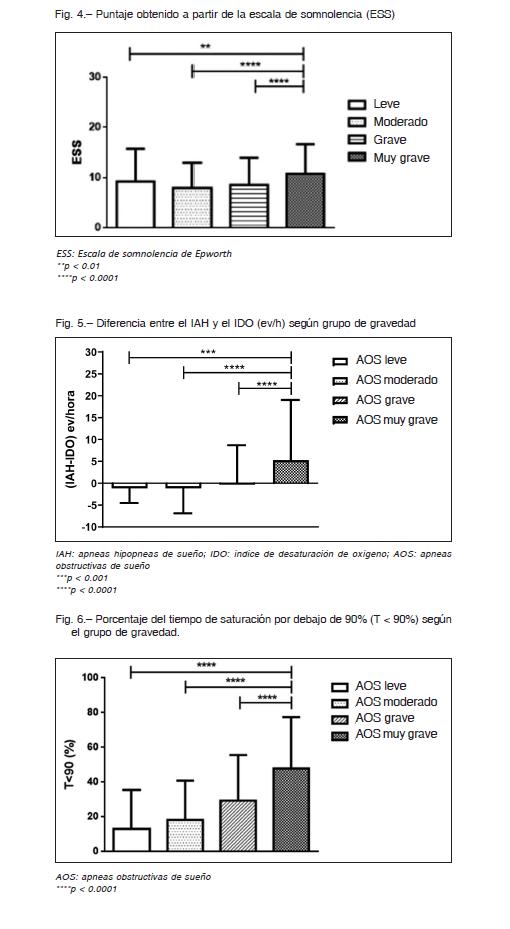
El porcentaje de sintomáticos determinado por la escala de somnolencia de Epworth mostró un proporcional incremento asociado a la gravedad por IAH, de este modo un 23.8% con AOS leve presentó un ESS > 10 puntos¸ un 26.4% con AOS moderado, un 31.5% de los pacientes graves y un 43.2 de aquellos con AOS de extrema gravedad. Más aún; los resultados de ESS (media y DS) mostraron un incremento proporcional al incremento de la gravedad en toda la población; 9.3 ± 6.5, 7.9 ± 5.0, 8.6 ± 5.4 vs. 10.7 ± 5.9; p< 0.0001 (Fig. 4). Los hallazgos de nuestro estudio mostraron un aumento proporcional en la diferencia IAH – ODI (ev/h). Los datos mostraron medianas e intervalos intercuartilos 25%-75% de -0.7 (-0.3/0.3) para los AOS leves, -0.7 (-3.1/1) para AOS moderado, 0 (-3/3) para los AOS graves y finalmente 2 (-1.3/8) para los AOS extremadamente graves; p < 0.0001 (Fig. 5).
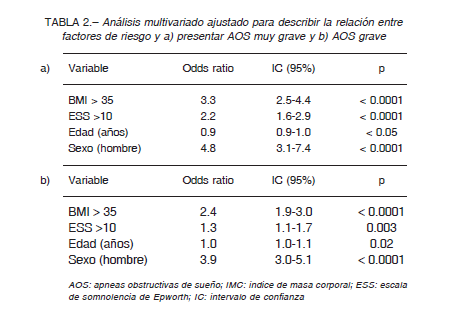
Se observó un progresivo incremento en el porcentaje de tiempo en que los pacientes permanecen por debajo de una saturación <90%. Los datos mostraron medianas e intervalos intercuartilos 25%-75% de 3 (1/13) para los AOS leves, 9 (3/23) para AOS moderado, 22 (10/42) para los AOS graves y finalmente 47 (27/69) para los AOS de extrema gravedad; p < 0.0001 (Fig. 6). Se realizó un análisis de regresión logística multivariada ajustado por edad (variable continua); ESS alto (> 10); IMC alto (> 35kg/m2) y sexo (masculino). Tal como se observa en la Tabla 2A, los resultados sugirieron que tener IMC > 35 kg/m2 está asociado con 3.3 veces más probabilidades de tener AOS muy grave (IAH ≥ 60 ev/h) y que la presencia de síntomas determinados por un ESS > 10, estaría asociada con 2.3 veces más probabilidades de tener AOS muy grave. Ser hombre incrementó solo un 1.5 las probabilidades de tener AOS muy grave y finalmente la edad no tuvo relación con la probabilidad de tener un AHI ≥ 60 ev/h. Este mismo análisis fue realizado con la categoría de pacientes graves, el mismo mostró resultados similares respecto del IMC > 35 kg/m2 y el sexo masculino. Sin embargo, en este caso no se encontró asociación con los síntomas (ESS >10) (Tabla 2b).
Discusión
Los hallazgos de este estudio determinaron que el 4.8% de los pacientes con riesgo de AOS evaluados rutinariamente en una unidad de sueño presentaron formas extremadamente graves de este trastorno.
La gravedad del AOS se evalúa tradicionalmente a través del incremento del IAH. Sin embargo, estos indicadores son dinámicos a través del tiempo y es recomendable complementarlos con la valoración de factores modificadores de la gravedad (grado de hipoxemia, fragmentación del sueño, síntomas, duración y distribución de los eventos, edad, etc.) 15.
Benjafield y col., basados en datos de 17 estudios, calcularon la prevalencia estimada de apneas del sueño y formas moderadas del trastorno (IAH > 15 ev/h) para nuestro país en 2 490 616 sujetos. Sin embargo, no existen datos que aporten conocimiento acerca de la proporción de casos graves o muy graves en nuestro medio 16.
Trabajos previos han demostrado que los cambios en el peso corporal se asocian a un aumento de la gravedad de la AOS y que esta relación varía ampliamente entre los pacientes con un IMC superior a 40 kg.m2. Aunque, la obesidad, representada por un IMC de 30 o superior, es más prevalente en las mujeres, 33% versus 27%, el SAHOS muestra una prevalencia superior al doble entre los varones. Para el mismo IMC los varones muestran SAHOS más grave y para la misma categoría de gravedad del SAHOS las mujeres tienen mayor IMC. Estas diferencias entre hombres y mujeres se basan fundamentalmente en la circunferencia del cuello ya que representa con una mayor distribución del tejido adiposo entre los varones 17-19.
Recientemente ha sido descripta una asociación entre la gravedad de la AOS y el incremento de especies reactivas de oxígeno 20. Dichos hallazgos podrían relacionarse con el incremento de la hipoxemia intermitente y la profundidad de las alteraciones del intercambio gaseoso.
Nuestros resultados han mostrado un incremento significativo del IDO y del T < 90 en relación a la gravedad.
Los pacientes con AOS de gravedad extrema presentan mayor grado de hipoxemia nocturna expresado por aumento en los indicadores como el tiempo con una saturación <90% y más comorbilidades tales como la hipertensión arterial 13. En concordancia, nuestros hallazgos mostraron un incremento proporcional en la diferencia IAH-IDO. Sin embargo, el grupo de gravedad extrema presentó mayor grado de obesidad y este factor podría influenciar los indicadores aumentando esta diferencia, como fue propuesto previamente por Ernst y col. 13,22.
Preis y col., describieron la relación entre parámetros antropométricos y la probabilidad de desarrollar eventos cardiovasculares vinculados a la AOS 23. En este estudio, se hallaron diferencias en variables como el sexo, la edad y el grado de obesidad en el grupo de gravedad extrema.
Se ha propuesto que el impacto de la hipertensión arterial (HTA) en los pacientes con AOS es mayor al incrementarse la gravedad 23. Los pacientes con mayor gravedad (≥ 60 ev/h) podrían asociarse con mayor probabilidad de desarrollar HTA y mayor gravedad de hipoxemia nocturna, en comparación con los pacientes con AOS moderado o grave definidos por el punto de corte tradicional (IAH > 30 eventos/hora); que de esta manera se presenta como una sobre simplificación de un grupo poblacional gravemente afectado por este padecimiento respiratorio. Rey de Castro y col. han descripto la necesidad de identificar variables de pronóstico para las formas muy severas de apneas del sueño 13.
Los hallazgos de este estudio han demostrado diferencias en la presentación clínica y en el grado de somnolencia subjetiva, posiblemente debido a mayor fragmentación de sueño y densidad de microdespertares asociados a eventos respiratorios en las formas graves. ESS alcanzó valores anormales en el 43% en el grupo específico de pacientes con AOS extremadamente grave.
Nuestro trabajo es retrospectivo, tiene como fortaleza el tamaño de la muestra, sin embargo, contiene las limitaciones de este tipo de diseño. No fueron recolectados datos relacionados con las medicaciones de los pacientes tales como opioides ni el registro de la presión arterial.
Además, su base es epidemiológica y no permite hipótesis de pronóstico.
Sin embargo, la población incluida representa la vida real y el conjunto de pacientes que habitualmente son derivados a centros de diagnóstico especializados. Las características clínicas evaluadas en los pacientes han sido tan solo aquellas que representan la sistemática de trabajo en nuestra Unidad.
Otra limitación son las variables de confusión relacionadas con la utilización de métodos simplificados de diagnóstico en domicilio. La capacidad diagnóstica de los polígrafos respiratorios que utilizamos es limitada, aunque todos ellos incluyeron al menos las 3 señales básicas en las que se basaron la lectura manual y la interpretación final del estudio de sueño. La PR domiciliaria podría establecer diferencias entre nuestros resultados y los de otros estudios que utilizaron polisomnografía convencional (PSG) en el laboratorio del sueño. En comparación con la PSG convencional, la PR tiene una tasa de subestimación
del 10-15% para el IAH, una limitación inherente a la ausencia de señales neurofisiológicas. Los índices utilizados (IAH e IDO) difieren de los de PSG ya que son el resultado del cociente entre los eventos y el tiempo total de grabación, aunque representan un estándar de diagnóstico en nuestro medio. Estudios longitudinales serán necesarios para conocer el valor clínico y pronóstico de estas formas extremas de la enfermedad 13, 23, 24. La clasificación habitual agrupa los pacientes graves cuando presentan un IAH mayor a 30 ev/hora; sin embargo, los pacientes con IAH mayor a 60 podrían representar un grupo de mayor gravedad. Esto se refleja en el patrón de hipoxemia que los mismos presentan. Las formas extremadamente graves de apneas del sueño se asocian a mayor grado de hipoxemia nocturna, síntomas de somnolencia más frecuentes y discordancias entre el índice de apneas e hipopneas e indicadores de saturación de oxígeno. Más aún, consideramos importante transmitir que estos pacientes, de gravedad extrema, que requieren tratamiento y supervisión inmediata, no constituyen casos aislados, sino que representan alrededor de un 5 % de los pacientes con AOS.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Richard W, Kox D, den Herder C, Laman M, van Tinteren H, de Vries N. The role of sleep position in obstructive sleep apnea syndrome. Eur Arch Otorhinolaryngol 2006; 263: 946-50.
2. Young T, Peppard P, Gottlieb D. Epidemiology of obstructive sleep apnea: a population health perspective. Am J Respir Crit Care Med 2002; 165: 1217-39.
3. Tufik S, Santos-Silva R, Taddei JA, Bittencourt LRA. Obstructive sleep apnea syndrome in the Sao Paulo Epidemiologic Sleep Study. Sleep Med 2010; 11: 441-6.
4. Peppard PE, Szklo-Coxe M, Hla KM, Young T. Longitudinal association of sleep-related breathing disorder and depression. Arch Intern Med 2006; 166: 1709-15.
5. Nieto FJ, Young TB, Lind BK, et al. Association of sleepdisordered breathing, sleep apnea, and hypertension in a large community-based study. Sleep Heart Health Study. JAMA J 2000; 283: 1829-36.
6. Coughlin SR, Mawdsley L, Mugarza JA, Calverley PM, Wilding JP. Obstructive sleep apnoea is independently associated with an increased prevalence of metabolic syndrome. Eur Heart J 2004; 25: 735-41.
7. Ip MS, Lam B, Ng MM, Lam WK, Tsang KW, Lam KS. Obstructive sleep apnea is independently associated with insulin resistance. Am J Respir Crit Care Med 2002; 165: 670-6.
8. Shamsuzzaman AS, Gersh BJ, Somers VK. Obstructive sleep apnea: implications for cardiac and vascular disease. JAMA 2003; 290: 1906-14.
9. Mandibular, D.E.L.O.S.D.D.E.A. et al. Guía Española De Práctica Clínica. Eur J Orthod 2016; doi: 10.1093/ejo/cjw078.
10. Jurcevic D, Shaman Z, Krishnan V. A new category: very severe obstructive sleep apnea has worse outcomes on morbidity and mortality. Chest J 2012; 142: 1075A.
11. Rey de Castro J, Huamaní C, Escobar-Córdoba F, Liendo C. Clinical factors associated with extreme sleep apnoea [AHI>100 events per hour] in Peruvian patients: A casecontrol study-A preliminary report. Sleep Sci 2015; 8: 31-5.
12. Varghese MJ, Sharma G, Shukla G, Seth S, Mishra S, Gupta A, Bahl VK. Longitudinal ventricular systolic dysfunction in patients with very severe obstructive sleep apnea: A case control study using speckle tracking imaging. Indian Heart J 2017; 69: 305-10.
13. Li J, Chen X, Sun J. Is the grading system of the severity of the OSAHS used presently rational or not?: from the view of incidence of hypertension in different severity groups. Eur Arch Otorhinolaryngol2014; 271: 2561-4.
14. Berry RB, Budhiraja R, Gottlieb DJ, et al. American Academy of Sleep Medicine. Rules for scoring respiratory events in sleep: update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2012; 8: 597-619.
15. Borsini E, Nogueira F, Nigro C. Apnea-hypopnea index in sleep studies and the risk of over-simplification. Sleep Sci 2018; 11: 45-8.
16. Benjafield AV, Ayas NT, Eastwood PR, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. Lancet Respir Med 2019; 7: 687-98.
17. Newman AB, Foster G, Givelber R, Nieto FJ, Redline S, Young T. Progression and regression of sleep-disordered breathing with changes in weight: the sleep heart health study. Arch Intern Med 2005; 165: 2408-13.
18. Schwartz A, Patil S, Laffan A, Polotsky V, Schneider H, Smith P. Obesity and obstructive sleep apnea. Pathogenic mechanisms and therapeutic approaches. Proc Am Thorac Soc 2008; 5: 185-92.
19. Cambursano VH. SAHOS, una vez más, favorecidas por la naturaleza. Revista Americana de Medicina Respiratoria 2015; 15: 161-3.
20. Lin CM, Davidson TM, Ancoli-Israel S. GenderDifferences in ObstructiveSleep Apnea and TreatmentImplications. Sleep Med Rev 2008; 12: 481-96.
21. Tóthová Ľ, Celec P, Mucska I, Hodosy J. Short-term effects of continuous positive airway pressure on oxidative stress in severe sleep apnea. Sleep Breath 2019; 23: 857-63.
22. Difference between apnea-hypopnea index (AHI) and oxygen desaturation index (ODI): proportional increase associated with degree of obesity. Ernst G, Bosio M, Salvado A, Dibur E, Nigro C, Borsini E. Sleep Breath 2016; 20: 1175-83.
23. Preis SR, Massaro JM, Hoffmann U, et al. Neck circumference as a novel measure of cardiometabolic risk: the Framingham Heart study. J Clin Endocrinol Metab 2010; 95: 3701-10.
24. Nigro CA, Dibur E, Borsini E, Malnis S, Ernst G, Bledel I, González S, Arce A, Nogueira F. The influence of gender on symptoms associated with obstructive sleep apnea. Sleep Breath 2018; 22: 683-93.
25. Nogueira F, Nigro C, Cambursano H, Borsini E, Silio J, Avila J. Practical guidelines for the diagnosis and treatment of obstructive sleep apnea syndrome. Medicina (B Aires) 2013; 73: 349-62.
