MATÍAS G. ZANUZZI 1, MÁXIMO J. CATTANEO 1, SILVINA M. LÓPEZ 1, MARÍA DE LOS ÁNGELES PÉREZ MAURE 1, CÉSAR A. ROMERO 1, 2
1 Servicio de Medicina Interna, Hospital Rawson, Ministerio de Salud de Córdoba, Córdoba, Argentina, 2 Global Health Initiative, Henry Ford Hospital, Detroit, Michigan, USA
Resumen La enfermedad cardiovascular y sus factores de riesgos como hipertensión arterial (HTA) y síndrome metabólico (SM), son una creciente causa de mortalidad entre los infectados con HIV. Nuestros objetivos fueron determinar la prevalencia HTA y SM en pacientes HIV positivos de la ciudad de Córdoba su asociación con el estado inmunológico, inflamación y terapia antirretroviral (TARAA). Fue un estudio aleatorizado de corte transversal. Se incluyeron 65 pacientes HIV positivos del programa provincial HIV-Córdoba, 57 (87%) recibían TARAA, 39 (60%) eran masculinos, con edad promedio de 44.7 ± 10 años. La concentración de linfocitos T CD4+ (LTCD4+) fue 404.4 ± 289.6 cel./ml. La carga viral (CV) fue indetectable en 56 (86.2%). La prevalencia de HTA fue de 40% (26/65) y se asoció a la duración de TARAA (p < 0.05). No hubo asociación entre años de infección por HIV, LTCD4+ y CV con HTA. La prevalencia de SM fue de 38.5% (25/65). El uso de TARAA fue más frecuente en aquellos con SM (OR: 1.80; IC95%: 1.43-2.28; p = 0.02). Pacientes bajo TARAA presentaron alta tasa de hipertrigliceridemia, intolerancia a la glucosa y niveles bajos de HDL (todos p < 0.01). SM se asoció a la duración de TARAA (p < 0.01). La TARAA se asoció a HTA y SM, no encontrándose relación con estado inmunológico, CV o marcadores de inflamación.
Palabras clave: hipertensión, síndrome metabólico, HIV, terapia antirretroviral altamente activa
Abstract Cardiovascular diseases (CVD) are a growing cause of mortality between human immunodeficiency virus (HIV) infected patients. Hypertension (HTN) and metabolic syndrome (MS) are important causes of CVD. The prevalence of HTN and MS in HIV infected patients in Córdoba, Argentina is unknown. Our aim is to determine the prevalence of HTN and MS in HIV patients in Córdoba and their association with immunological state, inflammation and highly active antiretroviral therapy (HAART) in an observational study. Sixty-five HIV infected patients from the provincial HIV program were randomly selected. Fifty-seven (87%) were on HAART, 39 (60%) were males. The mean age was 44.7 ± 10 years. Mean CD4+ T lymphocytes (CD4+T) count was 404.4 ± 289.6 cells/ml. Viral load (VL) was undetectable in 56 (86.2%). The prevalence of HTN was 40%, and it was associated with the duration of HAART (p < 0.05). There was no association between years of HIV infection, CD4+T, VL and blood pressure. The prevalence of MS was 38.5% (25/65). MS was more frequent between those with HAART (OR: 1.80; CI 95%; 1.43-2.28; p = 0.02). Patients on HAART had higher rates of hypertriglyceridemia, impaired glucose tolerance and lower levels of HDLc (p < 0.01). MS was associated with the HAART duration (p < 0.01). HIV infected patients had a high prevalence of HTN and MS. HAART was associated with both HTN and MS, but there was no association between immunological status, VL or inflammatory markers.
Key words: hypertension, metabolic syndrome, HIV, antiretroviral therapy highly active
Dirección postal: César A. Romero, Crisol 30 1° “A”, Nueva Córdoba, 5000 Córdoba, Argentina
e-mail: cromerocba@hotmail.com
Conocimiento actual
• La enfermedad cardiovascular y sus factores de riesgo son una creciente causa de morbimortalidad entre los pacientes HIV positivos. El efecto directo del virus, el impacto de la inmunodeficiencia, comorbilidades, coinfecciones, la activación inmune crónica y las toxicidades del tratamiento antirretroviral contribuyen al desarrollo de la enfermedad cardiovascular.
Contribución del artículo al conocimiento actual
• En pacientes HIV/Sida de Córdoba (grupo de 65 casos) se cumple una relación entre HTA (presión arterial elevada) y síndrome metabólico, con el tratamiento antiviral, en especial entre HTA y tratamiento previo con inhibidores de la proteasa.
La creciente supervivencia de las personas infectadas por el virus de la inmunodeficiencia humana (HIV) se relaciona con un aumento de las comorbilidades no comunicables, que incluyen enfermedades cardiovasculares (ECV), diabetes y otras afecciones metabólicas, enfermedades renales, cánceres y enfermedades mentales entre los pacientes infectados por el HIV 1.
Las ECV se han convertido en una causa importante de morbimortalidad en esta población. El riesgo de ECV es 2 veces mayor en las personas que viven con HIV y la carga global de la ECV asociada al HIV se ha triplicado en las últimas dos décadas, siendo responsable de la pérdida de 2.6 millones de años de vida ajustados por discapacidad por año (DALYs)2. La patogenia de los eventos cardiovasculares es multifactorial y compleja. El efecto directo del virus, el impacto de la inmunodeficiencia, las comorbilidades subyacentes, las coinfecciones, la activación inmune crónica y las toxicidades de la terapia antirretroviral altamente activa (TARAA) contribuyen al desarrollo de dichos eventos 3.
La hipertensión arterial (HTA) es un importante factor de riesgo para las ECV y un problema creciente entre las personas que viven con HIV 4. La prevalencia estimada de HTA en adultos infectados por el HIV varía de 15% a 50%, y es significativamente más alta que la tasa observada en personas no infectadas 5.
El síndrome metabólico (SM) designa un grupo de trastornos metabólicos que surgen de la resistencia a la insulina (IR) acompañados por una función y disposición anormal del tejido adiposo. El SM es un factor de riesgo importante para la enfermedad coronaria, la diabetes y varios tipos de cáncer 6. La infección por HIV se ha relacionado con un aumento en los niveles de triglicéridos (TG) y con niveles reducidos de colesterol total (Ct), colesterol HDL (HDLc) y colesterol LDL (LDLc). Pero al mismo tiempo, la TARAA se asocia con cambios morfológicos y metabólicos, tales como lipoatrofia facial y de las extremidades, lipoacumulación dorso-cervical y abdominal, resistencia a la insulina y un perfil lípido diferente en comparación con pacientes no tratados 7.
El programa provincial de HIV-Sida de la provincia de Córdoba, perteneciente al Ministerio de Salud provincial, incluye a cerca de 5000 pacientes, de los cuales 2000 se encuentran en la ciudad de Córdoba. El programa funciona físicamente en el Hospital Rawson de esta ciudad, donde la mayoría recibe asistencia médica. El mismo no incluye pacientes con seguridad social o pertenecientes a empresas pre-pagas de salud. No se conoce la prevalencia de HTA y SM en los pacientes HIV de la provincia
de Córdoba, Argentina. Nuestro objetivo fue determinar esa prevalencia en esta población y, en segundo lugar, analizar si la TARAA, el estado inmunológico y la inflamación de bajo grado tienen asociación con HTA y la presencia de SM.
Materiales y métodos
Se trata de un estudio poblacional, observacional, analítico, de corte transversal, que incluyó pacientes pertenecientes al programa provincial de HIV-Sida de la provincia de Córdoba (n = 2000). En base a esta población se realizó una muestra aleatorizada de 72 pacientes, obtenida por generación de números al azar a través de software Epidat. El tamaño muestral fue calculado con una potencia del 95% y un error de tipo I equivalente al 5% en base a una población de 2000 pacientes, con un margen de error del 10%, asumiendo una prevalencia del 20% y una pérdida del 20% (n = 12). Setenta y dos pacientes fueron seleccionados y contactados por teléfono e invitados a concurrir al hospital para participar.
Los criterios de inclusión fueron: edad mayor de 18 años, serología positiva para HIV, pertenecer al programa provincial de HIV-Sida de la provincia de Córdoba. Criterios de exclusión: embarazadas y pacientes con enfermedad renal terminal.
Se realizó un examen clínico de rutina, con medición de datos antropométricos. Se clasificó a los pacientes acorde al índice de masa corporal (IMC, kg/m2) según los valores publicados por la OMS en normopeso (IMC < 25), sobrepeso (IMC > 25 y < 30) y obesidad (IMC > 30). Se consideraron como sedentarios a aquellos que realizaban menos de 150 minutos semanales de actividad física aeróbica de intensidad moderada o, menos de 75 minutos semanales, cuando ésta era de intensidad elevada.
Se realizó medición de presión arterial en consultorio en 3 oportunidades separadas por 5 minutos, con el paciente sentado y utilizando tensiómetro oscilométrico digital marca Omrom HEM-1. Se utilizó el promedio de las últimas dos mediciones para determinar los valores de PA de cada uno. Para el análisis final se consideraron hipertensos a aquellos con un promedio de presión arterial sistólica (PAS) ≥ 140 mmHg y/o presión arterial diastólica (PAD) ≥ 90 mmHg y a aquellos con diagnóstico previo de HTA. A quienes estaban recibiendo mediación antihipertensiva y tenían un promedio de PAS < 140 mmHg y PAD < 90 mmHg se los consideró hipertensos controlados. Se obtuvo una muestra sanguínea para determinar glucemia, colesterol total, HDLc, LDLc, triglicéridos, acido úrico, creatininemia y ionograma plasmático. El dosaje de proteína C reactiva ultrasensible (PCRus) se realizó a través de kits comerciales (método turbidimétrico) y se utilizó como valor de corte a 4 mg/dl para considerar a un paciente con inflamación de bajo grado. Se realizó diagnóstico de SM en aquellos que tenían un perímetro de cintura > 94 cm en el hombre y > 88 cm en la mujer, asociado a dos de los siguientes criterios: triglicéridos > 150 mg/dl o en tratamiento específico; HDLc < 40 mg/dl en la mujer y < 50 mg/dl en el hombre o en tratamiento con efecto sobre HDLc; PAS ≥ 130 mmHg y/o PAD ≥ 85 mmHg o en tratamiento antihipertensivo; glucemia alterada en ayunas o diabetes, según lo recomendado por la Asociación Latinoamericana de Diabetes (ALAD) 8. Para determinar la presencia de insulinorresistencia se calculó el índice triglicéridos/HDLc, considerando como valores ≥ 3.5 en hombres y ≥ 2.5 en mujeres para hacer diagnóstico 9.
Se dosaron niveles de linfocitos T CD4+ (LTCD4+) por citometría de flujo (BD FACSC, simple plataforma). Se definió como estadío 1 de la Infección por HIV cuando LTCD4+ > 500, estadío 2 entre 200-500 y, estadío 3, cuando el recuento era < 200, acorde a los valores publicados por el CDC (Center for Disease Control and Prevention)10. A su vez se detalló la carga viral plasmática (copias ARN/ml) del HIV de los últimos 6 meses por RT-PCR.
Se obtuvieron datos secundarios a través de las historias clínicas en lo referente al año de diagnostico de la infección por HIV, esquemas de tratamiento antirretroviral previos, enfermedades marcadoras del síndrome de inmunodeficiencia adquirida (Sida), profilaxis antibiótica según valores de LTCD4+, co-infección con el virus de la hepatitis B (VHB) y el de la hepatitis C (VHC).
Los datos cuantitativos se expresaron como promedio ± desvío estándar y, como porcentual a los cualitativos.
Para el análisis de distribución normal los datos cuantitativos fueron evaluados a través del test de Smirnorff-Kolmogorov. Se utilizó test T para comparar las diferencias entre los pacientes con y sin diagnóstico de HTA o SM cuando la distribución de los datos era normal y U de Man-Whitney para las variables de distribución no paramétrico. Se realizó prueba de Chi cuadrado para las variables cualitativas. Se utilizó correlación de Pearson para analizar la asociación entre variables cuantitativas y niveles de PA. A fin de determinar la relación entre años de HIV, cifras de PA, inflamación de bajo grado y perfil lipídico se realizaron modelos de regresión lineal simple y múltiple, incluyendo las variables surgidas de una correlación simple y las esperadas según la bibliografía. Se utilizó software SPSS v24 (Chicago, inc.) y se consideró significativa a una p ≤ 0.05.
El estudio fue aprobado por el comité de ética institucional del Hospital Rawson. Todos los pacientes firmaron consentimiento informado.
Resultados
De los 72 pacientes invitados a participar se incluyeron 65, ya que 7 no concurrieron a la consulta. Treinta y nueve (60%) correspondieron al sexo masculino y la edad promedio fue 44.7 (27-69) años. Veintinueve (44.6%) presentaban sobrepeso, 13 (20%) obesidad, mientras que 23 (35.4%) tenían peso normal. Del total 45 (69.2%) eran sedentarios. El resto de las características clínicas y de laboratorio se presentan en las Tablas 1 y 2.
El tiempo promedio de infección con HIV fue de 7.7 (0-28) años. La mayoría (57/65; 87.7%) estaba bajo TARAA al momento del estudio, con un promedio de LTCD4+ 404.4 ± 289.6 cel/ml y el 86.2% tenía una CV indetectable (Tabla 2).
El diagnóstico previo de HTA estaba presente en 13/65 (20%) y solo la mitad estaba recibiendo tratamiento antihipertensivo (7/13). La prevalencia de HTA fue de 40% (26/65). Según diagnóstico previo de HTA, uso de tratamiento hipertensivo y valores finales obtenidos en consultorio, 50% desconocía su condición de hipertenso, 23.1% conocía su diagnóstico, pero no recibía tratamiento antihipertensivo, 19.2% estaba tratado pero no controlaba PA y, sólo 7.7%, eran hipertensos controlados.
La Tabla 1 muestra que los pacientes con diagnóstico de HTA eran en promedio de mayor edad que los normotensos, sin encontrar diferencias entre sexos. La duración de la infección por HIV fue similar entre HTA y normotensos. El antecedente de familiares con HTA era más frecuente en los hipertensos (84.6% vs. 59.0%; p = 0.03). Los hipertensos eran significativamente más obesos (34.6% vs. 10.3%; p = 0.04), con un perímetro de cintura mayor, sin embargo, no se encontraron diferencias con respecto al grado de actividad física (HTA 2.1 ± 3.0 h/semana vs. No HTA 3.8 ± 4.9 h/semana; p = 0.20).
Si bien los hipertensos tenían un perfil metabólico más alterado que los normotensos (Tabla 1), el porcentaje de insulinorresistencia fue similar entre ambos grupos (p = 0.2). Tampoco se encontraron diferencias en la inflamación de bajo grado entre ambos grupos, medida a través de PCRus (3.3 ± 3.8 vs. 2.6 ± 4.2; p = 0.4) y dímero D (299.3 ± 109.5 vs 285.3 ± 137.8; p = 0.7).
Cuando se analizaron las características clínicas asociadas al diagnóstico de la infección por el HIV según diagnóstico de HTA, no encontramos diferencias con respecto a los años de infección y al número LTCD4+. Sin embargo, los hipertensos tenían más años de TARAA y un porcentaje de pacientes bajo TARAA mayor (Tabla 2).
En el análisis por clase de TARAA recibida no se encontraron diferencias entre ambos grupos, sin embargo, aquellos que habían recibido inhibidores de proteasa (IP) como parte de sus tratamientos previos, presentaron mayor frecuencia de HTA. No se encontraron diferencias con respecto al historial de enfermedades marcadoras de Sida y a la co-infección con VHB y VHC.
La prevalencia de SM fue del 38.5% (25/64), sin encontrar diferencias con respecto a la edad, género y hábitos tóxicos El porcentaje de obesos fue mayor dentro del grupo con SM (40.0 vs. 5.3%; p = 0.001), lo cual también se refleja en el IMC (29.0 ± 4.5 vs. 23.6 ± 3.6; p = < 0.01) y perímetro de cintura (101.5 ± 7.6 vs. 83.5 ± 9.7; p = < 0.01). El SM se relacionó con PAS (p= 0.03) y PAD (p = 0.01). En consultorio, los valores de PAS y PAD eran respectivamente 9 mmHg y 7 mmHg más elevados que en los pacientes sin SM. Los niveles de ácido úrico (p = 0.02) y creatininemia (p = 0.01) fueron significativamente mayores en los pacientes con SM.
Con respecto a la relación TG/HDLc hubo una diferencia significativamente mayor para los pacientes con SM, demostrando una clara diferencia en el porcentaje de aquellos con insulinorresistencia entre ambos grupos (72.0 vs. 31.6%; p = 0.005). Si bien los pacientes con SM presentaron mayores niveles de PCRus, las diferencias no fueron significativas entre ambos grupos (p = 0.2).
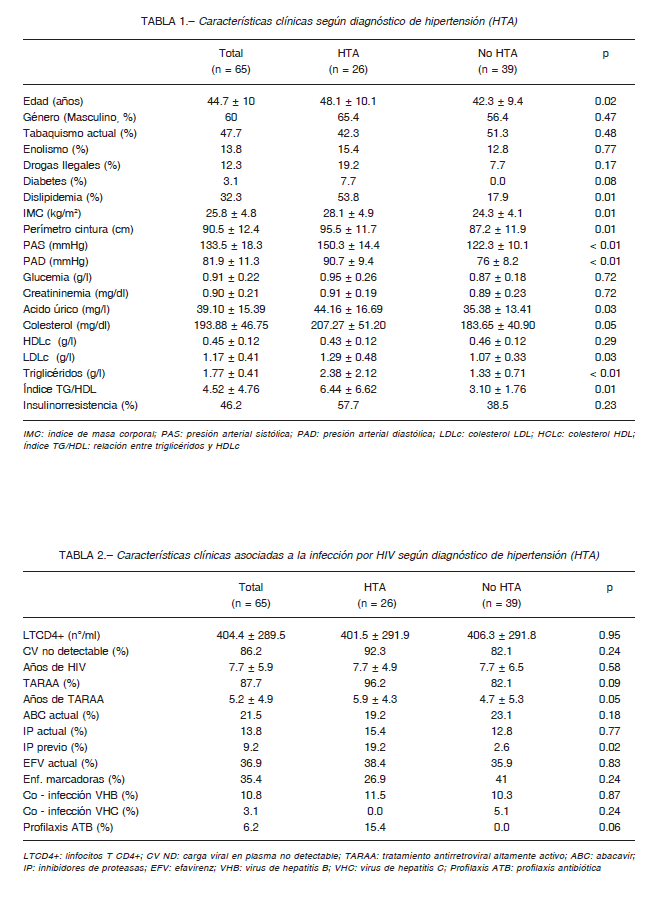
Dentro de los componentes del SM encontramos que la PA fue el más frecuente (88%), seguido por niveles de triglicéridos (68%), valores de HDLc (64%) y glucemia (24%). Cuando realizamos el análisis por género, solo se halló la misma distribución de los componentes para los hombres. En el caso de las mujeres, la PA seguía siendo el más frecuente, sin embargo, niveles bajos de HDLc era más frecuente que los niveles de triglicéridos (Fig. 1).
En la Tabla 3 se observa las características del HIV según diagnostico de SM. No se encontraron diferencias con respecto a los años de infección, a los niveles de LTCD4+ y a la cantidad de copias del virus en sangre. Entre los pacientes con SM la TARAA era más frecuente, con un riesgo asociado de SM para aquellos bajo tratamiento de casi el doble (OR: 1.80; IC 95%; [1.428-2.285]; p = 0.023).
Con respecto a los componentes del SM, en los tratados era más frecuente el aumento de triglicéridos (42.1 vs. 12.5%; p = 0.009), la HTA (66.7 vs. 25%; p = 0.023), la intolerancia a la glucosa (22.8 vs. 0%; p = 0.019) y niveles bajos de HDLc (52.6 vs. 37.5%; p = 0.003). La presencia de SM no solo se asoció con el uso de TARAA sino que también a la duración. Esto se ve reflejado en el mayor número con carga viral indetectable, aunque sin diferencias significativas (p = 0.09).
Discusión
En nuestro estudio pudimos demostrar que existe una alta prevalencia de HTA y SM entre los pacientes HIV de la ciudad de Córdoba. Si bien el estado inmunológico y la inflamación de bajo grado se asocian con el desarrollo de enfermedades cardiovasculares, solo la TARAA y la duración de la misma se asociaron con la presencia de HTA y SM en nuestros pacientes. Entre quienes tenían HTA, encontramos que la mitad desconocía su diagnóstico.
En aquellos con diagnóstico previo de HTA solo la mitad recibía tratamiento anti-hipertensivo y de estos el 30% tenía la presión controlada. Del total hipertensos, solo el 7% se encontraba tratado y controlado. Estas cifras se encuentran muy por debajo de los valores comunicados a nivel nacional 11, 12. Además, encontramos muy elevada prevalencia de obesidad-sobrepeso y sedentarismo en esta población.
La prevalencia estimada de HTA en pacientes HIV oscila en un rango amplio, en un meta análisis reciente 13 la prevalencia de HTA para pacientes HIV positivos fue de 25.2%, la cual ascendía a 40.3% en mayores de 50 años, edad similar al promedio de nuestros pacientes.
La hipertensión en los portadores de HIV se atribuye a un gran número de mecanismos. Se ha demostrado que persiste replicación viral en diversos tejidos corporales de infectados que están bajo TARAA eficaz y con carga viral indetectable en plasma a través de los métodos actuales, lo cual predispone a un estado de inflamación de bajo grado crónico14. Los pacientes HIV presentan marcadores elevados de disfunción endotelial, inflamación y coagulación.
En un estudio Arildsen y col. 15 comparan los niveles de estos marcadores antes y después de 6 meses del tratamiento antirretroviral. Si bien los niveles disminuyen sustancialmente luego del tratamiento, aún permanecen más elevados que los del grupo de personas no infectadas.
En nuestro estudio no hemos podido demostrar asociación entre el estado inmunológico (LTCD4+, carga viral en plasma), marcadores de inflamación de bajo (PCRus) y alteración de la cascada de la coagulación (Dímero D) con hipertensión, lo cual puede deberse a que casi el 90% se encontraban con carga viral indetectable.
La duración de la infección no fue diferente entre los pacientes con y sin hipertensión. Sin embargo, en los hipertensos, hubo un porcentaje mayor de profilaxis antibiótica.
Esta relación entre HTA y profilaxis antibiótica podría ser explicada a través de dos potenciales mecanismos.
Uno, podría ser reflejo de un grado de inmunodeficiencia grave en el pasado. Se ha demostrado 16, que el nadir de LTCD4+ se relaciona con hipertensión sostenida y eventos cardiovasculares. Por otro lado, el uso de profilaxis antibiótica podría asociarse a algún grado de daño renal subclínico debido a la toxicidad de algunos antibióticos como la trimetroprima-sulfometoxazol 17.
Los hipertensos tenían una mayor duración de TARAA con respecto a los normotensos. Baekken y col. 18 informaron que las personas expuestas a más de 5 años de TARAA tenían tasas más altas de HTA que las de los controles HIV negativos, iguales en edad, sexo e IMC, y a las personas con HIV que no habían recibido TARAA.
Palacios y col. 19 compararon los niveles de PA previos y posteriores al comienzo de la TARAA; luego de 48 semanas de tratamiento aumentó significativamente la prevalencia de HTA en el grupo de pacientes tratados. En dicho estudio no encontraron asociación entre la HTA y la prevalencia de Sida, duración de la infección, niveles de ARN plasmáticos de HIV, recuento de LTCD4+ o el uso de diferentes grupos de antirretrovirales, lo cual coincide con nuestros resultados.
La prevalencia real del SM entre las personas con HIV es aún controvertida debido a las estimaciones de muy amplio rango en los estudios observacionales, por lo que es difícil establecer si la prevalencia en pacientes con HIV es diferente o comparable a la informada para la población general.
La prevalencia obtenida en nuestro estudio fue mayor a la de otras publicaciones en las cuales se obtuvieron resultados similares a la población general 20, 21.
En el análisis por género no encontramos diferencias, lo cual difiere de la mayoría de las publicaciones en las cuales las mujeres tienen una prevalencia mayor que los hombres 22.
No encontramos asociación entre el SM y los años de infección por el HIV. En algunos estudios se informó que a mayor duración de la infección mayor riesgo de desarrollo del SM 23, 24, sin embargo, no siempre se ajustaba estos resultados a la edad de los pacientes.
La relación causal entre la TARAA y la presencia del SM ya ha sido descripta 25. En nuestro estudio, el uso de TARAA era más frecuente dentro de los pacientes con SM. Encontramos una asociación positiva entre la duración de la TARAA y la presencia del SM. Esto concuerda con el hallazgo de Bosho y col. 26 en el cual los que recibieron TARAA durante más de 5 años tenían un 15.6% más de probabilidades de tener SM que aquellos con una duración del tratamiento menor. Resultados similares fueron publicados en el estudio DAD en el cual hubo incremento de la prevalencia de SM luego de un período de seguimiento mayor 27.
En el análisis por componentes del SM encontramos que el aumento de la PA y de triglicéridos fueron los criterios más frecuentes. La hipertrigliceridemia fue más frecuente en los pacientes bajo TARAA (42.1 vs 12.5%), lo cual coincide con la publicación de Ekoru y col. 28 en la cual los pacientes bajo tratamiento tenían el doble de riesgo que los naive (RR 2.05; IC 1.51-2.77). Se han propuesto muchos mecanismos por los cuales el TARAA puede llevar a niveles elevados de TG, entre los cuales se destaca una reducción en el aclaramiento de TG de la circulación a través del deterioro de la actividad de la lipoproteína lipasa 29.
El bajo nivel de HDLc fue el segundo componente más importante en las mujeres y el tercero cuando no se hizo un análisis por género. En nuestros pacientes no hubo diferencia entre aquellos que estaban recibiendo o no TARAA, lo que coincide con un estudio de cohorte realizado en España, donde los no tratados presentaron niveles bajos de HDLc, al igual que en aquellos que recibían TARAA que presentaban una supresión viral adecuada y una reconstitución inmune 30.
En nuestro estudio pudimos observar que los pacientes HIV tienen una alta prevalencia de factores de riesgo cardiovascular cuando comparamos los resultados con el 4° informe sobre factores de riesgo de la ciudad de Córdoba 31.
Podemos observar que los pacientes con HIV tienen un mayor porcentaje de tabaquismo (47.7% vs. 26.5%) y consumo de alcohol (13.8% vs. 11.2%), lo cual coincide con lo publicado previamente 32 donde los HIV positivos mostraron mayores hábitos tóxicos que la población general.
Con respecto al sobrepeso y la obesidad, encontramos resultados similares a la población de la provincia de Córdoba 31, lo cual refleja que no solo es importante realizar medidas antropométricas clásicas en los pacientes HIV, sino que además se deben buscar cambios específicos en la distribución de la grasa corporal tales como la lipoatrofia, giba dorsal, etc. 33
Destacamos como limitaciones de nuestro trabajo que fue realizado en un solo centro, dentro de un programa que muestra un alto grado de control del HIV, lo que puede no representar a todos los pacientes HIV positivos.
Respecto de la metodología del estudio debemos recordar que, al tratarse de un estudio de asociación, los hallazgos aquí demostrados deben ser confirmados con estudios prospectivos. Una sola toma de presión puede no ser diagnóstica, debido al efecto de bata blanca y la presencia de hipertensión enmascarada, si bien estos números tienden a neutralizarse entre sí.
Los pacientes HIV positivos presentan una alta prevalencia de hipertensión y síndrome metabólico. Los infectados con HIV que presentan HTA, muestran un bajo grado de tratamiento antihipertensivo y control de la presión arterial. Esta población presenta alta prevalencia de obesidad y sobrepeso, así como de sedentarismo, cuando la comparamos con la población general de la misma ciudad y año en el que se realizó el estudio. El tratamiento antirretroviral, así como su duración, fue el principal factor de riesgo asociado a hipertensión y síndrome metabólico.
Agradecimientos: El presente trabajo se realizó gracias al aporte de la Sociedad Argentina de Hipertensión Arterial (SAHA) a través del programa de Beca Anual en Área Epidemiológica otorgado en abril de 2013
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Casper C; Crane H; Menon M, et al. HIV/AIDS comorbidities: Impact on cancer, noncommunicable diseases, and rreproductive health. En: Holmes KK, Bertozzi S, Bloom BR, et al, editors. Major Infectious Diseases. 3rd edition. Washington (DC): The International Bank for Reconstruction and Development / The World Bank; 2017 Nov 3. Chapter 3. En: https://www.ncbi.nlm.nih.gov/books/NBK525185/ doi: 10.1596/978-1-4648-0524-0/ch3; consultado marzo 2020.
2. Shah ASV, Stelzle D, Lee KK, et al. Global burden of atherosclerotic cardiovascular disease in people living with the human immunodeficiency virus: a systematic review and meta-analysis. Circulation 2018; 138: 1100-12.
3. Hsu D, Sereti I. Serious non-AIDS events: therapeutic targets of immune activation and chronic inflammation in HIV infection. Drugs 2016; 76: 533-49.
4. De Socio GV, Ricci E, Maggi P, et al. Prevalence, awareness, treatment, and control rate of hypertension in HIV-infected patients: the HIV-HY study. Am J Hypertens 2014; 27: 222-8
5. Lattanzi S, Brigo, F, Silvestrini M. Integrated care of hypertension in HIV patients. J Clin Hypertens 2018; 20: 1493-5.
6. Kaur, J. A comprehensive review on metabolic syndrome. Cardiol Res Pract. 2014: 943162.
7. Duro M, Sarmento Castro R, Almeida C, et al. Lipid profiles changes by high activity anti – retroviral therapy. Clinical Biochemistry 2013; 46: 740-4.
8. Consenso latinoamericano de la Asociación Latinoamericana de Diabetes (ALAD). Epidemiología, diagnóstico, control y tratamiento del síndrome metabólico en adultos. En: http: //alad-americalatina.org/wp-content/uploads/2016/10/SX.-METABOLICO-EN-AULTOS.pdf; consultado marzo 2020.
9. Salazar M; Carbajal H, Espeche W, et al. Comparison of the abilities of the plasma triglyceride/high-density lipoprotein cholesterol ratio and the metabolic syndrome to identify insulin resistance. Diab Vasc Dis Res 2013; 10: 346-52.
10. Selik R, Mokotoff E, Branson B, et al. Revised Surveillance Case Definition for HIV Infection – United States, 2014. MMWR 2014; Vol 63, N° 23.
11. Delucchi A, Majul C, Vicario A, et al. Registro nacional de hipertensión arterial. Características epidemiológicas de la hipertensión arterial en la Argentina. Renata 2. Rev Argent Cardiol 2017; 85: 354-60.
12. Marín MJ, Garcia Vasquez F, Martinez Marissi E, et al. May measurement month: analysis of the blood pressure screening in Argentina – Americas. Eur Heart J Suppl 2019; 21: D8-D10.
13. Yunan X, Xinguang C, Wang K. Global prevalence of hypertension among people living with HIV: a systematic review and meta-analysis. J Am Soc Hypertens 2017; 11: 530-40.
14. Ghosn J, Taiwo B, Seedat S, et al. HIV. The Lancet 2018; 392: 685-697.
15. Arildsen H, Sorensen KE, Ingersev JM, et al. Endothelial dysfunction, increased inflammation and activated coagulation in HIV-infected patients improve after initiation of highly active antiretroviral therapy. HIV Medicine 2013; 14: 1-9.
16. Manner I, Troseid M, Oektedaken O, et al. Low nadir CDA cell count predicts sustained hypertension in HIV-infected individuals. The Journal of Clinical Hypertension 2013; 15: 101-107.
17. Fraser T, Avellaneda A, Graviss E, Musher D. Acute kidney injury associated with trimethroprim/sulfamethoxazole. J Antimicrob Chemother 2012; 67: 1271-7.
18. Baekken M, Os I, Sanvik L, Oektedalen O. Hypertension in an urban HIV-positive population compared with the general population: influence of combination of antiretroviral therapy. J Hypertens 2008; 26: 2126-33.
19. Palacios R, Santos J, García A, et al. Impact of highly active antiretroviral therapy on blood pressure in HIVinfected patients. A prospective study in a cohort of naïve patients. HIV Medicine 2006; 7: 10-5.
20. Calza L, Colangeli V, Magistrelli E, et al. Prevalence of metabolic syndrome in HIV-infected patients naive to antiretroviral therapy or receiving a first-line treatment. HIV Clinical Trials 2017; 18: 110-7.
21. Cahn P, Leite O, Rosales A, et al. Metabolic profile and cardiovascular risk factors among Latin American HIVinfected patients receiving HAART. Braz J Infect Dis 2010; 14: 158-66.
22. Rogalska-Polnska M, Grzeszczuk A, Rogalski P, Lucejko M, Flisiak R. Metabolic syndrome in HIV infected adults in Poland. Kardiologia Polska 2018; 76: 548-53.
23. Serrao R, Piñero C, Vélez J, et al. Non-AIDS-related comorbidities in people living with HIV-1 aged 50 years and older: The AGING POSITIVE study. Int J Infect Dis 2019; 79: 94-100.
24. Raposo MA, Armiliato GNA, Guimarães NS, Caram CA, Silveira RDS, Tupinambás U. Metabolic disorders and cardiovascular risk in people living with HIV/AIDS without the use of antiretroviral therapy. Rev Soc Bras Med Trop 2017; 50: 598-606.
25. Krishnan S, Schouten JT, Atkinson B, et al. Changes in metabolic syndrome status after initiation of antiretroviral therapy. J Acquir Immune Defic Syndr 2015; 68: 73-80.
26. Bosho D, Dube L, Mega T, et al. Prevalence and predictor of metabolic syndrome among people living with human immunodeficiency virus. Diabetol Metab Syndr 2018; 10: 10.
27. Friis-Møller N, Weber R, Reiss P, et al. Cardiovascular disease risk factors in HIV patients–association with antiretroviral therapy. Results from the DAD study. AIDS 2003; 17: 1179-93.
28. Ekoru K, Young EH, Dillon DG, et al. HIV treatment is associated with a twofold higher probability of raised triglycerides: pooled analyses in 21023 individuals in Sub-Saharan Africa. Global Health Epidemiol Genom 2018; 3: e7.
29. Liang JS, Distler O, Cooper DA, et al. HIV protease inhibitors protect apolipoprotein B from degradation by the proteasome: a potential mechanism for protease inhibitorinduced hyperlipidemia. Nat Med 2001; 7: 1327-31.
30. Estrada V, Geijo P, Fuentes-Ferrer M, et al. Dyslipidaemia in HIV-infected women on antiretroviral therapy. Analysis of 922 patients from the Spanish VACH cohort. BMC Women’s Health 2011; 11: 36.
31. Dirección General de Estadísticas y Censos de la Provincia de Córdoba. Encuesta Nacional de Factores de Riesgo para la Salud. En: https: //datosestadistica.cba.gov.ar/dataset/156dea86-bc8d-4a9a-82df-04b67b6d63a7/resource/365494ac-a7bb-4557-982d-7a3cc7e88d25/download/desd_enfr_2005_2009_2013.pdf; consultado marzo 2020.
32. Wardell JD, Shuper PA, Hendershot CS. A longitudinal investigation of the association between cannabis use and alcohol use among people living with HIV. Drug Alcohol Depend 2018; 193: 7-13.
33. Grinspoon S, Carr A. Cardiovascular risk and body-fat abnormalities in HIV- infected adults. N Eng J Med 2005; 352: 48-62.
– – – –
The fundamentally novel effect of human evolution is that the anthropogenic change of our habitat is now proceeding so fast that genetic evolution cannot possibly keep pace with it –each of us becomes a Rip van Winkle* even in his own lifetime. We have coped with this in three ways: by invading more and more land areas of the world; by living in far higher densities than our ancestors; and by adjusting phenotypically to a wide range of new conditions.
El nuevo y fundamental efecto de la evolución humana es que el cambio antropogénico ahora es tan rápido que la evolución genética no puede mantener el paso con el –cada uno de nosotros se transforma en un Rip van Winkle aun en su propia vida. Lo enfrentamos de tres maneras: invadiendo más y más las tierras del mundo; viviendo en densidades mucho mayores que nuestros ancestros y ajustando el fenotipo a un amplio abanico de nuevas condiciones.
Nikolaas (Niko) Tinbergen* (1907-1988)
The Croonian Lecture. Functional ethology and the human sciences. Proc R Soc Lond Biol Sci 1972; 182: p 385-410
*Rip van Winkle es el protagonista de un cuento de Washington Irving. Rip es un vago que duerme y sueña por veinte años, cuando despierta, se sorprende por los cambios que ocurrieron mientras dormía. *Tinbergen recibió el Premio Nobel de Fisiología o Medicina junto con Konrad Lorenz y Karl von Fritsch “por sus descubrimientos relativos a la organización y elicitación [sic] de los patrones de conducta individual y social.”
