GISELA VECCHIO 1, 2, VALERIA ZAPICO 1, ALEJANDRO CATANZARITI 1, INDALECIO CARBONI BISSO 2, MARCOS LAS HERAS 2
1 Farmacia, 2 Terapia Intensiva de Adultos, Hospital Italiano de Buenos Aires, Argentina
Resumen Durante el transcurso de la pandemia causada por el virus SARS-CoV-2 se han utilizado diferentes fármacos como potenciales tratamientos específicos con el objetivo de lograr mejoría clínica y/o disminuir la mortalidad de los afectados, pero al tratarse de una enfermedad hasta ahora desconocida, la evidencia acerca de su seguridad y eficacia se va construyendo a medida que se los prescribe. La farmacovigilancia intensiva en este contexto permite detectar eventos adversos y mediante su reporte y análisis inferir el perfil de seguridad en cada indicación. Se realizó un estudio observacional, retrospectivo, en un único centro, en el cual se relevaron los eventos adversos en 23 pacientes adultos en estado crítico, de los cuales 18 recibieron lopinavir/ritonavir como tratamiento empírico, entre el 15 de marzo y el 15 de junio de 2020, durante su internación en una Unidad de Cuidados Intensivos. Se describe el tipo de eventos adversos, su gravedad y si fueron motivo de suspensión del tratamiento. Los resultados del presente análisis muestran una alta tasa de eventos adversos (10/23, 43%) entre los que recibieron lopinavir/ritonavir, llevando en la mayoría de los casos a la decisión de suspender el mismo antes de completar el tratamiento. Aun con las limitaciones propias del reducido número de casos, la divulgación de dichos resultados aporta evidencia para definir el perfil de seguridad de la combinación lopinavir / ritonavir usado en enfermedad grave por SARS-CoV-2.
Palabras clave: cuidados críticos, COVID-19, Argentina, lopinavir, ritonavir
Abstract During the SARSCoV-2 pandemic many drugs have been used as potential treatments in order to improve the clinical outcome and reduce the mortality. But since it is a currently unknown disease, the evidence about efficacy and
safety is built as the drugs are prescribed. In this context, intensive pharmacovigilance allows early detection of adverse events, and thereby infer the safety profile of the indication. We conducted an observational, retrospective, single-center study involving adult patients with severe SARS-CoV-2 infection. All adverse events detected in 23 patients in the Intensive Care Unit between March 15 and June 15, 2020 were registered. We describe type and severity of the adverse events and if treatment suspension was needed. The results show a high rate of adverse events (10/23, 43%) in treatment with lopinavir/ritonavir. In most cases early treatment suspension was required. Even though the limitations of our study derived from the small sample size, these results could help in building evidence about the safety of using lopinavir/ritonavir for severe SARS-CoV-2 infection.
Key words: critical care, COVID-19, Argentina, lopinavir, ritonavir
Dirección postal: Gisela Vecchio, Hospital Italiano de Buenos Aires, Tte. Gral. J. D. Perón 4190, 1199 Buenos Aires, Argentina
e-mail: gisela.vecchio@hospitalitaliano.org.ar
La enfermedad por coronavirus (COVID-19), causada por el coronavirus tipo 2 del síndrome respiratorio agudo grave (SARS-CoV-2), fue definida como pandemia por la Organización Mundial de la Salud (OMS) en marzo de 2020 1, y desde entonces, ha afectado a más de 12 millones de personas alrededor del mundo. En Argentina el primer caso confirmado se registró el 5 de marzo de 2020 2 y al 15 de junio el total de personas contagiadas en el país era 32 785, 47% en Ciudad Autónoma de Buenos Aires 3. En este mismo período en nuestro centro, un hospital universitario de alta complejidad, se confirmaron 338 casos, de los cuales 23 requirieron internación en la Unidad de Cuidados Intensivos (UCI).
Ante la ausencia de un tratamiento antiviral específico para COVID-19, la OMS ha priorizado algunos medicamentos para ser investigados en ensayos clínicos basados en la eficacia in vitro, así como de los datos de seguridad disponibles 4. Uno de los tratamientos propuestos es la combinación lopinavir/ritonavir, que en 2003, durante el brote de coronavirus del síndrome respiratorio agudo grave (SARS-CoV-1), demostró actividad inhibitoria in vitro contra ese virus 5. Sin embargo, recientemente el estudio LOTUS, diseñado para evaluar la eficacia de lopinavir /ritonavir en COVID-19, no encontró diferencias significativas en la mortalidad o mejoría clínica respecto de placebo, pero sí se informaron eventos adversos más comúnmente en el grupo que recibió tratamiento 6.
Ante la escasez de ensayos controlados, la revisión oportuna de los datos y la detección de señales en tiempo real pueden proporcionar información de seguridad 7. Presentamos una serie de casos en los que se administró lopinavir/ritonavir a pacientes con COVID-19 internados en la unidad de cuidados intensivos (UCI) de nuestro centro.
Materiales y métodos
Se realizó un estudio observacional, retrospectivo, en un único centro. Se incluyeron los datos de los mayores de 18 años con COVID-19 internados en la UCI que siguiendo los criterios de indicación del Ministerio de Salud de la Nación 8, recibieron lopinavir/ritonavir (400/100 mg cada 12 horas en comprimidos recubiertos o solución oral) como tratamiento empírico de enfermedad grave por SARS-Cov-2, entre el 15 de marzo de 2020 y el 15 de junio de 2020.
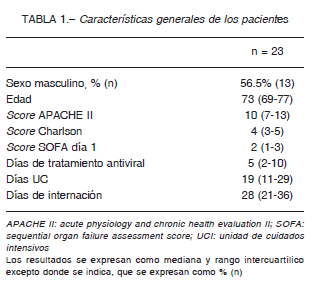
Las características generales, como sexo, edad, gravedad, duración de la estadía en la UCI, días de internación hospitalaria y días de tratamiento se extrajeron de las historias clínicas de los casos incluidos. Para los casos en los que se observó un evento adverso se registraron, además, los signos/síntomas, el tiempo transcurrido desde el inicio del tratamiento y se aplicó el algoritmo de Naranjo 9. Este algoritmo consta de una serie de diez preguntas que intenta establecer causalidad entre el evento y el fármaco y cuyo resultado (de mayor a menor grado de causalidad) puede ser: reacción definida, probable, posible o dudosa. Finalmente se clasificaron los eventos adversos según su gravedad 10 en:
Leves: eventos adversos fácilmente tolerados, no necesitan tratamiento, generalmente de corta duración, no prolongan la hospitalización.
Moderados: manifestaciones clínicas importantes, sin amenaza inmediata a la vida pero que requieren medidas terapéuticas.
Graves: que producen la muerte, amenazan la vida, producen incapacidad permanente o sustancial, requieren hospitalización o prolongan el tiempo de hospitalización, producen anomalías congénitas o procesos malignos.
Resultados
Durante el período de estudio, 23 pacientes fueron confirmados como COVID-19 en la UCI de nuestro centro (Tabla 1). Entre ellos, 18 iniciaron lopinavir/ritonavir como tratamiento empírico de enfermedad grave por SARSCoV-2 y 5 fueron excluidos por encontrarse recibiendo medicación crónica que contraindicaba el inicio del tratamiento.
Solo 6 de los 18 completaron el tratamiento y otros 10 presentaron eventos adversos que llevaron a suspender el mismo antes de los 10-14 días estipulados.
En 2 casos se suspendió lopinavir/ritonavir para evitar potenciales interacciones medicamentosas graves con otros fármacos que el paciente debía recibir.
Mediante la aplicación del algoritmo de Naranjo sobre los eventos que llevaron a la suspensión del fármaco, se estableció una relación de causalidad definida como “posible” en el 80% de los eventos, y en un 20% como “probable”.
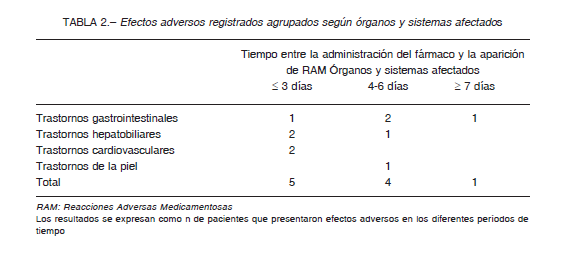
De los 10 eventos adversos detectados (Tabla 2) se clasificaron 5 como leves (intolerancia gastrointestinal, elevación transitoria de enzimas hepáticas, que revirtieron rápidamente al suspender el fármaco sin requerir tratamiento adicional), 4 como moderados (1 farmacodermia, 2 diarreas y 1 bradicardia, que requirieron tratamiento) y 1 grave (bradicardia extrema).
Los eventos adversos detectados se notificaron al Sistema Nacional de Farmacovigilancia.
Discusión
Ante una virosis sin tratamiento específico conocido, en la que un porcentaje de pacientes cursan una forma grave de presentación, enfrentamos el dilema de proveer solo medidas clínicas de sus complicaciones o administrar además medicamentos específicos, aunque la evidencia de sus beneficios no haya sido demostrada. Si se decide utilizar estos medicamentos se deben tener en cuenta sus contraindicaciones, interacciones medicamentosas y eventos adversos.
En nuestra serie de casos se detectó una alta incidencia de eventos adversos, similar a la publicada por Cao y col. 6 pero superior a otras series. Esto puede deberse a que todos nuestros pacientes eran casos de COVID-19 grave mientras que en otros publicados se incluyen casos leves a moderados 11, 12. El tipo de eventos adversos en nuestra serie de casos coinciden con los ya descritos para lopinavir/ritonavir en el tratamiento de la infección del HIV 13 y con los descritos en pacientes con COVID- 19 11.
Todos los eventos adversos se manifestaron dentro de los siete días de iniciado el tratamiento, de los cuales la mitad se dio dentro de los primeros tres días.
Las limitaciones de este trabajo están dadas por tratarse de un estudio unicéntrico y retrospectivo, que ha estudiado un número pequeño de una población específica, la de pacientes críticos, con mayor coexistencia de factores predisponentes a los eventos descritos. Sin embargo, la detección oportuna de los efectos adversos y la asignación de causalidad al uso de lopinavir/ ritonavir efectuada nos permitió suspender tempranamente el tratamiento evitando de esta manera un mayor daño.
Por otra parte, el informe de estos eventos al Sistema Nacional de Farmacovigilancia, representa un aporte de información que, analizada de manera global, permitirá definir mejor el perfil de eventos adversos del fármaco en la subpoblación de pacientes COVID-19 que lo reciben.
Bibliografía
1. Coronavirus Disease (COVID-19) – events as they happen, En: https://www.who.int/emergencies/diseases/novelcoronavirus-2019/events-as-they-happen; consultado junio 2020.
2. Gemelli NA. Management of COVID-19 outbreak in Argentina: the beginning. Disaster Med Public Health Prep 2020; 1-3. doi: 10.1017/dmp.2020.116.
3. Argentina.gob.ar. Junio de 2020. En: https://www.argentina.gob.ar/coronavirus/informe-diario/junio2020; consultado junio 2020.
4. R&D Blueprint and COVID-19. En: https://www.who.int/teams/blueprint/covid-19; consultado julio 2020.
5. Chu CM. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax 2004; 59: 252-6.
6. Cao B, Wang Y, Wen D, et al. A trial of lopinavir-ritonavir in adults hospitalized with severe Covid-19. N Engl J Med 2020; 382: 1787-99.
7. Chandler RE, McCarthy D, Delumeau J-C, et al. The role of pharmacovigilance and ISoP during the global COVID-19 pandemic. Drug Saf 2020; 43: 511-2.
8. Tratamiento farmacológico específico con lopinavir/ritonavir de pacientes con infección por COVID-19. Ministerio de Salud Argentina. En http://www.msal.gob.ar/images/stories/bes/graficos/0000001852cnt-tratamiento-farmacologico-especifico-con-lopinavir-ritonavir-pacientes-infeccioncovid19-irets.pdf; consultado julio 2020.
9. Naranjo CA, Busto U, Sellers EM, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981; 30: 239-45.
10. ANMAT. Guía de buenas prácticas de farmacovigilancia. En: http://www.anmat.gov.ar/farmacovigilancia/docs/Guia_BPF.pdf ; consultado julio 2020.
11. Tobaiqy M, Alhumaid S, Al Mutair A. Efficacy and safety of lopinavir/ritonavir for treatment of COVID-19: A Systematic review and meta-analysis. MedRxiv 2020. 06.16.20133298.
12. Li Y, Xie Z, Lin W, et al. Efficacy and safety of lopinavir/ritonavir or arbidol in adult patients with mild/moderate COVID-19: an exploratory randomized controlled trial. Med 2020; 1: 1-9.
13. Kaletra – Ficha técnica. En: https://www.ema.europa.eu/en/documents/product-information/kaletra-epar-productinformation_es.pdf; consultado julio 2020.
