GUILLERMO MENGA†, MELINA S. GIRBAL, LUCIANA MONTOTO PIAZZA, MARTIN E. FERNÁNDEZ
Hospital Municipal de Rehabilitación Respiratoria María Ferrer, Buenos Aires, Argentina
Resumen La deficiencia de alfa-1 antitripsina (AAT) es uno de los trastornos hereditarios más frecuentes y con mayor incidencia en pacientes con enfermedad pulmonar obstructiva crónica (EPOC). Se desconoce su prevalencia en aquellos con neumotórax espontáneo. El objetivo fue estimar la prevalencia de deficiencia de AAT en sujetos con neumotórax espontáneo. El estudio fue prospectivo y de corte transversal en pacientes con neumotórax espontáneo primario. Se excluyeron aquellos con neumotórax secundario. Se realizó cuantificación de AAT en suero por nefelometría y posterior genotipificación rápida (PCR en tiempo real) para detectar los alelos de deficiencia más prevalentes (Z y S) en aquellos con concentraciones séricas ≤ 120 mg/dl. Se incluyeron 58 pacientes con neumotórax espontáneo primario. La edad promedio fue de 34 ± 13 años con predominio de sexo masculino (72%) y alta prevalencia de tabaquismo actual y pasado (60%). Del total, el 26% (IC95%: 15-39) presentó concentraciones de AAT ≤ 120mg/dl. Encontramos 7 formas deficitarias (12%; IC 95%: 5-23%). Un paciente presentó una forma grave Pi*ZZ (1.7%), 3 fueron heterocigotos Z (5.2%) y 3 heterocigotos S (5.2%). La prevalencia de variantes deficitarias de AAT fue alta en este grupo con neumotórax espontáneo.
Palabras clave: neumotórax espontáneo, déficit de alfa-1 antitripsina, prevalencia
Abstract Alpha-1 antitrypsin (AAT) deficiency is one of the most common inherited disorders with a higher incidence in patients with chronic obstructive pulmonary disease (COPD). Its prevalence in patients with spontaneous pneumothorax is unknown. The objective was to estimate the prevalence of AAT deficiency in patients with spontaneous pneumothorax. This was a prospective cross-sectional study, in patients with spontaneous pneumothorax, where those with secondary pneumothorax were excluded. Quantification of serum AAT by nephelometry and subsequent rapid genotyping (real time PCR) was performed, in order to detect the most prevalent deficiency alleles (Z and S) in those subjects with serum AAT concentrations ≤ 120 mg/dl. Fifty-eight patients with primary spontaneous pneumothorax were included. The average age was 34 ± 13 years with male predominance (72%) and high prevalence of current and past smoking (60%). Twenty six percent of them (95% CI: 15-39) presented AAT serum concentrations ≤ 120mg/dl. We found 7 deficiency variants (12%; IC 95%: 5-23%). One patient presented a severe Pi*ZZ form (1.7%), 3 were heterozygotes Z (5.2%) and 3 heterozygotes S (5.2%). The prevalence of AAT deficient variants was high in patients with spontaneous pneumothorax.
Key words: pneumothorax, spontaneous, alpha-1 antitrypsin deficiency, prevalence
Dirección postal: Martin E. Fernández, Hospital Municipal de Rehabilitación Respiratoria María Ferrer, Dr. Enrique Finochietto 849, 1272 Buenos Aires, Argentina
e-mail: martineduardofernandez@hotmail.com
El déficit de alfa-1 antitripsina (AAT) es uno de los trastornos hereditarios más frecuentes de la población adulta, habiéndose identificado más de 100 variantes genéticas 1. La AAT constituye el 90% de la actividad anti proteasa del suero (principalmente por inhibición de la elastasa de los neutrófilos) y se ha demostrado que reduce la expresión de citoquinas pro-inflamatorias, estando dotada de propiedades reparadoras del tejido conectivo 2. El déficit de AAT se manifiesta clásicamente por enfermedad pulmonar obstructiva crónica (EPOC) precoz con enfisema panlobular basal, usualmente asociada con genotipos homocigoto Z1, 2. Otras manifestaciones de déficit grave de AAT incluyen la cirrosis hepática, cáncer hepático, vasculitis y paniculitis 1, 2.
Se cree que el espectro de la presentación pulmonar de la enfermedad podría ser mucho más amplio, incluyendo la asociación de déficit de AAT con bronquiectasias, asma, fibrosis pulmonar, pero es importante no limitarse exclusivamente a las presentaciones clásicas a la hora del diagnóstico 3, 4.
La prevalencia de déficit grave de AAT (concentraciones séricas < 35mg/dl asociado en general a genotipos Pi*ZZ) en la población general varía de 1:2000-1:5000 individuos en algunas regiones de Europa, a 1:5000- 10 000 en EE.UU. y Canadá 1, 5.
Se han descrito varios casos de neumotórax espontáneo, (incluyendo la población pediátrica), como primera presentación de déficit de AAT 6-11. Sin embargo, la prevalencia de déficit de AAT en pacientes con neumotórax espontáneo ha sido poco estudiada.
El objetivo principal del estudio fue establecer la prevalencia del déficit de AAT en una población consecutiva de pacientes con neumotórax espontáneo.
Materiales y métodos
El estudio fue de corte transversal (de prevalencia) en pacientes con neumotórax espontáneo en el contexto de la práctica habitual (vida real) de nuestro centro. Se incluyeron pacientes consecutivos adultos (≥ 18 años de edad) de ambos sexos con diagnóstico de neumotórax espontáneo que consultaron o fueron derivados a nuestro centro especializado en enfermedades respiratorias. Fueron excluidos los pacientes con diagnóstico de neumotórax espontáneo secundario. La evaluación de las características demográficas y clínicas, junto con la determinación de AAT, fue realizada luego del diagnóstico de neumotórax sin seguimiento posterior o grupo control.
Se definió neumotórax espontáneo como aquel ocurrido sin la presencia de trauma o factor precipitante evidente y en ausencia de antecedentes aparentes de enfermedad respiratoria.
Se consideró neumotórax secundario como el que ocurre en presencia de factor precipitante evidente o enfermedad respiratoria conocida 12-14.
Todas las muestras de los pacientes con neumotórax se analizaron en el Laboratorio de Biología Molecular del Hospital Elizalde, contiguo a nuestro centro. La cuantificación de AAT se realizó en suero obtenido luego de la extracción de sangre en cada paciente con neumotórax. La determinación de AAT fue realizada por inmunonefelometría, utilizando un equipo Immage, de Beckman Coulter, y reactivos con calibradores para inmunoensayos de Immage. El dosaje se efectuó en muestras de suero, obtenidas luego de centrifugar la muestra.
Las muestras procesadas en el mismo día se mantuvieron refrigeradas a 4°C. Aquellas que fueron procesadas dentro de los 5 días se mantuvieron en freezer a – 20 °C. Los valores normales de referencia de laboratorio son de 100 a 200 mg/dl.
En los pacientes con neumotórax espontáneo con valores de AAT ≤ 120mg /dl se realizó genotipificación rápida por reacción en cadena de la polimerasa en tiempo real (PCR en tiempo real). El material genético se obtuvo a partir muestras de sangre con anticoagulante EDTA. Se utilizó extracción automatizada, con MgNA Pure Roche, según el protocolo provisto por el fabricante. Las muestras de ADN, se conservaron en freezer a – 20 °C hasta ser procesadas. Mediante PCR en tiempo real se realizó la detección de alelo S y Z, con sondas Taqman de hibridación alelo específicas, utilizando el termociclador Step One, de Applied Biosystems (desde 2014 a 2017). A partir de 2017 se cambió el equipamiento por un equipo Real Time PCR, Cobas Z480 de Roche. Este kit permite detectar mutaciones en codón 264 (Pi*S) y 342 (Pi*Z) en el gen de AAT. Se clasificaron los pacientes según la combinación de alelos codominantes S y Z, y se consideraron como genotipo asociado a déficit las variantes ZZ, SZ, SS, heterocigoto Z y heterocigoto S.
El estudio fue aprobado por el comité de revisión institucional y/o ética de nuestro centro. Todos los pacientes debieron firmar un consentimiento informado antes de ingresar.
El estudio se realizó respetando las normativas locales para estudios observacionales (resolución 1480/2011 del Ministerio de Salud de la Nación).
Análisis estadístico: No se realizó un cálculo formal de tamaño muestral previo al inicio del estudio. Se utilizó principalmente estadística descriptiva en el análisis de los resultados.
Las variables numéricas fueron resumidas por su media y desvío estándar y las categóricas por su frecuencia, porcentaje e intervalo de confianza del 95% (IC95%) según fuese aplicable.
IC95% se calcularon por método exacto de Clopper-Pearson basado en la distribución binomial (programa: Cran R versión 3.5.0, librería “binom”). Para las comparaciones entre subgrupos de pacientes se utilizaron pruebas no paramétricas para las variables continuas y test de Chi cuadrado o test exacto de Fisher para las variables categóricas. Se estableció un valor de 5% como nivel de significancia.
Resultados
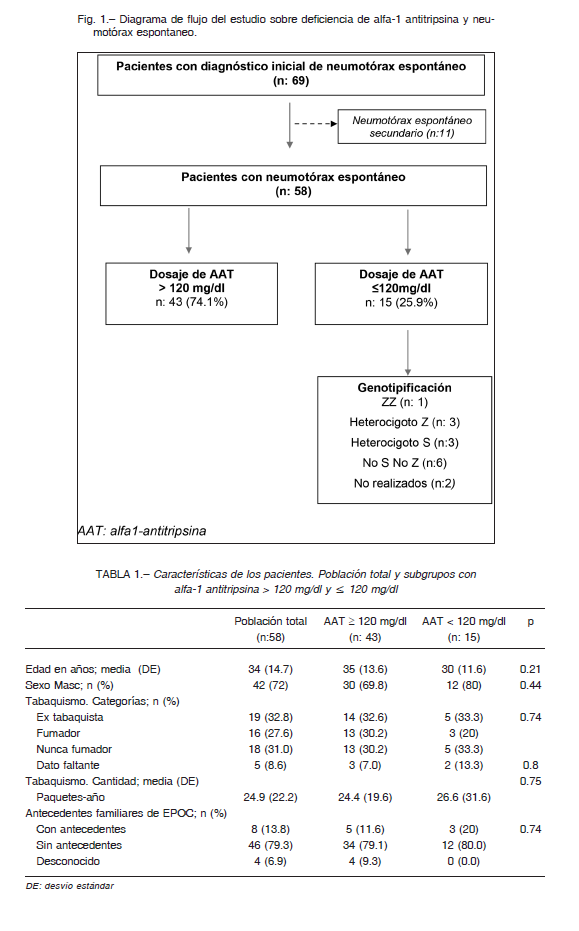
Se seleccionaron 58 pacientes consecutivos con edad ≥ 18 años con diagnóstico de neumotórax espontáneo que consultaron o fueron derivados a nuestro hospital especializado en enfermedades respiratorias entre 2013 y 2019. En todos los casos se realizó cuantificación de AAT en suero por nefelometría y en aquellos con AAT ≤ 120mg /dl se efectuó genotipificación rápida (Fig. 1).
La edad promedio de la población fue 34 ± 13 años, con predominio de sexo masculino (72%), la mayoría sin antecedentes familiares de EPOC (80%), pero con elevada prevalencia de tabaquismo actual y ex tabaquismo (Tabla 1).
Del total de los pacientes, 26% (IC95%: 15-39) presentó concentraciones de AAT ≤ 120 mg/dl (Fig. 1). No encontramos diferencias clínicamente relevantes entre los subgrupos que presentaron valores de AAT por nefelometría en suero > 120 mg/dl o ≤ 120 mg/dl (Tabla 1).
Se consideraron como genotipo asociado a déficit las variantes ZZ, SZ, SS, heterocigoto Z y heterocigoto S. Del total de 58 enfermos con neumotórax espontáneo encontramos 7 formas deficitarias (12%; IC 95%: 5-23.3%).
Un paciente presento una forma grave Pi*ZZ, tres fueron heterocigotos Z y otros tres heterocigotos S. El caso con la forma Pi*ZZ es un varón de 23 años, sin antecedentes de tabaquismo, que presentó un neumotórax espontáneo.
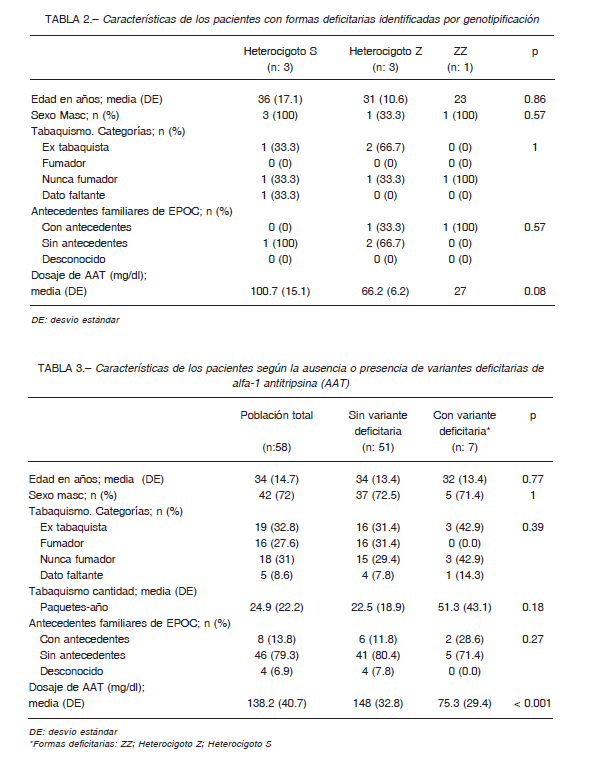
Es interesante destacar que este paciente tenía antecedentes familiares de EPOC. Las características clínicas de las 7 formas deficitarias se resumen en la Tabla 2.
Observamos una tendencia a menor concentración sérica de AAT en la forma grave y los heterocigotos Z (25 mg/dl y 66.2 ± 6.2, respectivamente) en relación con los heterocigotos S (100.7 ± 15.1 mg/dl), p:0.076.
Al comparar las características basales entre los pacientes que no presentaron variantes deficitarias (n: 51) con los que presentaron las variantes deficitarias (n: 7), solo encontramos diferencias estadísticamente significativas en los niveles de dosaje de AAT (Tabla 3). Los casos con variantes deficitarias tuvieron niveles séricos de AAT significativamente más bajos comparados con aquellos sin estas variantes (75.3 ± 29.4 mg/dl vs. 148 ± 32.8 mg/dl, respectivamente, p < 0.001).
Discusión
El neumotórax espontáneo tiene una incidencia estimada de entre 7-18 casos por 100 000 en los hombres y entre 1-6 casos por 100 000 en las mujeres, siendo el tabaquismo el principal factor de riesgo 12-14. Nuestra población se caracterizó por ser adultos jóvenes con predominio de sexo masculino y elevada prevalencia de tabaquismo, tal como es de esperar en esta patología 12-14. El objetivo de nuestro estudio fue establecer la prevalencia del déficit de AAT en una población de pacientes con neumotórax espontáneo. Encontramos una elevada prevalencia de formas deficitarias de las cuáles una fue grave (Pi*ZZ) y 3 fueron heterocigotos Z.
Esta prevalencia no es conocida. Sin embargo, se ha observado que el neumotórax puede ser ocasionalmente el síntoma de presentación de la deficiencia de AAT y que entre 2-3% de los pacientes con las formas graves Pi*ZZ mueren por neumotórax 15.
En la fisiopatología de la enfermedad hay evidencias a favor de las contribuciones genéticas, como lo es la historia familiar (10-12% de los casos).
El neumotórax espontáneo se asocia a varios síndromes genéticos de tipo multi-sistémico relacionados con mutaciones de genes supresores tumorales, trastornos del tejido conectivo y trastornos de la arquitectura pulmonar, dentro de los cuales se encuentra el déficit de AAT 15.
El programa de cribado estuvo basado en la determinación de AAT en suero por nefelometría con posterior genotificación rápida (PCR en tiempo real) en los pacientes con concentraciones por debajo de un umbral de corte de 120 mg/dl, tal como se recomienda actualmente y se realiza en otros centros 16, 17. El protocolo seguido no incluyó fenotipificación ni secuenciación completa. Debido a este motivo hay variantes raras clínicamente relevantes que se han descrito en otros casos de neumotórax espontáneo, y que tal vez no se han podido detectar aquí.
Existen muy pocas series recientes que han investigado la prevalencia de déficit de AAT en pacientes con neumotórax espontáneo 18, 19. Una serie de casos analizó 39 pacientes con neumotórax espontáneo y 100 sujetos de control sin enfermedad pulmonar, apareados por edad y sexo. En ese estudio se detectaron fenotipos de deficiencia de AAT en 3 (7.7%) pacientes con neumotórax espontáneo (Pi*ZZ, Pi*SZ, Pi*MZ) y solo en uno (1%) caso en el grupo control (Pi*MZ), lo que está en línea con nuestras observaciones 19. Si tomamos esta serie y la nuestra en forma conjunta, la prevalencia de las formas graves (Pi*ZZ) sería del 2% (IC95%: 0.25%-7.2%) que está muy por encima de las prevalencias esperadas en la población general de Europa (1:2000-1:5000) y de la población adulta de nuestro país (1:1000) 1, 5, 20.
Los pacientes con neumotórax espontáneo no tienen enfermedad pulmonar clínicamente evidente. No obstante, la mayoría tienen bullas sub-pleurales 12, 14. El mecanismo de formación de estas bullas es desconocido, pero se postula que las fibras elásticas de estas bullas se degradan debido a un desequilibrio entre la elastasa y AAT 13, 21. Este desequilibrio podría estar a su vez potenciado por la reacción inflamatoria local que se desencadena en forma secundaria al tabaquismo y también por el déficit de AAT 13, 21.
Este mecanismo podría explicar la asociación entre neumotórax espontáneo y tabaquismo y potencialmente también la asociación con las variantes graves (Pi*ZZ) de déficit de AAT. En forma complementaria se ha descripto que las variantes con déficit moderado (Pi*MZ o Pi*SZ), podrían estar también asociadas con el neumotórax espontáneo, algo que merece mayor investigación futura 6, 7, 19.
Nuestro estudio tiene varias limitaciones. Fue un análisis de corte transversal (sin seguimiento) en el momento del diagnóstico del neumotórax y en el contexto de la práctica habitual de nuestro centro. El número de pacientes incluidos con neumotórax espontáneo es bajo y por ende los intervalos de confianza de nuestras observaciones son amplios. La probabilidad de detectar formas más raras de baja prevalencia es mucho menor.
No obstante, nuestra serie es una de las más grandes que ha estudiado la prevalencia de déficit de AAT en estos enfermos. La prevalencia de variantes deficitarias de AAT (incluyendo la variante asociada a déficit grave) fue más alta con relación a lo esperable en la población general. De confirmarse, nuestras observaciones implicarían la necesidad de ampliar las indicaciones de cribado de déficit de AAT, y potencialmente investigar el efecto del tratamiento sustitutivo en los pacientes con formas deficitarias graves.
Agradecimientos: Queremos recordar y agradecer especialmente al primer autor Dr. Guillermo Menga†, quien ha sido pionero y líder en la investigación de déficit de alfa-1 antitripsina en la Argentina y Latinoamérica, que lamentablemente falleció durante la redacción de este manuscrito.
Agradecemos a Raúl Bozzo (IC PROJECTS) por su colaboración en el análisis de los datos y coordinación de la publicación.
Conflicto de intereses: Martin E. Fernández ha recibido ayuda financiera del laboratorio Tuteur S.A. para la asistencia a congresos. El resto de los autores, ninguno para declarar
Bibliografía
1. Miravitlles M, Dirksen A, Ferrarotti I, et al. European Respiratory Society statement: diagnosis and treatment of pulmonary disease in α1-antitrypsin deficiency. Eur Respir J 2017; 30: 50:1700610.
2. Menga G, Miravitlles M, Blanco I, et al. Normativas de diagnóstico y tratamiento del déficit de alfa-1 antitripsina. Revista Americana de Medicina Respiratoria 2014; 14: 28-46.
3. Gramegna A, Aliberti S, Confalonieri M, et al. Alpha-1 antitrypsin deficiency as a common treatable mechanism in chronic respiratory disorders and for conditions different from pulmonary emphysema? A commentary on the new European Respiratory Society statement. Multidiscip Respir Med 2018; 13: 39.
4. Sandhaus RA, Turino G, Brantly ML, et al. The diagnosis and management of alpha-1 antitrypsin deficiency in the adult. Chronic Obstr Pulm Dis 2016; 3:668-82.
5. De Serres FJ, Blanco I. Prevalence of α1-antitrypsin deficiency alleles PI*S and PI*Z worldwide and effective screening for each of the five phenotypic classes PI*MS, PI*MZ, PI*SS, PI*SZ, and PI*ZZ: a comprehensive review. Ther Adv Respir Dis 2012; 6: 277-95.
6. Mostafavi S, Lieberman J. Intermediate alpha 1-antitrypsin deficiency with apical lung bullae and spontaneous pneumothorax. Presence of a Z variant in an American black. Chest 1991; 99: 1545-6.
7. Lepiorz M, Großer C, Hofmann HS, Pfeifer M. A rare cause of a spontaneous pneumothorax. Pneumologie 2017; 71: 590-3.
8. Kusu T, Nakagiri T, Minami M, et al. Null allele alpha-1 antitrypsin deficiency: case report of the total pleural covering technique for disease-associated pneumothorax. Gen Thorac Cardiovasc Surg 2012; 60: 452-5.
9. Greene DN, Procter M, Krautscheid P, et al. α1-antitrypsin deficiency in fraternal twins born with familial spontaneous pneumothorax. Chest 2012; 141: 239-41.
10. Kanazawa S, Kinoshita Y, Nakagawa Y, et al. Pneumothorax associated with alpha1-antitrypsin deficiency. Intern Med 2009; 48: 387-8.
11. Lin YC, Chiu WK, Chang H, et al. Spontaneous pneumo-thorax in flight as first manifestation of alpha-1 antitrypsin deficiency. Aviat Space Environ Med 2008; 79:704-6.
12. Bintcliffe O, Maskell N. Spontaneous pneumothorax. BMJ 2014;348: g2928.
13. Sahn SA, Heffner JE. Spontaneous pneumothorax. N Engl J Med 2000; 342: 868-74.
14. Grupo de Trabajo de la SEPAR. Normativa sobre diagnóstico y tratamiento del neumotórax. Arch Bronconeumol 2002; 38: 589-95.
15. Boone PM, Scott RM, Marciniak SJ, et al. The genetics of pneumothorax. Am J Respir Crit Care Med 2019; 199: 1344-57.
16. Miravitlles M, López-Campos JL. Nuevo documento europeo sobre el déficit de alfa-1-antitripsina: de la teoría a la práctica diaria. Monogr Arch Bronconeumol 2018; 00172. En: https://pdfs.semanticscholar.org/6e98/32102e730534f8e5e827d0bb98bdea4b4472.pdf; consultado julio 2019.
17. Miravitlles M, Herr C, Ferrarotti I, et al. Laboratory testing of individuals with severe alpha1-antitrypsindeficiency in three European centres. Eur Respir J 2010; 35: 960-8.
18. Pawlowicz A, Droszcz W. Pulmonary function and alpha-1-antitrypsin levels in patients after so-called idiopathic spontaneous pneumothorax. Bull Eur Physiopathol Respir 1987; 23: 1-4.
19. Serapinas D, Obrikyte V, Vaicius D, et al. Alpha-1 antitrypsin deficiency and spontaneous pneumothorax: possible causal relationship. Pneumologia 2014; 63: 32-5.
20. Menga G, Fernandez Acquier M, Echazarreta AL, et al. Prevalence of Alpha-1 Antitrypsin deficiency in COPD patients in Argentina. The DAAT.AR Study. Arch Bronconeumol 2019; S0300-2896 (19)30578-2.
21. Haraguchi S, Fukuda Y. Histogenesis of abnormal elastic fibers in blebs and bullae of patients with spontaneous pneumothorax: ultrastructural and immunohistochemical studies. Acta Pathol Jpn 1993; 43: 709-22.
