DARDO RIVEROS 1, DANIELA MAYMÓ 1, JULIA LAVIANO 1, FLORENCIA FORNILLO 1, JOSÉ FERNÁNDEZ 1, RICARDO BENZADON 1, JORGE SOLIMANO 1, ROBERTO CACCHIONE 1, LEANDRO RIERA 1, PATRICIO DUARTE 1, NICOLÁS CAZAP 1, DANIEL GOTTA 1, JUAN GARCÍA ALTUVE 1, RICARDO VALENTINI 2, JUAN DUPONT 1
1 Servicio de Hematología, Medicina Transfusional y Trasplante de Médula Ósea, 2 Departamento de Medicina Interna, Centro de Educación Médica e Investigaciones Clínicas Norberto Quirno (CEMIC), Buenos Aires, Argentina
Resumen La pandemia COVID-19 provocada por el betacoronavirus SARS-CoV-2 exige rápidas respuestas desde el campo de la medicina. El riesgo de tromboembolismo venoso y arterial está aumentado durante la infección, especialmente en pacientes críticos. En ese contexto se destaca una coagulopatía caracterizada por niveles elevados de dímero D, con tendencia a la falla multiorgánica, y aumento de la mortalidad. Esas anormalidades de la hemostasia responden a varios mecanismos que deben tenerse en cuenta para la toma de decisiones terapéuticas. Analizamos la evidencia científica disponible en la que se fundamenta el enfoque terapéutico de la coagulopatía descripta y sus complicaciones, con el objetivo de diseñar recomendaciones terapéuticas realistas tendientes a disminuir la morbilidad y la mortalidad en pacientes con COVID-19.
Palabras clave: COVID-19, tromboembolismo, coagulopatía inducida por sepsis, coagulación intravascular diseminada, tormenta de citoquinas, heparina
Abstract The coronavirus disease 2019 (COVID-19) pandemic requires rapid medical responses. The risk of venous and arterial thromboembolism increases in critically ill patients with SARS-CoV-2 infection. There is a hypercoagulable state that includes elevated levels of D-dimer, with an increased risk of organ failure and increased mortality. The abnormalities described in hemostasis should be considered for therapeutic decision making. We analyzed the available scientific evidence for the therapeutic approach of coagulopathy in the course of the disease with the objective of designing realistic therapeutic recommendations aimed at reducing morbidity and mortality in patients with COVID-19.
Key words: COVID-19, thromboembolism, sepsis induced coagulopathy, disseminated intravascular coagulation, cytokine storm, heparin
Dirección postal: Dardo Riveros, CEMIC, Galván 4102, 1431 Buenos Aires, Argentina
e-mail: dardoriveros@hotmail.com
La pandemia COVID-19 provocada por el betacoronavirus SARS-CoV-2 exige rápidas respuestas desde el campo de la medicina. Esto genera diariamente una enorme cantidad de información sobre diversos aspectos de la enfermedad, traduciéndose en recomendaciones que por la misma urgencia no siempre cumplen con los estándares necesarios para su aplicación.
El riesgo de tromboembolismo venoso (TEV) y arterial (TEA) está aumentado en pacientes críticos con infección por SARS-CoV-2. Los trastornos hemostáticos descriptos en ese contexto son la expresión de un estado de hipercoagulabilidad desencadenado por múltiples factores entre los que se destacan la inmovilidad, la enfermedad crítica y la inflamación, entre otros. El objetivo de esta revisión fue analizar la evidencia científica disponible sobre la que se fundamenta el manejo de la coagulopatía y la de sus complicaciones trombóticas durante la infección por SARS-CoV-2, con la finalidad de diseñar recomendaciones preventivas y/o terapéuticas para la práctica clínica durante la pandemia.
Coagulopatía COVID-19 y microtrombosis
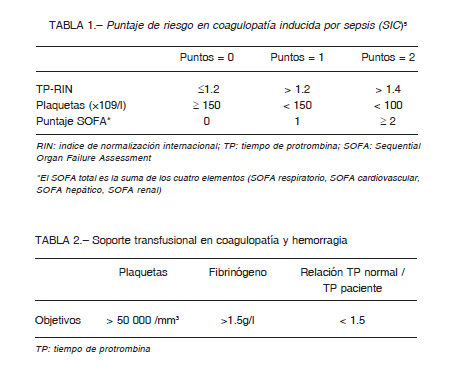
En febrero de 2020 el grupo del Hospital Tongji de Wuhan, China, comunicó las alteraciones de la hemostasia halladas en 183 pacientes con infección por SARS-CoV-2 y neumonía 1,2. Según los autores, en el 72% de los casos el cuadro hematológico fue caracterizado como coagulación intravascular diseminada “abierta” (CID) según los criterios de la Sociedad Internacional de Hemostasia y Trombosis (SIHT) 3, y su presencia fue asociada a evolución tórpida con elevada mortalidad. Argumentaron que la coagulopatía inducida por COVID-19 (CIC-19) es similar a la observada en infecciones provocadas por otros patógenos de acuerdo al Tercer Consenso Internacional sobre Sepsis 4, y que las anormalidades de la hemostasia descriptas deben tenerse en cuenta para la toma de decisiones terapéuticas. La SIHT ha desarrollado y validado el score CIS (coagulopatía inducida por sepsis, SIC por sus siglas en inglés), de utilidad también en COVID-19 5 (Tabla 1).
Con el objetivo de investigar el efecto de la heparina, el mismo grupo del Hospital Tongji extendió sus observaciones retrospectivas en 449 pacientes consecutivos con infección severa, definida como tal por parámetros de fisiopatología pulmonar 6. Noventa y siete de ellos (21.6%) tenían un score CIS ≥ 4. Noventa y nueve de los 449, recibieron heparina (enoxaparina 40-60 mg/día o heparina no fraccionada 10 000-15 000 U/día) durante por lo menos 7 días. Con los otros 350 pacientes se utilizaron solamente las medidas de soporte habituales, sin administración de heparina. Analizaron la mortalidad al día 28, comprobando que en el grupo total no hubo diferencias que favorecieran a quienes habían recibido heparina. Sin embargo los resultados fueron distintos cuando estratificaron a los pacientes por el score CIS o por los niveles de dímero-D. Los que tenían un score ≥ 4 y/o un nivel de dímero-D > 6 veces sobre el límite superior normal se beneficiaron con la heparina, ya que la mortalidad en ellos fue menor en un 20% con respecto a los que, teniendo el mismo grado de severidad hemostática, no la habían recibido. El aumento de la mortalidad entre los que no recibieron heparina comenzó a notarse en los estratos con niveles de dímero-D > 4 y > 5 veces sobre el límite superior normal, aunque sin significación estadística. Nótese que las dosis de heparina son las que habitualmente se utilizan como profilaxis del TEV, y que son también las recomendadas para casos con CID en sepsis, cuando hay manifestaciones clínicas de obstrucción de la microcirculación (p.ej. necrosis acral bilateral o purpura fulminans) 7.
En una comunicación sobre su propia experiencia, Connors y Levy advierten que si bien la coagulopatía que observaron en sus pacientes también tiene las características hemostáticas de CID y una expresión clínica dominada por el compromiso pulmonar grave con ausencia de hemorragias, no se destacan en ella inicialmente las anormalidades del tiempo de protrombina ni la plaquetopenia 8.
Recomiendan iniciar tratamiento con heparina en las dosis utilizadas para profilaxis del TEV, además de adoptar las medidas específicas y de soporte habituales en el manejo de los estados infecciosos en general. Afirman que por el momento no hay evidencias sólidas sobre la eficacia y seguridad de la heparina administrada en dosis plena de anticoagulación, por lo que no aconsejan esta modalidad en casos de CIC-19.
En una línea de razonamiento similar, la SIHT comunicó guías interinas, recomendando la internación de todos los pacientes que tuvieran evidencias de las alteraciones hemostáticas referidas, independientemente de otras manifestaciones de gravedad, para iniciar así la administración de heparina de bajo peso molecular (HBPM) en dosis de profilaxis. No hacen referencia acerca de aumentar la dosis ante situaciones de empeoramiento, recomendando terapia transfusional si existieran alteraciones de la hemostasia con manifestaciones hemorrágicas 9 (Tabla 2).
Desde el Hospital St. James en Dublin, Fogarty y col. exponen una visión alternativa con respecto al mecanismo de la coagulopatía 10. En el análisis de sus pacientes describen un comportamiento compatible con CID “compensada” o “sobrecompensada” definidos por criterios de la SIHT, sin plaquetopenia, con aumento del dímero-D y del fibrinógeno. Explican estos cambios como el resultado de un estímulo inflamatorio intenso, con incremento excesivo de reactantes de fase aguda en población caucásica, la que tiene un riesgo trombótico 3 a 4 veces superior al de la asiática, según resultados de estudios epidemiológicos 11.
El cuadro clínico dominante en sus pacientes fue el de una insuficiencia respiratoria severa que atribuyen a coagulación intravascular pulmonar localizada, postulando que la utilización de heparina en dosis de anticoagulación plena puede ser de utilidad, lo que debe demostrarse en estudios diseñados con ese objetivo.
En apoyo de este concepto sobre el compromiso respiratorio trombogénico, recientemente se ha comprobado en autopsias la presencia de endoteliosis, neoangiogénesis y microangiopatía con trombosis en pulmones de pacientes con infección por SARS-CoV-2, hallazgos no detectados en neumonía por influenza 12. En neumocitos y endotelio existe una elevada expresión de ACE2 (enzima convertidora de la angiotensina tipo 2, según siglas en inglés), que es también uno de los receptores reconocidos como funcionales para el ingreso del coronavirus a las células. Esto explicaría la localización pulmonar preferencial de la trombosis en casos severos con CIC-19 10,13.
Se puede concluir que la coagulopatía descripta en el curso de infección por SARS-CoV-2 se asocia a un elevado riesgo de muerte por injuria pulmonar aguda, falla multiorgánica y complicaciones trombóticas, mientras que las hemorragias son poco frecuentes. En algunos casos las alteraciones de laboratorio permiten definirla como CID según los criterios de la SIHT, aunque la hipoprotrombinemia y la plaquetopenia no son tan acentuadas como en sepsis de otras etiologías. El aumento del dímero-D es predictor de enfermedad crítica y mortalidad, y las alteraciones de la hemostasia que integran el score CIS son herramientas hematológicas valiosas en el proceso diagnóstico. Sin embargo, la mayor parte de los casos no pueden ser clasificados como CID, ya que algunos se caracterizan por hallazgos sugestivos de microangiopatía trombótica, con aumento de ferritina y lactato deshidrogenasa (LDH), además de evidencias de microtrombosis en circulación pulmonar. Tal vez puede afirmarse que la CIC-19 es una combinación de proporciones variables entre CID y microangiopatía trombótica pulmonar 14. Sin embargo, la CIC-19 se expresa más frecuentemente con otros rasgos que la diferencian tanto de la CID como de la microangiopatía trombótica. Recientemente se ha postulado que un estado hiperinflamatorio desempeñaría el papel principal en las alteraciones de la coagulación observadas en pacientes con COVID-19, especialmente en los internados en Unidades de Cuidados Intensivos (UCI). Caracterizada como “tormenta de citoquinas” por el aumento en los niveles plasmáticos de interleuquinas (IL) pro-inflamatorias (IL-1, IL-6) y del factor de necrosis tumoral (FNTα) entre otros, produce injuria endotelial e induce la expresión de factor tisular, inhibe las vías anticoagulantes naturales y activa la fibrinólisis por liberación de activadores del plasminógeno. Este mecanismo, conocido como inmunotrombosis por involucrar a las vías de la coagulación y la inflamación, se expresa biológicamente con aumentos del dímero-D, LDH, IL-6, fibrinógeno, ferritina y otros reactantes de fase aguda 15.
Los niveles de dímero-D y de IL-6 se correlacionan con la gravedad de la enfermedad.
El perfil protrombótico inducido durante la infección puede expresarse también como síndrome antifosfolípido, con presencia de anticoagulante lúpico y/o anticuerpos anticardiolipina o anti-β2GP1. Este fenómeno ha sido descripto con menor frecuencia que los antes referidos, pero puede tener una evolución dramática con trombosis en arterias de pequeño calibre, planteando una dificultosa diferenciación con las microangiopatías trombóticas críticas o con la trombocitopenia inducida por heparina.
Otros autores describieron también episodios de isquemia cerebral en pacientes jóvenes, atribuyendo el fenómeno a disfunción endotelial, producto del intenso estímulo inflamatorio 16-18.
Ante la multiplicidad de vías que pueden conducir a la CIC-19 y a sus complicaciones trombóticas se impone una pregunta: ¿es la coagulopatía consecuencia de una acción directa viral con activación de la coagulación o es producto exclusivamente de la “tormenta de citoquinas”? 19. En el primer caso los pacientes tendrían un perfil hemostático compatible con CID, mientras que si el efecto fuera mediado por las citoquinas el cuadro de laboratorio estaría caracterizado por niveles más altos de dímero-D, hiperfibrinogenemia y aumento de otros marcadores de fase aguda (ferritina, velocidad de sedimentación globular, proteína C reactiva, procalcitonina, IL-6) sin afectación significativa de plaquetas ni del tiempo de protrombina.
Teóricamente la respuesta a esa pregunta podría polarizar la conducta terapéutica entre antitrombóticos y antiinflamatorios, y ya hay varios estudios que exploran la actividad de fármacos dirigidos a atenuar o inhibir las consecuencias de la inmunotrombosis (p.ej. dexametasona, tocilizumab) 20,21. Lo más probable es que haya un efecto de suma entre los dos procesos fisiopatológicos mencionados, aunque en la mayoría de los casos predominaría el estímulo inflamatorio y la tormenta de citoquinas sobre el de CID inducida en forma directa por el virus 33.
Mientras se trata de elucidar estos aspectos, la heparina es por ahora el agente más aceptado para tratar esta coagulopatía, debido a su versatilidad funcional (antitrombótico, estabilizador endotelial, antagonista de la inflamación y antiviral) 22.
En ausencia de contraindicaciones, la utilización de heparina en la modalidad de profilaxis, con dosis bajas o intermedias, ha sido beneficiosa según la experiencia de algunos grupos, y desde esas experiencias se ha generalizado su recomendación. El objetivo es el de limitar la microtrombosis y prevenir el TEV. Por el momento no hay evidencias que favorezcan el empleo de dosis para anticoagulación plena. Pero es necesario disponer de datos reales en cuanto a los riesgos de hemorragia y trombosis durante la infección por SARS-CoV-2, para fundamentar el uso de heparina sobre bases sólidas en términos de riesgos/beneficios. Un estudio retrospectivo observacional realizado en EE.UU. es esclarecedor en este sentido 23. En 400 pacientes internados y tratados con heparina en dosis de profilaxis clásica, las hemorragias graves se observaron en el 5.6% de los casos críticos y fueron una importante causa de morbilidad, mientras que la frecuencia del TEV comprobado por técnicas de imágenes fue de 7.6%, un nivel significativamente inferior al documentado inicialmente por el grupo de Wuhan o por series europeas. Otro dato de interés aportado por esta experiencia es que un patrón de laboratorio compatible con CID se asoció con hemorragias, en tanto que un perfil de laboratorio indicativo de etiología inflamatoria (trombocitosis, hiperfibrinogenemia, ferritina y procalcitonina elevadas) aumentaba el riesgo de trombosis. Por esto, se recomienda cautela al momento de utilizar heparina en este contexto, especialmente en la elección de la dosis, Varios estudios en marcha están dirigidos a aclarar la utilidad de la heparina en COVID-19 en términos de riesgo y beneficios, utilizando profilaxis clásica con dosis baja (enoxaparina 40 mg/día), profilaxis con dosis intermedia en cuadros más severos (enoxaparina 30-40 mg cada 12 h) o anticoagulación plena con heparina no fraccionada (HNF) o con HBPM 24, 25.
Otros anticoagulantes no han sido probados en la CIC-19 en pacientes internados y no pueden ser recomendados por ahora. En casos con evidencias claras de microangiopatía trombótica algunos expertos postulan la utilización de terapia de recambio plasmático, aunque este procedimiento debería ser validado adecuadamente en ese escenario 14.
La complicación tromboembólica
Los pacientes internados por COVID-19 tienen un alto riesgo para el desarrollo de TEV y TEA, de acuerdo a los resultados de algunos estudios y a reportes de casos.
Las frecuencias referidas para el TEV son muy variables, oscilando entre el 8% y el 69% y predominando la embolia de pulmón sobre las trombosis venosas, especialmente en UCI, donde la mortalidad para los casos severos es del 40% proximadamente 23,26-29. La amplia diferencia de las cifras sobre prevalencia de TEV puede explicarse por la multiplicidad de factores involucrados en el riesgo de trombosis en el curso de esta infección (edad, etnia, enfermedades asociadas, tiempo de inmovilidad/reposo, medicación concomitante, uso de catéteres venosos centrales, respuesta inflamatoria individual, etc.). No debe considerarse menor la contribución de la CIC-19, ya que es una expresión directa del estado hipercoagulable generado por la convergencia de los factores mencionados y se asocia en forma directa con la mortalidad, por lo que el manejo apropiado de ella es una prioridad. La frecuencia en el hallazgo de la trombosis venosa puede también variar de acuerdo a la estrategia elegida para su detección, ya que no es lo mismo realizar la ultrasonografía en el enfermo sintomático que hacerla en forma seriada para diagnosticarla en período subclínico.
La frecuencia del TEA es bastante menor (3%-5%), pero llamativamente predomina en pacientes más jóvenes con localización en sistema nervioso central e impone consideraciones diagnósticas y terapéuticas algo más conflictivas 16-18. Recientemente se comunicó también el compromiso arterial sistémico grave en siete adultos mayores con COVID-19 y con enfermedades cardiovasculares asociadas 30.
Por razones logísticas y epidemiológicas el diagnóstico por imágenes del TEV o del TEA en pacientes hospitalizados es dificultoso, especialmente en UCI.
Además, el recurso de la utilización del dímero-D en esas circunstancias pierde eficacia, aunque una reciente comunicación le adjudica un alto valor predictivo negativo en TEV durante la infección por SARS-CoV-2 y algunos grupos aún sostienen su importancia en el arsenal diagnóstico en ese escenario 31. Por estas razones no se aconseja el cribado diagnóstico, recomendándose estudiar solamente al paciente sintomático y utilizando métodos de imágenes que puedan operarse en la UCI (ultrasonografía compresiva y ecocardiografía). Si esto no fuera posible se impone confirmar el diagnóstico con otros medios (p. ej. la angiotomografía), ya que no es seguro iniciar anticoagulación en enfermedades críticas respaldados solamente en la evidencia clínica.
La prevención del TEV en ICU o en sala general se basa en la administración de HBPM o de HNF en baja dosis en todos los pacientes con COVID-19, de acuerdo a las normas habituales de profilaxis antitrombótica, siempre y cuando no haya contraindicaciones (hemorragia activa y/o plaquetopenia <30 000 /mm3), en cuyo caso deben aplicarse medidas de profilaxis mecánica (p. ej. compresión neumática intermitente). Esta recomendación se sustenta en la ya mencionada alta incidencia de tromboembolismo que se observó en pacientes hospitalizados, lo que ha llevado a varios grupos a proponer profilaxis con una dosis mayor o intermedia de heparina si existieran criterios que supongan un riesgo más elevado. Uno de esos criterios es la severidad de la CIC-19, recomendándose dosis intermedia para casos de alto riesgo (score CIS ≥ 4 y/o dímero-D > 4 veces sobre el límite superior normal) y dosis baja para el resto, siempre reguladas de acuerdo a la función renal y al peso o al índice de masa corporal (IMC). Ha sido invocada también la utilización de HBPM o de HNF en dosis de anticoagulación completa
para pacientes de alto riesgo, pero las evidencias actuales sobre la eficacia y seguridad de esta modalidad son limitadas, por lo que es necesario esperar resultados de estudios diseñados especialmente para aclarar este aspecto, ya que se trata de pacientes que tienen también un riesgo hemorrágico no desdeñable 23, 28. La profilaxis debe continuarse durante 14 a 30 días desde el egreso del hospital, según recomendaciones recientes. Para esta fase de extensión puede ser más cómodo el uso de anticoagulantes orales directos (AOD), pero hay que tener en cuenta el problema de las posibles interacciones de estos agentes con otros medicamentos que se utilizan durante la enfermedad 32, 33.
En lo que se refiere al tratamiento del TEV deben seguirse las normas habituales de anticoagulación inicial con heparina (preferentemente HNF por infusión continua en pacientes críticos e inestables) y pasaje luego a dicumarínicos o a AOD durante 3 meses, sin olvidar el riesgo potencial de los últimos en cuanto a las interacciones medicamentosas. En embolia de pulmón con hipotensión o inestabilidad hemodinámica corresponde considerar la posibilidad de trombolisis sistémica, y de existir contraindicación utilizar el método instrumental guiado con catéter.
El tratamiento del TEA suele ser multimodal e individualizado (antiagregación plaquetaria, anticoagulación, fibrinólisis o intervencionismo vascular) 18-20, 25.
La mayoría de los pacientes a los que se les diagnostica la infección transcurren la enfermedad no hospitalizados.
La conducta hematológica a tomar con ellos es motivo de algunas dudas. Por el momento, y hasta que se tengan mayores certezas, el manejo debe estar basado en medidas entalladas a la situación particular. En los casos en los que coexisten otros factores de riesgo cardiovascular (obesidad, antecedente de TEV, inmovilidad o reposo prolongado) es razonable iniciar la profilaxis domiciliaria con heparina en dosis baja o AOD33, previo estudio basal de la hemostasia para detectar precozmente alteraciones que puedan condicionar la estrategia del seguimiento.
Consideraciones finales
Contingencia e incertidumbre dominan el panorama de la pandemia COVID-19. Hipótesis novedosas y provocativas como las que involucran a las células progenitoras hematopoyéticas y a las mesenquimáticas en la génesis de la enfermedad habilitan la exploración de nuevas rutas fisiopatológicas y terapéuticas15. Pero la coyuntura impone la necesidad de dar respuestas ágiles a una realidad dramática, y esto se traduce en recomendaciones que generalmente están basadas en datos de estudios retrospectivos o en reportes de casos aislados. Estas características dificultan la concreción de los consensos necesarios para el manejo de la enfermedad en sus múltiples facetas. Sin embargo, y a pesar de estas limitaciones, en el campo hematológico se constatan algunas evidencias que permiten delinear recomendaciones institucionales para la práctica diaria 32-35 (Tabla 3).
1. La CIC-19 tiene un significado pronóstico determinante.
Definida inicialmente como CID, ahora se sabe que el mecanismo fisiopatológico más frecuente es el de un intenso estímulo inflamatorio que se expresa con un perfil de laboratorio distintivo dominado por el aumento del dímero-D, hiperfibrinogenemia con trombocitosis y sin hipoprotrombinemia significativa. No obstante, una minoría de pacientes puede tener alteraciones de la hemostasia características de CID según los criterios de la SIHT.
Se puede evaluar la gravedad de la CIC-19 con el score CIS (Tabla 1). Un puntaje ≥ 4 es de alto riesgo y se traduce en alta mortalidad, y el mismo impacto pronóstico tiene el dímero-D cuando su valor supera 4 veces el límite máximo normal. Para detectar en forma precoz estas anormalidades se aconseja solicitar estudios de hemostasia al momento de la internación y luego cada 48-72 h.
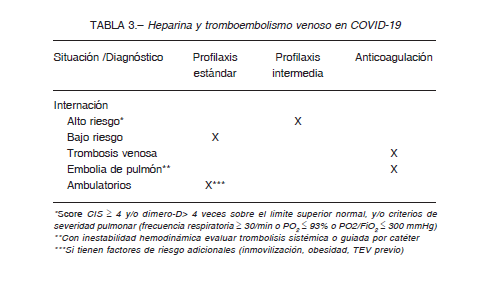
2. En casos hospitalizados con CIC-19 y score de alto riesgo y/o elevación en los niveles de dímero-D (≥ 4 veces sobre el límite superior normal) se recomienda el uso de HBPM en dosis de profilaxis intermedia (enoxaparina 40 mg cada 12 h) o HNF sódica (12 U/kg/hora) con el objetivo de controlar la microtrombosis y disminuir la incidencia de TEV. La misma recomendación es válida para pacientes internados con infección severa (frecuencia respiratoria ≥ 30/min, PO2 ≤ 93%, PaO2/ FiO2 ≤ 300 mmHg)6. Aún no hay datos sobre la eficacia y la seguridad de heparina administrada en dosis de anticoagulación para estas situaciones.
En pacientes hospitalizados que no reúnen criterios de CIC-19 de alto riesgo ni de enfermedad pulmonar severa se recomienda profilaxis con dosis baja de enoxaparina (40 mg cada 24 h) o HNF sódica (9 U/kg/h).
En los casos en los que la coagulopatía es definida como CID “abierta”, hecho poco frecuente según comunicaciones recientes 23, el tratamiento debe centrarse en las medidas de soporte habituales en los procesos infecciosos, la terapia transfusional para reponer los componentes hemostáticos en caso de hemorragia activa (Tabla 2), y heparina en dosis baja como profilaxis del TEV o como tratamiento en casos con obstrucción de la microcirculación periférica (“purpura fulminans”) 3.
3. En todos los casos la heparina debe prescribirse si no hay contraindicación para su uso (sangrado activo y/o plaquetopenia ≤ 30 000/mm3) y considerando el riesgo de hemorragias 36.
La dosis se ajustará de acuerdo a función renal y al IMC
• Clearance de creatinina ≤ 30ml/min: enoxaparina 20-30 mg cada 24 h o HNF sódica 9 U/kg/hora
• I MC > 30: enoxaparina 0.5 mg/kg cada 24 h por vía subcutánea
Como criterio general se prefiere la HNF sobre la HBPM en enfermos clínicamente inestables que puedan requerir procedimientos invasivos, o que tengan insuficiencia renal.
4. El TEV tiene una alta incidencia (8%-69%) con amplias variaciones según factores diversos (enfermedad crítica, estrategia diagnóstica, etnia, etc.). La prevención del TEV en pacientes internados debe realizarse según lo enunciado en los puntos 2 y 3, mientras que en los casos no hospitalizados se recomienda profilaxis con dosis baja (enoxaparina 40 mg cada 24 h) solamente en aquellos que tengan factores de riesgo adicionales (inmovilización, obesidad, antecedentes de TEV, neoplasias). La profilaxis debe extenderse durante 14-30 días desde el egreso del hospital o del levantamiento de la internación domiciliaria.
5. Se aconseja que el diagnóstico de tromboembolismo se efectúe preferentemente con herramientas disponibles en el punto de atención (ultrasonografía Doppler, ecocardiografía).
Si esto no fuera posible hay que recurrir a la metodología estándar para confirmar el diagnóstico (p.ej. angiotomografía).
6. El tratamiento del TEV debe iniciarse en la internación con HBPM o HNF en dosis de anticoagulación y con los objetivos habituales para la situación, extendiendo la terapia durante 3 meses con dicumarínicos o con AOD.
7. Los AOD son una opción posible en la profilaxis extendida y en el tratamiento del TEV luego de la internación. Pero no hay experiencia con ellos en el contexto de COVID-19, y potencialmente pueden sufrir interacciones con otros medicamentos que se utilicen durante la infección.
8. En TEA el tratamiento no está aun debidamente pautado pero en general comprende una estrategia multimodal individualizada para cada situación (antiagregación, anticoagulación, fibrinólisis, intervencionismo endovascular).
Estas recomendaciones tienen carácter preliminar, ya que nuevos datos van a surgir en la realidad cambiante de la pandemia que previsiblemente van a modificar parcialmente nuestra concepción fisiopatológica y terapéutica de la CIC-19 y sus consecuencias.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020; 18: 844-7.
2. Lillicrap D. Disseminated intravascular coagulation in patients with 2019-nCoV pneumonia. J Thromb Haemost 2020; 18: 786-7.
3. Wada H, Thachil J, Di Nisio M, et al, The Scientific Standardization Committee on DIC of the International Society on Thrombosis Haemostasis: Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines. J Thromb Haemost 2013; 11: 761-7.
4. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315: 801-10.
5. Iba T, Nisio MD, Levy JH, et al. New criteria for sepsisinduced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open 2017; 7: e017046.
6. Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe
coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020; 18: 1094-9.
7. Levi M, Scully M. How I treat disseminated intravascular coagulation. Blood 2018; 131: 845-54.
8. Connors JM, Levy JH. COVID-19 and its implications for thrombosis and anticoagulation. Blood 2020. doi: 10.1182/blood.2020006000.
9. Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost 2020; 18: 1023-6.
10. Fogarty H, Townsend L, Ni Cheallaigh C, et al. COVID19 coagulopathy in Caucasian patients. Br J Haematol 2020. doi: 10.1111/bjh.16749.
11. Huang D, Wong E, Zuo ML, et al. Risk of venous thromboembolism in Chinese pregnant women: Hong Kong venous thromboembolism study. Blood Res 2019; 54: 175-80.
12. Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med 2020. doi: 10.1056/NEJMoa20154322
13. Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 2003; 426: 450-4.
14. Levi M, Thachil J, Iba T, Levy JH. Coagulation abnormalities and thrombosis in patients with COVID-19. Lancet Haematol 2020; 7: e438-40.
15. Debuc B, Smadja DM. Is COVID-19 a new hematologic disease? Stem Cell Rev Rep 2020; 1-5. doi: 10.1007/s12015-020-09987-4.
16. Zhang Y, Xiao M, Zhang S, et al. Coagulopathy and antiphospholipid antibodies in patients with Covid-19. N Engl J Med 2020; 382: e38.
17. Oxley TJ, Mocco J, Majidi S, et al. Large-vessel stroke as a presenting feature of Covid-19 in the young. N Engl J Med 2020; 382: e60.
18. Li Y, Li M, Wang M, et al. Acute cerebrovascular disease following COVID-19: a single center, retrospective, observational study. Stroke Vasc Neurol 2020. svn-2020-000431. doi: 10.1136/svn-2020-000431. Online ahead of print.
19. Editorial. COVID19 coagulopathy: an evolving story. www.thelancet.com/haematology Vol 7 June 2020
20. Keller MJ, Kitsis EA, Arora S, et al. Effect of systemic glucocorticoids on mortality or mechanical ventilation in patients with COVID-19. J Hosp Med 2020; 15: 489-93.
21. Zhang C, Wu Z, Li J-W, Zaho H, Wang G-Q. Cytokine release syndrome in severe COVID-19: interleukin- 6 receptor antagonist tocilizumab may be the key to reduce mortality. Int J Antimicrob Agents 2020; 55: 105954.
22. Thachil J. The versatile heparin in COVID-19. J Thromb Haemost 2020; 18: 1020-2.
23. Al-Samkar H, Karp Leaf RS, Dzik WH, et al. COVID-19 and coagulation: bleeding and thrombotic manifestations of SARS-CoV-2 infection. Blood 2020; 136: 489-500.
24. Paranjpe I, Fuster V, Lala A, et al. Association of treatment dose anticoagulation with in-hospital survival among hospitalized patients with COVID-19 J Am Coll Cardiol 2020; S0735-1097 35218-9. doi: 10.1016/j.jacc.2020.05.001.
25. Atallah B, Mallah SI, AlMahmeed W. Anticoagulation in COVID-19 Eur Heart J Cardiovasc Pharmacother 2020; pvaa036. doi: 10.1093/ehjcvp/pvaa036.
26. Tal S, Spectre G, Kornowski R, Perl L. Venous thromboembolism complicated with COVID-19: What do we know so far? Acta Haematol 2020; 1-8. doi: 10.1159/000508233
27. Zhang L, Feng X, Zhang D, et al. Deep vein thrombosis in hospitalized patients with coronavirus disease 2019 (COVID-19) in Wuhan, China: prevalence, risk factors, and outcome Circulation 2020. doi: 10.1161/CIRCULATIONAHA.120.046702.
28. Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 2020; 191: 145-47.
29. Llitjos JF, Leclerc M, Chochois C, et al. High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients. J Thromb Haemost 2020. doi: 10.1111/jth.14869.
30. Kashi M, Jacquin A, Dakhil B, et al. Severe arterial thrombosis associated with Covid-19 infection. Thromb Res 2020; 192: 75-7.
31. Cui S, Chen S, Li X, Liu S, Wang F. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost 2020; 18: 1421-24.
32. Spyropoulos AC, Levy JH, Ageno W, et al. Scientific and standardization committee communication: clinical guidance on the diagnosis, prevention and treatment of venous thromboembolism in hospitalized patients with COVID-19 .J Thromb Haemost 2020. doi: 10.1111/jth.14929.
33. Connors JM, Levy JH. COVID-19 and its implications for thrombosis and anticoagulation. Blood 2020; 135: 2033-40.
34. Bikdeli B, Madhavan MV, Jimenez D, et al. COVID-19 and thrombotic or thromboembolic disease: implications for prevention, antithrombotic therapy, and follow-up. J Am Coll Cardiol 2020; 75: 2950-73.
35. Vazquez FJ, Korin J, Baldessari EM, et al. Recomendaciones para el uso de tromboprofilaxis en pacientes hospitalizados por COVID-19 en la Argentina. Medicina (B Aires) 2020; 80 (Suplemento III): 65-6.
36. Xu J-F, Wang L, Zhao L, et al. Risk assessment of venous thromboembolism and bleeding in COVID-19 patients. Research Square 2020. En: https://assets.researchsquare.com/files/rs-18340/v1/manuscript.pdf; consultado agosto 2020.
