MAGALÍ BLANCO 1, 3, GLENDA ERNST 2, STELLA VALIENSI 1, ELDA BERROZPE 1, OSCAR MARTÍNEZ 1, EDUARDO BORSINI 1-3
1 Unidad de Sueño y Ventilación, 2 Departamento de Docencia e Investigación, 3 Centro de Medicina Respiratoria, Hospital Británico de Buenos Aires, Argentina
Resumen La polisomnografía sin supervisión técnica en tiempo real (estudio de sueño de nivel II) ha sido descripta como una prueba con adecuada calidad de señales neurológicas y respiratorias. Comparamos eficiencia y calidad de sueño en pacientes hospitalizados y en el laboratorio de sueño. El estudio fue retrospectivo, en una muestra consecutiva de recolección sistemática basada en polisomnografía nivel II. Incluimos 486 pacientes; 156 hospitalizados y 330 ambulatorios; 94 hombres (60.2%) vs. 181 (55%); edad: 67.5 ± 12.8 vs. 59.3 ± 14.7 años, p < 0.001; índice de masa corporal (kg/m2): 29.5 ± 6.3 vs. 29.7 ± 6.3, p: 0.8. El índice de apneas e hipopneas por hora de sueño (IAH en ev/h) fue: 20.8 (8.3-42.5) vs. 12.1 (4.8-26.23), p < 0.01, apneas obstructivas del sueño (AOS) leve: 30 (19.2%) vs.104 (31.5%) p < 0.05 y AOS grave 62 (37.2%) vs. 64 (18.9%), p < 0.0001. La población hospitalizada mostró mayor gravedad por IAH (p < 0.01). El tiempo total de sueño y la eficiencia media (%) fueron menores en hospitalizados; 231 minutos vs. 304, p < 0.0001 y 63.7 vs. 76.8, p < 0.001. Una escasa proporción tuvo una eficiencia normal (> 80% de tiempo total de sueño), siendo mayor en ambulatorios: 41.5 vs. 22.5 p < 0.001. Finalmente, en aquellos con tiempo total de sueño > 3 horas, la eficiencia (%) fue menor en hospitalizados; 73.3 (60.8-82.1) vs. 78.5 (67.1-86.2), p < 0.01. En pacientes hospitalizados la calidad y eficiencia de sueño fueron menores con escasa proporción de pacientes que duermen cuatro horas durante la polisomnografía.
Palabras clave: polisomnografía, síndromes de la apnea del sueño, eficiencia del sueño
Abstract Polysomnography without real-time technical supervision (sleep test level II) h as been described with adequate quality of neurological and respiratory signals. We compare the efficiency and quality of sleep in hospitalized patients and in the sleep laboratory. The study was retrospective, in a consecutive sample of systematic collection based on PSG level II. We include 486 patients: 156 hospitalized and 330 outpatients; 94 men (60.2%) vs. 181 (55%); age: 67.5 ± 12.8 vs. 59.3 ± 14.7 years, p < 0.001; body mass index (kg/m2): 29.5 ± 6.3 vs. 29.7 ± 6.3, p: 0.8. The rate of apneas and hypopneas per sleep hour (AHI in ev/h) was: 20.8 (8.3-42.5) vs. 12.1 (4.8-26.23), p < 0.01; mild obstructive sleep apnea (OSA): 30 (19.2%) vs. 104 (31.5%) p < 0.05 and severe OSA: 62 (37.2%) vs. 64 (18.9%), p <0.0001. The hospitalized population showed greater severity by AHI (p < 0.01). Total sleep time and mean efficiency (%) were lower in hospitalized: 231 minutes vs. 304, p < 0.0001 and 63.7 vs. 76.8, p < 0.001. A small proportion had a normal efficiency (> 80% of total sleep time), being higher in outpatients: 41.5 vs. 22.5 p < 0.001. Finally, in those with total sleep time > 3 hours, the efficiency (%) was lower in hospitalized: 73.3 (60.8-82.1) vs. 78.5 (67.1-86.2), p < 0.01. In hospitalized patients the quality and efficiency of sleep were lower with a small proportion of patients sleeping four hours during a polysomnography test.
Key words: polysomnography, sleep apnea syndromes, sleep efficiency
Dirección postal: Magalí Blanco, Laboratorio Pulmonar, Hospital Británico de Buenos Aires, Perdriel 74, 1280 Buenos Aires, Argentina
e-mail: blanco.magali@hotmail.com
La apnea obstructiva del sueño (AOS) constituye un trastorno respiratorio crónico de gran relevancia en la población general. Es una enfermedad cuya prevalencia en adultos se estima en 22% en hombres y 17% en mujeres, de acuerdo a la revisión del 2015 realizada por Franklin y col. 1. En un estudio efectuado en Sao Paulo, Brasil, se halló que un tercio de la población general padecía AOS 2.
La evaluación objetiva mediante polisomnografía (PSG) vigilada por personal técnico especializado (nivel I de la clasificación de la Academia Americana de Medicina del Sueño), es actualmente el estándar de referencia para el diagnóstico de la AOS 3-4. Sin embargo, se han desarrollado dispositivos portátiles para registrar parámetros de sueño sin supervisión técnica en tiempo real (clasificados como estudios de nivel II) describiéndose en ellos una buena calidad de las señales neurológicas y respiratorias, con adecuada correlación con parámetros fisiológicos cuando se compararon en el laboratorio de sueño vs. registros obtenidos en el domicilio del paciente 5, 6.
La eficiencia del sueño relaciona el tiempo total de sueño con el tiempo pasado en la cama. Varias publicaciones hacen referencia a que la calidad de sueño sería menor en el laboratorio de sueño comparada con resultados de PSG nivel II en el domicilio 5, 7, 8, mostrando menor eficiencia del sueño, menor porcentaje de etapa de sueño REM (del inglés; rapid eye movements) y aumento de microdespertares (arousals), no hallándose diferencias en cuanto a la estimación del índice de apneas e hipopneas por hora de sueño (IAH).
Sin embargo, es escaso el conocimiento actual sobre la eficiencia de sueño y calidad de la polisomnografía (PSG) realizada en la planta de internación de un hospital general, donde la prevalencia de AOS podría ser notoriamente mayor que en la población general 7-8.
Algunas unidades de sueño con gran demanda, tienen listas de espera, por lo que ofrecen estudios de PSG con vigilancia técnica parcial o bien, sin vigilancia en tiempo real en pacientes hospitalizados, en etapa estable, o luego de la mejoría de la enfermedad que generó la admisión.
La clasificación de los niveles de PSG de la Academia Americana de Medicina del Sueño (AASM) discrimina el uso de dispositivos nivel I y nivel II (domiciliarios) en los cuales se requiere personal técnico para su correcta colocación y control del paciente, aunque no precisan una vigilancia del trazado en tiempo real.
Los criterios de calidad de los estudios de sueño realizados en el contexto específico de la planta de internación no han sido suficientemente estudiados. Por ello nos propusimos describir y comparar la calidad de los registros de PSG y la eficiencia de sueño (Eff), en la PSG con vigilancia parcial realizada en pacientes ambulatorios que concurren a realizarse el estudio con dispositivos portátiles en el ámbito del laboratorio de sueño y PSG no vigilada con los mismos equipos y montajes en pacientes hospitalizados.
Materiales y métodos
Se trata de un estudio retrospectivo, descriptivo y comparativo, basado en una muestra consecutiva de registros de PSG nivel II, de una base de datos de recolección sistemática.
El objetivo del estudio fue describir y comparar la eficiencia y calidad de sueño mediante PSG realizada en la planta de internación de pacientes hospitalizados y en el laboratorio de sueño.
El protocolo fue aprobado por el Comité de Ética y Revisión Institucional del Hospital Británico de Buenos Aires (protocolo #996) de acuerdo a los principios éticos de la declaración de Helsinki y sus modificaciones sucesivas.
Se incluyeron registros de PSG consecutivos de pacientes adultos entre julio de 2014 y enero del 2018 derivados por especialistas (clínicos, neurólogos, cardiólogos y neumonólogos) por sospecha clínica de AOS, debido a alguno de los síntomas cardinales: ronquido, somnolencia excesiva o apneas observadas por terceros.
Los pacientes ambulatorios concurrieron a la Unidad de Sueño a un estudio nocturno entre las 22.30 a las 06:30 horas. Se utilizó una habitación acondicionada fuera de la planta ordinaria de internación. Se instruyó a los pacientes ambulatorios a no modificar sus hábitos de alimentación o medicación antes de la prueba de sueño.
Los hospitalizados fueron seleccionados por sospecha de AOS para una PSG sin vigilancia técnica continua en la planta de internación con una agenda similar. Los investigadores del estudio no modificaron el régimen de medicación o tratamiento de los internados antes de la realización de la PSG.
Se registraron; edad, sexo, índice de masa corporal (IMC; en kg/m2) y motivo de internación.
Los menores de 18 años y aquellos que utilizaban oxigenoterapia, CPAP (siglas en inglés de presión positiva continúa en la vía aérea), o ventilación no invasiva, fueron excluidos del estudio.
El equipamiento, procedimiento de instalación y montajes fueron los mismos en ambos grupos. Utilizamos dispositivos portátiles ALICE PDX (Philips-Respironics, USA). El montaje incluyó al menos dos canales de electroencefalografía (EEG; C4, 02); dos canales de electrooculograma, tres canales de electromiografía (submentoniano, tibiales anteriores en ambas extremidades); electrocardiograma (un canal); flujo aéreo por termistancia y cánula nasal; esfuerzo respiratorio de tórax y abdomen usando sensores RIP (pletismografía por inductancia respiratoria); ronquido; posición corporal; oximetría de pulso y frecuencia cardíaca.
Todos los registros se analizaron manualmente mediante software específico (G3 Philips-Respironics, USA). Médicos expertos en Medicina del Sueño realizaron la puntuación de los registros usando criterios estandarizados cumpliendo las normativas AASM 3-4.
Definimos tiempo total de sueño (TST) al resultante del total de tiempos calificados en cualquier etapa de sueño y eficiencia (Eff) al cociente entre el tiempo total de sueño sobre el tiempo total en cama. La latencia se definió como el tiempo entre “luces apagadas” y la primera etapa de sueño por criterios neurofisiológicos.
Se estableció que un evento respiratorio era una apnea cuando el flujo aéreo nasal se redujo en más de un 90% y una hipopnea si se redujo entre un 30% y un 90%, asociada a una caída en la saturación de > 3% o asociado a un microdespertar cortical. En ambos casos durante un tiempo superior a 10 segundos. El índice de apneas e hipoapneas (IAH) se definió como el número de eventos respiratorios (apneas o hipopneas) (ev/h) por hora de sueño. y éste fue de valor patológico cuando alcanzó > 5 ev/h, estableciéndose las siguientes categorías de gravedad: leve (IAH entre 5.1 y 14.9 ev/h), moderado (IAH entre 15 y 29.9 ev/h) y grave (IAH ≥ 30 ev/h). Todos los datos se calcularon en función del TST luego de la calificación manual.
No se incluyeron registros de titulación de CPAP o bajo ventilación no invasiva. Los registros de PSG con montaje para epilepsia o realizados en pacientes con sospecha de trastornos del sueño no respiratorios no fueron incluidos en este análisis. (Fig. 1).
Las variables continuas fueron consignadas como media y desvío estándar (±) o mediana y rango intercuartilo. Para evaluar diferencias entre grupos se utilizaron test de Student (t-test) o Mann Whitney, dependiendo de su distribución. Las variables dicotómicas fueron consignadas como número y porcentaje. Las diferencias entre variables categóricas fueron evaluadas mediante Chi cuadrado. Todos los análisis fueron a dos colas y se consideró estadísticamente significativo un valor de p < 0.05.
Resultados
Se incluyeron 486 registros en igual número de pacientes; 156 en la habitación de la planta de internación (PI) y 330 PSG en pacientes ambulatorios (PA) que concurrieron de manera programada al laboratorio de sueño.
La comparación entre PI vs. PA mostró: 94 fueron hombres (60.2%) vs. 181 (55%); edad: 67.5 ± 12.8 vs. 59.3 ± 14.7, p < 0.001; índice de masa corporal: 29.5 ± 6.3 vs. 29.7 ± 6.3, p 0.8 (Tabla 1). En la Tabla 2 se muestran los motivos de internación más frecuentes.
Los indicadores respiratorios (ev/h) entre PI vs. PA mostraron; índice de apneas e hipopneas por hora de sueño (IAH) 20.8 (8.3-42.5) vs. 12.1 (4.8-26.23), p < 0.01,AOS en grado leve: 30 (19.2%) vs.104 (31.5%) p < 0.05, y apneas obstructivas del sueño graves (AOS) 62 (37.2%) vs. 64 (18.9%), p < 0.0001. La población hospitalizada mostró mayor gravedad por IAH y no se encontraron diferencias en la proporción de pacientes sin AOS, saturación media ni tiempo de saturación por debajo del 90%. (Tabla 1).
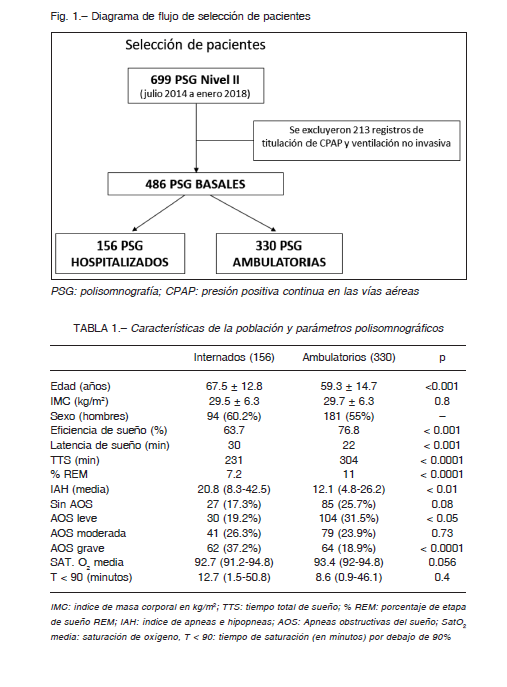
El TTS fue menor en PI: 231 minutos vs. 304 con p < 0.0001 y la Eff media (%) fue menor en el grupo de hospitalizados; 63.7 vs. 76.8 con diferencias estadísticamente significativas, p < 0.001. (Fig. 2A y B respectivamente).
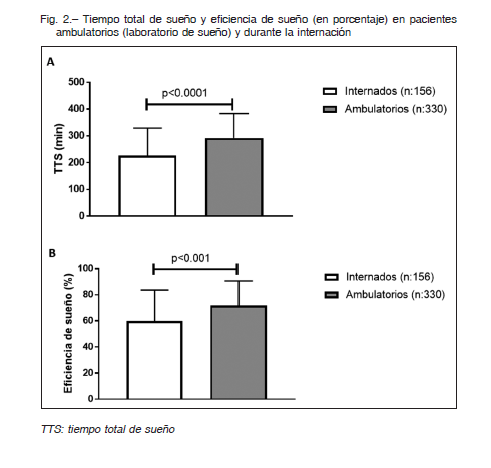
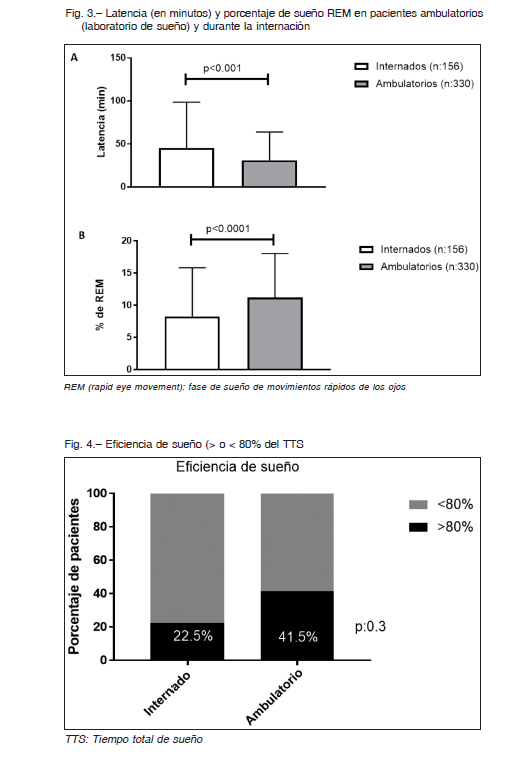
La latencia de sueño en minutos fue: 30 vs. 22, p < 0.001, tiempo total de sueño (TTS min); 231 vs. 304, p < 0.0001 (Fig. 3A) y el porcentaje de sueño REM fue de 7.1% vs. 11%, p < 0.0001, respectivamente (Fig. 3B). Más aún, en ambos grupos una escasa proporción de pacientes tuvo una Eff normal (> 80% de TTS), siendo mayor en PA; 41.5 vs. 22.5 p < 0.001 (Fig. 4).

Finalmente, en aquellos con TTS > 180 min (tres horas), la Eff (%) fue menor en el grupo PI (mediana y percentilo 25-75); 73.3 (60.8-82.1) vs. 78.5 (67.1-86.2), p < 0.01.
Discusión
Nuestro estudio expone diferencias en la calidad de sueño en la PSG nivel II en el laboratorio de sueño en relación a la PSG realizada en la planta de hospitalización.
La PSG con vigilancia técnica en el laboratorio de sueño según normativas estandarizadas es la prueba de referencia para el diagnóstico de AOS. La PSG nivel II no se recomienda como una práctica estándar, según recomendaciones internacionales (AASM), aunque la información que provee es similar y su costo es inferior 4-8.
La situación de cada institución puede determinar adaptación de la estrategia de diagnóstico en la AOS.
Nuestro centro tiene 2-3 meses de demora para PSG y frecuentemente el especialista en medicina respiratoria es convocado para definir un caso de AOS probable en un paciente que cursa una internación por otra causa.
Bruyneel y col., en un estudio prospectivo, aleatorizado, ciego y cruzado, compararon PSG en el laboratorio de sueño vs. PSG en el domicilio sin vigilancia técnica, hallando una elevada eficiencia diagnóstica con alto grado de acuerdo en los indicadores respiratorios, por lo que proponen a la PSG domiciliaria como una alternativa rentable y eficaz en el proceso diagnóstico de la AOS 7.
Sin embargo, factores extrínsecos (vinculados al ambiente) e intrínsecos (vinculados fundamentalmente a las afecciones de cada paciente y a sus alteraciones en el ritmo circadiano) interrelacionados entre sí, pueden ser responsables de la fragmentación del sueño de los hospitalizados e influir en los resultados de los estudios de PSG.
Además, características propias de cada paciente como hábitos de sueño y calidad del sueño previas a la internación, respuesta inflamatoria, dolor y ansiedad, así como la pérdida de los ciclos de luz-oscuridad y del ritmo circadiano, podrían afectar la calidad de sueño durante la hospitalización 10. Adicionalmente, el ruido ambiental, las intervenciones de enfermería o la presencia de familiares o cuidadores podrían perturbar el sueño en condiciones de internación.
Las anomalías de la arquitectura del sueño son comunes, aunque poco reconocidas, en hospitalizados. Las que han sido más frecuentemente descriptas son la reducción del tiempo total de sueño, etapas REM y N3 (sueño delta o de onda lenta) y aumento en el porcentaje de la etapa N1 (sueño superficial no consolidado) 11, consistentes con nuestros hallazgos.
En nuestra experiencia, los hospitalizados muestran un TTS reducido con latencias de sueño prolongadas.
Este hallazgo alcanza diferencias notables cuando son comparados con pacientes ambulatorios que fueron sometidos a una PSG técnicamente similar dentro del mismo hospital (en el ámbito del laboratorio de sueño) y podría reflejar alteraciones circadianas dependientes de la situación clínica 9.
Los laboratorios de sueño tienen que cumplir regulaciones respecto del nivel de luminosidad y ruido 4, 10 y aunque nosotros no hemos tomado mediciones en este sentido, hipotetizamos que el lugar y el momento en el que se realiza la evaluación polisomnográfica podrían influir en la calidad del estudio.
La AASM sugiere prudencia con las decisiones que se toman basados en estudios domiciliarios no vigilados, debido a que pueden subestimar los indicadores respiratorios y advierten que un resultado negativo no descarta la AOS 3-4,12. En este contexto, la PSG evalúa múltiples variables del sueño y arrojaría mayor exactitud en el cálculo de los indicadores respiratorios si se compara con los métodos de diagnóstico simplificados, ya que permite interpretar los arousals corticales.
En nuestra experiencia, pese a que la PSG en PI obtuvo muestra de sueño escasa y con eficiencia reducida, permitió diagnosticar y clasificar a los pacientes con IAH elevado en grado patológico en el 80% de los casos, siendo el disturbio respiratorio grave en el 37% de manera concordante a otras series publicadas 13-17.
La realización de una PSG, su análisis e interpretación y las conductas que se basan en sus hallazgos presentan dificultades en internados. Incluso la correlación con los hallazgos clínicos es difícil ya que los cuestionarios de sueño no han sido validados en este contexto, la somnolencia puede tener un origen multifactorial y la AOS es prevalente e incluso puede ser oligo o asintomática, como lo han sugerido Venkateshiah y Collop 9.
En este estudio, la población analizada tuvo una significativa preponderancia de los diagnósticos relacionados a enfermedad cerebral isquémica, desmielinizante o degenerativa que podría influir sensiblemente en los indicadores de calidad de sueño. Este dato es de interés, ya que en ciertas poblaciones la identificación y el tratamiento precoz de la AOS podrían mejorar el pronóstico (accidente cerebrovascular agudo e insuficiencia cardíaca, por ejemplo) 11.
En este contexto, nuestros hallazgos adquieren jerarquía debido a la identificación de apneas obstructivas del sueño graves en el 37.2% en este grupo de pacientes. Pese a la eficiencia de sueño reducida, la PSG en hospitalizados permite identificar poblaciones de riesgo elevado que accederían al tratamiento precozmente.
El diseño retrospectivo de nuestro trabajo no nos permite evaluar la eficacia diagnóstica de la PSG ni hacer recomendaciones para su aplicación, sin embargo, los dispositivos usados en ambos grupos y la técnica de lectura e interpretación fueron similares en una población con elevada prevalencia de AOS.
Finalmente, no fueron incluidas la totalidad de las variables que pueden actuar como probables causas de interrupción del sueño durante la noche de adquisición del trazado en los hospitalizados. Nuestros hallazgos ponen en evidencia la prudencia necesaria al analizar indicadores obtenidos de estudios hospitalarios en pacientes que cursan enfermedades agudas, ya que no conocemos el momento óptimo para el registro de PSG.
La decisión de estudiar a cualquier hospitalizado debe fundamentarse en una evaluación completa y una correcta interpretación del cuadro clínico. Asimismo, se deben tomar precauciones para evitar interrupciones innecesarias del sueño. No parece criterioso realizar estudios en pacientes críticamente inestables o en situaciones en las que la información no sería útil a la hora de indicar la terapia específica para las AOS 18.
Las condiciones clínicas pueden cambiar a medida que la enfermedad de base evoluciona o se resuelve, y podría ser necesario repetir un nuevo registro de PSG como procedimiento ambulatorio diferido (por ejemplo, después de un accidente cerebrovascular o resolución de la falla cardíaca) para redefinir el tratamiento definitivo.
Las indicaciones y estándares de práctica específicamente para hospitalizados son aún una deuda pendiente.
Finalmente, en hospitalizados la calidad y la eficiencia de sueño fueron menores y una escasa proporción de pacientes duerme cuatro horas durante un registro basal de polisomnografía no vigilada.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Franklin KA, Lindberg E. Obstructive sleep apnea is a common disorder in the population-a review on the epidemiology of sleep apnea. J Thorac Dis 2015; 7: 1311-22.
2. Tufik S, Santos-Silva R, Taddei JA, et al. Obstructive sleep apnea syndrome in the Sao Paulo Epidemiologic Sleep Study. Sleep Med 2010; 11: 441-6.
3. Berry RB, Budhiraja R, Gottlieb DJ, et al. American Acad emy of Sleep Medicine. Rules for scoring respiratory events in sleep: update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2012; 15; 8: 597-619.
4. Kapur VK, Auckley DH, Chowdhuri S, et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med 2017; 13: 479-504.
5. Iber C, Redline S, Kaplan Gilpin AM, et al. Polysomnography performed in the unattended home versus the attended laboratory setting-Sleep Heart Health Study methodology. Sleep 2004; 1; 27: 536-40.
6. Kapur VK, Rapoport DM, Sanders MH, et a. Rates of sensor loss in unattended home polysomnography: the influence of age, gender, obesity, and sleep-disordered breathing. Sleep 2000; 23:682-8.
7. Bruyneel M, Sanida C, Art G, et al. Sleep efficiency during sleep studies: results of a prospective study comparing home-based and in-hospital polysomnography. J Sleep Res 2011; 20: 201-6.
8. Bruyneel M, Ninane V. Unattended home-based polysomnography for sleep disordered breathing: current concepts and perspectives. Sleep Med Rev 2014; 18: 341-7.
9. Elliott R, Rai T, McKinley S. Factors affecting sleep in the critically ill: an observational study. J Crit Care 2014; 29: 859-63.
10. Chediak AD, Ibraheim G. Sleep medicine board certification status of physicians and American Academy of Sleep Medicine sleep center accreditation improves healthcare outcomes in obstructive sleep apnea patients treated with positive pressure therapy. It’s not complicated! J Clin Sleep Med 2014; 10: 251-3.
11. Venkateshiah SB, Collop NA. Sleep and sleep disorders in the hospital. Chest 2012; 141: 1337-45.
12. Collop NA, Anderson WM, Boehlecke B, et al. Clinical guidelines for the use of unattended portable monitors in the diagnosis of obstructive sleep apnea in adult patients. Portable Monitoring Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2007; 3: 737-47.
13. Sahlin C, Sandberg O, Gustafson Y, et al. Obstructive sleep apnea is a risk factor for death in patients with stroke: a 10-year follow-up. Arch Intern Med 2008; 168: 297-301.
14. Lee CH, Khoo SM, Tai BC, et al. Obstructive sleep apnea in patients admitted for acute myocardial infarction. Prevalence, predictors, and effect on microvascular perfusion. Chest 2009; 135: 1488-95.
15. Padeletti M, Green P, Mooney AM, Basner RC, Mancini DM. Sleep disordered breathing in patients with acutely decompensated heart failure. Sleep Med 2009; 10: 353- 60.
16. Stierer TL, Wright C, George A, Thompson RE, Wu CL, Collop N. Risk assessment of obstructive sleep apnea in a population of patients undergoing ambulatory surgery. J Clin Sleep Med 2010; 6: 467-72.
17. Goring K, Collop N. Sleep disordered breathing in hospitalized patients. J Clin Sleep Med 2008; 4:105 – 10.
18. Farney RJ, Walker JM, Cloward TV, Shilling KC, Boyle KM, Simons RG. Polysomnography in hospitalized patients using a wireless wide area network. J Clin Sleep Med 2006; 2: 28-34.
– – – –
[…]Todo se ha dicho de mí en San Juan, algún mal han creído; pero nadie ha dudado nunca de mi honradez y patriotismo, y apelo a de ello al testimonio de los que han escogido llamarse mis enemigos. Viví honorablemente haciendo de perito partidor, para lo cual me habilitaban algunos rudimentos de geometría práctica y el arte de levantar planos que había adquirido en mi infancia. Forzado por falta de abogados, defendí algunos pleitos, y siendo el Dr. Aberastain* supremo juez de alzada y mi íntimo amigo, perdí ante su tribunal los dos más importantes. Si este hecho no aboga por mi capacidad leguleya, muestra al menos la incorruptibilidad del juez.
Domingo Faustino Sarmiento (1811-1888)
Recuerdos de provincia (1850). Buenos Aires: Eudeba, 1960, p 210
*Antonino Aberastain (1810-1861). abogado y político sanjuanino, gobernador de San Juan por unos meses (1860-1861). Participó en las disputas entre federales y unitarios, después de Caseros. Derrotado y fusilado después de la batalla de Rinconada del Pocito.
