CONSTANZA F. RAMACCIOTTI, M. CELINA PEREYRA, EDUARDO N. COHEN
Servicio de Endocrinología, Clínica Universitaria Reina Fabiola, Córdoba, Argentina
Resumen El hipoparatiroidismo (hipoPTH) es una enfermedad infrecuente caracterizada por hipocalcemia y niveles inapropiadamente bajos o ausentes de parathormona. Presentamos el caso de un hombre de 25 años, deportista de alto rendimiento, con antecedente de hipoPTH secundario a tiroidectomía total dos años antes por cáncer papilar multifocal bilateral tiroideo, estadificado como T3 N1b M0, derivado por hipocalcemia sintomática. Presentaba calcemias promedio de 7mg%, síntomas de hipocalcemia en reposo y múltiples internaciones. Inicialmente, se optimizó tratamiento convencional con aporte de calcio vía oral hasta 12g/día, vitamina D y calcitriol, sin mejoría clínica ni bioquímica. Se descartaron malabsorción y complicaciones crónicas de hipoPTH. Se evidenció a través de cuestionario de salud SF-36 disminución de la calidad de vida. Se indicó sustitución con parathormona recombinante humana [rhPTH(1-84)] 50μg/día subcutánea con posterior ascenso a 75μg y reducción progresiva de la medicación por vía oral. Actualmente se encuentra asintomático, sin requerimiento de calcio ni vitamina D, mantiene calcemias de 9mg%, realiza actividad deportiva y demuestra marcada mejoría en la calidad de vida según cuestionario SF-36 (36-Item Short Form Health Survey).
Palabras clave: hipoparatiroidismo, rhPTH(1-84), hormona paratiroidea
Abstract Hypoparathyroidism (HypoPT) is a rare disease characterized by low calcium and inappropriately low circulating parathormone levels. We present the case of a 25-year-old high-performance athlete male, with history of HypoPT after total thyroidectomy for papillary thyroid carcinoma (T3 N1b M0) two years before, who was referred to our clinic for symptomatic hypocalcemia. The patient reported serum calcium average levels of 7mg%, presented symptoms of hypocalcemia at rest and had multiple hospital admissions. First, standard treatment was optimized by calcium supplementation up to 12g/d and active vitamin D, not showing clinical or biochemical improvement. Malabsorption and complications of chronic HypoPT were ruled out. The 36-Item Short Form Health Survey (SF-36) demonstrated an impaired quality of life (QoL). Full-length recombinant human parathyroid hormone [rhPTH(1-84)] therapy was started with 50μg/d subcutaneous, and later adjusted to 75μg/d and the oral treatment gradually decreased. Currently, he is asymptomatic, with serum calcium levels above 9mg%, without receiving oral medication. He performs sports activity and shows marked improvement in quality of life according to SF-36 questionnaire.
Key words: hypoparathyroidism, rhPTH(1-84), parathyroid hormone
Dirección postal: Constanza Ramacciotti, Servicio de Endocrinología, Clínica Universitaria Reina Fabiola, Oncativo 1248, Barrio General Paz, 5000 Córdoba, Argentina
e-mail: cramacciotti@hotmail.com
El hipoparatiroidismo (hipoPTH) es una enfermedad infrecuente, caracterizada por hipocalcemia (dos determinaciones de calcio sérico por debajo del rango de referencia, separado cada una por dos semanas), niveles inapropiadamente bajos o ausentes de parathormona (PTH), hiperfosfatemia e hipercalciuria 1-5.
El hipoPTH puede ser primario, por causas genéticas sindrómicas y no sindrómicas; o secundario, siendo éste el más frecuente en adultos, el 75% es posterior a cirugías en la región cervical 3, 6-8.
Los síntomas pueden ser agudos o crónicos, la calidad de vida se ve significativamente afectada; genera disminución de la concentración, depresión y ansiedad sumados a fatiga, calambres musculares y dolor muscular 3, 7.
El tratamiento convencional consiste en aporte de calcio elemental, calcitriol, vitamina D3, magnesio y/o
diuréticos tiazídicos3. Aun bajo adherencia absoluta al tratamiento, hay pacientes refractarios al mismo 3-5, 9-12.
En 2015 la Administración de Drogas y Alimentos de EE.UU. (Food and Drug Administration – FDA), y posteriormente en 2017 la Comisión Médica Europea (EMEA), aprobaron el uso de hormona paratiroidea recombinante humana [rhPTH(1-84)] como tratamiento adyuvante al calcio y vitamina D en los casos de hipoPTH refractario 3,4.
Caso clínico
Deportista masculino de alto rendimiento de 25 años, con antecedente de hipoPTH postquirúrgico persistente, fue derivado por hipocalcemia sintomática. Dos años antes se había realizado tiroidectomía total con linfadenectomía seguida de 150 mCi de I131 por carcinoma papilar tiroideo, T3 N1b M0, estadio I, con riesgo inicial de recurrencia intermedio y excelente respuesta al tratamiento inicial. Recibía citrato de calcio 2.50 g/día y calcitriol 0.25 μg/día. Presentaba calcemias promedio de 7 mg% (8.6-10.2 mg%) con PTHi 10.5 pg/ml (15-65 pg/ml), hipomagnesemia leve, fosfatemia y calciuria en límite superior.
Se optimizó progresivamente el tratamiento convencional de hipoPTH de la siguiente manera: calcio hasta 12 g/día, vitamina D3 1000 UI/día, calcitriol 1.5 μg/día y magnesio vía oral (VO), sin lograr los objetivos terapéuticos previstos (Tabla 1). Requirió reiteradas internaciones por hipocalcemia aguda grave de hasta 4 mg% asociadas a laringoespasmo y prolongación del intervalo QT en electrocardiograma, requiriendo infusión continua de gluconato de calcio endovenoso.
Se descartaron malabsorción por marcadores serológicos para enfermedad celíaca y biopsia intestinal, complicaciones crónicas de hipoPTH renales y calcificaciones cerebrales.
Los marcadores de formación y resorción óseos evidenciaron baja formación y remodelado y la densitometría mineral ósea (DMO) se encontró dentro de parámetros normales.
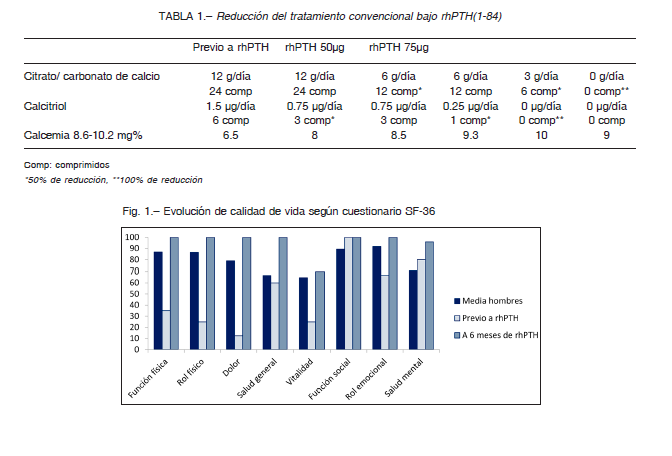
El rendimiento físico deportivo y bienestar emocional estaban afectados debido a que presentaba síntomas de hipocalcemia incluso en reposo. Se realizó cuestionario de salud SF-36 que objetivó disminución significativa de calidad de vida por enfermedad crónica (Fig. 1). El paciente requirió apoyo psicológico durante su evolución.
Debido a la falta de respuesta clínica y bioquímica al tratamiento convencional optimizado y disminución de calidad de vida, se indicó rhPTH(1-84). Se inició rhPTH(1-84) 50 μg/día subcutáneo (SC) en muslo y al mismo tiempo se redujo un 50% el calcitriol (de 1.50 a 0.75 μg/día). Se lograron calcemias de 8 mg%, sin embargo, continuaba con altos requerimientos de calcio y vitamina D. Por esta razón, dos meses después se aumentó rhPTH(1-84) a 75 μg/día y se redujo un 50% el calcio (de 12 a 6 g/día). Se lograron calcemias superiores a 9 mg% por lo que se continuó la reducción progresiva de calcio y vitamina D hasta lograr suspenderlos (Tabla 1).
A tres años de tratamiento con rhPTH(1-84) se encuentra asintomático, sin requerimiento de calcio y vitamina D, mantiene calcemias de 9 mg%, realiza actividad deportiva y demuestra marcada mejoría en calidad de vida en el cuestionario SF-36 (Fig. 1). Se realizaron nuevamente marcadores de remodelación ósea que mostraron mejoría respecto a valores previos.
Se realizó la re-estadificación de carcinoma tiroideo con tirotropina alfa (rhTSH), encontrándose libre de enfermedad.
Discusión
El hipoPTH es una enfermedad huérfana caracterizada por hipocalcemia e hiperfosfatemia debido a niveles inapropiadamente bajos o ausentes de PTH 1-3.
El tratamiento convencional incluye calcio elemental, calcitriol, vitamina D y diuréticos tiazídicos. Resulta complejo lograr el equilibrio entre hipocalcemia e hipercalciuria.
Los objetivos terapéuticos son un paciente asintomático sin disminución de calidad de vida, calcemia en límite inferior normal, sin hipercalciuria y un bajo producto fosfocálcico 1-3. Aun bajo adherencia absoluta al tratamiento hay pacientes refractarios 3-5,9-12.
Han sido estudiadas dos tipos de moléculas para reemplazo de la hormona faltante, la fracción biológicamente activa de PTH [rhPTH(1-34)] y la molécula completa obtenida por ADN recombinante [rhPTH(1-84)], solo esta última fue aprobada por la FDA para el tratamiento de hipoPTH.
La principal ventaja de rhPTH(1-84) sobre rhPTH(1-34) es que el calcio retorna a valores pre- dosis luego de 24 horas vs. 16-24 horas 3,13.
La rhPTH(1-84) incrementa el calcio iónico de manera dosis dependiente, la dosis de inicio recomendada es
50 μg/día SC, simultáneamente el calcitriol es reducido al 50%, y según la respuesta calcémica, puede ser titulada en intervalos de 2-4 semanas a 25, 75 o 100 μg/día 3,13. Los objetivos del tratamiento con rhPTH(1-84) son minimizar o eliminar el uso de calcitriol, reducir el aporte de calcio a 0.5 g/día y mantener calcemias entre 8-9 mg% 13.
El tratamiento de hipoPTH con rhPTH(1-84) se recomienda cuando la hipocalcemia no puede ser controlada a pesar de tratamiento convencional optimizado, dosis mayores a 2.5 g/día de calcio o dosis mayores a 1.5 μg/día de calcitriol, hipercalciuria, nefrolitiasis/ nefrocalcinosis/ disminución de filtrado glomerular a menos de 60 ml/min, hiperfosfatemia y/o producto fosfocálcico mayor a 55 mg2, malabsorción o marcada reducción de la calidad de vida, excepto en hipocalcemia autosómica dominante 2, 3, 14.
Los efectos de rhPTH(1-84) en hipoPTH han sido comunicados ampliamente 3,4, 9-12. Respecto a la disminución del tratamiento convencional, Cusano y col. demostraron una disminución del 37% de calcio y 45% de vitamina D, el estudio REPLACE 52% y 78%, y Rubin y col. 53% y 67% respectivamente en seis años de seguimiento 4, 9-11. En el estudio REPEAT, el 58% de los pacientes lograron independencia de calcio y vitamina D3,12. Nuestro paciente redujo un 100% el tratamiento convencional bajo rhPTH(1-84).
Los hipoparatiroideos con rhPTH(1-84) mantienen calcemias en el límite inferior normal 4, la calciuria puede disminuir 4, 10-12 o permanecer estable 9, y la fosfatemia disminuye 4,11,12.
El tratamiento con rhPTH(1-84) produce un aumento en la DMO en columna lumbar y una disminución en tercio distal de radio, sin cambios significativos a nivel del cuello femoral, compatibles con los efectos de PTH4.
Se ha comprobado mejoría en la calidad de vida de pacientes tratados con rhPTH(1-84) según el cuestionario SF-363,10. Nuestro paciente mostró mejoría en la calidad de vida evidenciada por los cuestionarios SF-36 realizados previo y a los seis meses de tratamiento con rhPTH(1-84).
Las reacciones adversas informadas fueron hipercalcemias que no requirieron hospitalización e hipocalcemias en el 3% y 12%, dentro del primer y segundo año de tratamiento respectivamente, que luego disminuyeron en el tiempo 4. Además, se informaron náuseas, cefalea, fatiga y parestesias en bajos porcentajes 4.
La FDA aprobó rhPTH(1-84) bajo la modalidad de advertencia black box para osteosarcoma debido a que se asoció en estudios con ratas, sin embargo las dosis utilizadas habían sido 3-71 veces mayores a las producidas para la administración en humanos a 100 μg/día 3, 14.
El estado hipotiroideo necesario para la evaluación de la respuesta al tratamiento de cáncer de tiroides puede lograrse tras suspensión hormonal de levotiroxina o la administración de rhTSH 15. La recategorización dinámica de riesgo a lo largo de la evolución de nuestro paciente se realizó bajo rhTSH, encontrándose libre de enfermedad.
Informamos la utilización simultanea de rhPTH(1-84) con rhTSH, sin interferencias.
La reciente aprobación por FDA de rhPTH(1-84) es un paso fundamental en el tratamiento de hipoPTH. Esta droga provee la hormona faltante y permite una significativa reducción de dosis de calcio y vitamina D, mantiene niveles de calcemia dentro del rango normal, mejora la homeostasis de calcio, reduce la calciuria y mejora la calidad de vida. El tratamiento con rhPTH(1-84) provee la hormona natural faltante, es prolongado, no posee límite terapéutico en el tiempo y una vez lograda la dosis definitiva requiere seguimiento clínico y bioquímico, acorde a guías internacionales de hipoPTH 1,2,5. Consideramos que en el futuro próximo contaremos con la evidencia necesaria para evaluar la seguridad y eficacia a largo plazo, dada la naturaleza crónica de la enfermedad y el seguimiento a pocos años de los estudios publicados.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Orloff LA, Wiseman SM, Bernet VJ, et al. American Thyroid Association Statement on Postoperative Hypoparathyroidism: Diagnosis, prevention, and management in adults. Thyroid 2018; 28: 830-41.
2. Bollerslev J, Rejnmark L, Marcocci C, et al. European Society of Endocrinology Clinical Guideline: Treatment of chronic hypoparathyroidism in adults. Eur J Endocrinol 2015; 173: G1-20.
3. Marcucci G, Della Pepa G, Brandi ML. Natpara for the treatment of hypoparathyroidism. Expert Opin Biol Ther 2016; 16: 1417-24.
4. Rubin MR, Cusano NE, Fan WW, et al. Therapy of hypoparathyroidism with PTH(1–84): a prospective six year investigation of efficacy and safety. J Clin Endocrinol Metab 2016; 101: 2742-50.
5. Bilezikian JP, Brandi ML, Cusano NE, et al. Management of hypoparathyroidism: present and future. J Clin Endocrinol Metab 2016; 101: 2313-24.
6. Clarke BL, Brown EM, Collins MT, et al. Epidemiology and diagnosis of hypoparathyroidism. J Clin Endocrinol Metab 2016; 101: 2284-99.
7. Maeda SS, Fortes EM, Oliveira UM, Borba VC, Lazaretti-Castro M. Hypo-parathyroidism and pseudo-hypoparathyroidism. Arq Bras Endocrinol Metabol 2006; 50: 664-73.
8. Clarke BL. Bone disease in hypoparathyroidism. Arq Bras Endocrinol Metabol 2014; 58: 545-52.
9. Rubin MR, Sliney JJ, McMahon DJ, Silverberg SJ, Bilezikian JP. Therapy of hypoparathyroidism with intact parathyroid hormone. Osteoporos Int 2010; 21: 1927-34.
10. Cusano NE, Rubin MR, McMahon DJ, et al. Therapy of hypoparathyroidism with PTH(1–84): a prospective fouryear investigation of efficacy and safety. J Clin Endocrinol Metab 2013; 98: 137-44.
11. Mannstadt M, Clarke BL, Vokes T, et al. Efficacy and safety of recombinant human parathyroid hormone (1–84) in hypoparathyroidism (REPLACE): a double-blind, placebocontrolled, randomised, phase 3 study. Lancet Diabetes Endocrinol 2013; 1: 275-83.
12. Lakatos P, Bajnok L, Lagast H, Valkusz Z. An open-label extension study of parathyroid hormone rhPTH(1-84) in adults with hypoparathyroidism. Endocr Pract 2016; 22: 523-32.
13. Edafe O, Antakia R, Laskar N, Uttley L, Balasubramanian S. Systematic review and meta-analysis of predictors of post-thyroidectomy hypocalcaemia. Br J Surg 2014; 101: 307-20.
14. Brandi ML, Bilezikian JP, Shoback D, et al. Management of hypoparathyroidism: summary statement and guidelines. J Clin Endocrinol Metab 2016; 101: 2273-83.
15. Haugen B, Alexander E, Bible K, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiates thyroid cancer. Thyroid 2016; 26: 1-133.
