CORINA NEMIROVSKY 1, MARÍA JOSÉ LÓPEZ FURST 1, DANIEL PRYLUKA 1, LAUTARO DE VEDIA 1, PABLO SCAPELLATO 1, ANGEL COLQUE 1, LAURA BARCELONA 1, JAVIER DESSE 1, MATÍAS CARADONTI 2, DANIEL VARCASIA 2, GABRIEL IPOHORSKI 3, ROBERTO VOTTA 4, MARCELO ZYLBERMAN 5, ADRIANA ROMANI5, PASCUAL VALDEZ 5, MAGDALENA PENINI 6, ADRIANA DE PAULIS 6, CELESTE LUCERO 7, ANDRÉS SANDOR 1, ROSITA CONTRERAS 1, ESTEBAN NANNINI 1, MARCELO GAÑETE 1, HÉCTOR RALLI 1, GUSTAVO LOPARDO 1, ANALÍA MYKIETIUK 1, SANDRA ARONSON 1 Y GRUPO DE TRABAJO DEL CONSENSO ARGENTINO DE INFECCIÓN URINARIA *
1 Sociedad Argentina de Infectología, 2 Sociedad Argentina de Urología, 3 Federación Argentina de Urología, 4 Federación Argentina de Sociedades de Ginecología y Obstetricia, 5 Sociedad Argentina de Medicina, 6 Sociedad Argentina de Bacteriología, Micología y Parasitología Clínica, 7 Administración Nacional de Laboratorios e Institutos de Salud Dr. Carlos Malbrán, Buenos Aires, Argentina
* Integrantes del Grupo de trabajo del Consenso Argentino de Infección Urinaria: ADRIANA FERNÁNDEZ LAUSI 1, ALEJANDRO FERNÁNDEZ GARCES 1, CLAUDIA RODRÍGUEZ 1, ANA CHATTAS 1, JAVIER FARINA 1, LILIANA CLARA 1, YANINA NUCCETELLI 1, FLAVIA AMALFA 6
Resumen La Sociedad Argentina de Infectología y otras sociedades científicas han actualizado estas recomendaciones utilizando, además de información internacional, la de un estudio multicéntrico prospectivo sobre infecciones del tracto urinario del adulto realizado en Argentina durante 2016-2017. La bacteriuria asintomática debe ser tratada solo en embarazadas, a quienes también se las debe investigar sistemáticamente; los antibióticos de elección son nitrofurantoína, amoxicilina, amoxicilina-clavulánico, cefalexina y trimetoprimasulfametoxazol. Ante procedimientos que impliquen lesión con sangrado del tracto urinario se recomienda solicitar urocultivo para pesquisar bacteriuria asintomática, y, si resultara positivo, administrar antimicrobianos según sensibilidad desde inmediatamente antes hasta 24 horas luego de la intervención. En mujeres, la cistitis puede ser tratada con nitrofurantoina, cefalexina, o fosfomicina y no se recomienda usar trimetoprima-sulfametoxazol o fluoroquinolonas; en pielonefritis puede emplearse ciprofloxacina, cefixima o cefalexina si el tratamiento es ambulatorio o ceftriaxona, cefazolina o amikacina si es hospitalario. En los hombres, las infecciones del tracto urinario se consideran siempre complicadas. Se recomienda tratamiento con nitrofurantoina o cefalexina por 7 días, o bien monodosis con fosfomicina. Para la pielonefritis en hombres se sugiere ciprofloxacina, ceftriaxona o cefixima si el tratamiento es ambulatorio y ceftriaxona o amikacina si es hospitalario. Se sugiere tratar las prostatitis bacterianas agudas con ceftriaxona o gentamicina. En cuanto a las prostatitis bacterianas crónicas, si bien su tratamiento de elección hasta hace poco fueron las fluoroquinolonas, la creciente resistencia y ciertas dudas sobre la seguridad de estas drogas obligan a considerar el uso de alternativas como fosfomicina.
Palabras clave: adulto, bacteriuria, agentes antimicrobianos urinarios, pielonefritis, cistitis, embarazo
Abstract The Argentine Society of Infectious Diseases and other scientific societies have updated these recommendations based on data on urinary tract infections in adults obtained from a prospective multicenter study conducted in Argentina during 2016-2017. Asymptomatic bacteriuria should be treated only in pregnant women, who should also be systematically investigated; the antibiotics of choice are nitrofurantoin, amoxicillin, clavulanic/amoxicillin, cephalexin and trimethoprim-sulfamethoxazole. In procedures involving injury to the urinary tract with bleeding, it is recommended to request urine culture and, in the presence of bacteriuria, antimicrobial treatment according to sensitivity should be prescribed from immediately before up to 24 hours after the intervention. In women, cystitis can be treated with nitrofurantoin, cephalexin or fosfomycin, while trimethoprim-sulfamethoxazole and fluoroquinolones are not recommended; pyelonephritis can be treated with ciprofloxacin, cefixime or cephalexin in ambulatory women or ceftriaxone, cefazolin or amikacin in those who are hospitalized. In men, urinary tract infections are always considered complicated; nitrofurantoin or cephalexin are recommended for 7 days, alternatively fosfomycin should be given in a single dose. In men, ciprofloxacin, ceftriaxone or cefixime are suggested for pyelonephritis on ambulatory treatment whereas ceftriaxone or amikacin are recommended for hospitalized patients. Acute bacterial prostatitis can be treated with ceftriaxone or gentamicin. Fluoroquinolones were the choice treatment for chronic bacterial prostatitis until recently; they are no longer recommended due to the increasing resistance and recent concerns regarding the safety of these drugs; alternative antibiotics such as fosfomycin are to be considered.
Key words: adult, bacteriuria, urinary anti-infective agents, pyelonephritis, cystitis, pregnancy
Dirección postal: Corina Nemirovsky, Sociedad Argentina de Infectología, Ángel J. Carranza 974, 1085 Buenos Aires, Argentina
e-mail: corina.nemirovsky@hospitalitaliano.org.ar
La infección del tracto urinario (ITU) continúa siendo uno de los motivos más frecuentes de prescripción de antimicrobianos. Hace ya más de 10 años se publicó en nuestro país un consenso intersociedades con recomendaciones para el tratamiento de la ITU 1. A pesar de ello, existe una amplia variación en las prescripciones, tanto en la elección del agente antimicrobiano como en las dosis indicadas y en la duración de los tratamientos.
Por otra parte, en los últimos años se han registrado relevantes cambios en las tasas de resistencia de los microorganismos habitualmente involucrados 2-4. Finalmente, en la actualidad se cuenta con la posibilidad de realizar intervenciones invasivas para el tratamiento de diferentes enfermedades del tracto urinario, muchas de ellas asociadas con mayores tasas de infección 5, 6.
Por tales razones, la Sociedad Argentina de Infectología (SADI) convocó a la Sociedad Argentina de Medicina (SAM), la Sociedad Argentina de Urología (SAU), la Federación Argentina de Urología (FAU, la Federación Argentina de Sociedades de Ginecología y Obstetricia (FASGO), la Sociedad Argentina de Bacteriología, Micología y Parasitología Clínica (SADEBAC) y el Servicio de Antimicrobianos ANLIS “Dr. Carlos G. Malbrán”, con el objetivo de proveer recomendaciones para el diagnóstico y tratamiento apropiado de adultos con ITU.
En este artículo se presenta la primera parte de las conclusiones del Consenso Argentino Intersociedades
de Infección Urinaria 2018-2019, en el que se abordan los siguientes temas: bacteriuria asintomática, ITU en mujeres e ITU en hombres. En otro artículo se presentarán las conclusiones en relación con la ITU en situaciones especiales: asociadas a sonda vesical, litiasis o stents ureterales, litotricia extracorpórea y transureteral, nefrolitotomía percutánea, y prostatitis bacteriana aguda asociada a biopsia prostática transrectal.
Metodología
Las recomendaciones fueron desarrolladas por especialistas pertenecientes a siete sociedades científicas de la República Argentina, todos ellos seleccionados por sus respectivas entidades en razón de su experiencia en el tratamiento de las ITU en sus diferentes aspectos. Los participantes del Consenso se reunieron tanto en grupos de trabajo como en forma plenaria para la preparación de los documentos durante 2018. En noviembre de ese año se realizó la reunión general final del Consenso donde se presentaron y discutieron las conclusiones de cada uno de los grupos de trabajo. El documento definitivo que aquí se presenta fue revisado a posteriori por los participantes para su corrección y actualización final.
El Consenso consiste en cuatro secciones presentadas en dos partes (Parte 1: Bacteriuria asintomática, ITU en mujeres, ITU en hombres; Parte 2: ITU en situaciones especiales). Esta actualización hace especial hincapié en la terapéutica, que es el aspecto que más modificaciones ha sufrido en los últimos años. Para profundizar los aspectos diagnósticos los autores refieren al lector a la versión anterior del Consenso 1.
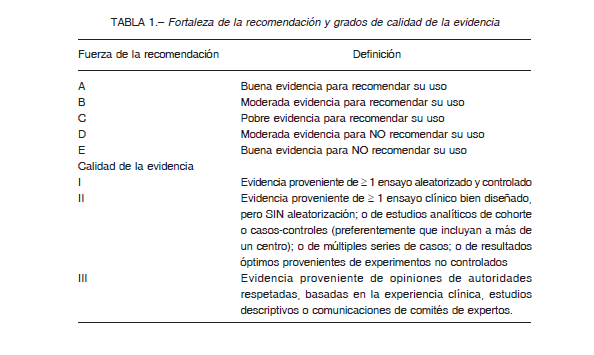
La metodología utilizada para la elaboración del Consenso consistió en la revisión de la evidencia publicada, utilizando el sistema de grados de recomendación propuesto en las Guías Clínicas de la Sociedad de Infectología de América – Servicio de Salud Pública de los EE.UU. (Infectious Diseases Society of America – US Public Health Service) 7, que considera la fortaleza de la recomendación y la calidad de la evidencia disponible (Tabla 1). A tal efecto se revisaron los estudios publicados en inglés y castellano relacionados con la etiología, el diagnóstico, el tratamiento y la prevención de la ITU en diferentes poblaciones adultas. Los mismos fueron identificados a través de búsquedas en PubMed, EBSCO, Librería Cochrane, diferentes sitios web y la revisión de las referencias de los artículos más relevantes que permitiera identificar otros estudios de valor para cumplir con el objetivo planteado.
Entre los estudios revisados se incluyeron ensayos clínicos prospectivos y aleatorizados, ensayos prospectivos de cohortes, estudios de casos y controles y otros tipos de estudios descriptivos. Se excluyeron estudios cuyos resultados, por adolecer de una pobre validez interna y externa, no permitían obtener conclusiones generalizables.
Además, se revisaron Guías y Recomendaciones elaboradas por organizaciones gubernamentales y no gubernamentales de diferentes países.
Debido a la relativa escasez de estudios aleatorizados y controlados, o de otra forma de evidencia de alto nivel en gran parte de los tópicos correspondientes a la materia, la mayoría de las recomendaciones se han basado en la discusión y el consenso tanto para establecer el nivel de evidencia proveniente de cada uno de los estudios analizados, como de la experiencia cotidiana de los autores.
La aplicación y difusión del presente Consenso proveerá al lector de las herramientas para el tratamiento
adecuado de las ITU. El uso de estas recomendaciones podrá reducir los costos (médicos, financieros y ecológicos) asociados con prácticas inapropiadas relacionadas con el uso de antibióticos, el empleo de las sondas vesicales, la duración de las hospitalizaciones, la solicitud de estudios diagnósticos y la utilización de variadas herramientas terapéuticas. De todos modos, la presente guía de ningún modo reemplaza al criterio clínico de los profesionales.
Datos epidemiológicos locales
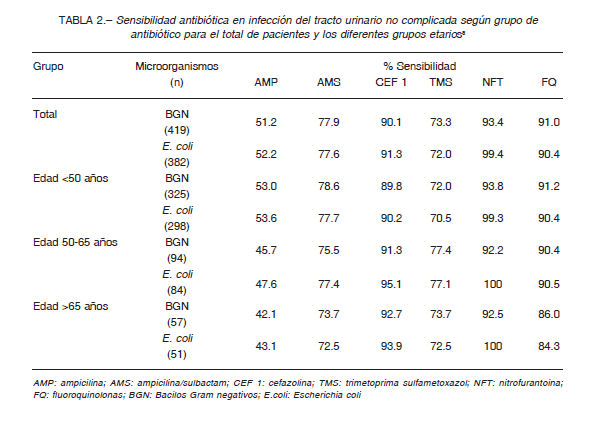
Durante el periodo 2016-2017, la SADI llevó a cabo un estudio multicéntrico prospectivo observacional del que participaron 13 centros de la Argentina (8 de la Ciudad de Buenos Aires) con el objetivo de recabar información sobre etiología y resistencia antibiótica en ITU no complicada 8.
Los tratamientos propuestos en este Consenso surgen a partir de los datos epidemiológicos obtenidos (Tabla 2) teniendo en consideración que, para la selección de un antimicrobiano, las tasas de resistencia no deberían superar el 20% para las ITU bajas y el 10% para las pielonefritis.
Bacteriuria asintomática
Se define como bacteriuria asintomática (BA) al desarrollo de un solo tipo de bacteria en la orina de individuos asintomáticos. Se requieren al menos dos urocultivos (UC) consecutivos en mujeres y uno solo en hombres con recuento ≥ 105 UFC/ml, ya sea con sedimento urinario normal o patológico. En pacientes cateterizados, un solo espécimen con recuento ≥ 102 indica la presencia de BA 1, 9, 10.
Entre las mujeres premenopáusicas que consultan de forma ambulatoria, la prevalencia es 2-10%. La BA se relaciona con la presencia de bacterias comensales y solo se debe indicar tratamiento antibiótico en situaciones determinadas, dado que no se demostraron complicaciones del árbol urinario en las mujeres que no fueron tratadas 11, 12. Por el contrario, la instauración de tratamiento en estas circunstancias se relacionó con la aparición de gérmenes multirresistentes 11, 12.
En presencia de BA no se considera necesario realizar estudios asociados (cistoscopia, ecografía) excepto que corresponda según los antecedentes clínicos. Por ejemplo, en el caso de aislamientos reiterados de bacterias productoras de ureasa (ej: Proteus mirabilis) se debe descartar la presencia de litiasis. Describimos a continuación algunas situaciones particulares en cuanto al abordaje de la BA.
Mujeres embarazadas
Se recomienda la búsqueda sistemática de la BA al menos una vez, entre la semana 12 y 16 de embarazo, preferentemente en la primera consulta prenatal (Fuerza de la recomendación AI) y solo repetirlo trimestralmente cuando la gestante presente otros factores de riego (patología renal, trasplante renal, litiasis, historia de pielonefritis a repetición o de reflujo vésico-ureteral) 13, 14.
En gestantes, la prevalencia de BA es 2-7% y constituye una indicación de antimicrobianos hasta lograr la esterilización del UC (CI) 15. En ausencia de tratamiento, podrían desarrollar cistitis y, en 30-50% de los casos, pielonefritis, debido a los cambios anatómicos y fisiológicos generados por el embarazo (estasis urinaria, dificultad para la evacuación total vesical), como así también, a otros factores asociados, tales como condición socioeconómica, partos previos, historia de ITU recurrente o diabetes 16.
La relación entre BA y el aumento de riesgo de parto prematuro y bajo peso al nacer es algo más incierta 13.
Con respecto al riesgo de parto prematuro en mujeres embarazadas tratadas por BA, dos estudios con algunas limitaciones demostraron que el riesgo era menor después del tratamiento 17, 18. Dos metaanálisis 13, 19 también notaron que el tratamiento resultó en menos riesgo. Sin embargo, otro estudio 20 no identificó ninguna diferencia con respecto al riesgo de parto prematuro o bajo peso al nacer.
Se puede optar por alguno de los siguientes esquemas, siempre utilizando el antibiograma como guía:
1) Nitrofurantoína 100 mg c/6-8 horas (la dosificación se aclara más adelante). Evitar en embarazo de término o trabajo de parto
2) Cefalexina 500 mg c/6-8 horas
3) Amoxicilina 500 mg c/8 horas
4) Amoxicilina-ácido clavulánico 875 mg c/12 horas
5) Trimetoprima-sulfametoxazol (TMS 800/160 mg c/12 horas (evitar en 1ro y 3er trimestre)
Se recomienda un ciclo de tratamiento de 4 a 7 días, dependiendo del antibiótico utilizado.
Se debe realizar UC de seguimiento 7 días posteriores a la finalización del tratamiento antimicrobiano y luego una vez por mes. En caso de persistir el UC positivo luego de dos tratamientos completos no eficaces, se deberá administrar tratamiento profiláctico por todo el período del embarazo según antibiograma 10.
Pacientes diabéticos
En diabéticos existe una mayor prevalencia de BA, aún con niveles controlados de glucemia. Sin embargo, un estudio aleatorizado controlado no demostró que el tratamiento de BA redujera los episodios de ITU 21. Se desaconseja la pesquisa de BA en esta población (EI).
Pacientes institucionalizados y/o mayores de 65 años
En este grupo, la tasa de BA se encuentra entre el 15 y el 50%. Se dificulta la diferenciación entre BA e ITU por la imposibilidad de realizar en muchas situaciones un interrogatorio que nos oriente en base al cuadro clínico. Diferentes estudios que compararon tratamiento antibiótico vs. placebo en los casos de BA, no demostraron aumento de la morbilidad en la rama placebo 22.
La terapia antimicrobiana no disminuye la frecuencia de los episodios de infección sintomática ni mejora los síntomas genitourinarios crónicos tales como la incontinencia, pero se asocia con efectos adversos y
promueve la reinfección con organismos multirresistentes 23-25. Se desaconseja la pesquisa de BA en esta población (EII).
Pacientes con alteraciones del tracto urinario y/o que requieren cateterización intermitente o sondado vesical
Los pacientes con vejiga neurogénica, patología de la médula espinal, esclerosis múltiple, neovejiga, etc., presentan su vía urinaria frecuentemente colonizada.
No se ha demostrado el beneficio de la pesquisa ni del tratamiento de la BA (DIII) 10, 25.
Pacientes en contexto de artroplastia
Dos estudios prospectivos de cohorte 26, 27 y uno aleatorizado 28 descartaron vinculación entre la presencia de BA previa a la cirugía ortopédica protésica y la infección del sitio quirúrgico, por lo que ni la pesquisa ni el tratamiento están recomendados (EI).
Pacientes que serán sometidos a procedimientos urológicos
En el contexto de procedimientos que impliquen lesión con sangrado de la mucosa del tracto urinario, el riesgo de bacteriemia asociada a BA es alrededor de 60% 25. Se recomienda la solicitud de UC para pesquisa de BA. En caso de resultar positivo, se deben indicar antimicrobianos según sensibilidad, inmediatamente antes del procedimiento, pero los mismos no deben prolongarse más allá de las 24 horas luego del procedimiento (AI). Algunos autores proponen extender la terapéutica si el paciente permanece con sonda vesical (CIII) 29.
Infecciones urinarias en mujeres
La incidencia de ITU en mujeres es claramente superior a la observada en hombres: se calcula que entre el 50 y el 60% de las mujeres adultas tendrá al menos un episodio de ITU en su vida 30. En un estudio se observó que casi el 10% de mujeres posmenopáusicas contactadas por teléfono afirmó haber tenido un episodio de ITU en el año previo 31. El pico de incidencia de ITU no complicada en mujeres se observa en las edades de máxima actividad sexual, generalmente entre los 18 y los 39 años 32.
En esta sección se analizarán los siguientes puntos: cistitis, pielonefritis, ITU en edad post-menopáusica, ITU recurrente e ITU en embarazadas.
Cistitis
Estudios epidemiológicos han descrito que la mitad de las mujeres reportarán al menos un episodio de cistitis en su vida y que el 25% tendrá un incidente recurrente 33.
La presencia de disuria, acompañada o no de polaquiuria, micción imperiosa, dolor suprapúbico y/o hematuria, sin fiebre, es la forma más frecuente de presentación.
Cuando se describen síntomas vaginales (flujo, ardor, prurito) disminuye la posibilidad diagnóstica de ITU. Ante la presencia de síntomas urinarios “clásicos”, la posibilidad de ITU es mayor al 80% y excede el valor predictivo de las tiras reactivas (dipstick) y del sedimento de orina 34.
Ante la necesidad del médico de confirmar el diagnóstico clínico, cualquiera de estos dos métodos es de utilidad.
En mujeres sanas sin factores de riesgo para infecciones con organismos resistentes a los medicamentos, puede no ser necesario un cultivo de orina confirmatorio en el primer episodio de cistitis.
El tratamiento apropiado de la cistitis contribuye a la curación clínica y también a prevenir la recaida33 y se basa comúnmente en la terapia antibacteriana corta.
Escherichia coli continúa siendo el uropatógeno principal.
El conocimiento de la etiología y los patrones de sensibilidad permiten la elaboración de guías locales que faciliten la toma de decisiones y la elección de los tratamientos empíricos adecuados 35-37.
1) Se recomienda nitrofurantoina como primera opción.
En nuestro país se comercializa la forma en macrocristales 100 mg, por lo que la dosis aprobada es de 100 mg por vía oral c/6 horas, por 5 días (AI) 38. En otros países, en los que se comercializa la composición de nitrofurantoina macrocritales/monohidrato, el intervalo interdosis puede extenderse a 12 horas. También existe bibliografía que respalda el uso de nitrofurantoína macrocristales en dosis de 100 mg c/8 horas 39-41 (CIII).
2) Otra opción es cefalexina 500 mg vía oral c/8 horas por 5-7 días (BII).
3) Como alternativa se puede indicar fosfomicina trometamol 3 g vía oral dosis única (AI). Comparada con la nitrofurantoina, la fosfomicina resultó menos efectiva 42.
Por esta razón y por el potencial impacto en la emergencia de resistencia se sugiere reservar esta alternativa terapéutica para cuando no existan otras opciones.
4) Las cifras nacionales de sensibilidad no favorecen el uso de TMS en forma empírica ya que la tasa de resistencia supera el 20% en la comunidad (Tabla 2).
5) No se recomienda el uso de fluoroquinolonas para el tratamiento empírico de la cistitis aguda (BIII). Los informes de efectos adversos post-comercialización han provocado la difusión de un alerta de los entes reguladores instando a contraindicar estas drogas como primera elección en infecciones leves con otras opciones terapéuticas 42, 43.
Pielonefritis aguda
La pielonefritis aguda es una infección grave del tracto urinario que afecta la pelvis y el parénquima renal 44.
La presentación clínica varía desde un cuadro leve solo manifestado por disuria hasta una sepsis por bacilos Gram negativos. Representa uno de los cuadros clínicos más frecuentes en los servicios de urgencias. Aunque la mortalidad asociada es baja (exceptuando algunos casos de sepsis urinaria grave), la morbilidad es importante y es causa frecuente de ausentismo laboral. En el anciano es una de las causas más comunes de bacteriemia y de shock séptico.
En el cuadro clínico clásico se producen manifestaciones locales como dolor lumbar o hipersensibilidad, y sistémicas como fiebre, náuseas y vómitos, que la diferencian de la infección del tracto urinario inferior. Un tercio de las mujeres con infección renal pueden tener solamente síntomas que sugieren infección urinaria baja (pielonefritis oculta) y en estos casos los regímenes antibióticos cortos habitualmente fracasan. Aproximadamente un 20% de las pacientes no tienen síntomas urinarios y algunas no tienen fiebre 1, 45.
El estudio que certifica el diagnóstico de pielonefritis es el UC. En aproximadamente el 80% de las pacientes con pielonefritis el recuento de colonias es >105 UFC. El Consenso Argentino Intersociedades de 2007 definió como significativo un recuento de colonias de 104 para el diagnóstico de pielonefritis (sensibilidad 90-95%) 1, 36. Las tasas de bacteriemia varían entre los estudios desde < 10% a > 50% según los factores del huésped, siendo mayor en presencia de enfermedad grave, inmunocompromiso, obstrucción urinaria y edad > 65 años. Los hemocultivos no deben ser realizados en forma rutinaria ante sospecha de pielonefritis porque el resultado no cambiará el tratamiento.
Pueden ser útiles para establecer el diagnóstico en casos ambiguos, por ejemplo en poblaciones con alta
prevalencia de bacteriuria asintomática o en sujetos que recibieron tratamiento antibiótico 46, 47.
Los estudios por imágenes no deben ser solicitados en forma rutinaria 36, 48. Se los recomienda en pacientes que ingresan con sepsis o shock séptico, con diagnóstico conocido o sospecha de obstrucción del tracto urinario, pH urinario ≥ 7, clearance de creatinina < 40 ml/min o en aquellos que continúan sintomáticos luego de 72 horas de tratamiento antibiótico efectivo, con el objetivo de descartar absceso renal o perirrenal, obstrucción y/o anomalías de la vía urinaria. La ecografía es menos costosa y más sensible para la detección de hidronefrosis y litiasis. La tomografía axial computarizada sería de elección para el diagnóstico de abscesos, inflamación y producción de gas.
Hay tres opciones de seguimiento de estas pacientes: en forma ambulatoria, observación en guardia evaluando la respuesta al tratamiento o ingreso hospitalario. Esta decisión va a depender de la gravedad de la presentación, la presencia de vómitos, la fragilidad y las patologías concomitantes 49. La mayoría no requiere hospitalización y puede ser tratada por vía oral en forma ambulatoria.
1) Como tratamiento empírico pueden indicarse ciprofloxacina 500 mg c/12 horas, cefixima 400 mg/día.
2) Otra opción es la administración de ceftriaxona 1g/día hasta disponer de los resultados del UC y continuar luego según antibiograma.
3) En presencia de síntomas graves, inestabilidad hemodinámica o intolerancia digestiva, se recomienda la internación y el inicio de tratamiento por vía parenteral, con ceftriaxona 1g/día, cefazolina 1-2 g c/8 horas o amikacina 1 g/día, observando la evolución, y luego continuar el tratamiento en forma ambulatoria una vez conocido el resultado del UC, cuando se llegue a la estabilidad clínica 36, 50-52.
4) Nitrofurantoina y fosfomicina no representan opciones válidas por su escasa penetración en el riñón, así como tampoco TMS debido a las altas tasas de resistencia.
Las opciones de tratamiento por vía oral, con documentación microbiológica, son TMS 160/800 mg c/12 horas, amoxicilina-ácido clavulánico 1g c/12 horas, cefalexina 500 mg c/8 horas, ciprofloxacina 500 mg c/12 horas y cefixima 400 mg 53. El tratamiento antibiótico de la pielonefritis debe prolongarse durante 7 días cuando se utilizan fluoroquinolonas 51, 52, 54 y 10 días cuando se utiliza TMS o β-lactámicos 55-57. La respuesta al tratamiento se evalúa clínicamente, y no está indicado realizar UC de control.
Infecciones del tracto urinario en la postmenopausia
En las mujeres postmenopáusicas existe una mayor colonización vaginal con bacilos Gram negativos y mayor incidencia de bacteriuria. Estos hallazgos microbiológicos se correlacionan con los cambios en el ambiente vaginal, como la desaparición de los lactobacilos, la elevación del pH, la atrofia en el epitelio uretral y el plexo suburetral 58, la presencia de residuo post-miccional debido a cambios hipotónicos de la contractilidad del detrusor y/o la mayor prevalencia de prolapso de órganos pélvicos que pueden dar como resultado una obstrucción parcial 59-61.
Los estudios epidemiológicos han demostrado que 15-20% de las mujeres de 65-70 años y 20-50% de las mayores de 80 años tienen bacteriuria. La incidencia de infecciones urinarias varía entre 10 y 30% 61.
El espectro clínico de presentación varía desde los clásicos signos y síntomas en las mujeres autoválidas a presentaciones más atípicas, incluyendo letargo, delirio, febrícula y anorexia. Este hallazgo hace más dificultoso el diagnóstico de ITU y genera una tendencia al diagnóstico erróneo y al uso inadecuado de antibióticos en esta población.
El tratamiento empírico de la ITU en mujeres postmenopáusicas es básicamente el mismo que en las mujeres jóvenes. Cabe mencionar que la nitrofurantoina no debe utilizarse con clearance de creatinina < 50 ml/min. Más allá de la recomendación de no utilizar quinolonas como tratamiento de primera línea para cualquier tipo de ITU dada la alta tasa de efectos adversos 42, 43, en pielonefritis la indicación de quinolonas se desaconseja dado que la prevalencia de resistencia para E. coli en mayores de 65 años es >15% (EIII).
Infección recurrente del tracto urinario
La ITU recurrente se define por la presencia de, al menos, tres episodios de ITU en el último año o dos episodios en los últimos 6 meses 1. Los estudios muestran que 30-44% de las pacientes que tienen un episodio de cistitis aguda tendrán una recurrencia, a menudo dentro de los tres meses 62. Se ha encontrado una tasa media de recurrencia de 2.6 (rango 0.3-7.6) infecciones por paciente por año 63.
Algunas medidas pueden disminuir la frecuencia de los episodios 1:
– Evitar la retención de orina y promover la micción post-coito
– Evitar el uso de diafragmas con cremas espermicidas como método anticonceptivo
– Evitar el estreñimiento
– La recomendación del uso de arándanos en jugo o comprimidos se ve limitada no solo por la inconsistencia de su eficacia sino también por la alta tasa de abandonos en tratamientos prolongados y las interacciones con otros medicamentos como warfarina 64, 65
– Estrógenos tópicos: en diversos estudios todas las preparaciones de estrógeno vaginal (óvulos, crema, anillos vaginales) disminuyeron el número de ITU en comparación con placebo o en comparación con la condición basal (número de infecciones antes de comenzar el estudio o presencia de bacteriuria) 66
– Estrógenos sistémicos: En ningún estudio se observó reducción significativa en los episodios de ITU en comparación con placebo 67, 68
– D-manosa: Los manósidos son moléculas pequeñas biodisponibles por vía oral y muestran acción inhibitoria sobre la adhesión bacteriana al uroepitelio 69. En un estudio se demostró que la administración de 2 g de D-manosa por día redujo el riesgo de recurrencia de ITU en forma similar al tratamiento con nitrofurantoina. Se requieren más estudios para validar estos datos 70.
– Incremento en la hidratación: En un estudio aleatorizado se indicó a mujeres postmenopáusicas agregar 1.5 litros por día a su consumo usual de agua. Se obtuvo una reducción aproximada del 50% del número de cistitis y se prescribieron significativamente menos antibióticos.
Aunque esta estrategia no resulta tan efectiva como la profilaxis antibiótica en reducción de la recurrencia, el efecto beneficioso de la mayor hidratación es seguro, barato y no selecciona resistencia antibiótica 71
– Las vacunas y la interferencia bacteriana basada en la instilación intravesical de cepas avirulentas de E. coli han mostrado resultados prometedores y podrían ser útiles en estas circunstancias68. No se dispone de evidencia suficiente para valorar la eficacia de otras medidas como la acidificación de la orina con vitamina C o hipurato de metenamina, la aplicación intravaginal de Lactobacillus y la utilización de sustancias análogas de receptores uroepiteliales 68.
Si a pesar de la implementación de estas medidas las ITU persisten, se considerarán algunas de las siguientes estrategias terapéuticas:
– Profilaxis antibiótica continua: en mujeres que presentan más de tres episodios en el año se puede indicar la administración de antibióticos en bajas dosis (TMS o nitrofurantoína), a fin de descolonizar el periné de la flora entérica. La elección del antibiótico debería hacerse en base a los resultados de UC previos y a los datos de epidemiología local. Si bien la profilaxis suele recomendarse durante seis a doce meses, en mujeres con altas tasas de recurrencia puede prolongarse por períodos mayores.
– Administración de antibióticos profilácticos post-coito: está dirigida a las mujeres que claramente relacionan los episodios de recurrencia con el acto sexual. Puede utilizarse TMS 400/80 mg, nitrofurantoína 50-100 mg, norfloxacina 400 mg o cefalexina 250 mg.
– Autotratamiento: si los episodios son menos de tres en el año se pueden indicar regímenes de 3 días con
TMS o fluoroquinolonas, 5 días con nitrofurantoína o 5-7 días con cefalosporinas de 1ra generación. Esta es una estrategia segura y efectiva como alternativa a los demás procedimientos mencionados.
Infecciones del tracto urinario en la embarazada
Las ITU son la segunda patología más común del embarazo después de la anemia 72. Se estima que 5-10% de las mujeres desarrollarán algún tipo de ITU durante el embarazo 73. La ITU es el tipo de infección más frecuente durante el embarazo, y representa el 5% de todas las admisiones hospitalarias de embarazadas 72.
Cistitis
La cistitis ocurre en 1-4% de las embarazadas, siendo el segundo semestre el momento de mayor prevalencia 74.
Es de destacar que una de cada tres embarazadas con BA desarrollará cistitis aguda 75.
El diagnóstico se confirma mediante un UC con > 1000 UFC/ml acompañado de clínica sugestiva de infección 29, 76. Ante síntomas de cistitis con UC negativo se debe descartar el síndrome uretral y solicitar búsqueda de Chlamydia trachomatis, Mycoplasma homminis y Ureaplasma urealiticum en primer chorro de orina o hisopado cervical.
El tratamiento se inicia en forma empírica y debe ajustarse según antibiograma. En una revisión sistemática Cochrane no se encontraron diferencias significativas entre los tratamientos antibióticos disponibles en cuanto a tasa de curación, infección recurrente, incidencia de pretérmino, admisión a unidad de cuidados intensivos neonatales y fiebre prolongada. Además, la tasa de efectos secundarios fue muy baja 75.
Pueden utilizarse las siguientes opciones:
1) Cefalexina 500 mg c/8 horas (CIII)
2) Nitrofurantoína 100 mg c/6 horas (AI) (evitar en embarazo de término o trabajo de parto). Sin embargo, según bibliografía comentada anteriormente39-41, podría ser administrada c/8 horas.
3) Fosfomicina trometamol 3 g única dosis (AI) En cuanto a duración, para minimizar la exposición del feto son preferibles las pautas cortas (4-7 días), que han mostrado ser eficaces, y se reserva la monodosis para la fosfomicina 76, 77.
Está indicado realizar un UC de control 7-15 días después de completar la antibioterapia, y mensualmente hasta finalizar el embarazo (AIII).
En caso de recidiva, se debe actuar en función del antibiograma. Si después de dos tratamientos completos
persiste la cistitis, está indicado el tratamiento supresor profiláctico.
Pielonefritis
La infección del parénquima renal aparece en 1-4% de las gestaciones y su prevalencia aumenta al 6% en gestantes en las que no se ha realizado pesquisa de BA durante el embarazo. El 80-90% de las pielonefritis aparecen en el segundo o tercer trimestre de la gestación y en el puerperio 73.
La pielonefritis en el embarazo es una enfermedad grave: alrededor del 20% desarrollará complicaciones, entre las que pueden mencionarse shock séptico, síndrome de distrés respiratorio del adulto (SDRA), anemia hemolítica, insuficiencia respiratoria, insuficiencia renal, abscesos renales y litiasis 76.
En 10-20% de las pacientes existe bacteriemia pero no hay evidencia de que esto implique un peor pronóstico o requiera un tratamiento diferente 76. De todas formas, sería razonable obtener hemocultivos en aquellas mujeres que sí presenten síntomas sépticos o que tengan comorbilidades y/o falta de respuesta al tratamiento antibiótico inicial 13, 73, 76 (BII).
Dado el mayor riesgo de complicaciones en embarazadas, la pielonefritis ha sido tratada tradicionalmente con hospitalización y antibióticos intravenosos hasta que la paciente esté afebril durante 24 a 48 horas y mejore sintomáticamente 10, 78. Las embarazadas con pielonefritis aguda sin anomalías renales o urológicas, complicaciones del embarazo, signos de sepsis o tratamientos antibióticos recientes podrían ser consideradas para tratamiento ambulatorio si se asegura un seguimiento apropiado (BI).
Esquemas terapéuticos
1) Ceftriaxona 1-2 g/24 h EV o IM (AII). Considerar 2 g ceftriaxona en 2do y 3er trimestre por el aumento del peso corporal y del volumen de distribución
2) En caso de alergia a β-lactámicos:
• Gentamicina 240 mg/24h IM/EV
• Aztreonam 1g-2g EV c/8-12 horas, según gravedad
Tras 48-72 horas afebril continuar con antibióticos por vía oral (según resultado de antibiograma) hasta completar 10 días de tratamiento.
Como seguimiento clínico se propone UC a los 7-14 días de finalizar tratamiento antibiótico. Teniendo en cuenta que hasta un 20% de las pielonefritis recidivan, se debe realizar un UC mensual de control. Considerar tratamiento antibiótico supresor en caso de pielonefritis recidivante durante la gestación o tras un único episodio de pielonefritis en pacientes con patología renal o de vías excretoras.
Infecciones urinarias en hombres
Las ITU en hombres se consideran dentro del grupo de las complicadas 79. Su incidencia es muy baja en hombres jóvenes. Un estudio europeo publicó una tasa de 6-8 episodios de ITU por cada 10 000 hombres entre 21-50 años 80. La incidencia aumenta a partir de los 50 años, cuando la patología prostática y las instrumentaciones de la vía urinaria, que son reconocidos factores de riesgo, se tornan más frecuentes.
Siempre debe efectuarse un UC para su estudio, y se considera significativo un recuento de bacterias superior a 103 UFC/ml (AI) 29.
Si bien se recomienda guiar el tratamiento antibiótico según los patrones de sensibilidad locales, debe destacarse que los datos epidemiológicos de IU en hombres son muy escasos debido a la baja incidencia de esta enfermedad.
El diagnóstico de ITU en un hombre suele conducir a evaluaciones adicionales en busca de problemas estructurales de la vía urinaria. Sin embargo, no existe acuerdo respecto a cómo y cuándo evaluar a estos pacientes.
Algunos estudios con escaso número de casos 81, 82 sugieren que, en ausencia de datos clínicos o de laboratorio orientadores, la evaluación rutinaria con imágenes sería innecesaria, ya que raramente ofrece información que obligue a modificar decisiones terapéuticas (BII). Los estudios rutinarios de imágenes deben reservarse para fracaso terapéutico, recurrencia temprana sintomática o hematuria microscópica persistente, sugestiva de anomalías urológicas mayores 83. En caso de requerirse estudios por imágenes, la ecografía renal es de elección para evaluar la presencia de obstrucción y eventualmente guiar intervenciones. En forma complementaria, la TC puede ser útil para definir la causa de una obstrucción, así como la naturaleza y extensión de lesiones intra y extrarrenales.
Muy pocos trabajos han evaluado el tratamiento de ITU en hombres, debido probablemente a la menor frecuencia en esta población en comparación con la mujer adulta.
La duración óptima del tratamiento en hombres no ha sido estudiada, por lo que los datos usados para realizar recomendaciones suelen surgir de la extrapolación de la información conocida en mujeres 49. A continuación se presentan las recomendaciones para el tratamiento de hombres con cistitis, pielonefritis y prostatitis.
Cistitis
No se ha comprobado que los cursos cortos de antibióticos, ensayados con eficacia en mujeres, sean apropiados para el tratamiento de cistitis en hombres1. Se recomienda que la extensión de los tratamientos en hombres sea de 7 días.
No se recomienda efectuar UC al final del tratamiento si la respuesta clínica fue favorable, dado que la colonización asintomática no debería ser tratada 25, 83 (BII).
Se recomienda el tratamiento con:
1) Nitrofurantoína 100 mg c/6 horas. Según bibliografía comentada anteriormente podría administrarse c/8 horas 39-41.
2) Cefalexina 500 mg c/8 horas
3) Fosfomicina trometamol 3 g en monodosis
Pielonefritis
Una gran proporción de los varones con ITU febril tienen compromiso prostático concomitante, evidenciado por incremento transitorio de PSA y/o del volumen prostático, por lo que algunos autores prefieren elegir drogas con buena penetración prostática para el tratamiento de la pielonefritis 80.
En cuanto a la duración del tratamiento antibiótico, un estudio aleatorizado que incluyó hombres demostró que 7 días no era inferior a 14 días en términos curación clínica temprana56. Teniendo en cuenta que el antibiótico utilizado en el estudio fue ciprofloxacina, debería considerarse prolongar el tratamiento a 10 días cuando se utilicen otros antibióticos, hasta que exista evidencia que avale el tratamiento acortado.
Se sugieren como tratamientos empíricos:
a) Para pielonefritis de tratamiento ambulatorio
1) Ciprofloxacina 500 mg c/12 horas VO
2) Ceftriaxona 1 g/día IM o IV
3) Cefixima 400 mg/día VO
b) Para pielonefritis que requiere internación
1) Ceftriaxona 1 g/día IV o IM
2) Amikacina 1 g/día IV o IM
Prostatitis
La prostatitis es la patología urológica más común en menores de 50 años y la tercera en mayores de 50 años; se ha estimado en un 25% la probabilidad de que un hombre padezca un episodio de prostatitis en su vida. La mayoría de las prostatitis bacterianas son consecuencia de una ITU causada por patógenos con factores de virulencia especiales. Los factores de riesgo más comunes son: instrumentación del tracto urinario, estrechez uretral y uretritis (generalmente por gérmenes asociados a infecciones de trasmisión sexual) 84.
Las prostatitis bacterianas agudas (PBA) comprenden < 1% de las prostatitis bacterianas; la mayoría de estos casos son causados por infección uretral ascendente o reflujo intraprostático. El compromiso general puede ser importante. En un estudio prospectivo, el 29% requirió hospitalización y el 17.6% presentó bacteriemia; además estos últimos fueron más frecuentemente re-hospitalizados luego del alta 85.
En la práctica, el diagnóstico de PBA suele efectuarse ante la presencia de síntomas urinarios y prostáticos, con repercusión sistémica, utilizándose el UC y los hemocultivos como métodos de investigación etiológica 86, 87.
En las PBA, según el estado del paciente, puede requerirse la hospitalización y la administración de dosis altas de antibióticos parenterales. El tratamiento puede consolidarse por vía oral una vez que el paciente se encuentre en recuperación para cumplir 2 a 4 semanas de tratamiento, siempre que los resultados de los cultivos lo permitan.
Se sugiere iniciar el tratamiento con:
1) Ceftriaxona 1 o 2 g por día IV o IM
2) Gentamicina 240 mg por día IV
La falta de respuesta clínica en las primeras 36 horas debe hacer sospechar la presencia de un absceso prostático 88. Los factores de riesgo para la presencia de absceso prostático son cateterización urinaria prolongada, manipulación uretral reciente e inmunocompromiso 89.
Las prostatitis bacterianas crónicas complican a aproximadamente el 5% de los pacientes con PBA, aunque
también pueden ocurrir sin infección aguda previa. La formación de biopelículas bacterianas y los cálculos prostáticos favorecen la persistencia de la infección y la aparición de resistencia bacteriana 90.
El tratamiento de la prostatitis bacteriana crónica es un desafío. La poca inflamación tisular que la glándula presenta dificulta la penetración de los antibióticos, condicionando una alta tasa de recidiva. Los antimicrobianos que mejor penetración prostática y eficacia clínica han demostrado son fluoroquinolonas, sulfonamidas, macrólidos y tetraciclinas 91. Recientemente, se ha añadido fosfomicina trometamol a esta lista, dado que demostró una buena concentración glandular en hombres sanos 92.
Si bien el tratamiento de prostatitis bacterianas crónicas con fluoroquinolonas por 4 a 6 semanas ha mostrado curas microbiológicas cercanas al 70% 93, la creciente resistencia en nuestro medio 8 y las advertencias recientes respecto a la seguridad de estas drogas 42, 43, obligan a reconsiderar su uso. Distintos estudios no aleatorizados avalarían el uso de fosfomicina en dosis diaria de 3 g por una semana, seguido de 3 g c/48 horas por 6 a 16 semanas 94, 95, aunque son necesarios mayores datos clínicos sobre la dosis apropiada y la posible combinación con otros agentes.
En las prostatitis bacterianas crónicas causadas por C. trachomatis, azitromicina 500 mg tres días a la semana durante 3 semanas mostró mejor respuesta que ciprofloxacina 500 mg/12 horas por 20 días 96. Azitromicina 1 g/semana por 4 semanas y doxiciclina 100 mg/12 horas por 28 días mostraron respuestas similares, tanto para el tratamiento de C. trachomatis 97 como de U. urealyticum 98.
El dolor pelviano crónico, con síntomas prostáticos y sin rescate microbiológico es un frecuente motivo de consulta. La mayoría de los estudios no mostraron beneficios en la administración de antibióticos en este escenario 99, no obstante, muchos autores recomiendan realizar una prueba terapéutica con antibióticos si no han sido utilizados anteriormente 90.
Bibliografía
1. Levy Hara G, Lopardo G, López Furst MJ, et al. Consenso Intersociedades para el manejo de la infección del tracto urinario. Rev Panam Infectologia 2007; 9: 57-69. En: https://www.sadi.org.ar/guias-recomendaciones-yconsensos/item/26-consenso-intersociedades-para-elmanejo-de-la-infeccion-urinaria-en-adultos; consultado octubre 2018.
2. Bertoni G, Pessacq P, Sarica K, et al. Etiology and antimicrobial resistance of uncomplicated urinary tract infections. Medicina (B Aires) 2017; 77: 304-8.
3. Cornistein W, Cremona A, Chattas AL, et al. An update on catheter-associated urinary tract infection. Inter-Society recommendations. Medicina (B Aires) 2018; 78: 258-64.
4. Leoni AF, Monterisi A, Acuña PG. Community acquired urinary tract infections in older adults. Rev Fac Cien Med Univ Nac Cordoba 2017; 74: 10-7.
5. Türk C, Petřík A, Sarica K, et al. EAU Guidelines on interventional treatment for urolithiasis. Eur Urol 2016; 69: 475-82.
6. Roberts MJ, Bennett HY, Harris PN, et al. Prostate biopsyrelated infection: A systematic review of risk factors, prevention strategies, and management approaches. Urology 2017; 104: 11-21.
7. Infectious Diseases Society of America. Handbook on clinical practice guideline development, 2015. En: http://www.idsociety.org/uploadedFiles/IDSA/ Guidelines-Patient_Care/IDSA_Practice_Guidelines/IDSA%20Handbook%20on%20CPG%20Development%2010.15.pdf; consultado octubre 2018.
8. Lopez Furst MJ, Mykietiuk A, Pessacq P, et al. Communityacquired uncomplicated urinary tract infections (UTI): current etiology and antimicrobial susceptibility in Argentina. A prospective, observational, multicenter study. IJID 2018; 73:7-9.
9. Gleckman R, Esposito A, Crowley M, Natsios GA. Reliability of a single urine culture in establishing diagnosis of asymptomatic bacteriuria in adult males. J Clin Microbiol 1979; 9: 596-7.
10. Grabe M, Bartoletti R, Bjerklund-Johansen TE, et al. Guidelines on urological infections. Eur Urol Suppl 2015; 15: 71-80. En: https://uroweb.org/wp-content/uploads/19-Urological-infections_LR2.pdf; consultado octubre 2018.
11. Schnarr J, Smaill F. Asymptomatic bacteriuria and symptomatic urinary tract infections in pregnancy. Eur J Clin Invest 2008; 38: 50-7.
12. Tencer J. Asymptomatic bacteriuria–a long-term study. Scand J Urol Nephrol 1988; 22: 31-4.
13. Smaill FM, Vazquez JC. Antibiotics for asymptomatic bacteriuria in pregnancy (Review). Cochrane Database Syst Rev 2015; 7: CDOOO490.
14. Lin K, Fajardo K, U.S. Preventive Services Task Force. Screening for asymptomatic bacteriuria in adults: evidence for the U.S. Preventive Services Task Force reaffirmation recommendation statement. Ann Intern Med 2008; 149: W20-4.
15. Care H. Screening for asymptomatic bacteriuria within the framework of the German maternity guidelines , under special consideration of test Publishing details. Institute for Quality and Efficiency in Health Care. Cologne, Germany: Institute for Quality and Efficiency in Health Care (IQWiG); 2015 Feb. Executive Summary of Final Report No. S13-02. En: https://www.ncbi.nlm.nih.gov/books/NBK385751/; consultado octubre 2019.
16. McIsaac W, Carroll JC, Biringer A, et al. Screening for asymptomatic bacteriuria in pregnancy. J Obstet Gynaecol Canada 2005; 27: 20-4.
17. Thomsen AC, Morup L, Brogaard Hansen K. Antibiotic elimination of group‐B streptococci in urine in prevention of preterm labour. Lancet 1987; 1: 591‐3.
18. Wren BG. Subclinical renal infection and prematurity. Med J Aust 1969; 2: 596‐600.
19. Romero R, Oyarzun E, Mazor M, Sirtori M, Hobbins JC, Bracken M. Meta-analysis of the relationship between asymptomatic bacteriuria and preterm delivery/low birth weight. Obstet Gyneco 1989; 73: 576-82.
20. Kazemier BM, Koningstein FN, Schneeberger C, et al. Maternal and neonatal consequences of treated and untreated asymptomatic bacteriuria in pregnancy: a prospective cohort study with an embedded randomised controlled trial. Lancet Infect Dis 2015; 15: c1324–33.
21. Zhanel GG, Harding GK, Nicolle LE. Asymptomatic bacteriuria in patients with diabetes mellitus. Rev Infect Dis 2018; 13: 150-4.
22. National Institute for Health and Care Excellence (NICE). Urinary tract infections in adults, 2015; 1–33. En: https://www.nice.org.uk/guidance/qs90; consultado octubre 2019.
23. Nicolle LE. Urinary tract infections in the older adult. Clin Geriatr Med 2016; 32: 523-38.
24. Detweiler K, Mayers D, Fletcher SG. Bacteruria and urinary tract infections in the elderly. Urol Clin North Am 2015; 42: 561-8.
25. Nicolle LE, Bradley S, Colgan R, Rice JC, Schaeffer A, Hooton TM. Infectious Diseases Society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults. Clin Infect Dis 2005; 40: 643-54.
26. Sousa R, Munoz-Mahamud E, Quayle J, et al. Is Asymptomatic bacteriuria a risk factor for prosthetic joint infection? Clin Infect Dis 2014; 59: 41-7.
27. Bouvet C, Lübbeke A, Bandi C, et al. Is there any benefit in pre-operative urinary analysis before elective total joint replacement? Bone Joint J 2014; 96–B : 390-4.
28. Cordero-Ampuero J, González-Fernández E, Martínez- Vélez D, Esteban J. Are antibiotics necessary in hip arthroplasty with asymptomatic bacteriuria? Seeding risk with/without treatment. Clin Orthop Relat Res 2013; 471: 3822-9.
29. De Cueto M. Aliaga L, Alos JI, et al. Diagnosis and treatment of urinary tract infection: Clinical guidelines of the Spanish Society of Clinical Microbiology and Infectious Diseases (SEIMC). Enferm Infecc Microbiol Clin 2017; 35: 314-20.
30. Foxman B, Gillespie B, Koopman J, et al. Risk factors for second urinary tract infection among college women. Am J Epidemiol 2000; 151: 1194-205.
31. Foxman B, Barlow R, D’Arcy H, Gillespie B, Sobel JD. Urinary tract infection: self-reported incidence and associated costs. Ann Epidemiol 2000; 10: 509-15.
32. Hooton TM, Besser R, Foxman B, Fritsche TR, Nicolle LE. Acute uncomplicated cystitis in an era of increasing antibiotic resistance: a proposed approach to empirical therapy. Clin Infect Dis 2004; 39: 75-80.
33. Cortes JA, Perdomo R, Morales D, et al. Guía de práctica clínica sobre diagnóstico y tratamiento de infección de vías urinarias no complicada en mujeres adquirida en la comunidad. Rev Fac Med 2015; 63: 565-81.
34. Fernández DJ, Di Chiazza S, Veyretou FP, et al. Análisis de orina: estandarización y control de calidad. Acta Bioquímica Clínica Latinoamericana 2014; 48: 213-21.
35. Spivak LG, Rapoport LM, Platonova DV, et al. Issues of spectrum and local sensitivity of E. coli in female patients with acute uncomplicated lower urinary tract infection. A review of M. Seitz study and own observation. Urologiia 2018; 3:58-62.
36. Gupta K, Hooton TM, Naber KG, et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clin Infect Dis 2011; 52: e103-20.
37. Datta R, Juthani-Mehta M. Nitrofurantoin vs. Fosfomycin: Rendering a verdict in a trial of acute uncomplicated cystitis. JAMA 2018; 319: 1771-2.
38. Ministerio de Salud. Secretaría de Políticas Regulatorias e Institutos, ANMAT. Disposición 1937, 27 Mar 2014. En: http://www.anmat.gov.ar/boletin_anmat/marzo_2014/Dispo_1937-14.pdf ; consultado junio 2019.
39. Wijma RA, Fransen F, Muller AE, Mouton JW. Optimizing dosing of nitrofurantoin from a PK/PD point of view: what do we need to know? Drug Resist Updat 2019; 43: 1-9.
40. Huttner A, Kowalczyk A, Turjeman A, et al. Effect of 5-day nitrofurantoin vs. single-dose fosfomycin on clinical resolution of uncomplicated lower urinary tract infection in women: A randomized clinical trial. JAMA 2018; 319: 1781-9.
41. Wijma RA, Huttner A, van Dun S, et al. Urinary antibacterial activity of fosfomycin and nitrofurantoin at registered dosages in healthy volunteers. Int J Antimicrob Agents 2019. pii: S0924-8579(19)30207-9.
42. FDA updates warnings for fluoroquinolone antibiotics on risks of mental health and low blood sugar adverse reactions. En : https://www.fda.gov/news-events/pressannouncements/fda-updates-warnings-fluoroquinoloneantibiotics-risks-mental-health-and-low-blood-sugar-adverse; consultado octubre 2018.
43. Fluoroquinolone and quinolone antibiotics: PRAC recommends new restrictions on use following review of disabling and potentially long-lasting side effects En: https://www.ema.europa.eu/en/news/fluoroquinolonequinolone-antibiotics-prac-recommends-new-restrictionsuse-following-review; consultado octubre 2018.
44. Hooton TM, Stamm WE. Diagnosis and treatment of uncomplicated urinary tract infections. Infect Dis Clin North Am 1997; 11: 551-81.
45. Piccoli GB, Consiglio V, Colla L, et al. Antibiotic treatment for acute ‘uncomplicated’ or ‘primary’ pyelonephritis: a systematic, ‘semantic revision.’ Int J Antimicrob Agents 2006; 28: S49-S63.
46. Velasco M, Martínez JA, Moreno-Martínez A, et al. Blood cultures for women with uncomplicated acute pyelonephritis: are they necessary? Clin Infect Dis 2003; 37: 1127-30.
47. Long B, Koyfman A. Long B, Koyfman A. Best clinical practice: Blood culture utility in the emergency department. J Emerg Med 2016; 51: 529-39.
48. van Nieuwkoop C, Hoppe BP, Bonten TN, et al. Predicting the need for radiologic imaging in adults with febrile urinary tract infection. Clin Infect Dis 2010; 51: 1266-72.
49. Johnson JR, Russo TA. Acute pyelonephritis in adults N Engl J Med 2018; 378: 48-59.
50. Gupta K, Hooton TM, Stamm WE. Increasing antimicrobial resistance and the management of uncomplicated community acquired urinary tract infections. Ann Int Med 2001; 135: 41-50.
51. Grigoyan L, Trautner BW, Gupta K. Diagnosis and management of urinary tract infections in the outpatient setting. A review. JAMA 2014; 312: 1677-84.
52. Sandberg T, Skoog G, Hermansson AB, et al. Ciprofloxacin for 7 days versus 14 days in women with acute pyelonephritis: a randomised, open-label and double- blind, placebo-controlled, non-inferiority trial. Lancet 2012; 380: 484-90.
53. Talan DA, Klimberg IW, Nicolle LE, Song J, Kowalsky SF, Church DA. Once daily, extended release ciprofloxacin for complicated urinary tract infections and acute uncomplicated pyelonephritis. J Urol 2004; 171: 734-9.
54. Peterson J, Kaul S, Khashab M, Fisher AC, Kahn JB. A double-blind, randomized comparison of levofloxacin 750 mg once- daily for five days with ciprofloxacin 400/500 mg twice-daily for 10 days for the treatment of complicated urinary tract infections and acute pyelonephritis. Urology 2008; 71: 17-22.
55. Andberg T, Bormefalk Hermansson A, Kahlmeter G et al. Ciprofloxacine for 7 days versus 14 days in women with acute pyelonephritis: a randomised, open-label and double-blind, placebo-controlled, non-inferiority trial. Lancet 2012; 380: 484-90.
56. van Nieuwkoop C, van der Starre WE, Stalenhoef JE, et al. Treatment duration of febrile urinary tract infection: a pragmatic randomized, double-blind, placebo- controlled non-inferiority trial in men and women. BMC Med 2017; 15: 70.
57. Eliakim-Raz N, Yahav D, Paul M, Lei-bovici L. Duration of antibiotic treatment for acute pyelonephritis and septic urinary tract infection – 7 days or less versus longer treatment: systematic review and meta-analysis of randomized controlled trials. J Antimicrob Chemother 2013; 68: 2183-91.
58. Kobata SA, Girão MJ, Baracat EC, et al. Estrogen therapy influence on periurethral vessels in postmenopausal incontinent women using Doppler velocimetry analysis. Maturita 2008; 61: 243-7.
59. Hamid R, Losco G. Pelvic organ prolapse-associated cystitis. Curr Bladder Dysfunct Rep 2014; 9: 175-80.
60. Gupta K, Scholes D, Stamm WE. Increasing prevalence of antimicrobial resistance among uropathogens causing acute uncomplicated cystitis in women. JAMA 1999; 281: 736-8.
61. Raz R. Postmenopausal women with recurrent UTI. Int J Antimicrob Agents 2001; 17: 269-71.
62. Valdevenito SJP. Recurrent urinary tract infection in women. Rev Chil Infectol 2008; 25: 268-76.
63. Gupta K, Trautner BW. Diagnosis and management of recurrent urinary tract infections in non-pregnant women. BMJ 2013; 346: f3140.
64. Jepson RG, Craig JC. A systematic review of the evidence for cranberries and blueberries in UTI prevention. Mol Nutr Food Re 2007; 51: 738-45.
65. Sumukadas D, Davey P, McMurdo ME. Recurrent urinary tract infections in older people: the role of cranberry products. Age Ageing 2009; 38: 255-7.
66. Perrotta C, Aznar M, Mejia R, Albert X, Ng CW. Oestrogens for preventing recurrent urinary tract infection in postmenopausal women. Cochrane Database Syst Rev 2008; 16; 2: CD005131.
67. Dueñas-Garcia OF, Sullivan G, Hall CD, Flynn MK, Dell K. Pharmacological agents to decrease new episodes of recurrent lower urinary tract infections in postmenopausal women. A systematic review. Female Pelvic Med Reconstr Surg 2016; 22: 63-9.
68. Beerepoot MA, Geerlings SE, van Haarst EP, van Charante NM, Riet G. Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. J Urol 2013; 190: 1981-9.
69. Sauer MM, Jakob RP, Eras J, et al. Catch-bond mechanism of the bacterial adhesin Fim H. Nat Commun 2016; 7: 10738.
70. Kranjčec B, Papeš D, Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial. World J Urol 2014; 32: 79-84.
71. Hooton TM, Vecchio M, Iroz A, et al. Effect of increased daily water intake in premenopausal women with recurrent urinary tract infections: A randomized clinical trial. JAMA Intern Med 2018; 178: 1509-15.
72. Amiri M, Lavasani Z, Norouzirad R, et al. Prevalence of urinary tract infection among pregnant women and its complications in their newborns during the birth in the hospitals of Dezful City, Iran, 2012-2013. Iran Red Crescent Med J 2015; 17: e26946.
73. Sociedad Española de Ginecología y Obstetricia (SEGO). Protocolo SEGO. Infección urinaria y gestación [Actualizado febrero 2013]. Prog Obstet Ginecol 2013. En: http://dx.doi.org/10.1016/j.pog.2013.09.001; consultado octubre 2018.
74. Matuszkiewicz-Rowińska J, Małyszko J, Wieliczko M. Urinary tract infections in pregnancy: old and new unresolved diagnostic and therapeutic problems. Arch Med Sci 2015; 11: 67-77.
75. Delzell JE, Lefevre ML. Urinary tract infections during pregnancy. Am Fam Physician 2000; 61: 713-20.
76. Hooton TM, Gupta K. Urinary tract infections and asymptomatic bacteriuria in pregnancy. UpToDate, Waltham, MA, [Internet] 2016. En: https://www.uptodate.com/contents/urinary-tract-infectionsand-asymptomatic-bacteriuria-in-pregnancy; consultado octubre 2018.
77. Vazquez JC, Abalos E. Treatments for symptomatic urinary tract infections during pregnancy. Cochrane Database Syst Rev 2011; (1): CD002256.
78. Hill JB, Sheffield JS, McIntire DD, Wendel GD. Acute pyelonephritis in pregnancy. Obstet Gynecol 2005; 105:18–23.
79. Naber KG, Berman B, Bishop MG, et al. EAU Guidelines for the Management of Urinary and Male Genital Tract Infections. Eur Urol 2001; 40: 576-88.
80. Vorland LH, Carlson K. An epidemiological survey of urinary tract infections among outpatients in Northern Norway. Scand J Infect Dis 1985; 17: 227-83.
81. Ulleryd P, Zackrisson B, Aus G, Bergdahl S, Hugosson J, Sandberg T. Selective urological evaluation in men with febrile urinary tract infection. BJU International 2001; 88: 15-20.
82. Abarbanel J, Engelstein D, Lask D, Livne PM. Urinary tract infection in men younger than 45 years of age: is there a need for urologic investigation? Urology 2003; 62: 27-9.
83. Caron F, Galperine T, Flateau C, et al. Practice guidelines for the management of adult community-acquired urinary tract infections. Med Mal Infect 2018; 48: 327-58.
84. Lipsky BA, Byren I, Hoey CT. Treatment of bacterial prostatitis. Clin Infect Dis 2010; 50: 1641-52.
85. Cai T, Pisano F, Nesi G, et al. Chlamydia trachomatis versus common uropathogens as a cause of chronic bacterial prostatitis: Is there any difference? Results of a prospective parallel-cohort study. Investig Clin Urol 2017; 58: 460-67.
86. Videčnik Zorman J, Matičič M, Jeverica S, Smrkolj T. Diagnosis and treatment of bacterial prostatitis. Acta Dermatovenerol Alp Pannonica Adriat 2015; 24: 25-9.
87. Coker TJ, Dierfeldt DM. Acute bacterial prostatitis: Diagnosis and management. Am Fam Physician 2016; 93: 114-20.
88. Lee Y, Lee D-G, Lee SH, Yoo KH. Risk factor analysis of ciprofloxacin-resistant and extended spectrum betalactamases pathogen-induced acute bacterial prostatitis in Korea. J Korean Med Sci 2016; 31: 1808-13.
89. Millán-Rodríguez F, Palou J, Bujons-Tur A, et al. Acute bacterial prostatitis: two different sub-categories according to a previous manipulation of the lower urinary tract. World J Urol 2006; 24: 45-50.
90. Rees J, Abrahams M, Doble A, Cooper A. Diagnosis and treatment of chronic bacterial prostatitis and chronic prostatitis/chronic pelvic pain syndrome: a consensus guideline. BJU Int 2015; 116: 509-25.
91. Gill BC, Shoskes DA. Bacterial prostatitis. Curr Opin Infect Dis 2016; 29: 86-91.
92. Gardiner BJ, Mahony AA, Ellis AG, et al. Is fosfomycin a potential treatment alternative for multidrug-resistant Gram-negative prostatitis? Clin Infect Dis 2014; 58: e101-5.
93. Wagenlehner FME, Weidner W, Naber KG. Therapy for prostatitis, with emphasis on bacterial prostatitis. Expert Opin Pharmacother 2007; 8: 1667-74.
94. Karaiskos I, Galani L, Sakka V, et al. Oral fosfomycin for the treatment of chronic bacterial prostatitis. J Antimicrob Chemother 2019; 74:1430-7.
95. Heras-Cañas V, Gutiérrez-Soto B, Almonte-Fernández H, et al. Antibiotic activity and concentrations in clinical samples from patients with chronic bacterial prostatitis. Actas Urol Esp 2017;41: 631-8.
96. Skerk V, Schönwald S, Krhen I, et al. Comparative analysis of azithromycin and ciprofloxacin in the treatment of chronic prostatitis caused by Chlamydia trachomatis. Int J Antimicrob Agents 2003; 21: 457-62.
97. Škerk V, Krhen I, Lisić M, et al. Comparative randomized pilot study of azithromycin and doxycycline efficacy in the treatment of prostate infection caused by Chlamydia trachomatis. Int J Antimicrob Agents 2004; 24:188-91.
98. Škerk V, Mareković I, Markovinović L, et al. Comparative randomized pilot study of azithromycin and doxycycline efficacy and tolerability in the treatment of prostate infection caused by Ureaplasma urealyticum. Chemotherapy 2006; 52: 9-11.
99. Polackwich AS, Shoskes DA. Chronic prostatitis/chronicpelvic pain syndrome: a review of evaluation and therapy. Prostate Cancer Prostatic Dis 2016; 19: 132-8.
