ISABEL A. LÜTHY 1, 2*, ISABEL N. KANTOR 2
1 Instituto de Biología y Medicina Experimental, IBYME-CONICET, 2 Comité de Redacción Medicina (B Aires), Buenos Aires, Argentina *Investigadora del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET)
Resumen En abril de 2019, UNICEF denunció que más de 20 millones de niños en todo el mundo no habían sido vacunados y alertó sobre posibles brotes de sarampión que, por su alta contagiosidad, es la
primera enfermedad en emerger entre las prevenibles mediante vacunación. De continuar el descenso en las
vacunaciones, podrían reaparecer también pertussis, tétanos y otras enfermedades con menor requerimiento
de cobertura para alcanzar protección poblacional. A fin de agosto de 2019 se inició en la Argentina el actual brote de sarampión. Este virus se transmite por vía respiratoria, infecta múltiples órganos e induce inmunosupresión. Su genoma consiste en ARN de cadena simple. La genotipificación se efectúa por secuenciación de un fragmento de 450 nucleótidos de la proteína N que contiene la mayor densidad de variación de nucleótidos del genoma. En Sudamérica circula el genotipo D8, y en Norteamérica hay, además, un 8% de genotipo B3. Cada persona con sarampión infecta, en promedio, otras 12-18 en una población susceptible. La vacunación confiere protección directa e indirecta, e induce tanto anticuerpos como inmunidad celular. Los recién nacidos tienen protección hasta los 6 meses por anticuerpos maternos transmitidos vía placentaria. En la Argentina, el Calendario de Vacunación incluye dos dosis de triple viral, a los 12 meses y a los 5 años, y una dosis cero (6-11 meses de edad) en distritos con casos de enfermedad. Una dosis protege al 93% de los vacunados a los 12 meses y dos dosis al 97%, de por vida.
Palabras clave: sarampión, prevención y control, vacunación, brote
Abstract In April 2019, UNICEF denounced that more than 20 million children worldwide had not been vaccinated and alerted on possible outbreaks of measles which, due to the high transmissibility of this virus, is the first disease preventable by vaccination to emerge. If the decline in vaccinations continues, pertussis, tetanus and other diseases, which require less coverage to achieve population protection, may also reappear. In Argentina, the current outbreak began in late August 2019. Measles virus is transmitted by air, infects multiple organs, and is associated with immunosuppression. Its genome consists of single stranded RNA. Genotyping is carried out by sequencing a 450-nucleotide fragment of the N protein, which contains the highest density of nucleotide variation. In South America, D8 is the circulating genotype and in North America, B3 accounts for 8% of the cases. Each person with measles infects, on average, another 12-18 people in a susceptible population. Vaccination confers direct and indirect protection, and induces both antibodies and cellular immunity. Newborns are protected by maternal antibodies transmitted via the placenta, up to 6 months. In Argentina, the Vaccination Calendar includes two doses of triple viral vaccine, at 12 months and 5 years, and a zero dose (6-11 months of age) in districts with disease cases. The protection conferred by the vaccine is 93% at 12 months with a dose, and with 2 doses 97% for life.
Key words: measles, prevention and control, vaccination, outbreaks
Dirección postal: Isabel A. Lüthy, Instituto de Biología y Medicina Experimental, Vuelta de Obligado 2490, 1428 Buenos Aires, Argentina
e-mail: isabel.luthy@gmail.com

Recientemente, a partir de preparados fijados en formol, del pulmón de una niña muerta por sarampión en 1912 (Berlin Museum of Medical History) y de otras dos muestras conservadas desde 1960, se secuenció el virus y se elaboró un nuevo árbol filogenético, que permitió determinar que, cerca de 345 a.C. el virus de la enfermedad bovina (rinderpest) mutó lo suficiente como para cambiar de huésped. En esa época algunas poblaciones de Eurasia llegaron a tener cerca de 250 000 habitantes, tamaño crítico para que la enfermedad pueda mantener su cadena de transmisión 1. La primera descripción clínica de la enfermedad la realizó el médico persa Rhazes en el siglo X. Mucho más tarde, luego de emerger en Europa como enfermedad endémica, causó devastación al ser exportada al Nuevo Mundo 2. Hoy los humanos son los únicos huéspedes naturales del sarampión, aunque otros primates pueden ser infectados y usados como modelo experimental.
Antes de la vacuna, el sarampión era una enfermedad común en la infancia, con 135 millones de casos estimados y más de 6 millones de muertes anuales en todo el mundo en 1963 2-4.
En la Argentina, las epidemias afectaban predominantemente a los menores de 5 años. En 1957, 1964 y 1968 se registraron brotes intensos, con un promedio de 60 000 casos en cada uno y tasas de incidencia entre 230 y 330/100 000 habitantes 4.
El sarampión es una de las mayores causas de muerte infantil, porque suprime la función inmune y facilita infecciones secundarias. Su erradicación es posible mediante una adecuada cobertura de vacunación.
En 1974 se inició el programa de inmunización global en las Américas, con la difusión generalizada de las
vacunas para el sarampión. En 2016, América Latina había alcanzado una cobertura global de vacunación del 97%, y un solo caso (importado), fue informado por Ecuador. Se consideró que esta Región, en la que ya habían sido eliminadas otras cuatro enfermedades prevenibles por vacunación: viruela en 1971, poliomielitis
en 1994, rubéola y el síndrome de rubéola congénita en 2015, sería la primera del mundo en ser declarada libre del sarampión 5.
Sin embargo, la tendencia descendente del número de casos se revirtió y pasó de 1 en 2016, a 730 casos en
2017, y a 16 422 en 2018 en la Región, la mayor parte (10 330) registrados en Brasil. En 2018 el sarampión
causó más de 140 000 muertes en todo el mundo 3, y entre enero 2019 y el 17 de febrero de 2020 se registraron 516 411 casos en 187 países, 21 656 de ellos en la Región de las Américas 6.
En abril de 2019, UNICEF denunció que más de 20 millones de niños en todo el mundo no recibieron la
vacuna en los últimos ocho años. La lista de países de altos ingresos con más población infantil sin vacunar, entre 2010 y 2017, la encabezaba EE.UU., con más de 2.5 millones. Le seguían Francia y el Reino Unido. En esos países el descenso de la cobertura se relacionó a grupos y campañas en contra de la vacunación, lo que determinó un aumento del número de niños susceptibles al virus 3. Mientras tanto, en países de África y Asia, con serias carencias en sus sistemas de salud, millones de niños no recibían la primera dosis de vacuna 7.
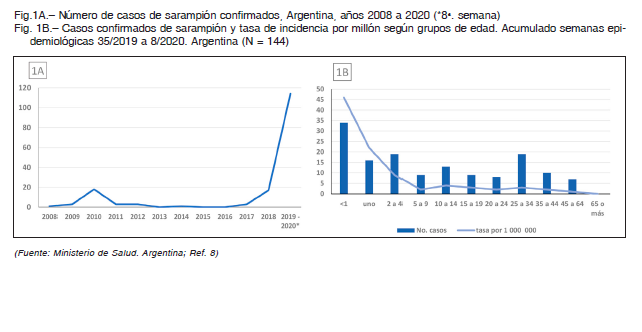
En nuestro país el sarampión es de comunicación obligatoria, por lo que la cantidad de casos notificados es confiable. El brote se inició en la última semana de agosto de 2019, y hasta la octava semana de 2020 había
144 casos confirmados. De ellos, 118 en el conurbano bonaerense, 25 en la ciudad de Buenos Aires y uno en
Córdoba8. De los casos en menores de 1 año, solo el 20% había recibido una o dos dosis de vacuna, y entre
los casos de 1-4 años, el 16% había recibido una dosis vacunal 6. El genotipo identificado fue D8 linaje MVs/Gir Somnath.IND/42.16 (más adelante se explicita la nomenclatura de los virus). El 13 de febrero se registró el primer fallecimiento por sarampión desde 1998, en un adulto inmunocomprometido8 (Figura 1 A, 1 B).
Luego de muchos años de ausencia de casos, el diagnóstico es difícil para los médicos que nunca vieron uno.
Los Boletines de vigilancia epidemiológica semanales, publicados por el Ministerio de Salud, contienen indicaciones precisas sobre el diagnóstico y las acciones a tomar ante todo caso sospechoso de sarampión, que incluyen la vacunación inmediata de los contactos que no cuenten con el esquema completo para su edad 8.
La enfermedad
El sarampión es una enfermedad altamente contagiosa, que se disemina a través de gotas en el aire y secreciones en forma de aerosol cuando una persona infectada tose o estornuda.
Luego de un periodo de 8 a 12 días, la enfermedad comienza con síntomas no específicos como fiebre, malestar, tos, rinitis, conjuntivitis y angina. Las manchas de Koplik, pequeñas manchas blancas patognomónicas, con centro azul-blancuzco, pueden verse en la mucosa bucal antes que la erupción. Luego de 2 a 4 días en que se intensifican los síntomas, aparece una erupción eritematosa maculopapular. La erupción comienza en la cara y cuello, progresa hacia los brazos y el tronco y luego a extremidades inferiores, y la fiebre aumenta abruptamente (40 °C-41 °C). La erupción desaparece entre los 3 y los 7 días. Los enfermos contagian entre 4 días antes y 4 días después del comienzo de la erupción. En personas inmunocomprometidas esta enfermedad puede ser grave, con más larga duración de la erupción y diseminación visceral, aunque algunas de ellas no desarrollan erupción.
El sarampión en personas vacunadas es leve y no alcanza la definición clínica de la enfermedad.
El virus del sarampión infecta múltiples órganos y da lugar a numerosas complicaciones. Las más comunes en niños incluyen otitis media, neumonía, laringotraqueobronquitis (crup) y diarrea. La neumonía, la complicación más seria del sarampión, es provocada por el mismo virus, por una infección bacteriana secundaria o por ambas. La fiebre alta puede originar convulsiones en 0.1% a 2.3% de los niños. Las complicaciones neurológicas incluyen encefalitis aguda viral o bacteriana, que ocurre en 1 a 4 por 1000 casos y a menudo provoca daño cerebral permanente.
Las complicaciones oculares, como la queratitis con ulceración de la córnea, pueden dejar cicatrices e incluso ceguera, especialmente en niños con deficiencia de vitamina A. Además de ser más grave en personas inmunocomprometidas, también lo es en niños menores de 5 años y en adultos mayores.
Luego de la infección, el virus puede persistir en el sistema nervioso central causando panencefalitis esclerosante subaguda, una rara enfermedad degenerativa caracterizada por cambios intelectuales y del comportamiento, que aparecen 6 a 10 años luego de la infección primaria. La ocurrencia de esta enfermedad se estima en 1 caso por cada 2500 a 10 000 infectados de sarampión.
Durante el embarazo, puede provocar partos prematuros, bajo peso al nacer y muerte materna, ya que las mujeres embarazadas son más susceptibles 2.
Durante muchos años se ha asociado la infección de sarampión con inmunosupresión. Esta enfermedad infecta células del sistema inmune causando inmunosupresión aguda. En los Países Bajos (donde la vacunación no es obligatoria) se estudiaron 77 niños no vacunados, antes y luego de dos meses de la infección natural, y se halló en ellos una reducción de entre 11 y 73% en el repertorio de anticuerpos totales circulantes. Por el contrario, en niños vacunados con vacuna triple viral MMR, estudiados en el mismo periodo, no solo no se halló disminución, sino que se registró un aumento significativo en el repertorio de epitopes reconocidos por sus anticuerpos. Esto último está avalando décadas de observación de una menor frecuencia de enfermedades infecciosas luego de la vacunación con MMR. En los niños que tuvieron sarampión, el repertorio de anticuerpos comienza a restablecerse nuevamente luego de nuevas exposiciones a los patógenos, con el riesgo que ello implica 9.
El virus del sarampión
El virus fue aislado en 1954, de un niño infectado con la enfermedad (Edmonston-cepa B), por Thomas C.
Peebles, en el laboratorio del Children’s Hospital Boston, EE.UU. 2. Es el prototipo del género Morbillivirus, familia Paramyxoviridae y subfamilia Paramyxovirinae. Su genoma consiste en un ARN simple cadena negativo no segmentado, que produce enfermedad exclusivamente en primates, y se transmite por vía respiratoria 10.
Los genomas de Morbillivirus están organizados en seis unidades transcripcionales contiguas, no solapadas, que codifican ocho proteínas virales y están separadas por tres nucleótidos que no son transcriptos. La Figura 2 muestra una imagen de microscopía electrónica del virus y la Figura 3 muestra su genoma (modificado de 11). Tres proteínas están involucradas en el control del genoma.
Como éste está compuesto de ARN, es necesaria una polimerasa especial, denominada L (del inglés large) con la que el virus hace nuevas copias de ARN utilizando ARN como templado. El ARN es encapsulado por una
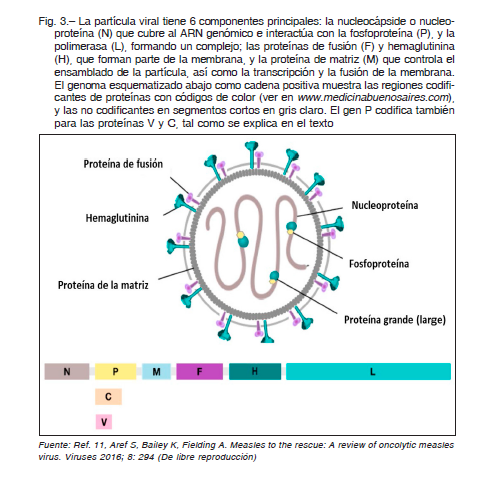
nucleoproteína (denominada N), con seis nucleótidos unidos a cada subunidad proteica. La fosfoproteína (P) es un cofactor que posee diversas “colas” flexibles, uniendo así la polimerasa a la nucleoproteína, y favoreciendo el proceso de replicación y transcripción. El proceso de replicación implica otra proteína viral, la C, que es transcripta de un segundo sitio de iniciación AUG con un marco de lectura alternativo del gen P. Este complejo ribonucleoproteico está envuelto en una membrana lipídica que contiene dos proteínas que coordinan el encuentro con las células blanco y el ingreso a su interior. La hemaglutinina (H) se une a receptores de la superficie celular y la proteína de fusión (F) fusiona la membrana viral a la celular, liberando el material genético viral dentro de la célula. La H es un blanco importante de nuestro sistema inmune, ampliamente utilizado en vacunas que emplean formas atenuadas del virus para estimular la producción de anticuerpos contra esa proteína. La proteína de la matriz (M) está involucrada en la formación de nuevas partículas virales en una célula infectada, asegurando que el ARN viral quede incluido.
Se produce además una edición de la secuencia en la mitad del templado de la fosfoproteína P, con inserción de una guanosina que produce un cambio en el marco de lectura, formando un antagonista de un interferón llamado V. Esta proteína se produce en cantidades mínimas en los virus adaptados a tejido linfoideo, pero en iguales cantidades de V y P en virus adaptados a tejido epitelial (recapitulado en 10).
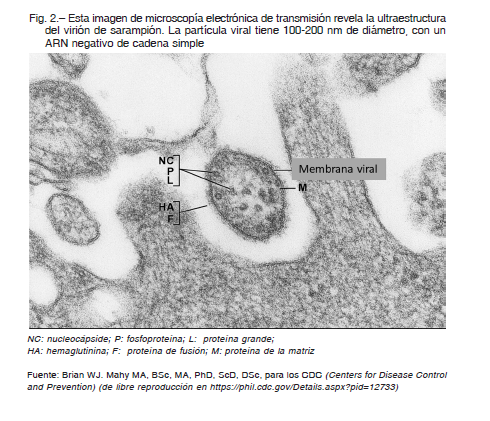
La Figura 3, parte superior, muestra un esquema de la partícula viral con sus proteínas, membrana viral y
ARN. Las partículas del virus normalmente poseen más de un genoma 11-15.
La genotipificación del virus
La genotipificación del virus, recomendada por la OMS, consiste en la secuenciación de un fragmento de 450 nucleótidos de la proteína N (secuencia N-450) ya que contiene la mayor densidad de variación de nucleótidos en una secuencia relativamente pequeña. La OMS reconoce 8 clados y 24 genotipos de VS. Los ocho clados se designan de A a H, con numerales para el genotipo individual.
Entre los genotipos, existen variantes que poseen secuencia idéntica o casi idéntica N-450. Los nombres de las cepas proveen información esencial para interpretar los datos moleculares. Todos llevan la sigla MV por measles virus seguido de “i” si fue aislado de un cultivo o “s” si fue de material clínico. Otra información posible es la ciudad o estado de donde se aisló, seguido de un punto y tres letras por el país; luego la fecha del comienzo de la erupción (semana y año), y el genotipo entre corchetes, que es opcional. Finalmente va una denominación si fue aislado de encefalitis por inclusión (MIBE), pan-encefalitis esclerosante subaguda (SSPE) o reacción a la vacuna (VAC). Ejemplos de esta denominación son: MVi/New-York.USA/03.98/2 [D2] y MVs/London.UNK/17.97 [G3] SSPE 16, 17. Los 24 genotipos de VS aislados hasta el presente son A, B1-B3, C1-C2, D1-D11, E, F, G1-G3 y H1-H2. De ellos solamente ocho fueron detectados en años recientes (B3, D3, D4, D6, D8, D9, G3, and H1), y cinco (B1, D1, E, F y G1) son considerados inactivos ya que no fueron detectados por más de 25 años. Cuatro de los genotipos circulan actualmente: D8, B3, H1 y D4.
En el actual brote, todos los casos genotipificados en Sudamérica son del genotipo D8, mientras que en México, EE.UU. y Canadá también se encuentra el genotipo B3 en aproximadamente 8% de los casos 6. Pese a la diversidad genotípica, existe un único serotipo de sarampión, lo cual implica un alto grado de similitud en los antígenos de superficie entre las distintas cepas. La naturaleza única del serotipo permite que la vacuna confiera inmunidad contra todos los genotipos conocidos. La vacunación desencadena la formación de anticuerpos neutralizantes específicos de las proteínas F y H, pero aquellos dirigidos contra la proteína H poseen mayor capacidad neutralizante. Uno de los epitopes neutralizantes está localizado en la cabeza de H e involucra la unión a uno de los receptores virales (signaling lymphocytic activation molecule, SLAM).
La estabilidad genética del virus es excepcionalmente alta, mostrando muy poca variación en la secuencia
durante largos periodos de tiempo. La tasa de mutación de este virus es mucho menor que la de otros virus con genoma ARN. Los virus de esta familia siguen la “regla de seis”, es decir que el número de nucleótidos es un múltiplo exacto de 6 (15 894 en el caso del sarampión), probablemente relacionado con la periodicidad de la interacción de la proteína N con el genoma. Esto restringe la cantidad de inserciones y deleciones. También las recombinaciones son raras en los virus ARN de sentido negativo como es el de sarampión 18.
Receptores celulares
Las interacciones de las glicoproteínas virales con los receptores celulares determinan el tropismo del virus del sarampión. Dado que utilizan dos receptores diferentes para unirse a diferentes tejidos, estos virus son considerados de tropismo dual. Luego del contagio, la SLAM media la entrada del virus, fundamentalmente a los macrófagos y células dendríticas alveolares que llevan la infección a través del epitelio respiratorio y hacia tejidos linfoides, provocando inmunosupresión. La segunda fase de la
infección es el pasaje del virus a las células epiteliales superiores que expresan nectina-4, un componente de adhesión, expresada preferencialmente en la tráquea 13.
Las vacunas
El desarrollo de la vacuna comenzó en 1954, cuando el virus del sarampión fue aislado en EE.UU. (cepa Edmonston) y propagado en cultivo en embriones de pollo. Hacia fines de los 50 se realizó un pequeño ensayo clínico que demostró que la vacuna era efectiva, pero provocaba sarpullido en la mayoría de los vacunados, debiéndose administrar inmunoglobulina concomitantemente. Con la atenuación del virus, lograda luego de múltiples pasajes en embriones de pollo, ya no fue necesaria la gamaglobulina.
Entre 1963 y 1968 se produjo una vacuna inactivada con formalina, pero se discontinuó debido al sarampión atípico que causaba. La cepa Edmonston fue posteriormente atenuada en la cepa Schwartz, que es usada en casi todas las vacunas, y la aún más atenuada Enders (Moraten) utilizada en los EE.UU. La vacuna de sarampión se presenta como monovalente, como triple MMR (que protege contra sarampión, paperas y rubeola) o cuádruple (contra las tres anteriores y varicela, MMRV).
Las contraindicaciones para las vacunas MMR y MMRV incluyen historia de anafilaxis a neomicina, reacciones alérgicas graves a cualquier componente de la vacuna, embarazo e inmunosupresión. La alergia al huevo no es una contraindicación. Los niños con infección HIV que no tienen inmunosupresión grave deben recibir la
vacuna MMR, pero no la MMRV. La eficacia de la vacuna es del 93% luego de una dosis a los 12 meses y del 97% luego de dos dosis. Las vacunas de sarampión proveen inmunidad de por vida. Aunque los niveles de anticuerpos disminuyen a lo largo del tiempo, siguen protegiendo a la mayoría de las personas vacunadas y no hay evidencia que la protección decline en adultos 2.
Esta vacunación comenzó en la Argentina en 1965, con bajas coberturas. En 1971 se promulgó la Ley Nacional N° 19.968 que reglamentó las campañas nacionales, realizándose la primera al año siguiente. Gracias a las
campañas efectivas de vacunación, durante el período 2001-2016 no se detectaron casos de sarampión en
nuestro país. Durante 2014 y 2017, la cobertura de las campañas de segunda dosis de vacunación bajó a niveles entre 86.5 y 90% de los niños, con lo cual se formó, año tras año, un cúmulo de niños susceptibles 6.
Las vacunas con virus atenuados de sarampión inducen tanto anticuerpos como inmunidad celular, que
maduran a lo largo de meses. La protección correlaciona mejor con la calidad y cantidad de anticuerpos neutralizantes, pero los linfocitos T también contribuyen a la misma.
Los anticuerpos neutralizantes están fundamentalmente dirigidos contra la proteína H, con una contribución de aquellos dirigidos contra F. La proteína H también contiene importantes epitopes de linfocitos T CD8+. Los anticuerpos específicos contra el virus y los linfocitos CD4+ disminuyen con el tiempo transcurrido desde la vacunación y los porcentajes de fracaso para vacunación secundaria son del orden del 5% luego de 10-15 años.
En los países industrializados, la vacuna se aplica por inyección subcutánea o intramuscular de MMR o de
MMRV. En países de bajos recursos, en muchos casos se administra la vacuna monovalente. No todos los niños responden a la dosis inicial aplicada en la primera infancia (85% a los 9 meses, 95% a los 12). Los anticuerpos maternos además inhiben la respuesta inmune. Por lo tanto, se requiere una segunda administración alrededor de los 5 años para alcanzar una inmunidad poblacional de 92-95% requerida para eliminar la transmisión endémica 6, 19.
Transmisibilidad y vacunación
El número de reproducción básico (R0) es el número promedio de casos secundarios de una enfermedad infecciosa que surge de un caso en una población susceptible.
Ro determina la cobertura de inmunización requerida para lograr la eliminación de una enfermedad infecciosa. A medida que Ro aumenta, se requiere una mayor cobertura de inmunización para lograr la inmunidad poblacional o efecto rebaño (herd immunity). Para el sarampión, Ro varía entre 12 y 18, lo que significa que cada persona con sarampión infecta, en promedio, a otras 12-18 personas en una población susceptible 20.
La vacunación confiere tanto protección directa como indirecta, la primera es sobre los individuos vacunados, mientras que la indirecta es la que se extiende a los sujetos susceptibles en los que se evita la infección porque la población que los rodea está inmunizada. La magnitud de estos efectos indirectos es función de la transmisibilidad del agente infeccioso, los parámetros de interconexión entre personas, distribución de la vacuna y distribución del efecto rebaño. Se denomina umbral de inmunidad poblacional a la proporción de la población que debe poseer inmunidad para detener la propagación de una enfermedad comunicable 21. Se considera que un nivel de 95% de vacunación es suficiente para impedir la propagación de la mayoría de las enfermedades infecciosas, protegiendo a quienes no pueden vacunarse. En este sentido, se ha descripto que la enorme mayoría de los recién nacidos están protegidos contra el sarampión debido a los anticuerpos maternos transmitidos por la placenta.
Sin embargo, alrededor de los 6 meses de edad, aun con lactancia materna, los anticuerpos tienden a disminuir 22, 23. Por esta razón es de suma importancia proteger a los bebés que todavía no han recibido la vacuna, para impedir la propagación de la enfermedad. En la Argentina, el Calendario Nacional de Vacunación incluye dos dosis de triple viral, a los 12 meses y a los 5 años de edad. Se ha instaurado además una dosis cero (6 a 11 meses de edad) en aquellos distritos en que se produjeron casos de esta enfermedad 24.
El sarampión se contagia días antes de manifestarse la enfermedad. Se ha sugerido que es como el canario
en la mina de carbón. A causa de su gran infectividad, es usualmente la primera enfermedad prevenible mediante vacunación en emerger. Y se alerta, con mucha razón que, de continuar el descenso en las vacunaciones, se pueden volver a ver casos de tos convulsa, tétanos y otras enfermedades, que requieren menor cobertura para alcanzar inmunidad poblacional 25. Resulta más grave aún el problema sanitario que presenta este hecho en un mundo de rápidos viajes internacionales y donde no en todos los países la vacunación es obligatoria. Varios de estos países están reviendo esta decisión, aunque lamentablemente ya es tarde para los más de 140 000 fallecidos en 2018 y por lo menos esa cifra en 2019 6, 24.
Agradecimientos: Las autoras agradecen los excelentes comentarios del Dr. Jorge Lattner (Hospital General de Agudos Dr. Juan A. Fernández), y los valiosos aportes hechos por los Dres. Viviana Ritacco y Juan Antonio Barcat, en la revisión del trabajo
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Düx A, Lequime S, Patrono LV, et al. The history of measles: from a 1912 genome to an antique origin. En: https://doi.org/10.1101/2019.12.29.889667 doi: bioRxiv preprint; consultado marzo 2020. Comentario en: https://www.sciencemag.org/news/2019/12/measles-may-have-emergedwhen-large-cities-rose-1500-years-earlier-thought.
2. Goodson JL, Seward JF. Measles 50 years after use of measles vaccine. Infect Dis Clin North Am 2015; 29:725-43.
3. Lüthy IA. Vacunar contra el sarampión. Medicina (B Aires) 2020; 80: 93-4.
4. Biscayart C, Elbert G, Zubieta A. Campaña nacional de seguimiento contra sarampión rubeola, 2018.
En: http://www.msal.gob.ar/images/stories/bes/graficos/0000001279cnt-2018-08_lineamientos-tecnicossarampion-rubeola.pdf; consultado enero 2020.
5. OPS/OMS. La región de las Américas es declarada libre de sarampión. En: https://www.paho.org/hq/index.
php?option=com_content&view=article&id=12528:regionamericas-declared-free-measles&Itemid=1926&lang=es; consultado febrero 2020.
6. WHO. Global Measles and Rubella Update, 18 February 2020. En: https://www.who.int/immunization/monitoring_surveillance/burden/vpd/surveillance_type/active/measles_monthlydata/en/; consultado febrero 2020.
7. UNICEF, Comunicado de Prensa, N. York, 25 abril 2019. En: https://www.unicef.org/lac/comunicados-prensa/losbrotes-sarampion-han-aumentado-en-todo-el-mundo; consultado febrero 2020.
8. Ministerio de Salud. Argentina. Boletines Integrados de Vigilancia. N486. SE 07 2020. Situación actual del sarampión en Argentina, p 8-11. En: https://www.argentina.gob.ar/sites/default/files/biv_486_edicion-ampliada.pdf, N487, SE 08/2020 y en: https://www.argentina.gob.ar/salud/epidemiologia/boletines2020; consultado febrero 2020.
9. Mina MJ, Kula T, Leng Y, et al. Measles virus infection diminishes preexisting antibodies that offer protection from other pathogens. Science 2019; 366: 599-606.
10. Laksono BM, de Vries RD, McQuaid S, Duprex WP, de Swart RL. Measles virus host invasion and pathogenesis. Viruses 2016; 8: 210.
11. Aref S, Bailey K, Fielding A. Measles to the rescue: A review of oncolytic measles virus. Viruses 2016; 8: 294.
12. Kiss G, Chen X, Brindley MA, et al. Capturing enveloped viruses on affinity grids for downstream cryo-electron microscopy applications. Microsc Microanal 2014; 20: 164-74.
13. Cattaneo R, Donohue RC, Generous AR, Navaratnarajah CK, Pfaller CK. Stronger together: Multi-genome transmission of measles virus. Virus Res 2019; 265: 74-79.
14. Protein Database (PDB). Measles proteins. 2019. En: https://pdb101.rcsb.org/motm/231; consultado enero 2020.
15. Pfaller CK, Bloyet LM, Donohue RC, et al. The C protein is recruited to measles virus ribonucleocapsids by the phosphoprotein. J Virol 2019 Nov 20[Online ahead of print]; DOI: 10.1128/JVI.01733-19.
16. Bianchi S, Frati ER, Lai A, et al. Genetic characterisation of measles virus variants identified during a large epidemic in Milan, Italy, March-December 2017. Epidemiol Infect 2019; 147: e80.
17. Centers for Disease Control and Prevention. Genetic analysis of measles viruses. 2020. En: https://www.cdc.gov/measles/lab-tools/genetic-analysis.html; consultado enero 2020.
18. Beaty SM, Lee B. Constraints on the genetic and antigenic variability of measles virus. Viruses 2016; 8: 109.
19. Griffin DE. Measles vaccine. Viral Immunol 2018; 31: 86-95.
20. Guerra FM, Bolotin S, Lim G, et al. The Basic Reproduction Number (R 0) of Measles: A Systematic Review. Lancet Infect Dis 2017; 17: e420-e428.
21. Nymark LS, Sharma T, Miller A, Enemark U, Griffiths UK. Inclusion of the value of herd immunity in economic evaluations of vaccines. A systematic review of methods used. Vaccine 2017; 35: 6828-41.
22. Guerra FM, Crowcroft NS, Friedman L, et al. Waning of measles maternal antibody in infants in measles elimination settings – a systematic literature review. Vaccine 2018; 36: 1248-55.
23 Javed N, Saqib MAN, Hassan Bullo MM, Asghar RJ. Seroprevalence of transplacentally acquired measles
antibodies in unvaccinated infants at nine months of age and its relation to the feeding practices. BMC Infect Dis 2019; 19: 587.
24. Ministerio de Salud. Alerta sarampión. 2019. En: https://www.argentina.gob.ar/salud/sarampion/vacunacion; consultado enero 2020.
25. Peeples L. Rethinking herd immunity. Nat Med 2019; 25: 1178-80.
