MARIA FLORENCIA FALCÓN 1, MARÍA EUGENIA PARADEDA 1, FLORENCIA GARCÍA KAMERMANN 1, VERÓNICA MALDONADO 2, LILI DÍAZ 1, LUCÍA CARDINAL 1
1 División Patología Ginecológica, Departamento de Patología, 2 Sección Tracto Genital Inferior, División Ginecología, Hospital de Clínicas José de San Martín, Buenos Aires, Argentina
Resumen El carcinoma escamoso vulvar puede desarrollarse de manera asociada o independiente a la infección por HPV. La relación entre la patogénesis, la clasificación, el perfil inmunohistoquímico, y el pronóstico ha sido estudiada con algunas discrepancias. El objetivo del trabajo fue observar la concordancia clásicamente descripta que asocia a los carcinomas queratinizantes con la ausencia de infección por HPV y a los carcinomas warty y basaloides con la presencia de dicho virus. Para ello, revisamos la clínica, la morfología y el inmunofenotipo de 39 casos de nuestro hospital. Los tumores fueron clasificados histológicamente en carcinomas escamosos queratinizantes clásicos (30), warty (5) y basaloides (4). En el análisis estadístico la expresión de p16 fue asociada de manera significativa con una edad menor al momento del diagnóstico (p = 0.0025), presencia de lesión intraepitelial escamosa de alto grado (p < 0.0001), coilocitosis (p = 0.02), y subtipo morfológico (p = 0.02); y fue inversamente asociado con la expresión de p53 (p < 0.0001) y con el liquen escleroso (p = 0.0051). Resulta peculiar que, de los casos estudiados, 4 carcinomas queratinizantes coexpresaron p16 y p53. Un solo tumor de tipo warty resultó negativo para p16 y positivo para p53, y 9 queratinizantes resultaron positivos para p16 y negativos para p53. Si bien estos hallazgos indican que con la sola utilización de la hematoxilina y eosina podrían definirse de manera correcta los tumores asociados al HPV, sugerimos fuertemente la realización de inmunohistoquímica, especialmente en carcinomas escamosos queratinizantes en pacientes jóvenes o con historia de HPV.
Palabras clave: cáncer de vulva, carcinogenesis vulvar, inmunohistoquímica
Abstract Squamous cell carcinoma of the vulva may develop in association or independently of HPV infection. The relationship between pathogenesis, classification, immunohistochemical profile and prognosis has been studied in the literature with some discrepancies. The aim of this study was to observe the classical association of keratinizing carcinomas with the absence of HPV infection and warty and basaloid carcinomas with the presence of this virus. Therefore, we reviewed the clinic, morphology, and immunophenotype of 39 cases. The tumors were histologically classified into classic keratinizing squamous carcinoma (30), warty (5) and basaloid (4). In the statistical analysis, diffuse expression with p16 was significantly associated with younger age (p = 0.0025), presence of high-grade intraepithelial lesion (p < 0.0001), koilocytosis (p = 0.02), and morphological subtype (p = 0.02), and was inversely associated with the expression of p53 (p < 0.0001) and the presence of lichen sclerosus (p = 0.0051). It is curious that 4 keratinizing carcinomas of the cases studied presented coexpression of p16 and p53. Only one warty tumor was negative for p16 and positive for p53, and 9 keratinizing tumors were positive for p16 and negative for p53. Although these findings show that the use of hematoxylin and eosin could correctly define tumors associated with HPV, we strongly suggest the performance of immunohistochemistry, especially in squamous keratinizing classic carcinomas in young patients with a history of HPV.
Key words: vulvar carcinoma, vulvar carcinogenesis, immunohistochemistry
Dirección postal: María Florencia Falcón, Departamento de Patología, Hospital de Clínicas José de San Martin, Av. Córdoba 2351, Piso 6 Sala 2, 1121 Buenos Aires, Argentina
e-mail: florflacon@hotmail.com
El carcinoma escamoso vulvar (CEV) representa el 5% de los tumores malignos del tracto genital inferior y
corresponde al 83% de los tumores vulvares 1. Al momento, no hay estadísticas de la prevalencia de este tumor en nuestro país. Sin embargo, anualmente se diagnostican 44 235 casos nuevos a nivel mundial 2.
Estos tumores comprenden un grupo heterogéneo de lesiones. Clásicamente se identificaron dos variantes morfológicas que se clasificaron como carcinomas asociados a HPV (warty y basaloide) y carcinomas independientes de HPV (queratinizantes clásicos) 3.
Los mismos presentan dos vías carcinogénicas distintas.
Los carcinomas asociados a HPV afectan por lo general a las mujeres jóvenes. En cambio, los tumores independientes de HPV se relacionan con liquen escleroso y con neoplasia intraepitelial vulvar diferenciada (VINd), y se presentan predominantemente en mujeres mayores.
Aunque su frecuencia es variable, los tumores independientes de HPV representarían dos tercios de los CEV a nivel mundial 4. Sin embargo, en la práctica diaria se observa superposición entre ambas morfologías, identificándose principalmente carcinomas queratinizantes asociados al HPV.
En este trabajo comunicamos nuestra experiencia con los CEV para caracterizar la relación entre la clínica, la morfología, la inmunohistoquímica y la evolución de las pacientes. Nuestro objetivo es lograr determinar si la morfología observada con hematoxilina y eosina es suficiente para efectuar diagnósticos de certeza o si es necesario efectuar técnicas inmunohistoquímicas suplementarias para determinar de manera más exacta el estatus de HPV en los tumores.
Materiales y métodos
Identificamos en la base de datos de nuestro hospital una cohorte de 39 pacientes tratadas con cirugía primaria para CEV, desde el 1 de enero de 2006 hasta el 31 de julio de 2018. Realizamos una revisión retrospectiva de registros médicos para obtener sus datos (edad, tabaquismo, motivo de consulta, clínica), tratamientos efectuados y seguimiento.
Para ser elegibles para su inclusión, se debía contar con los preparados histológicos y tacos de parafina completos para su revisión. Se excluyeron los carcinomas verrugosos.
Dos patólogos revisaron todos los casos para certificar tipo y grado histológico, lesiones adyacentes concomitantes, márgenes de resección, estadio patológico y compromiso de los ganglios linfáticos. Los carcinomas se subdividieron en basaloide, warty y queratinizantes clásicos, según los criterios de la Organización Mundial de la Salud (OMS) 5 de 2014. La clasificación histológica fue reevaluada sin conocer los resultados inmunohistoquímicos.
Se seleccionó el taco de tumor más representativo y en los 39 efectuamos técnicas de inmunohistoquímica para p16 y p53. Se cortaron secciones de 5 micrones de los tacos de parafina y se efectuó la técnica utilizando el sistema Ventana para p16 (CINtec, Roche) y para p53 (anticuerpo monoclonal Biogenex anti proteína p53 [DO7]). Se utilizó como control para la proteína p16 un carcinoma escamoso de cuello uterino y para la proteína p53 un carcinoma seroso del ovario. Los resultados fueron analizados a ciegas, desconociendo las características clínico-patológicas de las pacientes. La positividad para p53 se definió como la tinción de más del 50% de los núcleos tumorales o ausencia completa de su expresión (null). La p16 se consideró positiva en aquellos casos en los que más del 70% del tumor presentaba tinción fuerte y difusa, nuclear y citoplasmática 6.
Se efectuó el análisis estadístico utilizando el test exacto de Fisher para variables categóricas y test t/ANOVA para variables continuas. Un valor p < 0.05 fue considerado estadísticamente significativo.
Resultados
Las características clinicopatológicas de las 39 pacientes se resumen en la Tabla 1. La media de edad fue de 64 años (rango 32 a 88). Dieciséis (41%) consultaron por prurito vulvar. Veinticinco (64%) se encontraban en estadio I al momento del diagnóstico. Ninguna se presentó en estadio IV. La mayoría (27, un 69%) fueron tratadas con vulvectomías radicales, 2 con vulvectomías simples y 10 fueron sujetas a resecciones amplias. En 29 (74%) se resecaron ganglios linfáticos mediante linfadenectomías.
El tamaño tumoral promedio fue de 3.8 cm (rango: 0.2 a 7.8 cm). Nueve fueron clasificados morfológicamente como subtipos asociados al HPV: 4 basaloides y 5 warty (Tabla 2). Estos subtipos se asociaron de manera significativa con lesión intraepitelial escamosa (SIL) de alto grado (6 casos). Los restantes 30 CEV fueron clasificados como queratinizantes, variante clásica.
Cinco tumores presentaron márgenes positivos y nueve invasión vasculolinfática. En el epitelio escamoso adyacente se observó SIL de alto grado en 13 casos, VINd en 12 casos y liquen escleroso en 24. En tres casos había liquen escleroso y SIL de alto grado de manera concomitante.
Veinte tumores (51%) tenían patrón de crecimiento predominantemente expansivo, 10 (26%) cordonado, y 9 (23%) de tipo spray. En solo seis había más de 50% de linfocitos estromales intratumorales.
Nueve pacientes recibieron radiación post quirúrgica.
Nueve presentaron recurrencia luego del tratamiento primario y 6 murieron por la enfermedad con un tiempo de supervivencia medio de 17 meses desde el momento del diagnóstico (rango: 2 a 32 meses).
Doce (41%) presentaron ganglios positivos y 17 negativos (59%).
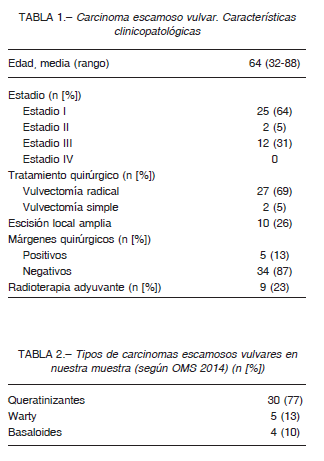
La expresión de p16 fue positiva en 20 casos y la de p53 fue positiva en 22 (19 sobreexpresión, 3 null) (Tabla 3, Fig. 1). En un caso de carcinoma basaloide no pudo realizarse la inmunohistoquímica por desgaste del taco de parafina.
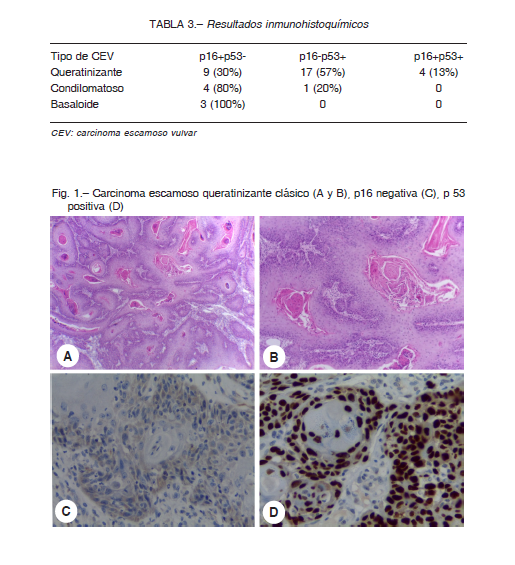
Entre los tumores warty y basaloides, 7 (87.5%) expresaron positividad para p16. En esta categoría uno solo demostró positividad exclusiva para p53 (12.5%) (Fig. 2).
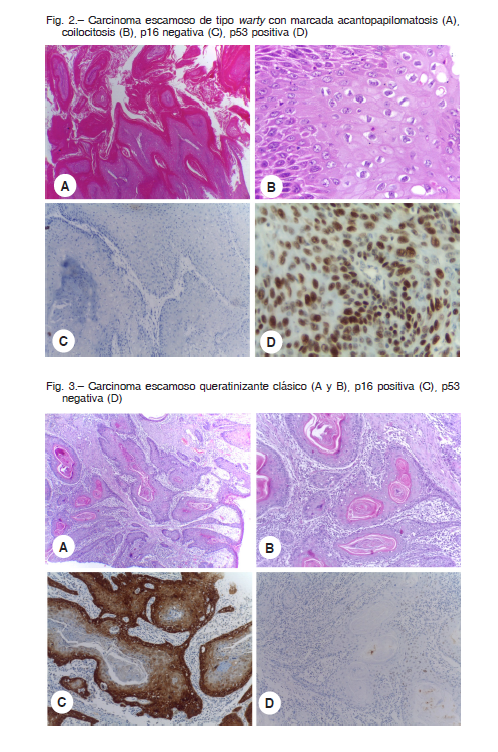
En contraste, entre los 30 tumores queratinizantes, 13 (43%) demostraron positividad para p16 (Fig. 3) y 21 (54%) fueron positivos para p53. La positividad dual para p16 y p53 fue observada en 4 casos (Tabla 3).
Una de las pacientes comenzó en el año 2011 con un carcinoma escamoso queratinizante G2 con SIL de alto grado adyacente y coexpresión de p16 y p53. En el año 2018 se le diagnostica Vind y liquen escleroso.
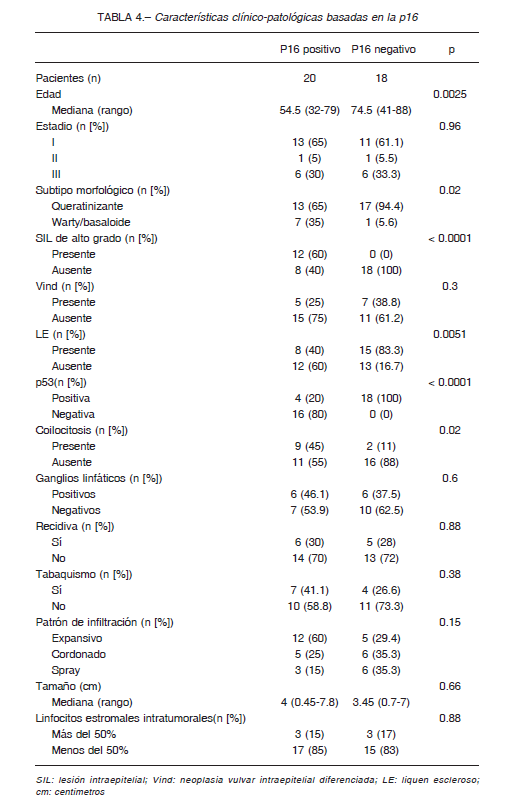
La p16 divide a las pacientes en dos categorías clínicopatológicas distintivas (Tabla 4). Aquellas con tumores p16 positivos eran más jóvenes (edad promedio de 54 vs. 74 años, p = 0.0025). Histológicamente, las neoplasias p16 positivas se asociaban con los subtipos morfológicos asociados a HPV, mientras que los tumores negativos para p16 rara vez exhibían un fenotipo warty o basaloide (p = 0.02). Además, los tumores positivos para p16 se asociaron de manera significativa con SIL de alto grado y coilocitosis (p < 0.0001 y 0.02 respectivamente). La inmunopositividad de p16 fue asociada de manera inversa con la presencia de liquen escleroso, así como también con la inmunopositividad para p53 (p = 0.0051 y < 0.0001 respectivamente).
El VINd se observó con mayor frecuencia en los tumores negativos para p16 (39% vs. 25%) pero la asociación no fue estadísticamente significativa (p = 0.3).
No se observó relación estadísticamente significativa entre los casos que recidivaron o presentaron ganglios positivos y sus hallazgos histológicos y/o inmunohistoquímicos.
Discusión
La incidencia del CEV permaneció relativamente estable en las últimas tres décadas, aunque la incidencia del VIN se incrementó en el tiempo 7,8. Esto puede deberse a una mejor detección de la lesión intraepitelial, lo que permite un tratamiento más efectivo antes del desarrollo de la lesión invasora.
En contraste con los carcinomas escamosos del cuello uterino y del ano, los cuales se encuentran asociados casi exclusivamente al HPV de alto riesgo, la presencia o ausencia del HPV en vulva separa a los CEV en dos entidades clinicopatológicas y moleculares distintivas.
Clásicamente se describen dos vías etiopatogénicas que llevan a CEV: (1) SIL de alto grado asociado a HPV
y (2) VINd que se desarrolla independientemente de la infección por HPV.
El SIL de alto grado asociado a HPV ocurre en mujeres jóvenes entre la tercera y quinta décadas de vida.
Los factores de riesgo incluyen: tabaquismo, número de parejas sexuales e inmunosupresión. Asimismo, la infección por HPV está fuertemente asociada9 al SIL de alto grado. Las proteínas oncogénicas E6 y E7 del HPV se unen e inactivan la p53 y la proteína del retinoblastoma (RB) respectivamente, generando una desregulación de la proliferación celular. La función fisiológica del RB es inhibir a las quinasas dependientes de ciclinas p16 (INK4A) y p14 (ARF). Por lo tanto, las neoplasias asociadas al HPV típicamente presentan aumentada la expresión de p16 y mínima o nula expresión de p53. La inmunohistoquímica para p16 detecta la sobreexpresión en la célula infectada 10.
La mayoría de estas pacientes padecen prurito y disuria. Clínicamente se manifiesta por máculas o pápulas eritematosas que pueden fusionarse conformando placas verrugosas. La mitad presentan lesiones multifocales en la vulva y entre el 18-52% lesiones HPV relacionadas concomitantes en el tracto genital.
La tasa de progresión a carcinoma invasor es menor al 5%9 y su recurrencia se observa en aproximadamente el 13-36% de los casos.
Morfológicamente, progresan hacia CEV de tipo warty o basaloide. El CEV de tipo basaloide presenta nidos, bandas anastomosadas y planchas de células escamosas basaloides. Las células tienen apariencia uniforme con escaso citoplasma, elevado índice mitótico, falta de maduración y una apariencia similar al SIL de alto grado variante basaloide. El CEV de tipo condilomatoso tiene un crecimiento exofítico con atipia, agrandamiento nuclear y coilocitosis superficial. Estos tumores expresan p16 de manera difusa e intensa, nuclear y citoplasmática, y son negativos con p53.
El VINd ocurre en mujeres postmenopaúsicas entre la sexta y octava década de vida y corresponde al 2-29% de las lesiones intraepiteliales 9. Generalmente se asocia con liquen escleroso. A diferencia del SIL de alto grado, el VINd suele ser unicéntrico (una lesión única) y no produce lesiones voluminosas. Clínicamente, las lesiones son blanquecino-grisáceas, rugosas, de bordes vagamente definidos y con nódulos elevados. Su tasa de progresión a CEV queratinizante es del 35%8. Este tumor presenta nidos de células escamosas con numerosas perlas córneas y suele invadir de manera expansiva, cordonada o tipo spray. Generalmente estos tumores expresan p53 y son negativos para p16.
Sin embargo, se observa en la práctica diaria y se han publicado en la bibliografía numerosos casos en los cuales la morfología observada con hematoxilina y eosina es discordante con los hallazgos inmunohistoquímicos para p16 y p5311. Se identificaron carcinomas escamosos queratinizantes asociados al HPV, así como carcinomas de tipo basaloide y warty sin asociación. En nuestro trabajo, si bien la relación entre la marcación con p16 y la morfología fue estadísticamente significativa (p = 0.02), encontramos 13 casos de carcinomas escamosos queratinizantes p16 positivos y carcinoma de tipo warty p53 positivo.
Vale la pena mencionar, que en el estudio de Oliva y col. 6, esta relación fue mucho menor (p<0.0001) ya que identificaron solo 15/97 casos discordantes (14 carcinomas escamosos p16 positivos y 1 warty/basaloide p53 positivo). Por lo tanto, resulta interesante que en nuestra población hayamos detectado más casos discordantes.
La edad promedio de las pacientes con carcinoma escamoso queratinizante p16 positivas p53 negativas fue de 53 años, mientras que la edad promedio en aquellas con carcinoma escamoso queratinizante p16 negativo y p53 positivo fue de 71 años. Esto significa que sería importante realizar técnicas de inmunohistoquímica frente a estos tumores, principalmente en menores de 60 años o que presenten lesiones por el HPV en otra localización del tracto genital inferior.
Cuando la categorización inmunohistoquímica y morfológica no coinciden, se puede realizar PCR o hibridación in situ para obtener la confirmación definitiva de infección.
Al igual que en 4 tumores observados en nuestro estudio, se han comunicado numerosos casos en los cuales los tumores presentan coexpresión de p16 y p53. Los mismos son en su mayoría negativos para HPV cuando se les realiza hibridación in situ 6. En estos casos, la vía de la carcinogénesis no estaría relacionada directamente con el virus sino con una mutación somática del RB, que resulta en una desregulación de la expresión de p16 11.
La asociación entre los marcadores biológicos y el pronóstico es controversial. En nuestra investigación no se observaron diferencias significativas entre las recidivas y muertes en los distintos tipos de carcinomas.
Sin embargo, numerosos estudios han demostrado una mejor supervivencia para CEV asociados al HPV. Recientemente, se descubrió que su presencia es un factor pronóstico independiente para la recaída local. El mayor número de mutaciones observadas en los tumores independientes de HPV podría explicar el peor pronóstico de estos tumores 12-14.
Creemos que la baja mortalidad y falta de diferencias significativa entre el pronóstico de nuestros tumores dependientes e independientes de HPV, se debe al poco tiempo de seguimiento de nuestras pacientes (4 meses a 8 años).
En base al estudio realizado, se observó que sería posible, en casos rutinarios, diagnosticar el tipo de CEV tan solo en base a la histología. Sin embargo, sería importante, especialmente en casos de carcinomas queratinizantes en mujeres jóvenes o con antecedentes de HPV, efectuar técnicas de inmunohistoquímica, y eventualmente técnicas de biología molecular, para poder realizar un diagnóstico certero y evitar posibles “falsos negativos”, debido a la confluencia de vías tumorales.
En nuestra serie, un número alto de carcinomas escamosos clásicos fue positivo para la proteína p16.
Esto indicaría otra vía de carcinogénesis independiente a la unión de la proteína oncogénica E7 al RB. Dichos hallazgos deberían confirmarse con la ausencia de ácidos nucleicos del HPV por técnica de PCR y así poder descartarla completamente.
Esta información sería importante no solo para el tratamiento (tipo de cirugía, utilización de inmunomoduladores locales, vacunas o respuesta a la radioterapia) y seguimiento adecuado de las pacientes, sino también para predecir el futuro de las mismas considerando el mejor pronóstico de los tumores asociados al HPV 10,15,16.
Por otro lado, se están efectuando ensayos clínicos para evaluar el potencial de distintos blancos inmunológicos.
Agradecimientos: Agradecemos la colaboración de los Dres. Dolores Sciaccaluga, médica patóloga que nos ayudó a revisar los preparados histológicos, y al Dr. Facundo Gómez Cherey, ginecólogo encargado de realizar la búsqueda de las historias clínicas.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Ries LAG, Young JL, Keel GE, Eisner MP, Lin YD, Horner M-J (eds). SEER Survival Monograph: Cancer Survival Among Adults: U.S. SEER Program, 1988-2001, Patient and Tumor Characteristics. National Cancer Institute, SEER Program, NIH Pub. No. 07-6215, Bethesda, MD, 2007.
2. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68: 394-424.
3. Del Pino M, Rodriguez-Carunchio L, Ordi J. Pathways of vulvar intraepithelial neoplasia and squamous cell carcinoma. Histopathology 2013; 62: 161-75.
4. Ueda Y, Enomoto T, Kimura T, Yoshino K, Fujita M, Kimura T. Two distinct pathways to development of
squamous cell carcinoma of the vulva. J Skin Cancer 2011; 95: 12-50.
5. Kurman RJ, Carcangiu ML, Herrington CS, Young RH. WHO classification of tumours of female reproductive
organs (4th ed.) 2014; WHO Press, chapter 9, p 229-53.
6. Dong F, Kojiro S, Borger DR, Growdon WB, Oliva E. Squamous cell carcinoma of the vulva: a subclassification of 97 cases by clinicopathologic, immunohistochemical, and molecular features (p16, p53, and EGFR). Am J Surg Pathol 2015; 39: 1045-53.
7. Judson PL, Habermann EB, Baxter NN, Durham SB, Virnig BA. Trends in the incidence of invasive and in situ vulvar carcinoma. Obstet Gynecol 2006; 107: 1018-22.
8. Joura EA, Lösch A, Haider-Angeler MG, Breitenecker G, Leodolter S. Trends in vulvar neoplasia. Increasing incidence of vulvar intraepithelial neoplasia and squamous cell carcinoma of the vulva in young women. J Reprod Med 2000; 45: 613-5
9. Hoang LN, Park KJ, Soslow RA, Murali R. Squamous precursor lesions of the vulva: current classification and diagnostic challenges. Pathology 2016; 48: 291-302.
10. van den Nieuwenhof HP, van Kempen LC, de Hullu JA, et al. The etiologic role of HPV in vulvar squamous cell carcinoma fine tunes. Cancer Epidemiol Biomarkers Prev 2009; 18: 2061-7.
11. Cheng AS, Karnezis AN, Jordan S, Singh N, Mc Alpine JN, Gilks CB. p16 immunostaining allows for accurate subclassification of vulvar squamous cell carcinoma into HPV-associated and HPV-independent cases. Int J Gynecol Pathol 2016; 35: 385-93.
12. Trietsch MD, Nooij LS, Gaarenstroom KN, van Poelgeest MI. Genetic and epigenetic changes in vulvar squamous cell carcinoma and its precursor lesions: a review of the current literature. Gynecol Oncol 2015; 136: 143-57.
13. Monk BJ, Burger RA, Lin F, Parham G, Vasilev SA, Wilczynski SP. Prognostic significance of human papillomavirus DNA in vulvar carcinoma. Obstet Gynecol 1995; 85: 709-15.
14. Rakislova N, Saco A, Sierra A, del Pino M, Ordi J. Role of human papillomavirus in vulvar cancer. Adv Anat Pathol 2017; 24: 201-14.15.
15. Wakeham K, Kavanagh K, Cuschieri K, et al. HPV status and favourable outcome in vulvar squamous cancer. Int J Cancer 2017; 140:1134-46.
16. McAlpine JN, Leung SCY, Cheng A, et al. Human papillomavirus (HPV)-independent vulvar squamous cell
carcinoma has a worse prognosis than HPV-associated disease: a retrospective cohort study. Histopathology
2017; 71: 238-46.
