SILVINA PAZ, LUIS FLOREZ BRACHO, JUAN SEBASTIÁN LASA, IGNACIO ZUBIAURRE
Servicio de Gastroenterología, Hospital Británico de Buenos Aires, Argentina
Resumen La resistencia bacteriana a ciertos antibióticos condiciona el éxito del tratamiento erradicador de la infección gástrica por Helicobacter pylori y es motivo de creciente preocupación a nivel mundial. Dada la escasa evidencia publicada en Argentina sobre este tema, nuestro objetivo fue investigar factores asociados a la persistencia de H. pylori post-tratamiento antibiótico. Se determinó la frecuencia de fracaso terapéutico en 81 pacientes con gastritis por H. pylori tratados en nuestro Servicio y sometidos al estudio de urea en aire espirado para confirmar la erradicación de la infección. La edad promedio fue 58±12 y 43.2% eran hombres. La frecuencia de fracaso terapéutico fue 17.3%. De los dos esquemas más utilizados, la frecuencia de fracaso fue mayor con claritromicina + amoxicilina que con levofloxacina + amoxicilina (25% vs. 6.6%, p=0.04). Como factores de riesgo investigamos las siguientes variables: edad, género, síntomas, tabaquismo, consumo de antiinflamatorios, diabetes, obesidad, tipo y duración de tratamiento. En el análisis univariado, el uso de esquemas con claritromicina y el género masculino se asociaron significativamente a persistencia de la infección [OR 4.2 (1.1-15.6) y 5.2 (1.1-26.4)]. En el análisis multivariado, el uso de esquema con claritromicina permaneció asociado al fracaso terapéutico [OR 5.38 (1.1-29.5)]. Concluimos que la inclusión de claritromicina en el esquema terapéutico para la gastritis por H. pylori se asoció a mayor fracaso terapéutico. Este fracaso es atribuible a alta prevalencia de resistencia de H. pylori a ese antibiótico en la población atendida en nuestro hospital y cuestiona las prácticas habituales de tratamiento en nuestro medio.
Palabras clave: Helicobacter pylori, gastritis, claritromicina
Abstract Antibiotic resistance may hinder the efficacy of eradication therapy against Helicobacter pylori infection and it has become a major concern worldwide. Due to the relatively scarce evidence published in Argentina on this topic, our aim was to describe factors associated with H. pylori persistence after antibiotic treatment. The therapeutic failure rate was described among 81 patients with H. pylori gastritis treated in our Hospital with a post-treatment urea breath test to determine successful eradication. Mean age was 58 ± 12 and 43.2% were male subjects. H. pylori persistence was observed in 17.3% of subjects. Therapeutic failure was more common among patients receiving clarithromycin + amoxicillin therapy that among those receiving levofloxacin + amoxicillin (25% vs. 6.6%, p = 0.04). The following variables were assessed: age, gender, referral symptoms, smoking, anti-inflammatory use, diabetes, obesity, treatment type and duration. Clarithromycin-based therapy and male gender were associated with infection persistence on univariate analysis [OR 4.2 (1.1-15.6) and 5.2 (1.1-26.4)]. On multivariate analysis, clarithromycin-based was associated with infection persistence [5.38 (1.1-29.5)]. We conclude that clarithromycinbased therapy is significantly associated with treatment failure. This failure may be due to an elevated prevalence of H. pylori resistance to clarithromycin in the population under study and raises the question on the utility of such therapeutic alternative.
Key words: Helicobacter pylori, gastritis, clarithromycin
Dirección postal: Juan Sebastián Lasa, Libertad 984 3P, 1012 Buenos Aires, Argentina
e-mail: drjuanslasa@gmail.com
El Helicobacter pylori es un bacilo Gram negativo que puede colonizar la mucosa gastroduodenal y es responsable de una serie de trastornos digestivos y extradigestivos bien individualizados 1. Es conocida su relación causal con la enfermedad ulcerosa péptica gastroduodenal 2, a punto tal que la introducción del tratamiento erradicador del H. pylori ha tenido una influencia profunda sobre la evolución natural de esta enfermedad y su pronóstico 3.
De la misma manera, su erradicación está vinculada a la curación de linfomas MALT (acrónimo de tejido linfoide asociado a mucosa gástrica, en inglés) 4. Además, diversos estudios epidemiológicos confirman que la infección por H. pylori es un factor de riesgo para el desarrollo de adenocarcinoma gástrico 5-7.
Es una infección ampliamente diseminada, pero la prevalencia varía, según el país o incluso la zona en estudio, entre 25 y 40% en EE.UU., y hasta 80% en algunos países de África y Latinoamérica 8-10. Estas variaciones dependen de una serie de factores, más allá de los geográficos, como edad, etnia, condiciones de higiene y otras variables socioeconómicas 11.
Por su relación directa con la etiopatogenia de enfermedades de importancia en salud pública, y por su
elevada prevalencia, resulta necesaria la terapia de erradicación de la infección. El tratamiento consiste en la administración de al menos dos antibióticos en combinación con un inhibidor de la secreción ácida gástrica (los inhibidores de la bomba de protones son los más utilizados) por un lapso de catorce días 12. Este esquema –que incluye el uso de antibióticos como claritromicina, amoxicilina, metronidazol o levofloxacina– es conocido como triple esquema, para diferenciarlo de los esquemas alternativos y/o basados en la administración de sales de bismuto 13. Por la facilidad en su administración y por su buena tolerancia, el esquema triple ha sido de elección como tratamiento de primera línea.
En los últimos años se ha observado un incremento significativo en la resistencia adquirida por el H. pylori a algunos de los antibióticos mencionados, lo cual disminuye de manera significativa la eficacia de dichos esquemas y constituye un problema creciente 14. Por ejemplo, en Italia y Japón, la prevalencia de resistencia de H. pylori a claritromicina llegaría al 40%, lo cual la descarta como alternativa terapéutica válida 15.
El problema de la resistencia antibiótica ha cobrado tanta relevancia que las guías sobre el tratamiento para la erradicación del H. pylori recientemente publicadas 16, 17 recomiendan que, en áreas donde se haya comprobado resistencia elevada a la claritromicina y/o al metronidazol, se utilicen esquemas alternativos –sugiriendo incluso los esquemas basados en sales de bismuto– como primera línea. La determinación de la resistencia del H. pylori a los antibióticos es engorrosa, debido a la dificultad de cultivarlo para la obtención de un antibiograma 18. Es por eso que gran parte de la evidencia acerca de la resistencia antibiótica del germen se basa en estudios en los que se evalúa la persistencia de la infección luego de la administración de un tipo de tratamiento, partiendo de la base de la extremadamente baja prevalencia de resistencia a amoxicilina que presenta el H. pylori 19.
En la Argentina no parece existir evidencia científica sobre la eficacia de los esquemas terapéuticos utilizados en la infección por H. pylori que permita inferir si la resistencia a antibióticos como claritromicina o metronidazol es elevada en nuestro medio 20, 21. Como se mencionó anteriormente, la determinación in vitro de la sensibilidad antibiótica del H. pylori es difícil de realizar y por ende, no está ampliamente difundida; estudios locales sobre la sensibilidad in vitro han sido desarrollados, con resultados dispares en cuanto a la prevalencia de resistencia a antibióticos de uso común como la claritromicina o quinolonas 22,23. Por consenso16, se define un porcentaje límite de persistencia de la infección con un tratamiento antibiótico determinado de 20%, por encima del cual, dicho antibiótico no debería ser utilizado como tratamiento de primera línea. Como consecuencia, el objetivo de este trabajo fue determinar la frecuencia de fracaso en la erradicación del H. pylori en pacientes tratados en nuestra institución y describir los factores de riesgo de fracaso terapéutico.
Materiales y métodos
Se realizó un estudio observacional de tipo corte transversal retrospectivo en el Servicio de Gastroenterología del Hospital Británico, en el período enero 2015 a julio 2017.
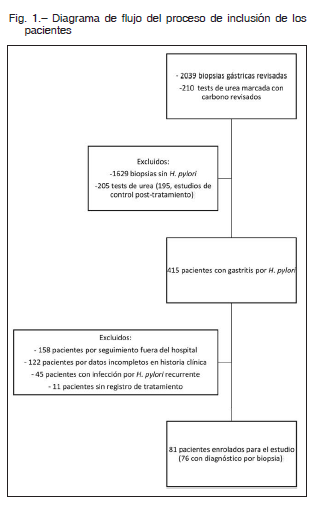
Se buscó a través de las bases de datos de endoscopía, medicina nuclear y anatomía patológica del Hospital, los casos que cumpliesen con los siguientes criterios de inclusión: a) edad mayor a 18 años, diagnóstico de infección por H. pylori por biopsia gástrica o bien por el test de urea marcada con carbono en aire espirado positivo; b) que hubieran recibido en nuestra institución tratamiento erradicador de la infección por H. pylori, independientemente del esquema utilizado; c) que luego de la finalización del tratamiento hubieran realizado algún estudio diagnóstico (biopsia gástrica o test de urea marcada con carbono en aire espirado) para corroborar la persistencia o no de la infección por H. pylori.
Fueron excluidos aquellos sujetos que presentaban infección por H. pylori recurrente y aquellos de quienes no se contase con información suficiente, a partir de las historias clínicas, para determinar el tipo de tratamiento administrado, la duración del mismo o bien el control de la erradicación.
Una vez identificados los casos que cumplían con los criterios de elegibilidad antes mencionados, se buscó en sus historias clínicas las siguientes variables: a) síntoma o cuadro clínico que motivó la búsqueda de la infección por H. pylori; b) método diagnóstico utilizado; c) tratamiento antibiótico recibido, dosis y tiempo total de tratamiento; d) resultado de estudio de confirmación de erradicación.
Asimismo, se recopilaron los siguientes datos de cada paciente incluido, con el fin de identificar factores adicionales que pudiesen vincularse al riesgo de fracaso terapéutico: edad, género, consumo de anti-inflamatorios no esteroideos, obesidad (definida como un índice de masa corporal superior a 30), diabetes mellitus tipo 2 (definido por constatación del antecedente en la historia clínica o bien por el consumo de
medicación para la resistencia a la insulina, hipoglucemiantes y/o insulina), tabaquismo (definido por constatación del antecedente en la historia clínica).
Se estimó la prevalencia global de fracaso del tratamiento erradicador, definido por la persistencia de la infección por H. pylori en los estudios post-tratamiento. Adicionalmente, se identificó la prevalencia de fracaso del tratamiento erradicador de los esquemas terapéuticos más frecuentemente utilizados en la población del estudio.
Teniendo en cuenta la hipótesis sostenida anteriormente, inferimos identificar una prevalencia de fracaso terapéutico superior al 20%; asumimos de manera hipotética que dicha prevalencia se situaría en 23%. Estimando un poder del 80% y un error alfa del 5%, calculamos el requerimiento de un tamaño muestral de 115 pacientes. Se decidió realizar un análisis inicial una vez alcanzados los dos tercios del tamaño muestral calculado. Los resultados de dicho análisis son los que se describen en este manuscrito.
Para el análisis estadístico, se utilizó el programa STATA (v11.1, Statacorp, College Station, Texas, USA). Se describieron las variables categóricas como porcentajes con su intervalo de confianza del 95% y a las variables numéricas como media con su desvío estándar. Para la comparación de variables categóricas, se utilizó el test de chi cuadrado o el test de Fisher de ser necesario; en el caso de las variables numéricas, el test t de Student. Fueron calculados los Odds Ratio con sus correspondientes intervalos de confianza del 95%. De acuerdo a los resultados del análisis univariado, se contempló la posibilidad de realizar un análisis multivariado para determinar variables independientes asociadas a la persistencia de la infección, siguiendo un modelo de regresión logística e incluyendo para ello a las variables que presentasen un valor de p menor a 0.1.
El protocolo del estudio fue evaluado y aprobado por el Comité de Revisión Institucional (número de aprobación del protocolo: 780). Como se trataba de un estudio observacional y retrospectivo, no se requirió de la firma de consentimiento informado por parte de los sujetos evaluados.
Los autores completaron un curso de guías de buenas prácticas clínicas en investigación previo a la concreción de este estudio; asimismo, se comprometieron a adherir a las normas de ética en investigación descriptas en la Declaración de Helsinki.
Resultados
Durante el período de estudio, se identificaron 210 test de urea en aire espirado, de los cuales 15 correspondieron a sujetos sin diagnóstico previo de infección por H. pylori; solamente se identificaron los datos completos de cinco de ellos. Asimismo, se revisaron 2039 biopsias gástricas, de las cuales 410 (20.1%) fueron compatibles con gastritis crónica por H. pylori. De estos, se incluyeron 76 sujetos que cumplieron con los criterios de elegibilidad. En la Figura 1 se observa el diagrama de flujo del proceso de selección de los pacientes incluidos en el estudio.
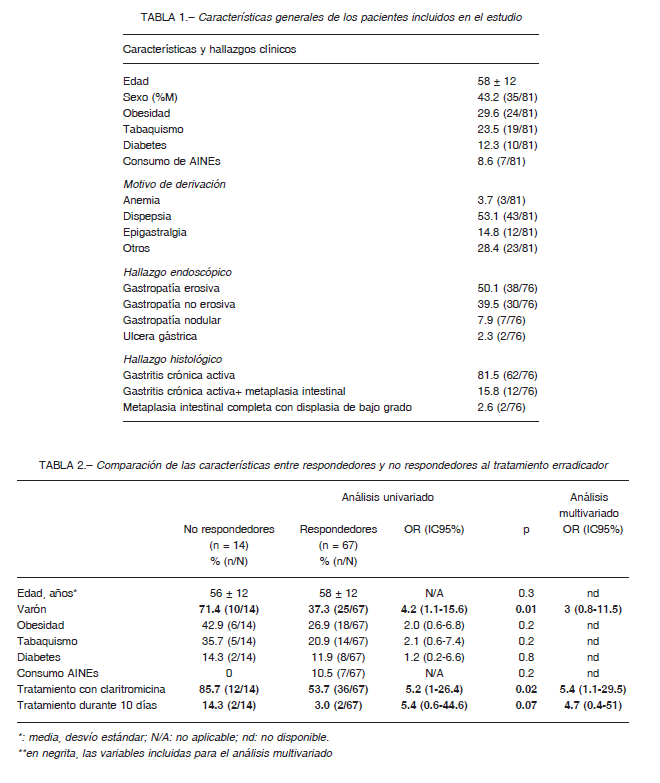
La Tabla 1 resume las características generales de los 81 pacientes que resultaron incluidos. Es llamativo el relativamente elevado porcentaje de sujetos obesos dentro de esta población (24/81, 29.6%). El motivo más frecuente de estudio fue la dispepsia (43/81, 53.1%).
De los 76 pacientes que se sometieron a una video endoscopia digestiva alta, el diagnóstico endoscópico más frecuente fue gastropatía erosiva (39/76, 50.6%). Por el contrario, se identificó un bajo porcentaje de úlcera gastroduodenal (2/76, 2.5%). Desde el punto de vista histológico, la mayoría de los pacientes presentaron gastritis crónica sin metaplasia intestinal (12/76, 16.1%). Solo dos de ellos (2/76, 2.5%) presentaron metaplasia intestinal con displasia de bajo grado. No se identificaron casos de adenocarcinoma o trastornos linfoproliferativos en la población estudiada.
El 96.3% (78/81) de los sujetos con infección por H. pylori recibió tratamiento por parte de un gastroenterólogo de la institución. El esquema terapéutico más frecuentemente indicado fue el triple esquema con claritromicina y amoxicilina (48/81, 59.3%). Treinta pacientes (37.0%) recibieron tratamiento con levofloxacina y amoxicilina, mientras que tres recibieron tratamiento concomitante con amoxicilina, claritromicina y metronidazol; 95.1% (77/81) de los pacientes recibieron tratamiento por 14 días – el resto, por 10 días solamente.
La frecuencia de fracaso de respuesta al tratamiento erradicador, determinada por el test de urea marcada con carbono en aire espirado (UBT, por Urea Breath Test), en forma global fue del 17.3% (14/81). Al comparar la proporción de persistencia de la infección por H. pylori de acuerdo al esquema terapéutico utilizado, la frecuencia de fracaso del triple esquema con claritromicina y amoxicilina fue 25% (12/48), un valor significativamente superior al observado en sujetos tratados con el triple esquema con levofloxacina y amoxicilina (2/30, 6.6%, p = 0.04).
La Tabla 2 compara las características clínicas y del tratamiento recibido entre sujetos que respondieron o no al tratamiento instaurado. Llama la atención la proporción comparativa de sujetos varones en el grupo de no respondedores [71.4% vs. 37.3%, OR 4.2 (1.1-15.6)], así como la proporción de sujetos tratados con un esquema basado en el uso de claritromicina [85.7% vs. 53.7%, OR 5.2 (1.0-26.4)]. En el análisis multivariado, solo el uso de un tratamiento basado en claritromicina demostró estar asociado de manera significativa al fracaso del tratamiento erradicador [OR 5.4 (1.1-29.5)].
Discusión
De acuerdo a nuestros resultados, una proporción elevada de pacientes con gastritis por H. pylori (17.3%) no responde satisfactoriamente al primer tratamiento instaurado.
Esto es significativamente más frecuente cuando se utiliza el esquema terapéutico basado en la administración de claritromicina y amoxicilina.
Es destacable la baja frecuencia del hallazgo de H. pylori mediante los dos métodos diagnósticos más frecuentemente utilizados en nuestro medio: la biopsia gástrica y el test de urea en aire espirado. La prevalencia encontrada (20.1%) es sustancialmente menor a la reportada en los pocos estudios epidemiológicos llevados a cabo en la Argentina. Según Pest y col 21, la prevalencia en población no seleccionada medida a través de serología es 44.8%. Este contraste llama más la atención teniendo en cuenta que la prevalencia descripta por nosotros contempla una población con síntomas de dispepsia –o por lo menos síntomas que ameritaron una consulta médica– lo cual naturalmente implicaría una sobreestimación de la prevalencia de la infección por H. pylori en la población general. Si bien es cierto que la serología puede tener menor especificidad 24 que los demás métodos diagnósticos, como el test de urea marcada con carbono en aire espirado o la determinación de antígeno de H. pylori en materia fecal, esto no sería motivo suficiente para justificar la diferencia observada. Es probable que dicha diferencia se deba principalmente a las características socioeconómicas de la población asistida en nuestra institución, elemento que influye en la prevalencia de gastritis por H. pylori y que resulta difícil de comparar con estudios previamente publicados.
Asimismo, llama la atención la baja prevalencia de enfermedad ulcerosa en la población en estudio (2.5%),
teniendo en cuenta una vez más que se trata de pacientes con síntomas de dispepsia o similares. Si bien no existe información actualizada sobre la prevalencia de enfermedad ulcerosa gastroduodenal en nuestro medio, la baja frecuencia observada aquí puede ser un reflejo de tres factores que han modificado la historia natural de dicha condición: por un lado, la búsqueda y tratamiento de la infección por H. pylori; por otro lado, y tal vez de un peso más importante, el uso difundido e incluso sin prescripción médica de bloqueantes de la secreción ácida gástrica, como los inhibidores de la bomba de protones 25. Por último, la situación socioeconómica es mejor que la de la población general y que la de la población asistida en hospitales públicos. Esto puede influir sobre el acceso al diagnóstico y tanto al acceso como a la adherencia al tratamiento.
En los últimos años, el fracaso del tratamiento instaurado para la erradicación del H. pylori y su vinculación con la resistencia a los antibióticos utilizados ha sido el foco de atención. De hecho, el recientemente publicado consenso de Maastricht 16, postula que en las regiones en las que la resistencia a la claritromicina estimada sea mayor del 15%, se opte o bien por un esquema con metronidazol y amoxicilina o de lo contrario –sobre todo si hay sospecha de resistencia de H. pylori al metronidazol– por el esquema cuádruple basado en sales de bismuto. Las guías del Colegio Americano de Gastroenterología 17 instan al uso del esquema cuádruple como primera opción terapéutica, sobre todo si el paciente ha recibido macrólidos en algún momento; además desaconsejan el uso del metronidazol como esquema triple y proponen como alternativa el uso de esquema triple con levofloxacina y amoxicilina o bien el esquema concomitante de amoxicilina, metronidazol y claritromicina. A pesar de que las recomendaciones de estas guías se fundamentan en estudios previamente publicados, la mayoría de nuestros pacientes fueron tratados con el esquema basado en claritromicina y amoxicilina. Esto se debe probablemente a la noción difundida en nuestro medio acerca del éxito terapéutico de estos esquemas en general y del esquema en cuestión en particular.
Los resultados aquí obtenidos muestran una alta proporción de fracasos terapéuticos en general y una proporción mucho más alta de fracaso del esquema que incluye claritomicina. Estos hallazgos deberían ser considerados para adoptar las recomendaciones de las guías antes mencionadas 17. En contraposición, el esquema que le sigue en cuanto a frecuencia de uso, de acuerdo a nuestros resultados –el triple esquema con levofloxacina y amoxicilina –presentó una proporción de fracaso terapéutico cercano al 10%. Si bien está descripto el desarrollo de resistencia a quinolonas por parte del H. pylori 26, por la facilidad de su administración y toma podría ser una alternativa atractiva como primera línea de tratamiento, especialmente en sujetos no expuestos a quinolonas recientemente. Por otra parte, a pesar de que no alcanzó una significancia estadística en el análisis multivariado, también identificamos al tratamiento menor de 14 días como potencial factor de riesgo de persistencia de la infección. Esto ha sido previamente publicado 27, por lo que nuestro hallazgo refuerza el concepto de que el tratamiento para H. pylori debería prolongarse durante 14 días.
Se deben mencionar algunas limitaciones de este trabajo. En primer lugar, se trata de un estudio retrospectivo, con las limitaciones lógicas que este tipo de diseño presentan. En segundo lugar, el tamaño muestral estimado inicialmente no fue alcanzado, lo cual podría tener una influencia en la exactitud de los resultados obtenidos. Sin embargo, el número de sujetos enrolados no dista mucho de lo proyectado, por lo que los resultados obtenidos describen una tendencia que posiblemente con mayor muestra se acentúe. Por otro lado, debido a que el estudio fue retrospectivo no se pudo evaluar un aspecto fundamental que puede estar involucrado en el éxito de la erradicación del H. pylori: la adherencia del paciente al tratamiento completo. Vale la pena recordar que, dadas las condiciones socioeconómicas de la población estudiada,
resulta difícil poder extrapolar los resultados encontrados a la población general de nuestro país. Sin embargo, nuestro estudio que, en nuestro conocimiento, sería el primero de nivel local, se orienta a determinar predictores del fracaso terapéutico de una infección frecuente.
En conclusión, identificamos que el fracaso terapéutico en pacientes con infección por H. pylori tratados por primera vez es mayor al 17% y que el predictor independiente asociado al riesgo de fracaso terapéutico es el uso del esquema triple con claritromicina. Por lo tanto, dicho esquema debería ser evitado en nuestro medio.
Conflicto de intereses: El Dr. Ignacio Zubiaurre declara haber recibido honorarios por disertaciones científicas por parte de los Laboratorios Abbvie y Takeda. El Dr. Juan Lasa declara haber recibido honorarios por disertaciones científicas por parte de los Laboratorios Sanofi-Aventis y Abbvie. El resto de los autores no tienen conflicto de intereses para declarar
Bibliografía
1. Mentis A, Lehours P, Megraud F. Epidemiology and diagnosis of Helicobacter pylori infection. Helicobacter 2015; 20 Suppl 1: 1-7.
2. Papatheodoris GV, Souqioultzis S, Archimandritis AJ. Effects of Helicobacter pylori and nonsteroidal anti-inflammatory drugs on peptic ulcer disease: a systematic review. Clin Gastroenterol Hepatol 2006; 4: 130-42.
3. Ford AC, Delaney BC, Forman D, Moayyedi P. Eradication therapy in Helicobacter pylori positive peptic ulcer disease: a systematic review and economic analysis. Am J Gastroenterol 2004; 99: 1833-55.
4. Suzuki H, Saito Y, Hibi T. Helicobacter pylori and gastric mucosa –associated lymphoid tissue lymphoma: updated review of clinical outcomes and the molecular pathogenesis. Gut Liver 2009; 3: 81-7.
5. Peterson WL. Review article: Helicobacter pylori and gastric adenocarcinoma. Aliment Pharmacol Ther 2002; Supl 1: 40-6.
6. Pelayo Correa, M Blanca Piazuelo, US. Helicobacter pylori infection and gastric adenocarcinoma. Gastroenterol Hepatol Rev 2011; 7: 59-64.
7. Sokic-Milutinovic S, Alempijevic T, Milosavljevic T, Sokic-Milutinovic T, Alempijevic T, Milosavljevic T. Role of Helicobacter pylori infection in gastric carcinogenesis: Current knowledge and future directions 2015 Advances in Gastric Cancer. World J Gastroenterol 2015; 21: 11654-72.
8. Awuku YA, Simpong DL, Alhassan IK, et al. Prevalence of Helicobacter pylori infection among children living in a rural setting in sub-Saharan Africa. BMC Public Health 2017; 17: 360.
9. Hooi JKY, Lai WY, Ng WK, et al. Global prevalence of Helicobacter pylori infection: systematic review and metaanalysis. Gastroenterology 2017;153: 420-9.
10. Otero RW, Gomez Z M, Otero P L, Trespalacios R A. Helicobacter pylori: ¿cómo se trata en el 2018? Rev
Gastroenterol Peru 2018; 38: 54-63.
11. Fernandez de Larrea N, Michel A, Romero B, et al. Antibody reactivity against Helicobacter pylori proteins in a sample of the Spanish adult population in 2008-2013. Helicobacter 2017;22 (5). doi 10.1111/hel.12401.
12. Talebi Bezmin Abadi A, Yamaoka Y. Helicobacter pylori therapy and clinical perspective. J Glob Antimicrob Resist 2018; 14: 111-7.
13. Zagari RM, Rabitti S, Eusebi LH, Bazzoli F. Treatment of Helicobacter pylori infection: a clinical practice update. Eur J Clin Invest 2018; 48(1). doi: 10.1111/eci.12857
14. Liou JM, Wu MS, Lin JT. Treatment of Helicobacter pylori infection: where are we now? J Gastroenterol Hepatol 2016; 31:1918-26.
15. Kocazeybek B, Tokman HB. Prevalence of primary antimicrobial resistance of Helicobacter pylori in Turkey: a systematic review. Helicobacter 2016; 21: 251-60.
16. Malfertheiner P, Megraud F, O’Morain CA, et al. Management of Helicobacter pylori infection: the Maastricht V/Florence Consensus Report. Gut 2017; 66: 6-30.
17. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG clinical guideline: treatment of Helicobacter pylori infection. Am J Gastroenterol 2017; 112: 212-39.
18. Costa S, Soares JB, Goncalves R. Efficacy and tolerability of culture-guided treatment for Helicobacter pylori infection. Eur J Gastroenterol Hepatol 2017; 29: 1258-63.
19. Fu W, Song Z, Zhou L, et al. Randomized clinical trial: esomeprazole, bismuth, levofloxacin and amoxicillin or cefuroxime as first-line eradication regimes for Helicobacter pylori infection. Dig Dis Sci 2017; 62: 1580-9.
20. Olmos JA, Rios H, Higa R. Prevalence of Helicobacter pylori infection in Argentina: results of a nationwide epidemiologic study. Argentinean Hp Epidemiologic Study Group. J Clin Gastroenterol 2000; 31: 33-7.
21. Pest PS, Corti R, Pedrana R, et al. Seroprevalence of Helicobacter pylori in the republic of Argentina: influence of age, sex, socioeconomic level, geographical area and health infrastructure. Multicenter study by the Club Argentino del Estomago y Duodeno. Acta Gastroenterol Latinoam 1999; 29: 297-305.
22. Pereyra LV, Gorordo Ipiña RC, Berruezo FA, Amieva CA, García ME, Bottiglieri MT. Sensibilidad a los antimicrobianos de aislamientos de Helicobacter pylori aislados de lesiones gástricas. Rev Argent Microbiol 2017; 49: 153-7.
23. Zerbetto de Palma G, Mendiondo N, Wonaga A, et al. Occurrence of mutations in the antimicrobial target genes related to levofloxacin, clarithromycin and amoxicillin resistance in Helicobacter pylori isolates from Buenos Aires city. Microb Drug Resist 2017; 23: 351-8.
24. Stone MA. Non-invasive testing for Helicobacter pylori. Postrad Med J 1999; 75: 74-7.
25. Vaduganathan M, Bhatt DL, Cryer BL, et al. Proton-pump inhibitors reduce gastrointestinal events regardless of aspirin dose in patients requiring dual antiplatelet therapy. J Am Coll Cardiol 2016; 67: 1661-71.
26. Phan TN, Santona A, Tran VH, et al. High rate of levofloxacin resistance in a background clarithromycin and metronidazole-resistant Helicobacter pylori in Vietnam. Int J Antimicrob Agents 2015; 45: 244-8.
27. Cao Z, Chen Q, Zhang W, et al. Fourteen-day optimized levofloxacin-based therapy versus classical quadruple therapy for Helicobacter pylori treatment failures: a randomized clinical trial. Scand J Gastroenterol 2015; 50: 1185-90.
