Resumen La miastenia gravis juvenil es una enfermedad autoimmune poco frecuente, por lo que ha sido difícil recopilar datos de estudios controlados aleatorizados prospectivos para evaluar la eficacia y los resultados de distintos tratamientos. Si bien hay diferencias entre la miastenia gravis juvenil y la del adulto, se han utilizado los datos aportados por algunas investigaciones en adultos en el tratamiento de la miastenia gravis juvenil. Se evaluarán las distintas opciones terapéuticas, con las distintas evidencias que lo sostienen y se elaborará un algoritmo de tratamiento teniendo siempre presente que cada paciente nos ofrece distintos desafíos.
Palabras clave: miastenia gravis, tratamiento, inmunosupresores, inmunomoduladores
Abstract Treatment of juvenile myasthenia gravis. Juvenile myasthenia gravis is a rare autoimmune disease, which has made it difficult to collect data from prospective randomized controlled trials to evaluate the efficacy and results of different treatments. Although there are differences between the juvenile myasthenia gravis and that of the adult, the data provided by some researches in adults in the treatment of juvenile myasthenia gravis have been used. The different therapeutic options will be evaluated, with the different evidences that sustain it and a treatment algorithm will be elaborated keeping always in mind that each patient offers us different challenges.
Key words: myasthenia gravis, treatment, immunosupressors, immunomodulators
e-mail: hugoarroyo2012@gmail.com
La miastenia gravis (MG) es una enfermedad autoinmune causada por autoanticuerpos dirigidos contra varias proteínas de la placa neuromuscular, más frecuentemente contra los receptores de acetilcolina (AChR). La MG tiene dos subtipos, ocular (MGO) y generalizada (MGG). Los anticuerpos contra AChR están elevados en la mayoría de los pacientes, especialmente en la forma generalizada.
Entre aquellos con anticuerpos AChR negativos, autoanticuerpos IgG contra tirosina quinasa músculo específica (MuSK) o contra receptor lipoproteína de baja densidad ligada a proteína 4 (LRP4), pueden estar elevados 1.
Un número importante de series de casos revisaron las terapias y los resultados en población pediátrica, pero ha sido difícil recopilar datos de estudios controlados aleatorizados prospectivos para evaluar la eficacia y los resultados del tratamiento 2. El objetivo de esta presentación es hacer una revisión actualizada del tratamiento y la evidencia que lo sostiene. Finalmente, elaborar un algoritmo que plantee las distintas opciones terapéuticas pero sin olvidar que el tratamiento de un paciente con MG es muy individualizado.
Inhibidores de la acetilcolinesterasa
Los inhibidores de la acetilcolinesterasa (IACE) son la primera línea de tratamiento. El bromuro de piridostigmina es el principal agente farmacológico usado en el tratamiento sintomático. Algunos pacientes con MGO pueden tratarse con IACE solamente, pero la mayoría de los casos de MGG requieren otras intervenciones. La dosis inicial es 0.5-1 mg/kg/dosis cada 4-6 horas mientras estén despiertos.
La acción máxima es entre 1-2 horas con desaparición de la acción entre 3 y 4 horas. La dosis máxima en niños es 7mg/kg/día pero se deberá valorar en cada paciente la máxima dosis con efecto beneficioso y sin síntomas colaterales 2. Es poco probable que altas dosis añadan un efecto beneficioso. Adolescentes mayores pueden recibir la dosis de adulto 600 mg/d hasta un máximo de 1500 mg 3. Los comprimidos de acción prolongada de 180 mg no son utilizados por la absorción errática. Otro IACE, el metilsulfato de neostigmina por vía parenteral; se usa especialmente para realizar el diagnóstico en reemplazo del cloruro de edrofonio (Tensilón®) 4.
Es necesario un ajuste de la dosis en el transcurso del tratamiento. Los pacientes o padres son los que
mejor nos orientarán y los adolescentes deben participar activamente en regular los horarios y la dosis a lo largo del día según la sintomatología.
Los IACE son poco eficaces para la debilidad grave, especialmente para la debilidad respiratoria y los síntomas deglutorios. Con respecto a los signos oculares, los IACE son más eficaces en la reducción de la ptosis que en mejorar la oftalmoparesia. Los pacientes MuSK positivos tienen menor respuesta a los IACE y algunos pueden demostrar un empeoramiento clínico y efectos secundarios significativos 2.
Náuseas, dolor abdominal y diarrea son los efectos colaterales más frecuentes e indican una dosis excesiva. Sialorrea, diaforesis bradicardia o síntomas de estimulación nicotínica como fasciculaciones, fatiga o calambres pueden anunciar una crisis nicotínica que, en nuestra experiencia, es excepcional.
Esteroides orales
Los esteroides orales (EO) son el pilar de la terapia autoinmune en la MG, basados en ensayos controlados
aleatorizados y apoyado por estudios observacionales y la opinión de los expertos. Un estudio retrospectivo en niños informó que el tratamiento con prednisona logró una buena respuesta terapéutica en el 61% de los pacientes 5, 6. Los niños con MGG después de un breve ensayo con IACE si persisten sintomáticos, se beneficiarán con esteroides orales. Se pueden utilizar dos esquemas de prednisona o prednisolona con “dosis alta” o “dosis baja”. El esquema con “dosis baja” implica una dosis de 0.2-0.5 mg/kg/día e ir aumentando hasta la menor dosis efectiva. El esquema con “dosis alta” inicia el tratamiento con 1-2 mg/kg/día y un máximo de 60 mg/día administrados en una toma por la mañana 3.
Una vez logrado la mejoría de los síntomas semantiene la dosis efectiva por 3-6 semanas para luego pasar a un régimen de días alternos. Dado que la introducción de los EO puede empeorar la debilidad, si se usa un esquema de “dosis altas” se aconseja internar al paciente, por lo que es aconsejable iniciar con “dosis baja” si el estado del mismo lo permite. Los pacientes deben ser informados de la posibilidad de aumento de la debilidad.
La suspensión de los EO debe realizarse lenta y cuidadosamente. Un régimen de días alternos es generalmente muy bien tolerado a largo plazo, con menos efectos secundarios que con los regímenes diarios.
Iniciar un tratamiento con esteroides orales antes de la timectomía ofrece algunos beneficios, ya que permite mejorar la condición clínica en el momento de la timectomía reduciendo los riesgos de la cirugía y un mejor estado general mientras se esperan los efectos de la timectomía, pero puede aumentar la grasa en el mediastino y complejizar la timectomía.
El uso de EO en MGO sigue siendo polémico, especialmente en el grupo prepuberal, por su mayor tasa de
remisión espontánea, curso más benigno, menor frecuencia de progresión a enfermedad generalizada y el riesgo de retraso del crecimiento 7. Sin embargo, en aquellos con pobre respuesta a los IACE, los EO deben utilizarse ya que se logra un buen control de los síntomas y son suficientes dosis bajas. Un estudio en adultos aleatorizado doble ciego demostró la utilidad de los esteroides en MGO 8. Si los EO evitan la generalización de una MGO es un tema controvertido.
El tratamiento con esteroides a largo plazo implica un mayor riesgo de aumento de peso, hipertensión, intolerancia a la glucosa, glaucoma, cambios de comportamiento, trastornos del sueño y hematomas y cambios estéticos. Los niños presentan a menudo retraso en el crecimiento y alteraciones óseas. Durante el tratamiento con esteroides se requiere suplemento de vitaminas, ingesta adecuada de calcio y protectores gástricos.
Timectomía
Alrededor de un 10% de adultos tienen timomas y entre un 70-80% de pacientes con MG tienen cambios hiperplásicos en el timo, los que no se observan en personas sanas. El timoma en niños es excepcional 9.
La timectomía tiene su indicación precisa en adultos con timoma y es un tratamiento aceptado para adultos con MG sin timoma, pero su utilidad en el tratamiento de la MG juvenil es menos clara. Un reciente ensayo aleatorizado evaluó el efecto de la timectomía en adultos con prednisona y demostró una reducción en el requerimiento de dosis del esteroide y mejoría de los síntomas en aquellos timectomizados 10.
Los beneficios de la timectomía fueron evaluados en estudios retrospectivos en pacientes con MG juvenil seropositivo y se asociada con mejor porcentaje de remisión 11, 12. En nuestra experiencia, el 25% de los timectomizados logró una remisión completa postimectomía luego de un seguimiento medio de 5 años 13.
Una revisión sistemática de 16 estudios que incluyó 1131 pacientes, demostró una mejoría en el 77% de los timectomizados 14. A pesar de las limitaciones de los estudios retrospectivos, la evidencia actual disponible apoya el uso de timectomía en niños peripuberales y postpuberales con MG generalizada juvenil moderada o grave y anticuerpos positivos que no respondieron a un tratamiento con medicamentos sintomáticos o con tratamientos inmunomoduladores o inmunosupresores, o son dependientes de un régimen intenso de estas terapias. La timectomía no demostró ser más efectiva que el tratamiento inmunosupresor en la MGO y no evitaría la evolución a una forma de MG generalizada 15. La timectomia puede ser considerada en pacientes con MGG seronegativos si no respondieron al tratamiento inmunosupresor o para minimizar los efectos colaterales. No hay evidencias de la utilidad en pacientes con anticuerpos anti MuSK o LRP4 16.
Otro aspecto controvertido es el tipo de timectomía.
La transesternal ampliada proporciona un acceso fácil a todas las áreas donde el tejido tímico ectópico puede presentarse pero la torascocópica aumentó su popularidad y los resultados no son inferiores a la esternotomía.
Además, tiene una baja morbilidad perioperatoria y un corto período de hospitalización, por lo que es una
opción en centros con suficiente experiencia médica y quirúrgica. En los pacientes más gravemente afectados, es importante estabilizarlos con inmunoglobulina endovenosa o plasmaféresis, lo que reduce el riesgo relacionado a la cirugía.
Hay algunos puntos sobre la timectomía que no están bien definidos:
1) ¿Es más efectiva si se realiza entre los primeros 12 meses del inicio de la enfermedad que si se realiza más tarde?
2) ¿Cuán precozmente se puede hacer la timectomía teniendo en cuenta el rol en el desarrollo del sistema
inmunológico?
3) ¿Hay diferencias en los resultados de la timectomía en prepúberes y en púberes?
4) ¿En pacientes con MG seronegativos es esperable similares resultados que en seropositivos?
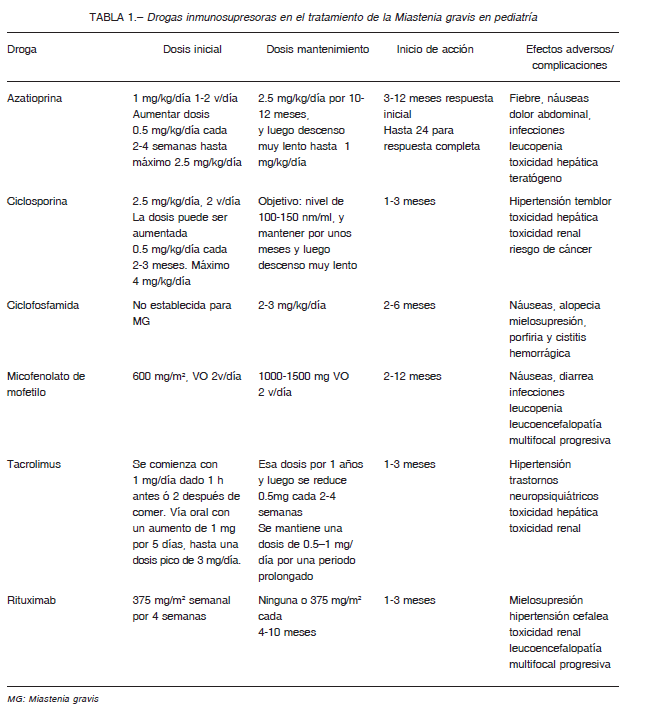
Otras drogas inmunosupresoras
Cuando no hay respuesta a los esteroides orales y/o se requieren muy altas dosis y no hubo respuesta a la
tiemctomía, se utilizan otros inmunosupresores como azatioprina, ciclosporina A, micofenolato de mofetilo y recientemente rituximab (Tabla 1). La experiencia con estas drogas en pediatría es limitada y deben ser indicadas por neurólogos con experiencia en ellas.
El consenso de experto sugiere utilizar azatioprina como primera droga inmunosupresora luego de los
corticoides. Una vez logrado el efecto deseado el descenso tiene que ser lento, con cambios cada 3-6
meses. Si no responde a un agente inmunosupresor o tiene complicaciones debe cambiarse a otra droga 3,16.
Inmunoglobulina intravenosa y plasmaféresis
La plasmaféresis se utiliza en el tratamiento de pacientes miasténicos con el objetivo de reducir anticuerpos y citoquinas en el suero. De la misma manera se utiliza la inmunoglobulina intravenosa (IGIV) por su mecanismo inmunomodulador con la supresión de autoanticuerpos reactivos a través de la red idiotipoantiidiotipo, impidiendo la activación de la producción de autoanticuerpos al saturar receptores de superficie de las células B y la inhibición de las células T autorreactivas, entre otros.
Un estudio aleatorizado controlado en adultos en crisis evaluó IGIV vs. placebo y demostró la eficacia de la IGIV.
Otros estudios también en adultos no presentaron una diferencia significativa entre la IGIV vs. plasmaféresis ni diferencias en la eficacia entre 1 g y 2 g/kg de IGIV o vs. metilprednisolona oral 17. Se comunicaron similares hallazgos en MG juvenil 18.
Muchos estudios han demostrado los beneficios de la plasmaféresis en pacientes con exacerbación o crisis
miasténicas, tanto en adultos como en niños 19.
Ambos métodos son útiles en pacientes MuSK positivos, pero no se recomiendan en el tratamiento de mantenimiento salvo situaciones excepcionales de refractariedad o intolerancia al tratamiento inmunosupresor. IGIV y plasmaféresis tienen ventajas y desventajas, por lo que utilizar uno u otro procedimiento dependerá de las facilidades que tenga cada institución.
Tratamiento del estrabismo y ambliopía
En el momento del diagnóstico de la MGO del 21% al 50% de los niños tiene ambliopía, pero con un adecuado tratamiento (oclusión, uso de lentes) se puede lograr una reducción a solo un 3%. En nuestra experiencia, un 20% de los pacientes con MGO queda con secuelas graves: ambliopía, mirada congelada.
El estrabismo es más difícil de tratar en pacientes con MGO. Persiste hasta en un 15%-57% en seguimientos
a largo plazo y la ptosis palpebral también suele persistir en el 46%-66% de los pacientes con enfermedad
estable 20.
La estabilidad del ángulo de desviación, el fracaso del tratamiento farmacológico y la falta de mejoría de la motilidad ocular después de inyección de neostigmina en al menos dos visitas, debe ser confirmada antes de sugerir una opción quirúrgica para el estrabismo de MGO ocular. Hay que ser cauteloso con las expectativas del tratamiento quirúrgico y de la posibilidad de intervenciones múltiples.
Conclusiones
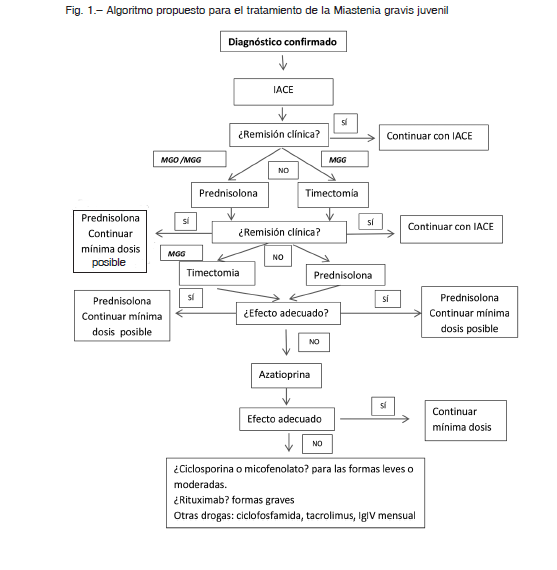
En la Figura 1 se muestra un algoritmo para el tratamiento de la MG juvenil. Esto es solo una orientación ya que cada paciente tiene características propias (forma ocular, generalizada, edad de inicio, gravedad del cuadro, anticuerpos, acceso a cuidados médicos, enfermedades asociadas, etc.) que hacen que el tratamiento sea muy individualizado y además se debe tener en cuenta los recursos y experiencia del centro que lo atiende.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Gilhus NE. Myasthenia Gravis. N Engl J Med 2016; 375: 2570-81.
2. Liew WK, Kang PB. Update on juvenile myasthenia gravis. Curr Opin Pediatr 2013; 25: 694-700.
3. Ionita CM, Acsadi G. Management of juvenile myasthenia gravis. Pediatr Neurol 2013; 48: 95-104.
4. Arroyo HA. Miastenia gravis y síndromes miasténicos en Fejerman N, Fernández Alvarez, Neurología Pediátrica, 3ra ed. Buenos Aires: Editorial Médica Panamericana, 2007.
5. Batocchi AP, Evoli A, Palmisani MT, Lo Monaco M, Bartoccioni M, Tonali P. Early-onset myasthenia gravis: Clinical characteristics and response to therapy. Eur J Pediatr 1990; 150: 66-8.
6. Schneider-Gold C, Gajdos P, Toyka KV, Hohlfeld RR. Corticosteroids for myasthenia gravis. Cochrane Database Syst Rev 2005. CD002828.
7. Khadilkar SV, Chaudhari CR, Patil TR, Desai ND, Jagiasi KA, Bhutada AG. Once myasthenic, always myasthenic? Observations on the behavior and prognosis of myasthenia gravis in a cohort of 100 patients. Neurol India 2014; 62: 492-7.
8. BenatarM, McDermott MP, Sanders DB, et al. Ef-ficacy of prednisone for the treatment of ocular myasthenia(EPITOME): A randomized, controlled trial. Muscle Nerve 2016 53: 363-9.
9. Evoli A, Batocchi AP, Bartoccioni E, Lino MM, Minisci C, Tonali P. Juvenile myasthenia gravis with prepubertal onset. Neuromuscul Disord 1998; 8: 561-7.
10. WolfeGI, KaminskiHJ, AbanIB, etal. Randomized trial of thymectomy in myasthenia gravis. N Engl J Med 2016; 375: 511-22.
11. Castro D, Derisavifard S, Anderson M, et al. Juvenile myasthenia gravis: A twenty-year experience. J Clin Neuromusc Dis 2013;14: 95-102.
12. Heng HS, Lim M, Absoud M, et al. Outcome of children with acetylcholinereceptor (AChR) antibody positive juvenile myasthenia gravis following thymectomy. Neuromuscul Disord 2014; 24: 25-30.
13. Arroyo HA, Rubio R. Miastenia Gravis generalizada en la infancia y adolescencia en Temas de Neuropediatría, Ruggieri V, Caraballo R, Arroyo H. Buenos Aires: Edición Médica Panamericana, 2005.
14. Madenci AL, Li GZ, Weil BR, Zurakowski D, Kang PB, Weldon CB. The role of thymectomy in the treatment of juvenile myasthenia gravis: a systematic review. Pediatr Surg Int 2017; 33: 683-94.
15. Mineo TC, Ambrogi V. Outcomes after thymectomy in class I myasthenia gravis. J Thorac Cardiovasc Surg 2013; 145: 1319-24.
16. Sanders DB, Wolfe GI, Benatar M, et al. International consensus guidance for management of myasthenia gravis: Executive summary. Neurology 2016 26; 87: 419-25.
17. Gajdos P, Chevret S, Toyka KV. Intravenous immunoglobulin for myasthenia gravis. Cochrane Database Syst Rev 2012; 12: CD002277.
18. Selcen D, Dabrowski ER, Michon AM, Nigro MA. High-dose intravenous immunoglobulin therapy in juvenile myasthenia gravis. Pediatr Neurol 2000; 22: 40-3.
19. Liew WK, Powell CA, Sloan SR, et al. Comparison of plasmapheresis and intravenous immunoglobulin as maintenance therapies for juvenile myasthenia gravis. JAMA Neurol 2014; 71: 575-80.
20. Peragallo JH, Velez FG, Demer JL, Pineles SL. Long-term follow-up of strabismus surgery for patients with ocular myasthenia gravis. J Neuroophthalmol 2013; 33: 40-4.
