MANDEEP RANA 1, CLAUDIA RIFFO ALLENDE 2, TOMÁS MESA LATORRE 2, KARINA ROSSO ASTORGA 3, ALCY R. TORRES 1
1 Department of Pediatrics, Division of Pediatric Neurology, Boston Medical Center, Boston University School of Medicine, Boston, USA, 2 Centro del Sueño, Pontificia Universidad Católica de Chile, Santiago de Chile, 3 Servicio de Neurología Pediátrica, Hospital Gustavo Fricke, Valparaíso, Chile
Resumen El sueño es un proceso fisiológico activo y cíclico que tiene efectos críticos en la salud. Sus funciones son numerosas: crecimiento, desarrollo, aprendizaje, memoria, eficiencia sináptica, regulación del comportamiento, emoción, fortalecimiento inmunológico y tiempo de limpieza de sustancias neurotóxicas. Durante los primeros años de vida hay una serie de cambios importantes en el desarrollo que conducen al patrón esperado de sueño y vigilia en los adultos. El sueño ocupa un tercio de la vida del adulto. Sin embargo, dormir durante los primeros meses de vida ocupa más del 50% del tiempo. Esta revisión del tema describirá los patrones normales de sueño en la infancia.
Palabras clave: sueño, pediatría, fisiología
Abstract Sleep in children: physiology and update of a literature review. Sleep is an active and cyclic physiological process that has a critical impact on health. Its functions are numerous: growth, development, learning, memory, synaptic efficiency, regulation of behavior, emotion, immune strengthening and cleaning time of neurotoxic substances. During the first years of life, there are a number of important changes in development, which lead to the expected pattern of sleep and wakefulness in adults. The sleep occupies a third of the adult’s life. However, sleeping during the first months of life takes up more than 50% of time. This review of the topic will describe normal sleep patterns in childhood.
Key words: sleep, pediatrics, physiology
e-mail: med.riffo@gmail.com
El sueño es un estado de comportamiento reversible caracterizado por la desconexión con el medio ambiente
mientras el organismo se relaja. El desarrollo de la organización del ciclo despierto-dormido es progresivo y empieza desde la vida intrauterina. Está estrechamente relacionado con la maduración del cerebro. La arquitectura del sueño, su duración, la proporción de las diferentes etapas del sueño y la cantidad necesaria que se requiere según la edad son específicos de cada individuo 1, 2.
El sueño es un proceso fisiológico altamente estructurado. Se han identificado dos estados diferentes de sueño basados en variables específicas: dormir con movimientos oculares rápidos (REM) y dormir con movimientos oculares no rápidos (NREM). Este último se compone de tres etapas: sueño superficial 1 (N1), sueño 2 (N2) y sueño profundo 3 (N3). En los bebés se conocen como sueño activo (REM) y pasivo (NREM)3. En el adulto la proporción de sueño REM/NREM es 20:80 3.
En 1966, Roffwarg y col. despertaron interés en los aspectos del desarrollo del sueño cuando informaron que los recién nacidos tenían un periodo REM mayor en comparación con los adultos 4. Estos investigadores postularon que el sueño REM contribuía a la maduración funcional y la activación de áreas motoras. Esta hipótesis ayudó a iniciar una serie de investigaciones sobre el sueño en niños que, asociada a los avances tecnológicos como la polisomnografia, ha permitido estudiarlo a profundidad en las diferentes edades 1, 2.
En el cerebro en desarrollo, el sueño es una de las funciones más importantes. En los recién nacidos a término, representa su actividad principal, duermen de 16 a 18 horas al día y de ello un 50% corresponde a sueño REM. En prematuros, sueño activo corresponde hasta un 80% (precursor de REM). A los 2 años, el niño ha dormido en promedio 10 000 horas (57%) en comparación a las 7500 (43%) horas que ha permanecido en vigilia 3.
Fisiología del sueño normal
La relación de activación y desactivación es un proceso complejo. La vigilia es mantenida por proyecciones neuronales ascendentes en el tronco cerebral llamado sistema de activación reticular. Este sistema excita a las neuronas con proyecciones tálamo-corticales, hipotálamo posterior y las partes inferiores del lóbulo frontal 5.
Durante el sueño, el cerebro es más sensible a los estímulos internos que a los externos. El interruptor que permite conciliar el sueño se encuentra en el núcleo preóptico ventrolateral del hipotálamo anterior. Esta área se activa durante el sueño y utiliza GABA y neurotransmisores inhibitorios como galanina para iniciarlo, mediante la inhibición de las neuronas que regulan el despertarse.
Durante el sueño NREM la mayoría de las neuronas tienen menos actividad que en la vigilia, con excepción
de las neuronas del tracto solitario y la región pre-óptica. Durante el período REM la actividad neuronal es mayor que en la vigilia, a excepción de las células serotoninérgicas del rafe y las noradrenérgicas del locus ceruleus que son inactivadas 6.
El patrón de sueño tiene un ritmo circadiano que se presenta cada 24 horas. El sustrato neurológico que explica esta ritmicidad se encuentra en el hipotálamo, particularmente en el núcleo supraquiasmático, que regula el reloj biológico en 24.2 horas. Esta estructura tiene múltiples conexiones dentro del sistema nervioso central, presenta regulación por mecanismos endógenos y exógenos (que les permite adaptarse a variables externas como la luz).
El ciclo diario sueño-vigilia depende de la interacción del proceso homeostático de sueño S y el proceso circadiano C, a menudo conocido como “Modelo de dos partes”. El principal determinante del proceso S para conducir al sueño se acumula con el período de vigilia prolongada y se disipa al dormirse. Por el contrario, el proceso C no depende de la duración previa de la vigilia del sueño, sino que es más bien un sistema auto-sostenible que regula intrínsecamente muchos ritmos de 24 horas, incluido el sueño. Los procesos S y C interactúan como antagonistas ayudando en la iniciación y el mantenimiento del sueño durante la noche y a mantener la vigilia durante todo el día 7.
Los ritmos circadianos se generan a nivel molecular mediante circuitos de retroalimentación transcripción/traducción. Las células son capaces de modular la expresión de genes con oscilaciones de 24 horas, se trata de los genes reloj o genes clock (CLOCK y BMAL1) y sus dos proteínas claves CLOCK y BMAL1, que activan la transcripción de otros genes PER 1,2,3 (período) y CRY 1,2. Las proteínas PER y CRY se trasladan de nuevo al núcleo y modulan la actividad de CLOCK-BMAL1.
Evolución del sueño en niños durante la noche
En el recién nacido (RN) a término se pueden identificar dos estados de sueño distintos durante un ciclo: REM y NREM. Cada ciclo dura 50 a 60 minutos y puede haber hasta 18-20 ciclos en un día. Un recién nacido duerme 16 a 18 horas (70%) en 24 horas. El sueño no tiene una organización circadiana, es decir, es indiferente al entorno. A los 3 meses de edad comienza a establecerse progresivamente un patrón circadiano del sueño ocupando más tiempo durante la noche en relación al día 8, 9.
Durante los primeros meses de vida, los niños entran rápidamente a la fase de sueño activo que se caracteriza por movimientos oculares rápidos, movimientos de succión, espasmos finos, muecas, sonrisas, vocalizaciones y temblores. Se pueden ver movimientos y estiramientos intermitentes de las extremidades o movimientos atetoides. Las ráfagas de activación muscular y respiración periódica ocurren de forma concomitante con movimientos oculares. Por el contrario, el sueño tranquilo se caracteriza por movimientos mínimos y la respiración es regular y monótona 9, 10.
El sueño activo puede exceder el 50% del tiempo de sueño en el recién nacido. La necesidad de altos niveles de sueño activo en el período neonatal no está clara, pero tal vez es importante para la maduración del cerebro y la plasticidad sináptica. Los períodos de sueño tranquilo duran unos 20 minutos y representan entre el 25 y el 35% del sueño total 10.
Al nacer, el cerebro de un recién nacido contiene 100 mil millones de neuronas y el número de sinapsis por neurona es de 2500. A medida que el niño aprende, se van creando nuevas sinapsis, por lo que a la edad de 2 a 3 años, el número de sinapsis es de 15 000 por neurona. Esta densidad sináptica sin embargo causa una sobrecarga en el cerebro que puede comprometer su eficiencia durante el crecimiento. En la adolescencia y hasta aproximadamente los 20 años, se produce la poda sináptica durante el sueño que se ha relacionado a una reducción del sueño de etapa N3. Durante el sueño las sinapsis se debilitan y se ha sugerido que la microglia puede eliminar las sinapsis débiles durante el sueño. Las variaciones circadianas de glucocorticoides y noradrenalina podrían relacionarse con los fenotipos de microglia y fuerza sináptica 8, 11.
Cambios en el sueño en el período fetal
A las 9 semanas se desarrolla la neurona motora de la médula espinal. Los estiramientos se observan a la semana 10, succionan y tragan líquido amniótico a la semana 11 y después de las 18-20 semanas se aprecian movimientos activos y mientras el feto duerme, se observan las patadas después de las 32 semanas.
Los movimientos oculares se visualizan en el ultrasonido fetal desde las 16 semanas y los movimientos
oculares rápidos (REM) desde las 18-20 semanas 10-12. Los estudios basados en ecografías del feto muestran que, a partir de las 20 semanas, se puede apreciar un ciclo de actividad-pasivo del sueño con ciclos de aproximadamente 50 minutos. En bebes prematuros menores de 24-26 semanas de gestación no se pueden distinguir ninguna las fases activa y pasiva.
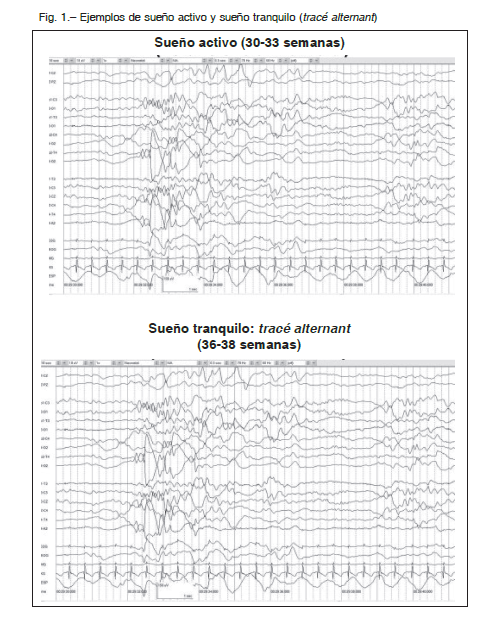
A las 30-32 semanas ya se identifican 3 etapas conductuales distintas: vigilia, REM y NREM. El electroencefalograma de sueño silencioso muestra ráfagas de ondas simétricas de alto voltaje que duran 4-5 segundos alternando con períodos de actividad de baja amplitud de duración similar dando lugar a un modelo típico conocido como “tracé alternant”. Durante el sueño activo, el electroencefalograma se compone de frecuencia mixta irregular de 4-8 Hz actividad.
El patrón de “tracé alternant” desaparece gradualmente durante el primer mes de vida y los husos del sueño
aparecen simultáneamente a las 4-6 semanas de edad.
A las 28 semanas ya se identifican 3 estadios de comportamiento: vigilia, REM y NREM (Fig. 1).
El sueño NREM etapas 1, 2 y 3 se puede distinguir entre 3 y 6 meses. El sueño NREM etapa 1 o sueño superficial, es considerado un período de transición entre la vigilia y sueño N2. La etapa N2 se caracteriza por la presencia de husos de sueño. Finalmente, el sueño en etapa N3, se caracteriza por la presencia de ondas delta de amplio voltaje. En la medida que estas etapas progresan se requieren estímulos más intensos para despertar al individuo.
Existen características en cada fase del sueño con funciones específicas funciones. La hormona de crecimiento y su hormona estimulante (GHRH de las siglas en inglés) se asocian al sueño NREM N3 o de ondas lentas, y se suprimen con la privación de sueño. La liberación de hormona de crecimiento en esta fase del sueño empieza después de los 3 meses de edad.
Desarrollo de la arquitectura del sueño en el niño
El ritmo ultradiano al nacer (períodos o ciclos recurrentes de menos de 24 horas) de sueño tranquilo y activo, tiene una duración de 50-60 minutos. La vigilia representa solo el 8-10% de un día en bebés de hasta 8 semanas. A los 11 meses de edad, los ciclos de sueño se repiten en un patrón polifásico en el día, interrumpido aproximadamente cada 3-4 horas por la alimentación. Dentro de un ciclo de sueño, el sueño REM dura 10-45 minutos, NREM cerca de 20 minutos y de transición aproximadamente 10 minutos.
Las etapas del sueño cambian desde la infancia hasta la adolescencia. En los primeros 3 meses, el sueño se inicia con sueño activo, entre los 3 y 6 meses ocurre un período de transición, tras lo cual el sueño comienza con sueño superficial N1. La latencia de sueño REM de 20-40 minutos es típica en bebés de 3 a 12 meses y ciclos de sueño con promedio de 50 minutos son comunes en comparación con los 100 minutos en adultos. El tiempo total de sueño (TTS) también disminuye durante la infancia y la adolescencia. El sueño dura 14.2 horas a los 6 meses disminuye a 13 horas cuando cumple un año. El número y la duración de las siestas disminuye un 82% y los niños a los 18 meses ya no hacen siestas. La duración del ciclo de sueño aumenta de 60 minutos en RN de término a 90 minutos en adultos 13.
La distribución de las fases del sueño cambia con la edad. Los prematuros pasan el 80% de su tiempo de
sueño en REM, el 50% a término, y se reduce al 30% al año. El sueño NREM aumenta mientras que el sueño REM disminuye. El sueño N3 es más prominente en el primer tercio de la noche, mientras que el REM se posiciona en el tercio final. Entre los 5 a 19 años, el porcentaje del sueño REM permanece estable, mientras que el porcentaje de NREM (N2) aumenta con una disminución concomitante en el sueño NREM (N3) 1, 13, 14. Aunque algunas diferencias pueden existir, los períodos de sueño son relativamente constantes a esta edad. N1 comprende 2-5%; N2 40-55%, N3 13-25% y REM aproximadamente 20-25%.
Después de la edad de 5 años los patrones de sueño permanecen relativamente constante durante el resto
del ciclo de vida 14, 15.
Conclusiones
El sueño es un estado de comportamiento reversible caracterizado por la desconexión con el medio ambiente mientras el organismo se relaja. Es un proceso activo relacionado con múltiples funciones. Al nacer el sueño activo (REM) es más largo que el sueño pasivo pero disminuye gradualmente con la edad. Esta revisión recoge los aspectos más importantes de la fisiología normal del sueño en la niñez, cuyo entendimiento es crítico para entender luego las desviaciones fisiológicas y las bases de un tratamiento de los trastornos del sueño en pediatría.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Chokroverty S. An Overview of normal sleep. In: Chokroverty S, Sleep Disorders Medicine, 4th ed. New York: Springer, 2017, p 5-27.
2. Blumberg MS. Ontogeny of sleep. In: Kushida CA, Encyclopedia of sleep, 1st ed. Boston, MA: Elsevier, 2013, p 32-7.
3. Santos IS, Bassani DG, Matijasevich A, et al. Infant sleep hygiene counseling (sleep trial): protocol of a randomized controlled trial. BMC Psychiatry 2016; 16: 307.
4. Roffwarg H, Muzio JN, Dement WC. Ontogenetic development of the human sleep-dream cycle. Science 1966; 152: 604-19.
5. Saper CB, Chou TC, Scamell TE. The sleep switch: hypothalamic control of sleep and wakefulness. Trends
Neurosci 2001; 24: 726-31.
6. Paolicelli RC, Bolasco G, Pagani F, et al. Synaptic pruning by microglia is necessary for normal brain development. Science 2011; 333: 1456-8.
7. Alam MA, Kostin A, Siegel J, McGinty D, Szymusiak R, Alam MN. Characteristics of sleep-active neurons in the medullary parafacial zone in rats. Sleep 2018; 41(10). doi: 10.1093/sleep/zsy130.
8. Choudhury ME, Miyanishi K, Takeda H, et al. Phagocytic elimination of synapses by microglia during sleep. Glia 2019. doi: 10.1002/glia.23698. [Epub ahead of print]
9. Sheldon S, Ferber R, Kryger M, Gozal D, Principles and Practice of Pediatric Sleep Medicine, 2nd ed, Elsevier Inc, Chapter 1, 2014, p 3-13.
10. Milh M, Kaminska A, Huon C, Lapillonne A, Ben-Ari Y, Khazipov R. Rapid cortical oscillations and early motor activity in premature human neonate. Cereb Cortex 2007; 17: 1582-94.
11. Daftary AS, Jalou HE, Shively L, Slaven JE, Davis SD. Polysomnography reference values in healthy newborns. J Clin Sleep Med 2019; 15: 437-43.
12. Mäkelä TE, Peltola MJ, Nieminen P. Night awakening in infancy: Developmental stability and longitudinal associations with psychomotor development. Dev Psychol 2018; 54: 1208-18.
13. Grigg-Damberger M. Ontogeny of sleep and its Functions in infancy, Childhood, And Adolescence In: Nevsimalova S, Bruni O, Sleep Disorders in Children. Switzerland: Springer, 2017, p 3-29.
14. Shellhaas RA, Burns JW, Hassan F, Carlson MD, Barks JDE, Chervin RD. Neonatal Sleep-Wake Analyses Predict 18-month Neurodevelopmental Outcomes. Sleep 2017; 40(11). doi: 10.1093/sleep/zsx144.
15. Feinberg I, Campbell IG. Sleep EEG changes during adolescence: an index of a fundamental brain reorganization. Brain Cogn 2010; 72: 56-65.
