ALCY R. TORRES 1, JUAN D. NARANJO 2, CARLA SALVADOR 3, MAURICIO MORA 3, OSCAR PAPAZIAN 4
1 Department of Pediatrics, Division of Neurology, Boston University School of Medicine, Boston, Massachusetts, USA, 2 Pontificia Universidad Católica de Ecuador, Quito, Ecuador, 3 Universidad de las Américas, Quito, Ecuador, 4 Department of Pediatrics, Division of Neurology, Herbert Wertheim School of Medicine, Florida International University, Miami, Florida, EE.UU.
Resumen Si una dificultad sobreviene durante el nacimiento de un niño, por una anomalía materna o fetal, aguda o crónica, la asfixia del cerebro fetal constituye un riesgo mayor, porque ella podría dar como resultado la destrucción de las neuronas y la posibilidad de evolucionar hacia una encefalopatía hipóxico isquémica con secuelas a largo plazo. En esta revisión se resaltan los aspectos científicos más recientes pero a la vez se ofrece un margen de conocimiento imprescindible en cuant o a la patofisiología, diagnóstico y tratamiento, así como también se ofrece una perspectiva sobre el futuro de la atención clínica de la encefalopatía hipóxico isquémica.
Palabras clave: hipoxia, isquemia, encefalopatía neonatal
Abstract Predominant factors of neonatal encephalopathy: hypoxic and ischemia, a global problem. If a difficulty arises during birth, due to a maternal or fetal anomaly, acute or chronic, asphyxia of the fetal brain constitutes a greater risk, because it could result in the destruction of neurons and the possibility of evolving towards a Ischemic Hypoxic Encephalopathy with long -term sequelae. This review highlights the most recent scientific aspects but at the same time it offers an essential margin of knowledge regarding pathophysiology, diagnosis and treatment, as well as offering a perspective on the future of clinical care of ischemic hypoxic encephalopathy.
Key words: hypoxia, ischemia, neonatal encephalopathy
e-mail: artorres@bu.edu
El diagnóstico de encefalopatía neonatal (EN), abarca un espectro de afecciones para referirse al síndrome de daño neurológico del recién nacido, que ocurre principalmente tras un proceso hipóxico-isquémico intraparto. Tiene repercusiones inmediatas (APGAR bajo, acidosis, alteración de la conciencia en el recién nacido, convulsiones, etc.) y a largo plazo (discapacidad intelectual, déficit de atención, conducta, etc.), de gravedad variable, desde un desarrollo neurológico normal hasta una mortalidad inminente; y multisistémica con insuficiencia respiratoria o cardiomiopatía 1, 2. Se estima que la incidencia de EN es de 3.0 por mil nacidos vivos (95% CI, 2.7-3.3) y para encefalopatía hipóxica isquémica (EHI) es 1.5 (95% CI, 1.3-1.7), de los cuales el 1.08 corresponde a EHI3. En Chile se estima que es aproximadamente de 4 a 6 por mil nacidos vivos 4.
Diversas modalidades de neuro-imagen como la ecografía, la tomografía computarizada, la resonancia
magnética, el electroencefalograma continuo con video regular o de amplitud integrada, tienen un gran valor diagnóstico y pronóstico cuando se realizan entre las 24 y 96 horas y a los 7 y 21 días de nacido respectivamente para identificar y caracterizar con precisión la gravedad, la extensión y la ubicación de la lesión cerebral 5-10.
El estudio de la EN y la EHI ha sido fundamental para el descubrimiento y desarrollo de nuevos protocolos, por ejemplo algunos estudios encontraron que el 64% de los casos de EN tuvieron episodios mayores de atención subóptima, correspondiendo al 75% de las muertes neonatales 11.
En la actualidad la hipotermia corporal es el tratamiento de elección para EIH 7-9, 12, con una reducción en el riesgo de muerte o discapacidad neurológica importante (riesgo relativo [RR], 0.76; IC 95%, 0.69-0.84) 13.
Fisiopatología
La encefalopatía hipóxica-isquémica ocurre a partir del déficit de oxígeno en el cerebro perinatal, provocando una deficiencia de energía, la isquemia es la más importante de estas dos formas de privación de oxígeno 1, 2, ya que el daño permanente sobre la célula nerviosa es desencadenado no solamente por deficiencia de oxígeno, sino también por el déficit de glucosa y otros nutrientes, alterando las acciones de glicolisis, ciclo de ácido nítrico, cadena de transporte de oxígeno, que funcionan en condiciones aerobias 1, 2, 7. Estas fallas generan daño mitocondrial, alteración de la integridad de la membrana celular que predispone al incremento de radicales libres, liberación de calcio intracelular, aminoácidos proinflamatorios, receptores de glutamato, que provocan un proceso de excitotoxicidad que concluirá en la apoptosis neuronal y muerte irreversible de la neurona 1, 2, 7.
Aunque las sustancias blanca y gris son afectadas tanto en neonatos a término como pretérmino, los progenitores oligodendrogliales son más vulnerables en neonatos pretérmino afectando la sustancia blanca, mientras que en neonatos a término la sustancia gris se ve mayormente afectada 1, 2, 14.
Encefalopatía del prematuro
La principal afección del prematuro es la leucomalacia periventricular que se manifiesta como una lesión mayor en la sustancia blanca y se define como una necrosis focal periventricular, asociada con una reacción gliosa difusa y activación de la microglia que rodea la sustancia blanca cerebral. Tras el evento hipóxico-isquémico, una serie de mecanismos favorecen la alteración de las funciones de progenitores oligodendrogliales y la subsecuente alteración en la mielinización. Es importante también
entender que concomitantemente ocurre un daño en la sustancia gris: 38% en el tálamo, 33% en el globo pálido e hipocampo y 29% en el núcleo dentado del cerebelo 15.
Presentación clínica
El Comité de Expertos del Colegio Americano de Obstetricia y Ginecología, respaldado por la Academia Americana de Pediatría6, usa criterios que han sido evaluados por diferentes estudios, reflejando la consistencia clínica en el momento de su aplicación 6. Estos son:
• Puntuación de Apgar < 5 a los 5 minutos y 10 minutos.
• Acidemia de la arteria umbilical fetal: arteria umbilical fetal, pH < 7.0, o déficit de la base ≥ 12 mmol/l, o ambos.
• Evidencia de lesión cerebral aguda observada en la resonancia magnética (RM), compatible con hipoxiaisquemia.
• Presencia de insuficiencia orgánica multisistémica, compatible con encefalopatía hipóxico-isquémica.
Gravedad
Los Criterios Modificados de Sarnat o de la Sociedad Iberoamericana de Neonatología, son herramientas importantes para la clasificación clínica de la gravedad, la cual serviría para ser usado en sala de partos y como guía terapéutica.
Manifestaciones multisistémicas
La respuesta fisiológica innata se manifiesta con una redistribución de flujo sanguíneo de órganos no vitales como la piel, a órganos de mayor importancia como el corazón y el cerebro. Dependiendo de la gravedad del cuadro, se puede evidenciar la falla de por lo menos un sistema u órgano adicional 8 tales como: insuficiencia respiratoria grave, asociado con sepsis, neumonía o síndrome de aspiración meconial, hipertensión pulmonar del recién nacido, lesión renal aguda, isquemia de miocardio, elevación de enzimas hepáticas y coagulación intravascular diseminada 3, 8, 11.
Evaluación diagnóstica
Sangre umbilical
El pH de la arteria umbilical de un recién nacido a término es de 7.27. En condiciones hipóxico-isquémicas el pH ≤ 7 y el déficit de base ≥ 12 mM, se asocian con incremento del riesgo de mortalidad por lesión neurológica. Algunos estudios sugieren que la variación de dos desviaciones estándar de los valores de pH es diagnóstica de acidemia fetal y este valor es necesario para admisión en Cuidados Intensivos Neonatales 6-8.
Imagen
La RM temprana, obtenida entre 24-96 horas de vida puede ser más sensible, mientras que una RM realizada a los 10 días de vida con una ventana aceptable entre 7 y 21 días de vida podría delinear mejor el grado de lesión cerebral 5-10.
La evidencia demuestra que la RM es superior a la tomografía computarizada, la cual proporciona una evaluación menos detallada de la lesión cerebral, pero es más sensible que la ecografía craneal para la hemorragia y anormalidades estructurales profundas del cerebro 16.
Ultrasonido cerebral
Se considera de menor valor diagnóstico y pronóstico, es altamente sensible (91%) y específico (81%) 5-8 para localizar hemorragias y evaluar el tamaño de los ventrículos, por ejemplo, se encontraron hallazgos ecográficos anormales del parénquima cerebral en 46.3% de recién nacidos con EHI leve, 96.7% con EHI moderada y 100% con EHI gravve 7, 17. Pese a estas ventajas, es una herramienta pobre en la evaluación de la sustancia blanca, área de especial interés en el estudio de la EHI, especialmente en prematuros.
Electroencefalografía
La electroencefalografía (EEG) se utiliza para determinar patrones correspondientes a convulsiones y su diferenciación con otros fenómenos. También permite establecer la gravedad del cuadro y su pronóstico. La supresión de actividad, el bajo voltaje y los trazados planos son predictores potenciales de muerte o deterioro del desarrollo neurológico 7, 18.
microARN (miARN)
Recientemente, los micro ARN (miARN) se han vuelto de interés para muchos investigadores debido a su
importante papel en el control postranscripcional y en la historia evolutiva. A pesar de esto, en los recién nacidos (RN) con EHI sigue siendo en gran parte desconocido debido a la limitada investigación en este campo, pero una mejor comprensión del papel de los miRNAs en la respuesta celular después de EHI aumentaría el éxito del diagnóstico, pronóstico y tratamiento efectivos de los recién nacidos 19.
Tratamiento
Hipotermia corporal terapéutica
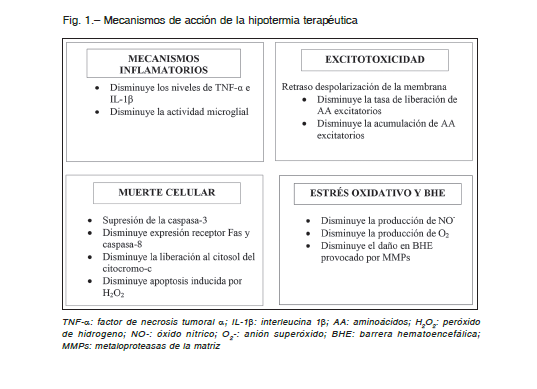
Su efecto es principalmente neuroprotector y está relacionado con la reducción del metabolismo cerebral, con un descenso del 5% por cada grado de temperatura, consiguiendo de esta forma modular y mitigar algunas de las rutas metabólicas lesivas desencadenadas tras la asfixia. Los mecanismos de acción sobre los cuales actúa la hipotermia se muestran en la Figura 1 9, 12, 20.
Criterios de inclusión
Los RN con: 1. Edad gestacional ≥ 36 semanas; 2. Edad postnatal ≤ 6 horas de vida; 3. Identificación de
un evento centinela; 4. pH de cordón o pH de sangre ≤ 7 y/o déficit de base ≥ -12 en la primera hora de vida; 5. Apgar ≤ 5 a los 10 minutos; 6. Reanimación con ventilación a presión positiva durante más de 10 minutos; 7. Evidencia de encefalopatía moderada a grave en el examen clínico 7, 9.
Criterios de exclusión
Los RN con: 1. Falta de evidencia de EHI o asfixia perinatal; 2. Peso al nacer < 1800 g; 3. Trastornos de la coagulación sanguínea, que no se corrigen con la administración de plaquetas, plasma o crioprecipitados; 4. Estado general o condición clínica grave, que cumpla con criterios de muerte cerebral, y se acuerda con los padres la futilidad del tratamiento 9.
Factor estimulante de la eritropoyesis
Se ha constatado la existencia del receptor de eritropoyetina (EPO) en progenitores neuroepiteliales del cerebro de embriones y fetos, el cual tiene la capacidad de estimular a dichos progenitores y prevenir su muerte. El uso tanto de la EPO como la EPO recombinante humana (rhEPO) es capaz de desarrollar una potente actividad antiapoptótica (favoreciendo la transcripción de genes Bcl-2 y Bcl-xL), así como antiinflamatoria y antioxidante. Además, es capaz de promover la neurogénesis, angiogénesis y la oligodendrogliosis en etapas tempranas y tardías tras un infarto neonatal 1, 20.
Células madre
El empleo de esta terapia en modelos de daño cerebral agudo pretende restaurar el tejido dañado a través de la formación de nuevas neuronas, vasos sanguíneos (angiogénesis) y mediante el fomento de la sinaptogénesis. Las células madre mesenquimales son multipotentes, con capacidad de diferenciarse hacia células de origen mesodérmico, como osteocitos, condrocitos, adipocitos, y también hacia neuronas y astrocitos 1,20.
Gases nobles
El xenón y el argón demostraron tener efectos neuroprotectores en modelos experimentales de EHI. Por su
parte, el xenón actúa como agente terapéutico debido a su capacidad de disminuir la excitotoxicidad mediante la modulación de los receptores N-metil D-aspartato (NMDA).
No se ha demostrado el efecto del argón en estudios clínicos hasta la fecha, pero ha mejorado los resultados de la hipotermia, respecto al biomarcador N-acetil-aspartato/lactato, el cual parece estar relacionado con un incremento de muerte cerebral y el desarrollo de secuelas neurológicas en el RN 20.
Melatonina
Esta neurohormona es capaz de incrementar el nivel de protección desarrollado por la hipotermia mediante la optimización del metabolismo energético cerebral. Algunos estudios determinaron una reducción en suero de superóxido dismutasa y óxido nítrico en sujetos tratados con melatonina e hipotermia frente a aquellos tratados únicamente con hipotermia, demostrando así, su efecto benéfico frente al estrés oxidativo 1, 20.
Alopurinol
Su efecto clínico radica en la inhibición de la enzima xantina oxidasa, implicada en el daño oxidativo, como quelante del hierro y de actuar como secuestrador de radicales hidroxilos 20.
Pronóstico
El pronóstico y gravedad de las secuelas neurológicas y neurodesarrollo a largo plazo en los RN diagnosticados de EHI dependen de su gravedad al momento del diagnóstico, las anormalidades encontradas en la RM y en el EEG y el uso de hipotermia terapéutica que permite una reducción en el riesgo de muerte o discapacidad neurológica importante ([RR], 0.76; IC 95%, 0.69-0.84) 13.
Aquellos RN diagnosticados con EHI leve tendrán un neurodesarrollo similar al de los RN a término y sanos 2,7.
Hasta el 80% de los RN con EHI grave desarrollan secuelas neurológicas graves, y el 20 % restante entre moderadas y leves. La tasa de mortalidad en este grupo es alta contemplando un 25 al 50% dentro de los primeros días tras el diagnóstico. Es importante recalcar que las muertes en este grupo son producidas por complicaciones secundarias (falla multiorgánica, sepsis, infecciones, neumonía por aspiración, etc.) al diagnóstico primario 2,7,9,13.
Conclusiones
La identificación oportuna de los signos clínicos y diagnósticos de la EIH en base a los últimos avances científicos, así como también la aplicación de terapia actualizada, son indispensables para el manejo integral de la enfermedad y su repercusión en el pronóstico del paciente.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Moral Y, Robertson NJ, Goñi-de-Cerio F, Alonso-Alconada D. Hipoxia-isquemia neonatal: bases celulares y moleculares del daño cerebral y modulación terapéutica de la neurogénesis. Rev Neurol 2019; 68: 23-36.
2. Douglas-Escobar M, Weiss MD. Hypoxic-ischemic encephalopathy: a review for the clinician. JAMA Pediatr
2015; 169: 397-403.
3. Kurinczuk JJ, White-Koning M, Badawi N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic
encephalopathy. Early Hum Dev 2010; 86: 329-38.
4. Novoa JM, Santos M, Latorre R, et al. ¿Es posible disminuir la incidencia de encefalopatía hipóxico isquémica? Rev Chil Obstet Ginecol 2017; 82: 51-7.
5. Liauw L. Hypoxic-ischaemic brain injury in young infants. Ann Acad Med Singapore 2009; 38: 788-94.
6. Executive summary: Neonatal encephalopathy and neurologic outcome, second edition. Report of the American College of Obstetricians and Gynecologists’ Task Force on Neonatal Encephalopathy. Obstet Gynecol 2014; 123:896-901.
7. Papazian O. Encefalopatía hipóxica-isquémica neonatal. Medicina (B Aires) 2018; 78 (Supl. II): 36-41.
8. Martinello K, Hart AR, Yap S, Mitra S, Robertson NJ. Management and investigation of neonatal encepha lopathy: 2017 uptodate. Arch Dis Child Fetal Neonatal Ed 2017; 102: F346-58.
9. Grupo de Trabajo Hipotermia Terapéutica, Comité de Estudios Feto-Neonatales (CEFEN). Recomendación
para el tratamiento con hipotermia en recién nacidos con encefalopatía hipóxico-isquémica. Resumen ejecutivo. Arch Argent Pediatr 2017; 115: s38-52.
10. Rana L, Sood D, Chauhan R, et al. MR Imaging of hypoxic ischemic encephalopathy- Distribution Patterns and ADC value correlations. Eur J Radiol Open 2018 16; 5:215-20.
11. Draper ES, Kurinczuk JJ, Lamming CR, Clarke M, James D, Field D. A confidential enquiry into cases of neonatal encephalopathy. Arch Dis Child Fetal Neonatal Ed 2002; 87: F176-80.
12. Adstamongkonkul D, Hess DC. Ischemic conditioning and neonatal hypoxic ischemic encephalopathy: a literature review. Cond Med 2017; 1: 9-16.
13. Tagin MA, Woolcott CG, Vincer MJ, et al. Hypothermia for neonatal hypoxic ischemic encephalopathy. Arch Pediatr Adolesc Med 2012; 166: 558-66.
14. Back SA, Luo NL, Borenstein NS, Levine JM, Volpe JJ, Kinney HC. Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury. J Neurosci 2001; 21: 1302-12.
15. Volpe JJ, Inder TE. Hypoxic-Ischemic and related disorders. In: Volpe JJ, eds. Hypoxic-Ischemic Injury in the Term Infants: Pathophysiology. Volpe’s Neurology of the Newborn, 6th ed. Philadelphia: Elsevier, 2017, p 485-500.
16. Barnette AR, Horbar JD, Soll RF, et al. Neuroimaging in the evaluation of neonatal encephalopathy. Pediatrics 2014; 133: e1508-17.
17. Guan B, Dai C, Zhang Y, et al. Early diagnosis and outcome prediction of neonatal hypoxic-ischemic encephalopathy with color Doppler ultrasound. Diagn Interv Imaging 2017; 98: 469-75.
18. Han Y, Fu N, Chen W, et al. Prognostic value of electroencephalography in hypothermia-treated neonates with hypoxic-ischemic encephalopathy: a meta-analysis. Pediatr Neurol 2019; 93: 3-10.
19. Ponnusamy V, Yip PK. The role of micro RNAs in newborn brain development and hypoxic ischemic encephalopathy. Neuropharmacology 2019; 1: 55-65.
20. Cánovas-Ahedo M, Alonso-Alconada D. Terapia combinada frente a la encefalopatía hipóxico-isquémica neonatal. An Pediatr (Barc) 2019; 91: 59. e1-59.e7.
