JORGE MALAGÓN VALDEZ
Clínica para la Atención del Neurodesarrollo, Universidad Autónoma de Aguascalientes, México
Resumen Se revisan dos de las principales enfermedades desmielinizantes en niños, la encefalomielitis aguda diseminada (EAD) y la esclerosis múltiple (EM). Por sus características fisiopatológicas, etiologías probables, manifestaciones clínicas, diagnóstico, tratamiento, pronóstico, evolución, así como alteraciones atípicas que complican su diagnóstico; cuanto más pequeño es el paciente se necesita estudiar más, antes de llegar al diagnóstico. El Grupo Internacional de Estudio de Esclerosis Múltiple Pediátrica publicó las definiciones operativas para enfermedades desmielinizantes adquiridas del sistema nervioso central: la EAD es monofásica, polisintomática y con encefalopatía. Su duración es de hasta 3 meses, con síntomas fluctuantes y hallazgos en resonancia magnética. La EM se define como síndrome aislado monofocal o polifocal, sin encefalopatía. Actualmente se consideran dos enfermedades diferentes y distinguibles desde el inicio de los síntomas.
Palabras clave: enfermedades desmielinizantes, encefalomielitis aguda diseminada, esclerosis múltiple, niñez
Abstract Demyelinizing diseases in children. Acute disseminated encephalomyelitis and multiple sclerosis. The two main demyelinating diseases in children are reviewed. Acute disseminated encephalomyelitis (ADEM) and multiple sclerosis (MS). For its physiopathological characteristics, probable etiologies, clinical manifestations, diagnosis, treatment, prognosis, evolution, as well as atypical alterations that complicate its diagnosis, the smaller the child is, more study is needed before reaching the diagnosis. The International Study Group of Multiple Pediatric Sclerosis, published the operating definitions for demyelinating diseases acquired from the central nervous system in children: the ADEM is monophasic, polysymptomatic and with encephalopathy. Its duration is up to 3 months, with fluctuating symptoms and magnetic resonance findings. MS is an isolated monofocal or polyfocal syndrome, without encephalopathy. Currently, two different and distinguishable diseases are considered from the onset of symptoms.
Key words: demyelinating diseases, acute disseminated encephalomyelitis, multiple sclerosis, childhood
e-mail: neuronags@hotmail.com
Las enfermedades desmielinizantes (ED) destruyen la mielina y el axón en grados variables lesionando la
sustancia blanca y, parcialmente, la sustancia gris. La etiología puede ser tóxica, vascular, infecciosa o inmunomediada, como en EAD y EM y otras como neuromielitis óptica, neuritis óptica y mielitis transversa aguda. Las que afectan a la mielina, que es anormal por trastorno no adquirido, alteran su producción o falla en su conservación por enfermedades metabólicas, inflamatorias o genéticas y se les llama dismielinizantes 1. Sin importantes para e diagnóstico la realización de una historia clínica con un buen interrogatorio y exploración física general y neurológica, así como el apoyo del laboratorio y en especial la resonancia magnética (RM).
En este trabajo se revisan los tratamientos establecidos y los que están en estudio, así como también los
aspectos conductuales, cognitivos y de rehabilitación.
Encefalomielitis aguda diseminada
La EAD se caracteriza por un primer ataque breve inflamatorio, afectando cerebro y médula espinal. Aparece frecuentemente luego de una infección viral como el herpes simple, mycoplasma, vacuna contra sarampión, paperas o rubeola. Es monofásica, predomina en meses frío y prevalece en prepúberes.
La enfermedad es inmumediada; lesiona agudamente la mielina, ganglios basales y sustancia gris cortical. No tiene marcadores biológicos, se diagnostica en base al cuadro clínico y hallazgos de neuroimágenes. No es claro si los anticuerpos séricos contra glucoproteína de mielina del oligodendrocito (anti-MOG) son indicadores veraces para el diagnóstico 2.
Los síntomas del EAD aparecen rápidamente. Se observan lesiones de la sustancia blanca y manifestaciones
neurológicas y clínica sugestiva de encefalitis, síntomas fluctuantes o nuevos hallazgos en la RM, se presenta en un episodio. La EM muy ocasionalmente se presenta con encefalitis. Es frecuente la confusión entre estas entidades debido a su similitud en varios aspectos 3.
La EAD es más frecuente en niños que la EM. Un líquido cefalorraquídeo (LCR) anormal no sugiere meningoencefalitis y pueden encontrarse valorares elevados de citoquina, similares a los encontrados en la EM. Puede no haber bandas oligoclonales (BOC) y la PCR es negativa 4.
En electroencefalograma presenta ondas lentas generalizadas y difusas, ocasionalmente hay foco de puntas
de predominio parieto-temporal.
La tomografía axial computarizada cerebral es de poca utilidad, siendo la RM muy importante para su diagnóstico. Se observan lesiones desmielinizantes en un mismo estadio, grandes, múltiples y asimétricas (Fig. 1). Generalmente se presentan en la unión sustancia gris-blanca bilateral, cerebelo, tallo cerebral, tálamo, en ganglios basales simétricos y sustancia blanca periventricular bilateral. La aparición de lesiones cerebrales múltiples obliga a ampliar el estudio a nivel medular 5.
Para su tratamiento se utilizan esteroides, en promedio durante dos semanas, también metilprednisolona,
inmunoglobulina o terapia mixta de inmunoglobulina más esteroides en casos graves. Pueden presentarse crisis epilépticas y en ese caso se tratan con antiepilépticos. La rehabilitación es importante y el pronóstico favorable, con buena recuperación. Algunos casos evolucionan a EM 6.
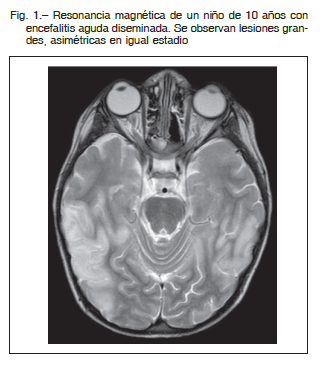
Esclerosis múltiple
La EM es una enfermedad crónica autoinmune e inflamatoria, manifestada por síntomas diseminados en tiempo y espacio. Representa un 5% de todos los casos de EM.
El diagnóstico es un reto por la variabilidad clínica y baja incidencia. En niños, el 10% manifiestan sus primeros síntomas antes de los 18 años. Antes de los 12 años predomina en las niñas 1.2 a 1, en mayores de 12 años es de 2.8 a 1. La forma más común es recaída-remitente 7.
Se ha visto que la combinación de factores virales y genéticos determina su presencia. Los criterios diagnósticos se han modificado por cambios en el conocimiento de la fisiopatología, aparición de nuevas tecnologías y la necesidad de un diagnóstico temprano y preciso. Se utilizan en la clínica los criterios de McDonald y los de Callen. En la RM da mayor sensibilidad 8, lo que permite iniciar tratamiento de problemas físicos y cognitivos para modificar su evolución y calidad de vida.
No hay suficientes estudios para diferenciar la presentación en el niño y el adulto. Hallazgos histopatológicos en la biopsia cerebral y estudios postmortem muestran desmielinización inflamatoria, macrófagos/microglia perivasculares en la lesión, células B raras y daño axonal limitado 9.
No hay un autoantígeno desencadenante inmunológico, se piensa que las células T juegan un papel importante en la inflamación debido a la mayor respuesta de las células T periféricas a varios antígenos propios. Se ha relacionado a anticuerpos séricos anti-MOG y a la proteína básica anti-mielínica (PBM) 10.
La inflamación cerebral en el niño se halla en múltiples sitios y en plena maduración, activa sobre todo en el sistema nervioso e inmunológico. Hay un aumento significativo de seropositividad del virus de Epstein-Barr comparativamente con controles 11. No está asociada la edad al momento de la toma de sangre, sexo, raza, etnia y estado del antígeno leucocitario humano (HLA-DRB1), que son genes encargados de la respuesta inmunológica y se ha demostrado que pacientes con HLA-DRB1 positivos a una infección con herpes simple-1 disminuye el riesgo en un 90%; contrariamente, si es negativo aumenta cuatro veces el riesgo de EM. Se ha involucrado a interleucina 1b y receptor de interleucina 1, para genes antagonistas y gen receptor 12.
Las vacunas como la de hepatitis B aumentan el riesgo después de 3 años, también se ha relacionado con exposición al tabaco en forma pasiva y activa, aumentando el riesgo de un primer episodio más del doble si se prolonga por ≥ 10 años. La vitamina D se relaciona con la prevención de recaídas; se desconoce si es por susceptibilidad o bajos niveles que predisponen a presentarlas 13.
La variabilidad clínica inicial provoca confusión por hallazgos sutiles, como cambios sensoriales o síntomas leves, más en pequeños, por limitación de su concepto corporal. El diagnóstico de EM se basa en la clínica, respaldado por LCR, RM y la exclusión de otras ED pediátricas.
Las manifestaciones clínicas son similares a las del adulto, como pérdida visual, parestesias, debilidad, ataxia, diplopía o síntomas urinarios y no se presenta encefalopatía.
Es de inicio monofocal y los síntomas del ataque se localizan en un área del sistema nervioso central en
un 90%. En menores de 10 años puede afectarse el tallo cerebral y presentar déficits polifocales. Los criterios de McDonald son de utilidad para diagnosticar el primer ataque entre EM y EAD. Pueden presentar cefalea, fiebre, vómito, letargo, alteraciones mentales y ocasionalmente crisis convulsivas 9, 14. Por tal motivo se deben estudiar otras posibilidades antes del diagnóstico definitivo.
No son raras las recidivas agudas y dan nuevas manifestaciones neurológicas en cerebro y médula espinal
que pueden durar más de 24 horas, sin fiebre o con otras enfermedades. Las recidivas tempranas son frecuentes en niños y se recuperan satisfactoriamente sin presentar discapacidad física acumulativa en los primeros 10 años de la enfermedad. En lesiones del tallo cerebral hay pobre recuperación y con posibilidad de presentar discapacidad física en el futuro.
El perfil del LCR varía según la edad, los leucocitos pueden ser normales con linfocitosis. Sin embargo, niños menores de 11 años tienen más neutrófilos que los mayores, sugiriendo una inflamación crónica. Las bandas oligoclonales (BOC) están presentes hasta en el 92% de los casos, menos frecuentes en niños pequeños, 43% contra un 63% en adolescentes. Se puede observar que si hay BOC positivas seguirán desarrollando EM.
Los anticuerpos anti-MOG y proteína básica de mielina pueden están presentes en la mayoría de los casos. El índice de IgG está elevado en el 68% de los adolescentes > 11 años, pero no en menores, por lo que depende de la edad y no de la duración de la enfermedad. Este perfil de IgG y celular es distinto en niños más pequeños y desaparece al repetir el LCR después de 18 meses, esto sugiere un fenómeno inmunológico transitorio 15.
La RM cerebral es el estudio ideal para el diagnóstico y posterior tratamiento. En ocasiones pueden presentarse discordancias entre las lesiones de la RM y la clínica.
Los niños tienen menos focos cerebrales en RM T2 y lesiones más grandes que los adultos. Al inicio de la
enfermedad hay lesiones con bordes mal definidos y confluentes en vías visuales, tallo cerebral y cerebelo (Fig. 2).
La RM en niños con un mes de evolución y un evento desmielinizante tiene un 81% de sensibilidad y 95% de
especificidad según dos de los siguientes criterios:
1) Ausencia de un patrón de lesión en T2 hiperintenso bilateral difuso
2) Presencia de “agujeros negros” en T1
3) Presencia de 2 o más focos periventriculares hiperintensos T2
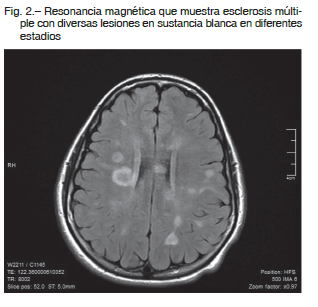
Las lesiones periventriculares de la materia blanca no son específicas de la EM, se observan en otras ED del sistema nervioso central, como la neuromielitis óptica 16.
Los potenciales evocados visuales prolongados pueden indicar una desmielinización asintomática de los nervios ópticos. Se debe tener precaución en los niños pequeños, ya que los resultados dependen en gran medida de la atención.
Las terapias de primera línea aprobadas para el tratamiento de la EM recurrente y remitente en adultos son acetato de glatiramer, interferon beta-1a, interferón-beta-1b, fingolimod, teriflunomida y dimetil fumarato. Las terapias de segunda línea son mitoxantrona, alemtuzumab, natalizumab y ocrelizumab. Además, se han evaluado terapias con rituximab y ciclofosfamida 17.
Fingolimod fue el único aprobado a través de la comparación con interferón-beta-1a en el estudio PARADIGMS 17 en niños de 10 años o más en presentación oral, modifica la enfermedad recurrente y remitente y reduce la tasa anualizada de lesiones. La teriflunomida y el dimetil fumarato están investigándose en niños con EM debido a sus efectos secundarios.
El interferón-beta-1a y 1b parecen ser seguros y bien tolerados en niños, hay porcentaje de suspensión alta y los efectos secundarios son comunes, hasta 65% presenta gripe, leucopenia, trombocitopenia, anemia, elevación transitoria de transaminasas y las reacciones en el lugar de inyección son comunes.
La dosis de interferón no está establecida en pediatría.
Los niños pequeños toleran dosis proporcionales, siguiendo protocolos de adultos o titulación gradual una a tres veces por semana para interferón-beta-1a. Los mayores de 10 años toleran dosis completas de interferón-beta-1b. Puede existir una tolerancia reducida en la población más joven 18.
En cuanto al acetato de glatiramer, hay pocas publicaciones del uso en pediatría. Es en general bien tolerado, excepto por reacciones en el lugar de la inyección y el dolor torácico raro y transitorio. La tasa media de recaída anualizada disminuye con el tratamiento 19.
En lo referente a inmunomoduladores y citotóxicos, el uso de interferón beta y fingolimod, modificadores de primera línea, se han utilizado en niños con éxito. Cuando no hay respuesta se utilizan ocasionalmente inmunomoduladores como el natalizumab que es bien tolerado. Hay poca experiencia con el uso de mitoxantrona. Algunos casos seguidos por el Grupo Internacional de Estudio de Esclerosis Múltiple Pediátrica sugieren precaución al usarla debido a los efectos secundarios como leucemia y cardiomiopatía. En los pocos casos en los que se utilizó rituximab, fue exitoso. Hay mínima experiencia con ciclofosfamida, se debe tener precaución por riesgos de infertilidad y neoplasias secundarias.
En los casos de recaídas, se sugiere tratamiento con metilprednisolona IV 30 mg/kg/día por 5 días, si no hay respuesta se recomienda la plasmaféresis por 1 semana en días alternos, con ciclofosfamida 2 mg/kg/día oral por la semana 20.
Con relación al pronóstico, las complicaciones psicosociales son importantes y se refieren a preocupaciones acerca del futuro, problemas en la familia, en la escuela, trastornos del estado de ánimo y deterioro cognitivo.
Cerca del 48% de niños con EM tienen trastornos afectivos como depresión, ansiedad, pánico, bipolaridad y de adaptación. Presentan fatiga, deterioro cognitivo en memoria, atención compleja, comprensión verbal y
funcionamiento ejecutivo. El deterioro cognitivo es por períodos cortos, en edad escolar se detecta por bajo rendimiento. Un porcentaje alto requiere de ayuda o una escuela especial y 14% son educados en el hogar. Si la enfermedad se inicia temprano los cocientes de inteligencia son más bajos 21.
La discapacidad física cuantificada por la escala de Kurtzke es menor en niños que en adultos, incluso cuando se ajustan para la duración de la enfermedad. La rehabilitación tiene un papel importante en el tratamiento integral de estos pacientes y debe darse educación en cuanto a la atención de la vejiga y los intestinos.
En casos de espasticidad, se recomienda tratamiento farmacológico con baclofeno, tizanidina o benzodiacepinas por vía oral, a dosis que no ocasionen sedación, aunado a la terapia física. A pesar de un desarrollo más lento de discapacidad irreversible, estos pacientes se enfrentan a la progresión de la enfermedad y los déficits neurológicos 10 años antes que la población mayor, al llegar a la edad adulta se iguala en relación a las secuelas. Lo ideal es tener familia y entrar en la fuerza laboral.
Agradecimientos: Mi agradecimiento especial a la Dra. María Elena Cuevas Díaz por su apoyo en la revisión final del escrito.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Kalb R. Pediatric multiple sclerosis and other demyelinating disorders in childhood. En: https://www.msif.org/wpcontent/uploads/2016/08/Pediatric-MS-and-other-demyelinating-disorders-in-childhood-English.pdf; consultado junio 2019
2. Pohl D, Alper G, Van Haren K, et al. Acute disseminated encephalomyelitis: Updates on an inflammatory CNS syndrome. Neurology 2016; 87(9 Suppl 2): S38-45.
3. Koelman DL, Mateen FJ. Acute disseminated encephalomyelitis: current controversies in diagnosis and outcome. J Neurol 2015; 262: 2013-24.
4. Leake JA, Albani S, Kao AS, et al. Acute disseminated encephalomyelitis in childhood: epidemiologic, clinical and laboratory features. Pediatr Infect Dis J 2004; 23: 756-64.
5. Cácereres F. Encefalomielitis diseminada aguda. En: https://radiodiagnosticando.com/2015/12/27/encefalomielitis-diseminada-aguda-emda/; consultado junio 2019.
6. Menge T, Hemmer B, Nessler S, et al. Accute disseminated encephalomyelitis: an update. Arch Neurol 2005; 62: 1673-80.
7. Jeong A, Oleske DM, Holman J. Epidemiology of pediatric-onset multiples sclerosis: a systematic review of the literature. J Child Neurol 2019. doi: 10.1177/0883073819845827. [Epub ahead of print]
8. Ketelslegers IA, Neuteboom RF, Boon M, Catsman-Berrevoets CE, Hintzen RQ; Dutch Pediatric MS Study Group. A comparison of MRI criteria for diagnosing pediatric ADEM and MS. Neurology 2010; 4: 1412-5.
9. Kuhlmann T, Ludwin S, Prat A, Antel J, Brück W, Lassmann H. An update histological classification system for multiple sclerosis lesions. Acta Neuropathol 2017; 133: 13-24.
10. Menge T, Lalive PH, H, von Büdingen C, Genain CP. Conformational epitopes of myelin oligodendrocyte glycoprotein are targets of potentially pathogenic antibody responses in multiple sclerosis. J Neuroinflammation 2011; 8: 161.
11. Pohl D, Krone B, Rostasy K, et al. Seroprevalence of Epstein-Barr virus in children with multiple sclerosis. Neurology 2006; 67: 2063-5.
12. Waubant E, Mowry EM, Krupp L, et al. Antibody response to common viruses and human leukocyte antigen-DRB1 in pediatric multiple sclerosis. Mult Scler 2013; 19: 891-5.
13. Graves JS, Barcellos LF, Krupp L, et al. Vitamin D genes influence MS relapses in children. Mult Scler 2019. doi: 10.1177/1352458519845842. [Epub ahead of print]
14. Krupp LB, Tardieu M, Amato MP, et al. International Pediatric Multiple Sclerosis Study Group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders: revisions to the 2007 definitions. Mult Scler 2013; 19: 1261-7.
15. Bar-Or A, Hintzen RQ, Dale RC, Rostasy K, Brück W, Chitnis T. Immunopathophysiology of pediatric CNS inflammatory demyelinating diseases. Neurology 2016; 87 (Supplement 2): S12-9.
16. Callen DJ, Shroff MM, Branson HM, et al. MRI in the diagnosis of pediatric multiple sclerosis. Neurology 2009; 72: 961-7.
17. Chitnis T, Arnold DL, Banwell B, et al. Trial of fingolimod versus interferon beta-1a in pediatric multiple sclerosis. N Engl J Med 2018; 379:1017-27.
18. Chitnis T, Tenembaum S, Banwell B, et al. Consensus statement: evaluation of new and existing therapeutics for pediatric multiple sclerosis. Mult Scler 2012; 18: 116-27.
19. Komek B, Bernert G, Balassy C, Geldner J, Prayer D, Feucht M. Glatiramer acetate treatment in patients with childhood and juvenile onset multiple sclerosis. Neuropediatrics 2003; 34:120-6.
20. Savransky A. Enfermedades desmielinizantes. Medicina (B Aires) 2018; 78 Suppl 2: 75-81.
21. Glanz BI, Dégano IR, Rintell DJ, Chitnis T, Weiner HL, Healy BC. Work productivity in relapsing multiple sclerosis: associations with disability, depression, fatigue, anxiety, cognition, and health-related quality of life. Value Health 2012; 15:1029-35.
