SANTIAGO G. PIGRETTI1, MATÍAS J. ALET1, CARLOS E. MAMANI2, CLAUDIA ALONZO5, MARTÍN AGUILAR3, HÉCTOR J. ÁLVAREZ4, SEBASTIÁN AMERISO1, MARÍA G. ANDRADE2, FLORENCIA ARCONDO2, CRISTIAN ARMENTEROS2, JOSÉ ARROYO4, RICARDO BEIGELMAN5, PABLO BONARDO1, MARÍA BRES BULLRICH5, CECILIA CABELLO6, GONZALO CAMARGO7, SEBASTIÁN CAMERLINGO2, ROLANDO CÁRDENAS8, HERNÁN CHÁVES3, CELINA CIARDI1, NICOLAS CIARROCHI4, JUAN CIRIO1, SANTIAGO CLAVERIE1, PEDRO COLLA MACHADO1, MARCELO COSTILLA4, MARÍA F. DÍAZ4, 5, DAIANA DOSSI1, MARÍA ESTRELLA GIMENEZ4, FABIANA GIBER6, MAIA GÓMEZ SCHNEIDER1, LEONARDO GONZÁLEZ1, ALEJANDRO HLAVNIKA4, PABLO IOLI1, CRISTIAN F. ISAAC1, ANDRÉS IZAGUIRRE5, FRANCISCO KLEIN4 PABLO KUSCHNER2, DAMIÁN LERMAN4, ROSSANA LÓPEZ4, VICTORIA MARQUEVICH4, JUAN C. MIRANDA8, MARGARITA MURGIERI6, ANDREA ODZAK2, PERLA PAHNKE4, GABRIEL PERSI1, 5, JOSÉ PIZZORNO2, JAVIER POLLAN2, VIRGINIA PUJOL LEREIS1, FLAVIO REQUEJO9, LAURA ROBLED6, JULIETA ROSALES1, ROMINA RUBIN6, RODRIGO SABIO2, VIRGINIA TEJADA JACOB1, LEANDRO TUMINO4, PASCUAL VALDEZ2, WALTER VIDETTA4, ANDRÉS VILELA2, VÍCTOR VILLAROEL SAAVEDRA1, MARTÍN WINKEL2, MARIA C. ZURRÚ1, 4, 5
1Sociedad Neurológica Argentina, 2 Sociedad Argentina de Medicina, 3 Sociedad Argentina de Radiología, 4 Sociedad Argentina de Terapia Intensiva, 5 Sociedad Argentina de Cardiología, 6 Sociedad Argentina de Geriatría y Gerontología, 7 Sociedad Argentina de Emergencias, 8 Colegio Argentino de Neurointervencionismo, 9 Asociación Argentina de Neurocirujanos
Resumen El accidente cerebrovascular es la tercera causa de muerte y la primera de discapacidad en la
Argentina. Los eventos isquémicos constituyen el 80% de los casos. Los accidentes vasculares cerebrales requieren la implementación de protocolos sistematizados que permitan reducir los tiempos en la atención, la morbilidad y mortalidad. En el consenso participaron especialistas de nueve sociedades médicas relacionadas con la atención de pacientes con enfermedad cerebrovascular. Se consensuó un temario separado en capítulos y para la redacción de los mismos se conformaron grupos de trabajo con miembros de diferentes especialidades médicas. Se discutió y acordó para cada tema el nivel de recomendación en base a la mejor evidencia clínica disponible para cada tópico. Se realizó una adaptación al ámbito local de las recomendaciones cuando se consideró necesario. El sistema de la American Heart Association se utilizó para redactar las recomendaciones y su grado de evidencia. La corrección y edición fue realizada por cinco revisores externos, que no participaron en la redacción y con amplia experiencia en enfermedad vascular. Finalizado el documento preliminar, se organizó una reunión general con todos los integrantes de los grupos de trabajo y los revisores para redactar las recomendaciones definitivas. El consenso abarca la atención del paciente con accidente cerebrovascular isquémico en la fase pre-hospitalaria, evaluación inicial en la central de emergencias, terapias de recanalización (trombolisis y/o trombectomía mecánica), craniectomía descompresiva, neuroimágenes y cuidados clínicos en la internación.
Palabras clave: accidente cerebrovascular, infarto cerebral, procedimientos endovasculares, infusiones, intraarterial, neuroimagen, stents, terapéutica
Glosario de abreviaturas ACM: arteria cerebral media; ACV: accidente cerebrovascular; ACVi: accidente cerebrovascular isquémico; AIT: accidente isquémico transitorio; ASPECTS: Alberta Program Early CT Score; DWI: difusión por resonancia magnética; ECG: electrocardiograma; ETE: eco-Doppler transesofágico; ETT: eco-Doppler transtorácico; FA: fibrilación auricular; FIM: Medida de Independencia Funcional; HBPM: heparinas de bajo peso molecular; HIC: hemorragia intracerebral; HNF: heparina no fraccionada; HTA: hipertensión arterial; IV: intravenoso; mRS: Escala de Rankin Modificada; mTICI: Modified Thrombolysis in cerebral Infarction score; NIHSS: Escala de ACV de Institutos de Salud de Estados Unidos de América; NNT: número necesario a tratar; OGVC: oclusión de gran vaso cerebral; RIN: relación internacional normatizada; RM: resonancia magnética; rtPA: activador tisular del plasminógeno; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TC: tomografía computada; TEV: tratamiento endovascular; TM: trombectomía mecánica; TVP: trombosis venosa profunda; UACV: Unidad de Accidente Cerebrovascular
Abstract Stroke is the third cause of death and the first cause of disability in Argentina. Ischemic events constitute 80% of cases. It requires the implementation of systematized protocols that allow reducing the time of care, morbidity and mortality. Specialists from nine medical societies related to the care of patients with cerebrovascular disease participated in the consensus. A separate agenda was agreed upon in chapters and for the writing of them, work groups were formed with members of different medical specialties. The level of recommendation was discussed and agreed upon for each topic based on the best clinical evidence available for each of them. An adaptation to the local scope of the recommendations
was made when it was considered necessary.The American Heart Association system was used to draft the recommendations and their level of evidence. The correction and editing were done by five external reviewers, who did not participate in the writing and with extensive experience in vascular pathology. Once the preliminary document was finalized, a general meeting was held with all the members of the working groups and the reviewers to reach final recommendations. The consensus covers the management of ischemic stroke in the pre-hospital phase, initial evaluation in the emergency center, recanalization therapies (thrombolysis and/or mechanical thrombectomy), decompressive craniectomy, neuroimaging and clinical care in the hospital.
Key words: stroke, cerebral infaction, endovascular procedures, infusions, intra-arterial, neuroimaging, stents, therapeutics
e-mail: spigretti@gmail.com
El accidente cerebrovascular (ACV) es la principal causa de discapacidad y la cuarta causa de muerte en países desarrollados 1. Si bien existe un incremento en la carga global de esta enfermedad, el uso de programas de formación y la optimización del tratamiento agudo han demostrado ser eficaces en la reducción de morbimortalidad en los últimos años 2. Nuestro objetivo es acercar a médicos involucrados en la atención inicial del ACV una guía actualizada formulada por diferentes especialistas en atención del ACV isquémico (ACVi) agudo. Para la confección de este consenso se siguieron las recomendaciones World Stroke Organization Stroke Guideline Development Handbook 3. Se convocó a representantes de diferentes sociedades médicas involucradas en la atención del ACVi. Las sociedades participantes fueron:
Sociedad Neurológica Argentina (SNA), Sociedad Argentina de Cardiología (SAC), Sociedad Argentina de Terapia Intensiva (SATI), Sociedad Argentina de Medicina (SAM), Sociedad Argentina de Emergencias (SAE), Colegio Argentino de Neurointervencionitas (CANI), Asociación Argentina de Neurocirujanos (AANC), Sociedad Argentina de Radiología (SAR) y Sociedad Argentina de Geriatría y Gerontología (SAGG). Todos los miembros son especialistas en esta enfermedad por su práctica clínica o su orientación a la investigación en este tema.
Se consensuó un temario separado en capítulos y para cada uno de ellos se conformaron grupos de trabajo con miembros de diferentes especialidades médicas. En cada grupo se designó un secretario, un director y personas encargadas de redacción. La redacción de cada capítulo se basó en preguntas guía a responder, formuladas por el grupo de trabajo. Se discutió y consensuó para cada tema el nivel de recomendación en base a la información preexistente. Se adoptó la información relevante a nuestro contexto. Para la obtención bibliográfica se realizó una búsqueda sistematizada en PubMed, seleccionándose como límites de búsqueda a guías o consensos nacionales con una antigüedad no mayor a cinco años, en español o inglés. En tópicos donde no existen guías previas se seleccionaron artículos de trascendencia, según la opinión de expertos.
Las recomendaciones y grados de evidencia fueron basadas en el sistema American Heart Association. La corrección y edición fue realizada por cinco revisores externos, que no participaron en la redacción y con amplia experiencia en consensos y enfermedad vascular. Finalizado el documento preliminar, se convocó una reunión general con todos los integrantes de los grupos de trabajo y los revisores para consensuar recomendaciones.
Situación epidemiológica del accidente cerebro vascular isquémico en Argentina
El aumento y envejecimiento de la población y la evidencia de que la frecuencia de eventos cerebrovasculares en los países en desarrollo es particularmente elevada, muestran la necesidad de información epidemiológica en nuestra región 4, 5. Los datos epidemiológicos de la enfermedad cerebrovascular son escasos en Argentina y Latinoamérica, con estudios basados y no basados en población 6-10. En los últimos años nuevos estudios han aportado información valiosa sobre la incidencia y prevalencia de esta enfermedad, incluso con diferenciación de tipo de ACV y tasas estandarizadas a la población 11, 12.
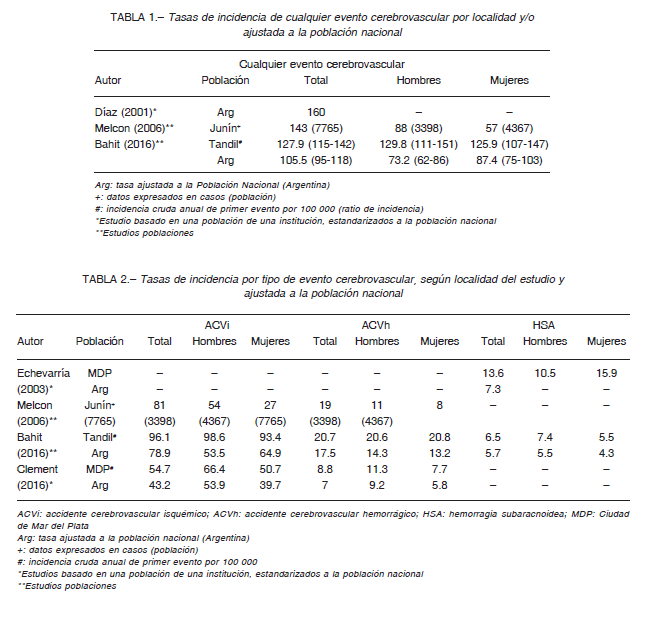
En un estudio realizado en la ciudad de Junín, provincia de Buenos Aires, se observó una prevalencia de 868 casos por cada 100.000 habitantes/año. En base a ello, se estimó una prevalencia global de 473 casos por cada 100 000 habitantes/año. Esta prevalencia aumenta con la edad 11. Un estudio más reciente, realizado en la ciudad de Tandil, provincia de Buenos Aires, halló una incidencia para primer ACVi estandarizado para la población argentina de 78.9 casos por cada 100 000 habitantes/año (56.1/100 000, extrapolado a la población mundial) 12. En un estudio de la ciudad de Mar del Plata, provincia de Buenos Aires, la tasa bruta ajustada a la población nacional en mayores de 21 años, fue de 43.2 (IC 95%: 42-44) para ACVi por cada 100 000 habitantes/año, y del 7 (IC 95%: 6.6-5.8) para ACV hemorrágico (datos no publicados).
En un trabajo previo, en la misma ciudad, se halló una incidencia ajustada a la población nacional de 7.3 cada 100 000 habitantes/año para hemorragia subaracnoidea 10.
En otra investigación del mismo centro, se informó una tasa ajustada a la población nacional para cualquier tipo de ACV, de 160 por cada 100 000 habitantes/año 9.
Un estudio epidemiológico realizado recientemente en la Ciudad de General Villegas, Buenos Aires, halló una prevalencia del 2% de ACV en personas mayores de 40 años, siendo la cuarta causa de mortalidad en esta población (publicación pendiente).
En la Tabla 1 se muestran las tasas por ciudad (Junín y Tandil) y ajustadas a la población argentina para cualquier tipo de ACV, con datos por sexo en dos de ellas. En la Tabla 2 se incluye el detalle de incidencia bruta y ajustada por localidad y a la población nacional argentina total y por sexos. En todos los casos se registró el primer evento. La seguridad del tratamiento con rtPA (activador tisular del plasminógeno) en nuestro país fue evaluada en la ciudad de Jujuy, evidenciando una tasa de mortalidad de aproximadamente un 50% en comparación a la registrada en los no tratados 13. Sin embargo, el tratamiento específico del ACVi con rtPA en nuestro medio es muy bajo. En el registro ARENAS (Argentina, Registro Nacional de Stroke) se observó que en hospitales privados solo el 1.2% de los pacientes con ACVi recibían tratamiento trombolítico.
Si bien no se cuenta aún con datos actualizados, está en curso el estudio ARENAS 2 para el nuevo relevamiento de esta información 14.
Según el estudio ReNACer (Registro Nacional de Accidentes Cerebrovasculares), la mortalidad intrahospitalaria por ACV fue del 9.1%, con una diferencia significativa en la mortalidad entre centros académicos y no académicos
(7.1% vs. 10.6%, p < 0.01) 15. Por otra parte, no existe un relevamiento de unidades especializadas en ACV (UACV), que permita estimar su número en todo el país. De hecho, a pesar de contar con una recomendación sólida a nivel mundial y nacional por parte de diferentes organizaciones científicas, no existe en Argentina ninguna exigencia de estas unidades en centros de alta complejidad por parte del estado. Sin embargo, en Buenos Aires, la presencia de una UACV en un hospital público ha mostrado que reduce significativamente los días de internación de los pacientes (promedio 7 vs. 23 días, p = 0.001) 16.
Otro aspecto epidemiológico de interés es la proporción y distribución nacional de neurólogos, dado que esto repercute directamente en aspectos cruciales de atención, tratamiento y prevención de las enfermedades cerebrovasculares.
En Argentina se estima que de la población médica, menos del 1% son neurólogos (1 neurólogo cada 116 médicos) de lo que se infiriere que hay aproximadamente 2.9 neurólogos cada 100 000 habitantes, con una distribución muy heterogénea. Por ejemplo, la Ciudad Autónoma de Buenos Aires posee el 31% de los neurólogos, mientras que en la provincia de Entre Ríos es de 0.8%, representando el 7.7% y 3.2% de la población del país respectivamente 17.
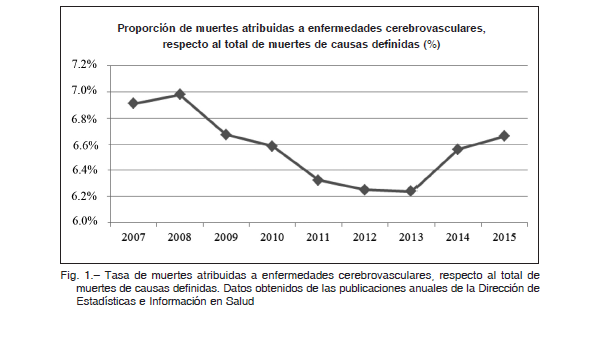
Según los datos publicados en 2016 por la Dirección de Estadísticas e Información en Salud, la primera causa de muerte está dada por el grupo conformado por las enfermedades del sistema circulatorio, (incluido el ACV), representando el 31% de las causas de muerte definidas. Específicamente, las muertes por eventos cerebrovasculares (sin diferenciar causas isquémicas de hemorrágicas), ocupa el cuarto lugar luego de los tumores, las enfermedades del sistema respiratorio y las
enfermedades cardiológicas (enfermedades isquémicas del corazón e insuficiencia cardíaca). En 2015 se produjeron 20 911 muertes por eventos cerebrovasculares, lo que representa aproximadamente el 6.7% del total de defunciones de causas definidas (Fig. 1) 18.
Unidad de accidente cerebrovascular:
concepto
La unidad de accidente cerebrovascular (UACV) es una modalidad de atención especializada en enfermedad cerebrovascular, conformada por un equipo multidisciplinario, organizado y protocolizado para la rápida evaluación y tratamiento del paciente con sospecha de ACV agudo. Incluye personal médico, enfermería, radiología, kinesiólogos, fonoaudiólogos, técnicos de laboratorio y nutricionistas.
Sus principales fortalezas son la comunicación fluida y el trabajo en equipo. La UACV es una fuerte recomendación de las principales sociedades científicas para el cuidado del paciente 19. Se demostró que los beneficios de tratar a un paciente en una UACV son comparables al beneficio del rtPA en el tratamiento agudo del ACV y perduran por años 20, además de ser costo-efectivos 21.
Aquellos centros que poseen esta atención especializada demostraron una disminución de la mortalidad y discapacidad del 40% 20, mayor tasa de utilización de rtPA, disminución del tiempo de estadía hospitalaria, aumento de egresos hospitalarios al hogar, mayor recuperación de la independencia funcional, movilización más temprana y menor tasa de complicaciones infecciosas y trombosis venosa profunda (TVP). Dichos beneficios se extienden a todos independientemente del género, edad, comorbilidad y gravedad del evento 1, 20-22. La organización de una UACV permite disminuir el tiempo del tratamiento
del ACV agudo (tiempo ingreso-contacto al médico, tiempo puerta-tomografía y tiempo puerta-aguja), una mejor tasa de profilaxis de TVP o de evaluación de la deglución.
– Se recomienda conformar unidades de ACV (Clase I, Nivel de evidencia A) y el uso de normas estandarizadas para la atención del paciente con ACV (Clase I, Nivel de evidencia B)
Conducta prehospitalaria
Es el conjunto de acciones desde el momento en que se genera el pedido de auxilio de la comunidad hasta el posible arribo al efector de salud con la capacidad y complejidad adecuadas. Considerando que por cada minuto que se demora en en la atención del ACVi se pierde la misma cantidad de neuronas que las correspondientes a entre 3 y 6 años de envejecimiento, resulta claro que la rapidez constituye un rasgo fundamental de la conducta pre-hospitalario 23.
Existen algunas recomendaciones generales para ser llevadas a cabo por los efectores del sistema de emergencias que se resumen en la Tabla 3 1, 19, 24-26. Algunas comunidades incorporaron en las últimas décadas la UACV móvil para llevas a cabo las acciones pre-hospitalarias.
Distintos estudios sugieren que su implementación acortaría el tiempo entre el comienzo de los síntomas y la terapia fibrinolítica, en comparación con el uso de la ambulancia convencional 27, 28. Por otra parte, parece razonable recurrir a esta estrategia de salud pública en centros urbanos densamente poblados, pero no es una opción costo-efectiva en sitios rurales.
Escalas pre-hospitalarias para valoración de ACV
La aplicación de una herramienta diagnóstica objetiva para ACV facilita la tarea inicial y colabora con la notificación pre-arribo 29, 30. Existen escalas pre-hospitalarias para uso del personal de salud que contribuyen a orientar acerca de los signos probables de ACV isquémico. Las más utilizadas son la Escala Pre-hospitalaria de Los Ángeles (LAPS) 1, 19, 29 y la Escala Pre-hospitalaria para Stroke de Cincinnati (CPSS) 19, 30 (ver Anexo).
Derivación del paciente con ACVi agudo
Ante la sospecha de ACVi, se recomienda la derivación temprana a un centro primario de atención de ACV (entendido como aquel que cuente con tomografía computada, posibilidad de administrar trombolisis sistémica y un médico entrenado en la administración de dicho tratamiento) o bien a un centro integral de neurología vascular (entendido como aquel que cuente con un equipo interdisciplinario conformado por médicos especialistas en Neurología, medicina de Emergencias, Medicina Interna, Diagnóstico por Imágenes, Neurocirugía y Neurointervencionismo, Enfermería, Bioquímica y Radiología, capaz de administrar trombolisis sistémica y tratamiento endovascular).
Se recomienda:
– Que la conducta pre-hospitalaria se inicie inmediatamente, aplicando un protocolo pre-establecido tendiente a evaluar la estabilidad clínica del paciente y establecer los medios para un traslado rápido y seguro (Clase I, Nivel de evidencia B)
– Realizar programas de entrenamiento al personal, contar con protocolos de traslado que incluyan límites de tiempo y la pre-notificación al centro receptor (Clase I, Nivel de evidencia B)
– Derivación a centros regionales que puedan administrar el tratamiento inicial endovenoso y centros capaces de realizar el tratamiento endovascular con rápida comunicación entre dichos establecimientos (Clase I, Nivel de evidencia A)

– Utilización de una herramienta objetiva, de sencillo aprendizaje y de aplicación rápida por el sistema responsable en la emergencia médica, entre ellas Cincinnati Prehospital Stroke Scale y Los Angeles Prehospital Stroke Screen (Clase I, Nivel de evidencia B)
Triage
El triage corresponde al conjunto sistemático de decisiones y acciones tendientes a priorizar las necesidades de los pacientes asistidos con el fin de destinarlos a la atención correspondiente en el menor tiempo posible. Entre sus objetivos se destacan brindar el recurso sanitario apropiado y la identificación de signos de inestabilidad 31, 32.
Elementos prioritarios y tiempo durante el triage
Los ingresados en el departamento de emergencias con sospecha de ACV requieren ser atendidos rápidamente.
Todo el personal sanitario debe estar capacitado para reconocer signos y síntomas de un ACV 33. La realización del triage hospitalario no debería demorar más de 5 minutos y podría ser hecho por personal de enfermería entrenado. Ante la sospecha de ACV se activa el sistema correspondiente, siendo recomendable que no supere los 10 minutos y que permita la evaluación por el equipo especializado en ACV no más allá de los 15 minutos desde la admisión 33-35.
Es relevante un interrogatorio dirigido a documentar:
– La hora de inicio de los síntomas
– El uso de medicamentos previos
– La existencia de antecedentes médicos (como factores de riesgo para aterosclerosis y enfermedad cardíaca, o historias de abuso de drogas, migraña, convulsiones, infección, trauma o embarazo) 24, 33.
Los datos históricos relacionados son importantes, dado que determinan la elegibilidad para intervenciones terapéuticas posteriores en el ACVi.
En ACVi se define como ventana terapéutica al período comprendido entre el inicio de los síntomas neurológicos y el tiempo máximo en que el tratamiento de reperfusión puede ser realizado. Uno de los objetivos primarios es reestablecer la irrigación del tejido comprometido. Determinar con precisión el tiempo de inicio de los síntomas neurológicos, o bien la última hora en que fue visto asintomático, constituye un dato fundamental 33. El personal de emergencias debe interrogar a los testigos o familiares, ya que la hora de inicio puede ser aportada por ellos.
Cuando el paciente es incapaz de ofrecer esta información (evento ocurrido durante el sueño, o en vigilia, por afasia o deterioro del sensorio) y no hay testigos, se considera que el comienzo es incierto, por lo tanto se toma como inicio para la ventana terapéutica la última vez que fue visto asintomático. Alrededor del 30% de los casos de ACV isquémico presentan un comienzo incierto y en 2/3 de ellos los defectos neurológicos aparecen al despertar (“wake up stroke”). En ciertas ocasiones, los síntomas son precedidos por otros similares con resolución posterior, lo que se conoce como accidente isquémico transitorio (AIT). Para diagnosticar un AIT es necesario que los síntomas sean transitorios y las imágenes negativas para isquemia aguda.
Aplicación de los sistemas y escalas de triage
Ante la sospecha de ACVi deben considerarse tres posibilidades en relación a la aplicación de los parámetros de triage. En primer lugar, en los pacientes trasladados por el sistema de emergencias médicas, resulta recomendable la aplicación en campo de las escalas mencionadas en el apartado anterior, en segundo lugar, aquellos internados en un centro hospitalario que presentan un déficit neurológico agudo, independientemente del motivo de internación, y finalmente, se destacan aquellos traídos por acompañantes o testigos. Estos podrían ser valorados con escalas de triage de uso intra-hospitalario, entre los que se mencionan el Manchester Triage System (MTS) 36, el Canadian emergency department triage and acuity scale (CTAS) 1, 37, el Sistema español de triage, el Índice de Severidad en la Emergencia (ESI) 38, 39 y el Australasian triage scale (ATS; con categoría 1-2 o rojo naranja) 32, 40.
La escala MTS, una de las más utilizadas en Europa y Norteamérica, es un método de priorización de pacientes, de aprendizaje fácil y ejecución rápida (entre 1 y 1.5 minutos), válido para adultos y niños y que permite definir circuitos de prioridad de tratamiento (Tabla 4) 41. Un estudio reciente mostró validez de buena a moderada del MTS en la población general 42, 43.
Existen estrategias de actuación destinadas al equipo de emergencias, entre las que destaca el “Triage Stroke Code”, programa de capacitación que se activa ante la aparición de los siguientes criterios: debilidad aguda de cualquier extremidad, ausencia de hipoglucemia o convulsión e inicio de los síntomas en las últimas 3 horas. El intervalo al tratamiento se redujo significativamente cuando se activó “Triage Stroke Code” (media: 58.7 minutos versus 86.9 minutos, p < 0.0001), facilitando el proceso de tratamiento del ACVi 44.

– Se recomienda la instauración de un protocolo para la evaluación de emergencia ante la sospecha de ACV (Clase I, Nivel de evidencia B). Se aconseja que los pacientes con sospecha de ACVi pasibles de ser tratados con terapia de reperfusión sean evaluados mediante la activación de un código de ACV (Clase I, Nivel de evidencia B)
Conducta inicial en el servicio de emergencias
El tratamiento agudo del ACV está dirigido fundamentalmente a salvar la penumbra isquémica. Este tejido no funcionante es potencialmente viable si se restituye el flujo sanguíneo dentro de cierto lapso. La penumbra se reduce minuto a minuto, dando paso a un infarto cerebral consolidado e irreversible, este proceso solo se puede detener si la intervención temprana es oportuna y adecuada.
Ésta se basa en dos principios básicos: reperfundir el vaso ocluido y aumentar el flujo colateral 19, 45, 46. Para la evaluación y estabilización inmediata se sugiere seguir los lineamientos ABCDE: permeabilidad de la vía aérea, respiración-ventilación, circulación y déficit neurológico, en virtud del orden de riesgo vital 1.
A. Vía aérea permeable; B. Mantenimiento de la ventilación y respiración
– Monitoreo continuo de la frecuencia respiratoria y de la saturación arterial de oxígeno 19
– Colocar oxígeno suplementario si presenta saturación arterial de oxígeno < 94% 19
– Evaluar requerimiento de intubación según Score de Coma Glasgow = 8 puntos y colocación de sonda nasogástrica
C. Circulación: Valores a tener en cuenta
– Control estricto de la frecuencia cardíaca y de la presión arterial (PA límite 185/110 mmHg en los que van a ser sometidos a trombolisis mientras que se acepta PA límite 220/110 mmHg a los que no sean candidatos a dicho tratamiento) 19, 45, 46
– Colocación de 2 vías periféricas de preferencia en región antero-cubital en brazo no parético
– Monitoreo continuo del ritmo cardíaco 1
– Realizar ECG, aunque no debe retrasar la neuroimagen 1, 17, 33, 40-42
– Comenzar hidratación con soluciones osmóticas al 0.9% 1 manteniendo la euvolemia. No se recomienda la administración de soluciones glucosadas en los no hipoglucémicos
– Prueba de glucemia por punción digital con tira reactiva 19, 45, 46, con corrección inmediata de la hipoglucemia ( < 60 mg/dl) o de la hiperglucemia, sugiriéndose atención en las primeras 24 horas con objetivo entre 140-180 mg/dl 48
– Laboratorio con recuento de plaquetas, glucemia, urea, creatinina, ionograma, coagulograma, marcadores de isquemia cardíaca (troponina) 1, 19, 33, 45-47. En relación a los gases arteriales, solo será realizada en vasos que puedan ser compresibles (arterias radial o pedia)
– Control estricto de la temperatura 1, recibiendo tratamiento si es superior a 37.5 °C5. La hipotermia terapéutica no tiene evidencia para su uso en esta enfermedad
– “Nada por boca”, inicialmente hasta la evaluación de la deglución por técnica validada como parte del tratamiento inicial 1
– El uso de catéteres uretrales permanentes debe ser evitado debido al riesgo de infecciones del tracto urinario 1
– Posición semisentada o cabecera a 30° en pacientes con riesgo de broncoaspiración y posición a 0° en aquellos sin hipoxemia ni riesgo de aspiración
D. Neurología: Grado de compromiso
– Evaluación neurológica completa con la escala de NIHSS (National Institutes of Health Stroke Scale) 19, 45-47
– La crisis sintomática aguda (definida como aquella que sucede dentro de los primeros siete días luego del ACVi) debe ser tratada con anticonvulsivantes de vida media corta (por ejemplo, lorazepam endovenoso) 1. En caso de haber iniciado mantenimiento, se sugiere discontinuarlo a partir de los 7 a 10 días
– No se recomienda la profilaxis anticonvulsiva 1
El examen general debe orientarse a la detección de cuadros que pueden representar una contraindicación absoluta o relativa para el empleo de trombolíticos (por ejemplo, hematomas, petequias o gingivorragia que sugieran coagulopatía o empleo de anticoagulantes; ruidos cardíacos hipofonéticos o inaudibles, que puede orientar a taponamiento cardíaco y potencial hemopericardio; cefalohematomas, otorraquia, rinorraquia, signo de ojos de mapache, entre otros, como evidencia de trauma craneoencefálico grave reciente). En una evaluación posterior (que no debería retrasar la potencial administración de rtPA) se pueden detectar signos que orienten al mecanismo subyacente del ACV (pulso desigual e irregular se correspondería con FA o flutter auricular; soplos carotídeos en relación a posible enfermedad de gran vaso; soplos cardíacos graves que sugieran valvulopatía, particularmente estenosis aórtica o enfermedad mitral; estigmas de uso de drogas endovenosas, signos de embolias sistémicas) 49.
Finalmente, tanto el examen como el interrogatorio deben descartar la posibilidad de que el déficit neurológico se deba a una condición que no sea un ACV (los denominados “cuadros simuladores de ACV” o “stroke mimics”). Si bien la evidencia sugiere que trombolizar en estos casos es una práctica segura (aunque ineficaz), la tasa de trombolizados es un indicador de la calidad del funcionamiento de la UACV 49. Los “cuadros simuladores” más frecuentes son convulsiones, migraña y cuadros conversivos. Merece mención aparte un tipo particular de “cuadro simulador”, la hipoglucemia. Aunque relativamente infrecuente, esta condición puede descartarse rápidamente mediante la determinación de glucemia capilar, y requiere tratamiento inmediato dado que la hipoglucemia sostenida puede generar secuelas neurológicas graves.
La “hora de oro” en la evaluación y tratamiento del ACVi
En el año 2003, el NINDS (Instituto Nacional de Trastornos Neurológicos y ACV de Estados Unidos) estableció como objetivo de calidad la denominada “cadena de supervivencia del ACV”, dando origen al concepto de la “hora de oro” 49, 50, que aboga por un tiempo puerta-aguja (P-A) de menos de 60 minutos. El tiempo puerta-aguja es el lapso entre el ingreso a la institución y el inicio de la infusión de rtPA. Una menor demora en la iniciación del tratamiento trombolítico redunda en un mayor beneficio clínico. Según una revisión, el número necesario a tratar (NNT) fue de 3.6 cuando el tratamiento se administró dentro de la primer hora y media de iniciados los síntomas, mientras que el mismo aumenta a 5.9 cuando el tratamiento inició entre las 3 y 4.5 horas de evolución del ACV 54. Por tanto, los procesos de estandarización y optimización de la atención temprana y eficaz del ACVi se hallan orientados a reducir el daño cerebral. El mismo consenso propuso los siguientes objetivos de tiempo para diferentes hitos del proceso diagnóstico-terapéutico: dentro de los primeros 10 minutos el paciente debe tener una evaluación inicial por el equipo médico del departamento de urgencias.
Antes de los 15 minutos ya debe haber sido evaluado por parte del equipo de ACV. La tomografía computada (TC) cerebral diagnóstica debe haber iniciado antes de los 25 minutos, y la misma interpretada para el minuto 45.
A esta altura la decisión de administrar rtPA ya debería haber sido tomada y el inicio del tratamiento trombolítico, marcado por la administración del bolo endovenoso, debería realizarse antes del minuto 60 49.
Se recomienda:
– Utilizar los lineamientos ABCD para la estabilización inicial de paciente (Clase I, Nivel de evidencia B)
– Uso de la escala NIHSS para evaluación clínica neurológica estandarizada del ACVi (Clase I, Nivel de evidencia B)
– La hipoglucemia debe ser descartada y tratada en la evaluación inicial de todo paciente con ACVi (Clase I, Nivel de evidencia C)
– Redactar protocolos institucionales de atención del ACVi orientados a alcanzar un tiempo puerta-aguja menor a 60 minutos en más del 50% de los casos (Clase I, Nivel de evidencia B).
– Sería razonable establecer un tiempo puerta-aguja menor a los 45 minutos optimizando protocolos (Clase IIb, Nivel de evidencia C)
Escalas (ver Anexo)
Numerosas publicaciones recomiendan la utilización de una escala estandarizada en la evaluación del examen físico a fin de documentar posibles déficits y su gravedad 1, 19, 50. Las dos escalas recomendadas son la Escala NIHSS y la Escala Neurológica Canadiense. La NIHSS ha sido validada en nuestro idioma y es la más ampliamente utilizada 51-53.
Escala de ACV de Institutos de Salud de Estados Unidos de América (NIHSS)
Esta escala se basa en la puntuación de acuerdo al nivel de gravedad de un conjunto de signos y síntomas evaluados. Consta 11 de ítems (el ítem 1 se divide en 3 sub-ítems y los ítems 5 y 6 en dos) y en cada uno de ellos a mayor gravedad presenta mayor puntuación. El rango total oscila entre los 0 y 42 puntos. Se considera habitualmente que una puntuación menor a 5 indica un ACV menor, en cambio una puntuación mayor a 20, un ACV extenso. La puntuación se correlaciona con el volumen del infarto en la TC 53.
El NIHSS inicial constituye un método de evaluación válido, reproducible y con fuerte predicción de mortalidad y funcionalidad tanto a corto como a largo plazo 19, 54-58.
Esta escala puede además contribuir a la localización de la oclusión arterial. Dado que facilita la comunicación entre los integrantes del equipo de salud su aceptación es amplia; incluso en las consultas por telemedicina, donde se recomienda el entrenamiento para su uso 59.
Numerosos estudios demostraron que la gravedad inicial del ACVi medido por el NIHSS es el factor predictor de mortalidad dominante 54, 55, 60. Valores elevados del NIHSS se asocian con oclusión de vasos mayores y dependencia funcional a los tres meses, aun si son tratados con terapia trombolítica 61-64. Este grado de vinculación entre la puntuación de la escala NIHSS y la posibilidad de la oclusión arterial conlleva importantes consecuencias en la toma de decisión de terapias fibrinolítica y/o tratamiento endovascular (TEV). Si bien algunos autores establecen una diferenciación de acuerdo a la gravedad, no existe un acuerdo general sobre los valores de corte establecidos, a lo que se agrega la falta de evidencia que demuestre su utilidad para la modificación en la toma de conducta terapéutica 61. Por otra parte, debe recordarse la expansión de criterios de inclusión para la terapia fibrinolítica que propone la incorporación de pacientes con puntuaciones bajas de la escala NIHSS 19, 65.
La escala de NIHSS es utilizada por entidades regulatorias como herramienta de criterio para la administración de rtPA endovenoso, siendo además uno de los parámetros fundamentales para la medición de la respuesta temprana a la terapéutica, el monitoreo del tratamiento y el control de potenciales complicaciones 1, 66-69. Entre los puntos débiles, se encuentran la infravaloración de síntomas secundarios a compromiso de tronco encefálico, cerebelo y hemisferio derecho por sobre el izquierdo; además, podría desestimar pacientes con síntomas aislados y con importante discapacidad, como la afasia, hemianopsia o monoplejías, asignándoles puntuaciones bajas 70.
Otras escalas de utilidad en ACV isquémico
Se encuentran disponibles otras escalas para la estratificación del riesgo, como Stroke Predictive Risk Score (iSCORE), Stroke Prognostication using Age and NIHSS (SPAN 100), SEDAN (escala de riesgo de hemorragia intracerebral sintomática), Safe Implementation of Treatments in Stroke-Intracerebral Hemorrhage score (SITS-ICH) y Hemorrhage After Thrombolysis (HAT) score, entre otras 71-75. La escala de colateralidad tomográfica (CTA score) ha demostrado ser pronostica en relación al volumen final y gravedad clínica del infarto 76. Sin embargo, estas escalas no fueron creadas para la toma de decisiones sobre una terapéutica específica, sino que se emplean para comprender el riesgo de posibles complicaciones.
Podrían tener influencia para decidir terapias en un futuro, en base a los aportes desde la investigación clínica.
Escala ABCD2
El riesgo de ACV posterior a la instauración de un AIT debe ser categorizado. El riesgo individual puede establecerse mediante la implementación de la escala ABCD y ABCD2 77, 78. Estas escalas utilizan datos demográficos y clínicos; la última es la más utilizada en la actualidad.
Esta herramienta evalúa el riesgo de recurrencia de los déficits neurológicos a las 48 horas, el cual oscila desde el 1% (bajo riesgo) hasta el 8.1% (alto riesgo). Los valores resultantes podrían orientar diferentes conductas, si bien existen discusiones en cuanto a su utilidad en la práctica clínica 5, 79, 80. Entre las debilidades que presenta pueden mencionarse la relación que existe entre valores bajos y la presencia de lesiones con restricción en difusión de la resonancia magnética (RM). Puntuaciones bajas en presencia de lesiones en difusión conllevan un riesgo incrementado de padecer un ACV, así como las puntuaciones altas sin lesiones no lo incrementan significativamente 81.
A su vez, esta escala no contempla la fibrilación auricular (FA) y la existencia de estenosis carotidea sintomática como variables de riesgo 80.
Alberta Program Early CT Score (ASPECTS)
Esta escala está desarrollada para identificar cambios tempranos en el territorio de la arteria cerebral media (ACM) y su aplicación se recomienda para la interpretación inicial de la TC 82. Permite identificar pacientes con menor riesgo de complicaciones ante la administración de rtPA endovenoso, a la vez que es útil en la selección de candidatos para trombectomía mecánica 1, 65, 66, 83, 84.
Analiza dos cortes tomográficos, uno a nivel ganglionar y otro supraganglionar, y divide el territorio de la ACM en diez áreas anatómicas. Partiendo de un valor normal de 10, cada área con hipodensidad resta puntaje al valor inicial relacionando valores mayores de la escala con menor extensión de la lesión 82. Esta escala también puede utilizarse en la secuencia difusión-RM. Entre las debilidades que presenta se encuentran su limitación a la circulación anterior, la escasa correlación con el volumen del ACV según la localización y carecer de un valor de corte claramente definido para delimitar un peor pronóstico funcional y/o baja respuesta a la terapéutica de reperfusión 85.
Si bien la evidencia actual no es suficiente para establecer un punto de corte vinculado a la relación costo beneficio, se reconoce como un factor pronóstico de respuesta a trombolisis intravenosa una puntuación de ASPECTS mayor a 765. En diferentes estudios de trombectomía mecánica se relacionaron valores altos de la escala con mejor pronóstico a la terapéutica, por lo que se recomienda un punto de corte mayor a 6 para una mejor costo-efectividad del procedimiento 83, 84, 86, 87. Es necesario interpretar los valores de esta escala en los pacientes con ACVi juntamente con otras herramientas, como el CTA colateral score y el DWI ASPECTS 65. Por último, cabe mencionar que se desarrolló el pc-ASPECTS, que evalúa infartos en el territorio vascular posterior, con un sistema de puntuación similar.
Escalas funcionales
Las dos escalas más utilizadas en ensayos clínicos para evaluación funcional, la medición del los efectos de los tratamientos implementados e incluso orientar la rehabilitación, son el Índice de Barthel y la Escala de Rankin Modificada (mRS).
El Índice de Barthel es una escala que mide 10 aspectos básicos del autocuidado y las actividades diarias; con un valor normal de 100 y valores por debajo que miden diferentes grados de discapacidad 88-90. Su puntuación se realiza por medio de la observación y el interrogatorio. Esta escala es útil en el control de la evolución de los pacientes en rehabilitación, no así en el evento agudo 35, 91.
La escala mRS es la más utilizada para evaluar la discapacidad de los pacientes con ACV y como herramienta para el diseño de investigación 92, 93. Define 7 grados, donde 0 es asintomático, 5 es discapacidad grave y 6 es muerte. Para su medición es necesario ajustarse a una serie de reglas, a fin de que los resultados tengan validez. La variabilidad entre observadores representa un obstáculo frecuente para su aplicación 94.
Se recomienda:
– El empleo cotidiano de la escala NIHSS para atención y seguimiento del paciente con ACVi (Clase I, Nivel de evidencia B)
– La realización de la escala de ABCD2 en la estratificación de riesgo de recurrencia luego de un AIT (Clase IIb, Nivel de evidencia B)
– Utilización de una escala para el análisis de las neuroimágenes en agudo como el ASPECTS (Clase I, Nivel de evidencia B)
– Uso de la escala de mRS como herramienta apropiada para la determinación del estado funcional previo del paciente y para su seguimiento (Clase IIa, Nivel de evidencia A)
– Uso del Índice de Barthel en el seguimiento funcional (Clase IIb, Nivel de evidencia B)
Estudios complementarios
Estudios durante la emergencia
Es importante tener presente que, al constituir la terapia fibrinolítica una prioridad en el ACVi agudo, la realización del laboratorio y estudios complementarios o la espera de sus resultados no deben retrasar la implementación del tratamiento 1, 19, 24, 95.
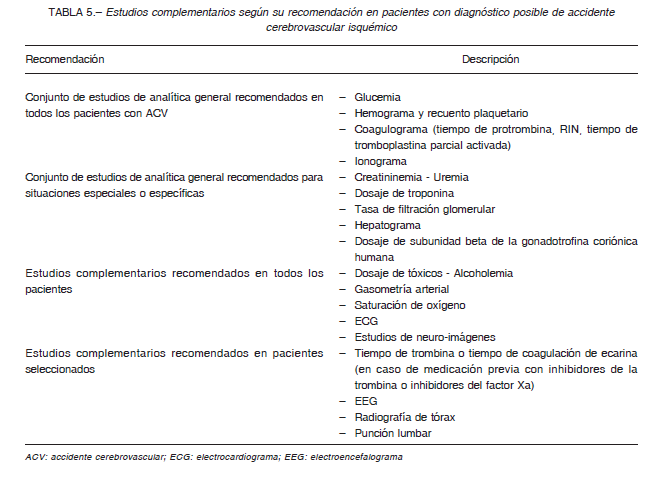
Diferentes guías concuerdan en realizar un conjunto determinado de estudios de analítica clínica en todo paciente con diagnóstico presuntivo de ACVi 1, 19, 24, 95.
Dichos estudios son la determinación de la glucemia, hemograma, coagulograma, ionograma, creatininemia, dosaje de troponina y tasa de calculada de filtración glomerular (Tabla 5). En el caso de los tratados con inhibidores directos de la trombina (dabigatrán), el tiempo de trombina constituye un indicador sensible para evaluar su actividad. Un valor normal de esta medición excluye la presencia de actividad significativa del fármaco; sin embargo, su prolongación puede ser influenciada por el uso de otros anticoagulantes. El tiempo de coagulación de ecarina muestra una relación linear con los niveles de los inhibidores de la trombina, por lo que también es de utilidad sin el inconveniente de estar condicionado por el uso simultáneo de otros anticoagulantes. El principal inconveniente está determinado, al igual que los ensayos aplicados para la medición de la actividad Xa, por la escasa disponibilidad de estas mediciones en los centros hospitalarios
En un 5-34% de los pacientes se presentan elevaciones de los marcadores cardíacos, teniendo implicancias pronosticas. La elevación de la troponina T está asociada con la gravedad del ACV y el riesgo de mortalidad, así como peor desenlace clínico. Este marcador de isquemia cardíaca es preferible a la creatina fosfoquinasa (dímero MB) por poseer mayor sensibilidad y especificidad 19, 24.
Según la sospecha clínica particular, serán de utilidad otros estudios de laboratorio. Entre ellos pueden mencionarse el hepatograma, el dosaje de subunidad beta de la gonadotrofina coriónica humana para diagnóstico de embarazo, el dosaje de tóxicos en orina y la gasometría arterial (Tabla 5) 24.
El beneficio diagnóstico del examen del líquido cefalorraquídeo es limitado para el ACVi, y se debe tener en cuenta en el caso que exista una sospecha fundamentada de hemorragia subaracnoidea no documentada en imágenes o de infección del sistema nervioso central.
Ante la existencia o sospecha de convulsiones como manifestación clínica del ACVi, se sugiere la realización de electroencefalograma 19, 24. La realización de un ECG de 12 derivaciones en conjunto con el dosaje de enzimas cardíacas (troponina) permite la identificación de isquemia miocárdica o arritmias.
La radiografía de tórax es discutible en ausencia de sospecha clínica y no debe retrasar la administración de rtPA endovenoso, pudiéndose realizar luego del tratamiento 1,19.
Se recomienda, en todos los casos:
– Obtener la determinación de glucemia previa a la administración de rtPA endovenoso (Clase I, Nivel de evidencia B)
– Realizar un conjunto limitado de estudios de laboratorio en el momento inicial. Aguardar el resultado de alguno de ellos, previo a la administración de rtPA, quedando a criterio del médico tratante según sospecha en cada caso (Clase I, Nivel de evidencia B)
– Un ECG, sin demorar el inicio de rtPA endovenoso (Clase I, Nivel de evidencia B)
– Dosaje basal de troponina, lo cual no debe demorar el inicio de rtPA endovenoso (Clase I, Nivel de evidencia B)
– Que la radiografía de tórax no demore el inicio de rtPA endovenoso, salvo sospecha de afección cardíaca o pulmonar que justifique su obtención (Clase IIb, Nivel de evidencia B)
Estudio etiológico durante la internación
Ninguno de los estudios referidos a continuación debe realizarse con urgencia, y menos aún retrasar la administración de rtPA endovenoso.
Doppler transcraneal
El Doppler transcraneal se utiliza para evaluar oclusiones y estenosis intracraneales proximales. Su validez diagnóstica es menor a la de la angio-tomografía y angio-resonancia en la enfermedad esteno-oclusiva intracraneana. Puede detectar señales microembólicas que se observan en enfermedad estenótica extracraneal o embolismo cardíaco. También se utiliza para monitorizar la terapia fibrinolítica. El estudio CLOTBUST mostró una mejoría de recanalización del vaso con el uso simultáneo del Doppler transcraneal continuo, pero no una mejoría clínica significativa 1, 19. El uso de la sonotrombolisis como terapia coadyuvante a la trombolisis actualmente no está recomendado 48. Es también una herramienta confiable para evaluar el suministro de colaterales en oclusiones de la arteria carótida interna 96, sin embargo, su utilidad está limitada en aquellos con malas ventanas óseas y su precisión depende de la experiencia del operador y la anatomía vascular del paciente.
Eco-Doppler transtorácico y transesofágico
Las guías referentes a adultos con AIT y ACVi mencionan la necesidad del estudio etiológico cardiovascular durante la hospitalización. Se utilizan el eco-Doppler transtorácico (ETT), eco-Doppler transesofágico (ETE) y eco-Doppler de vasos de cuello, entre otros 1, 97. No todos utilizan los mismos parámetros para niveles de evidencia y grados de recomendación, por lo que este consenso intenta unificar dichos conceptos.
Se recomienda:
– Que los estudios solicitados para establecer las causas del ACV se realicen de forma precoz, pero no deben retrasar el tratamiento general y específico (Clase I, Nivel de evidencia C)
– El estudio de fuentes potenciales de embolias de la aorta proximal y cardíacas (Clase I, Nivel de evidencia C)
– ETE para determinar con mayor exactitud afección en la aorta proximal (Clase I, Nivel de evidencia C)
– ETT o ETE para la evaluación de las cámaras cardíacas (la elección de uno u otro procedimiento dependerá de las características clínicas del paciente y de la disponibilidad) (Clase I, Nivel de evidencia C)
Es importante tener en cuenta a la endocarditis infecciosa como causa de ACV embólico y el rol de la ultrasonografía cardíaca en el diagnóstico y conducta terapéutica. Las guías europeas de 2007 mencionan conceptos que pueden ser de orientación en estos casos 98.
Se recomienda:
– ETT como imagen inicial ante la sospecha de endocarditis infecciosa (Clase I, Nivel de evidencia B)
– ETE ante la sospecha de endocarditis infecciosa y ETT normal (Clase I, Nivel de evidencia B)
Eco-Doppler de vasos de cuello
El riesgo de recurrencia luego de un ACVi es alto en pacientes con estenosis carotideas superiores al 70%, por lo que los estudios vasculares correspondientes debieran ser realizados en la primera semana 19, 95.
– Se recomienda eco-Doppler carotideo y vertebral para la evaluación de los vasos de cuello (Clase I, Nivel de evidencia A)
– Ante el hallazgo de una estenosis carotidea superior al 70%, se sugiere confirmar el grado de oclusión con un segundo método no invasivo (Clase IIa, Nivel de evidencia B)
Neuroimágenes
Tomografía computada
La TC sin contraste suele ser suficiente en la evaluación de los pacientes con un probable ACVi agudo. Aporta información acerca de la presencia o no de tejido isquémico, la localización y tamaño de la isquemia, su distribución vascular y la presencia o no de sangrado 99. También permite descartar causas no vasculares de síntomas neurológicos.
En pacientes con compromiso de la ACM, se pueden observar signos tempranos de isquemia en aproximadamente el 60% de los casos dentro de las 2 horas del inicio de los síntomas y más del 80% de los casos dentro de las 6 horas 100, 101. También es importante determinar la extensión de la isquemia ya que a mayor territorio vascular comprometido, mayor es el riesgo de transformación hemorrágica. Se recomienda no administrar tratamiento si la extensión del ACV, visualizado como hipodensidad franca, supera al tercio del territorio de la ACM 102. Para estas evaluaciones se necesita entrenamiento y algunas escalas como el ASPECTS pueden ayudar a una determinación de la extensión más precisa 103, 104.
Una de las limitaciones de la TC es su baja sensibilidad para la detección de pequeñas lesiones isquémicas, sobre todo si se asientan sobre la fosa posterior 105. Hay diversos signos radiológicos que pueden ser de utilidad cuando se evalúa la TC sin contraste. Entre los signos precoces que suelen observarse se menciona la pérdida de diferenciación entre la sustancia gris y la blanca, ya sea en los ganglios basales (oscurecimiento lenticular), en la ínsula con falta de diferenciación cortico-subcortical (ribete insular) o sobre la convexidad (ribete cortical) 106, 107. También pueden observarse signos que sugieran la presencia de un trombo intraarterial cuando se observa hiperdensidad sobre el segmento M1 de la arteria cerebral media (signo de la cuerda) o en un ramo de la misma en la fisura silviana (signo del punto) 108, 109.
Durante la evaluación inicial, se recomienda la toma de imágenes vasculares intracraneales no invasivas en aquellos pacientes en los que se contempla un tratamiento de trombectomía mecánica. Estos estudios por imágenes deben hacerse ser lo más rápido posible, sin demorar el comienzo de la administración del rtPA endovenoso. La angiografía por TC puede ser utilizada para la determinación del estado de la vasculatura intracraneal y extracraneal, dando información sobre estenosis y oclusiones arteriales. La exactitud de este estudio para la determinación de oclusión de grandes vasos intracraneales es muy alta, alcanzando la sensibilidad y especificidad cercanas a la de la angiografía digital 110.
No existe un acuerdo respecto a la estrategia en la utilización de imágenes vasculares (angiografía digital, angiografía por TC o angiografía por RM), por lo que la elección debe basarse principalmente en la preferencia del médico tratante. Si bien la obtención de imágenes de angiografía por RM incrementa el tiempo de estudio, esto no afecta negativamente el pronóstico clínico de los pacientes 111, 112.
La perfusión por TC, con el cálculo de los volúmenes del centro necrótico y penumbra del infarto, es una técnica a ser considerada en los pacientes en los que se evalúa la administración de tratamiento de reperfusión pasado el tiempo de ventana terapéutica 113, 114. Estas técnicas aportan información adicional, sobre todo del tejido potencialmente salvable (en penumbra), que pueden mejorar la toma de decisiones. Sin embargo, hay que considerar que la adquisición conlleva una mayor irradiación, administración de contraste endovenoso y tiempos más prolongados de adquisición e interpretación de las imágenes.
Si bien existe consenso respecto a la utilización de la TC en el ACV agudo, determinado principalmente por su alta sensibilidad y especificidad en la detección de hemorragias intracraneanas, algunos centros optan por la RM como primer paso en el algoritmo diagnóstico cuando hay sospecha de ACV, basándose principalmente en la utilidad de la secuencia de difusión y gradiente de eco 115.
Resonancia magnética
En el ACV agudo, las imágenes de difusión (DWI) presentan una mayor sensibilidad para detectar el área isquémica respecto a la TC, la cual puede manifestarse ya a los 35 minutos de instaurado el cuadro, como una lesión con señal hiperintensa, e hipointensa en el mapa de coeficiente de difusión aparente, indicando presencia de edema citotóxico 116. De esta manera, la utilización de DWI no solo aporta sensibilidad, sino también especificidad al permitir caracterizar las lesiones temporalmente.
La utilización de imágenes de difusión presenta ventajas respecto a la TC en la detección de infartos lacunares y pequeñas isquemias corticales, siendo además la modalidad de elección para la detección de lesiones isquémicas en la fosa posterior 117, 118. Más allá de estas ventajas, la utilización de imágenes de RM en el ACV agudo en ventana para trombolisis (0 a 4.5 horas) se reserva para aquellos centros con disponibilidad del método las 24 horas, siempre y cuando su utilización no demore la terapia trombolítica.
La discordancia entre el área de isquemia instalada visible en DWI y el déficit de perfusión, se denomina mismatch 119.
Este mismatch, puede ser detectado mediante la utilización de imágenes de perfusión cerebral definiendo así el área de penumbra, la cual puede utilizarse como marcador para predecir la potencial expansión del infarto. Mediante la utilización de imágenes de susceptibilidad magnética o T2*, la sensibilidad y especificidad de la RM en la detección de sangrados intracraneanos en el paciente con síntomas de ACV agudo es similar a la de la TC 120.
La utilización de este tipo de imágenes, principalmente las secuencias de gradiente de eco, permite detectar hemorragias crónicas. La presencia de microsangrados crónicos, en número menor a 5, no aumenta significativamente el riesgo de complicaciones hemorrágicas sintomáticas derivado de la trombolisis endovenosa, mientras que el riesgo es incierto en pacientes con numerosas microhemorragias crónicas 121, 122.
Se recomienda:
– La rápida adquisición y evaluación de las imágenes del parénquima encefálico previa a la administración de cualquier tratamiento específico (Clase I, Nivel de evidencia A)
– Dentro de los 45 minutos de la llegada del paciente con ACV, obtener una interpretación confiable de las imágenes del parénquima encefálico, ya sean de TC o
– Que la toma de imágenes vasculares no demore el comienzo de la administración del rtPA endovenoso (Clase I, Nivel de evidencia A)
Trombolisis sistémica
La administración de rtPA endovenoso conlleva un margen de seguridad y efectividad aceptables. El NINDS tPA Study demostró un incremento absoluto del 12% en el número de pacientes con ausente o mínima discapacidad cuando fueron tratados con rtPA comparados con placebo a los 3 meses, siendo esta mejoría independiente del subtipo de ACV. Además, se observó un incremento en el riesgo de hemorragias intracraneales (6 versus 0.6%) en los tratados con la droga, sin aumento en la mortalidad 123, 124. La administración oportuna del rtPA a pacientes apropiadamente seleccionados constituye el principal tratamiento temprano en el ACVi 19.
La reperfusión del tejido encefálico en el área de penumbra se asocia a una reducción de la discapacidad, mejoría en las actividades de la vida diaria y una reducción de los déficits neurológicos, medidos por el Índice de Barthel, la escala NIHSS, el Glasgow Outcome Score y mRS 24,123. La magnitud en la restauración del flujo sanguíneo es dependiente del tiempo y conlleva una reducción del daño a largo plazo cuando es realizada oportunamente 19.
Ante la sospecha de ACVi es importante la derivación y tratamiento sin demoras por el equipo sanitario. Es deseable que se respeten los tiempos establecidos en el apartado “la hora de oro”.
Ventana para el uso de activador tisular del plasminógeno endovenoso
En 2008, el estudio ECASS III aleatorizó 821 pacientes en 2 grupos [placebo versus activador tisular del plasminógeno (rtPA)] aplicando un tiempo de ventana extendida de 3 a 4.5 horas. Los criterios de exclusión fueron la edad mayor a 80 años, el NIHSS mayor a 25, cualquier uso de anticoagulantes previos y la combinación de ACV y diabetes.
Los resultados obtenidos evidenciaron un modesto pero significativo aumento en la tasa de pacientes con vida independiente a los 3 meses tratados con la droga. Las tasas de hemorragia cerebral fueron similares a estudios previos 69. Un metaanálisis posterior convalidó estos beneficios, por lo que la American Heart Association/American Stroke Association extendió sus recomendaciones sobre el uso del rtPA hasta las 4.5 horas 19,125. Sin embargo, la Food and Drug Administration no aprobó su utilización en este contexto. El estudio IST3 (International Stroke Trial 3) incluyó una cohorte numerosa de pacientes (3035 en total) a la terapia con rtPA versus placebo, extendiendo el tiempo de ventana hasta 6 horas en casos seleccionados.
Se evidenció un incremento en el riesgo de hemorragia y un beneficio del tratamiento fibrinolítico en esta ventana terapéutica, incluso en mayores de 80 años. Aunque este estudio mostró cierta utilidad en pacientes con una ventana terapéutica extendida, el nivel de evidencia no fue lo suficientemente fuerte como para modificar el tiempo límite superior 65, 126. La determinación del período de ventana consiste actualmente hasta 3 horas (ventana convencional) y hasta 4.5 horas (ventana extendida) desde el inicio de los síntomas neurológicos 1.
Selección de pacientes para rtPA endovenoso
Una determinación apropiada de los criterios de selección para fibrinólisis en cada paciente resulta fundamental. Si bien los criterios iniciales, basados en el estudio NINDS tPA Stroke Study, fueron estrictos y limitaban a los pasibles de ser tratados con rtPA 123, en los últimos años se han flexibilizado 65, 69, 126. Actualmente se incorporan mayor cantidad de personas para esta terapia, demostrando aceptables resultados.
Considerada la ventana terapéutica de hasta 4.5 horas, se incluye para terapia con rtPA a los mayores de 18 años, con TC o RM que presente signos de isquemia que no supere el 33% del territorio de la ACM y con manifestación de la voluntad del paciente o de sus representantes legales si fuese posible (cabe aclarar en este punto que, de no poder obtener el consentimiento informado, se debe proceder igualmente con el tratamiento de reperfusión endovenosa). Con respecto a la puntuación de NIHSS, el estudio ECASS III estableció como criterio de exclusión el ACVi grave, definido como un puntaje mayor a 25, o bien la extensión de la isquemia definida previamente en los estudios por imágenes 69. Sin embargo, la inclusión de pacientes con puntuaciones mayores a 22, a pesar de la gravedad del cuadro clínico, podría tener cierto efecto beneficioso al tratamiento con rtPA dentro de una ventana de 3 horas 127. No existen publicaciones que puedan establecer un límite superior en el puntaje del NIHSS para la administración de rtPA, quedando la decisión de tratar a las consideraciones de los equipos de salud intervinientes, contemplando parámetros de costo-efectividad y ética de los esfuerzos terapéuticos. Los pacientes con síntomas menores o escasos corresponden a los que presentan generalmente una puntuación de NIHSS igual o menor a 419. No siempre un puntaje bajo refleja la gravedad y la discapacidad posterior provocada por un déficit aislado.
Por tal motivo, la exclusión de estos pacientes podría privarlos de una terapia con posibilidades de recuperación, existiendo informes acerca del empeoramiento posterior 128-132. En casos de ACVi con puntuaciones bajas, algunos parámetros que brindan los estudios por imágenes podrían identificar a quienes presentarán deterioro neurológico luego de la admisión 133, por lo que serían candidatos para recibir rtPA independientemente de su estado neurológico. La realización de nuevos estudios permitirá apoyar la incorporación progresiva de este grupo de pacientes.
Por lo tanto, en la actualidad se acepta el tratamiento con rtPA a aquellos con los siguientes déficits neurológicos con riesgo de discapacidad y NIHSS < 5:
– Hemianopsia completa o bilateral (= 2 puntos en el ítem 3 del NIHSS)
– Afasia grave, afasia global o mutismo (= 2 puntos en el ítem 9 del NIHSS)
– Extinción visual o sensitiva (= 1 puntos en el ítem 11 del NIHSS)
– Cualquier debilidad que limite el esfuerzo sostenido contra la gravedad (= 2 puntos en los ítems 5 o 6 del NIHSS) 63
En el caso de los mayores de 80 años, el beneficio es menor si la ventana de administración se extiende hasta las 4.5 horas, por lo que el nivel de recomendación en la administración de fibrinolíticos es menor en comparación con personas de menor edad.
Algunas condiciones desaconsejan, en forma absoluta o relativa, la terapia farmacológica con rtPA intravenoso.
Administración
El protocolo de administración del rtPA intravenoso más difundido es el establecido por la American Heart Association y se encuentra recomendado por varias guías sobre ACVi (Tabla 6) 1, 123, 124.
Criterios de exclusión
En las Tablas 7, 8, 9 y 10 se describen los criterios de exclusión (absolutos y relativos).
Efectos adversos
El NINDS TPA Study mostró un incremento de diez veces en la frecuencia de sangrado cerebral en el grupo de tratados con rtPA. En ensayos posteriores, la tasa de hemorragia cerebral sintomática y mortalidad de los tratados con rtPA fueron similares al compararse con el estudio NINDS 134, 135.


La prevención de las complicaciones hemorrágicas graves se realiza con un cuidadoso criterio para la selección de los pacientes, la observación clínica y la atención de la presión arterial. Un aumento de 4 o más puntos en la escala de NIHSS sugiere deterioro neurológico, debiéndose realizar una TC. La infusión debe ser interrumpida si existe sospecha clínica de complicación hemorrágica. Sobre las complicaciones vinculadas al rtPA, hay insuficientes datos para recomendar el uso de plasma fresco congelado, transfusión de plaquetas o administración de concentrados de protrombina para los eventos hemorrágicos 1.

El angioedema orolingual es una complicación transitoria y contralateral al hemisferio isquémico. Ocurre entre el 1.3 y el 5.1% de todos los que reciben el rtPA 134, 136, 137. Está asociado al uso de inhibidores de la enzima convertidora de angiotensina. Ante su ocurrencia, se recomienda suspender la infusión, considerar el tratamiento de la vía aérea si fuera necesario y administrar hidrocortisona 100 mg, ranitidina 50 mg y difenhidramina 50 mg 137. El uso de noradrenalina nebulizada debería confrontarse con el riesgo de hipertensión y la posibilidad de provocar una hemorragia intracerebral (HIC) 1, 138.
Trombolisis en pacientes con oclusión de gran vaso
El aumento de la eficacia de los tratamientos de reperfusión endovascular se asocia a un claro beneficio en los pacientes con ACVi. Sin embargo, de no existir contraindicaciones para terapia fibrinolítica, la misma debe ser administrada, aun si se está considerando la posibilidad de implementar un TEV 1. Al mismo tiempo, esta conducta no debe retrasar la administración de rtPA endovenoso en forma temprana, ya que esto es determinante de su eficacia 19, 83.
Se recomienda:
– Administración de rtPA endovenoso, en pacientes debidamente seleccionados, dentro de la ventana terapéutica de 3 horas de iniciado el ACVi. Todos los esfuerzos deben ser realizados para acortar la demora en el inicio de dicha terapia (Clase I, Nivel de evidencia A)
– Administración de rtPA endovenoso, en pacientes debidamente seleccionados, dentro de la ventana de tratamiento entre las 3 a 4.5 horas de iniciado el ACVi (Clase I, Nivel de evidencia B)
– Utilizar una dosis de rtPA de 0.9mg/kg/dosis (dosis máxima 90 mg), administrando el 10% en bolo intravenoso en un minuto y el 90% restante en infusión continua durante una hora (Clase I, Nivel de evidencia A)
– Que los pacientes candidatos a rtPA endovenoso reciban dicho tratamiento independientemente de que se encuentre disponible el tratamiento de reperfusión endovascular (Clase I, Nivel de Evidencia A)
– El uso de rtPA endovenoso en pacientes con ACVi que se presenten con síntomas menores o con mejoría parcial dentro del tiempo de ventana terapéutica, considerando sus potenciales beneficios y riesgos (Clase IIb, Nivel de evidencia C)
Trombectomía mecánica/trombolisis intraarterial
En la oclusión de gran vaso cerebral (OGVC) el promedio de recanalización con rtPA intravenoso es del 6% para la obstrucción de la arteria carótida interna intracraneana y 30% para la oclusión de la ACM en sus segmentos M1 y M2 139. Estos datos originaron el desarrollo de otras estrategias terapéuticas de reperfusión. En el año 2015, los estudios MR-CLEAN 86, EXTEND-IA 140 y SWIFT-PRIME 141 mostraron beneficio de la trombectomía mecánica (TM) sobre el tratamiento médico en los pacientes con OGVC en el territorio anterior con una ventana terapéutica de menos de 6 horas, con un NNT para reducir la discapacidad de 8, 2.8 y 4, respectivamente. Los estudios REVASCAT 142 y ESCAPE 143 extendieron su eficacia dentro de las 8 y 12 horas, con un NNT de 6.5 y 4, respectivamente.
En estas ventanas mayores a 6 horas los resultados son cuestionados por la reducida cantidad de pacientes. En la actualidad, la ventana terapéutica determina la estrategia de tratamiento de reperfusión en los pacientes con ACVi agudo de la siguiente manera:
1) Ventana < 4.5 horas se recomienda el tratamiento con rtPA IV
2) Ventana < 4.5 horas y OGVC se recomienda tratamiento con rtPA IV seguido de TM en caso de no obtener mejoría
3) Ventana entre 4.5 a 6 horas se recomienda TM
4) Ventana < 6 horas, OGVC y contraindicación para tratamiento con rtPA IV se recomienda TM
Recientemente el estudio DAWN demostró la eficacia de la TM en oclusiones proximales en pacientes con ACVi que se presentan entre las 6 y 24 horas de iniciado los síntomas. El grupo sometido a trombectomía presentó mayor independencia funcional a 90 días cuando se lo comparó con el tratamiento convencional (49% vs. 13%, IC: 21-44%). Los pacientes fueron seleccionados en relación a la presencia de infartos pequeños con déficit clínico importante presentando al momento de la inclusión NIHSS = 10 puntos con volúmenes de infarto < 21 ml (para = 80 años) y < 31 ml (para < 80 años) o NIHSS = 20 con un infarto < 51 ml (< 80 años)144. Estos beneficios fueron confirmados por el estudio DEFUSE III que incluyó pacientes entre 18 y 90 años con NIHSS = 6 con ACVi entre 6 y 16 horas de iniciado los síntomas, con infartos con volumen < 70 ml y mistmach en neuroimagen (mistmach cociente = 1.8 o mismatch volumen de = 15 ml) 145.
Se recomienda
– Que todo paciente con indicación de tratamiento con rtPA endovenoso reciba dicho tratamiento, aun si el TEV se encuentra disponible (Clase I, Nivel de evidencia A)
– TEV para aquellos que cumplen de forma simultánea todos los siguientes criterios (Clase I, Nivel de evidencia A):
– Edad = 18 años
– Previamente independientes: escala mRS < 1
– Tiempo de evolución desde inicio hasta punción arterial menor a 6 horas
– NIHSS = 6
– Oclusión aislada de arteria carótida interna distal o ACM proximal (M1)
– TC basal sin alteraciones o con ASPECTS = 6
– Que han sido tratados previamente con trombolisis IV según protocolo
– La edad elevada por sí sola no es una razón para evitar la TM como un tratamiento complementario
Se recomienda:
– Que la reperfusión (mTICI 2b/3) se alcance tan pronto sea posible (Clase I, Nivel de evidencia B)
– Que la decisión de realizar TEV sea llevado a cabo en conjunto por un equipo multidisciplinario que incluya al menos un neurólogo con experiencia en enfermedad cerebrovascular y un neuro-intervencionista, y sea realizado en centros de atención integral de ACV (Clase IIb, Nivel de evidencia B)
– Que el TEV sea realizada por un neuro-intervencionista que cumpla con los requerimientos nacionales e internacionales de formación y experiencia (Clase IIb, Nivel de evidencia B)
– La elección de la anestesia depende de la situación de cada paciente y la misma se debe llevar a cabo evitando la demora en el inicio del TEV (Clase IIb, Nivel de evidencia C)
– La trombectomía mecánica en pacientes seleccionados con ACVi entre las 6 y 16 horas de iniciados los síntomas con OGVC en circulación anterior y que cumplan los criterios DAWN o DEFUSE III (Clase I, Nivel de evidencia A)
– La trombectomía mecánica en pacientes seleccionados con ACVi entre las 16 y las 24 horas de iniciados los síntomas con OGVC en circulación anterior y que cumplan los criterios DAWN (Clase IIa, Nivel de evidencia B)
Existen otras circunstancias en las que podría existir beneficio, aunque el grado de evidencia es menor. Es fundamental individualizar la indicación según cada paciente.
A. Edad menor a 18 años: se puede realizar TEV si técnicamente es posible, solicitando previamente consentimiento informado por padres o tutor (Clase IIb, Nivel de evidencia C)
B. Contraindicación para el tratamiento con rtPA endovenoso, con OGVC, deben ser considerados para TEV como primera opción preferentemente antes de las 6 horas (Clase IIa, Nivel de evidencia C)
C. Aunque el beneficio es incierto, el TEV es una opción terapéutica en los cuidadosamente seleccionados con menos de 6 horas de evolución y oclusión de ramas distales de la ACM, arteria cerebral anterior, arteria cerebral posterior, arterias vertebrales y arteria basilar (Clase IIb, Nivel de evidencia C)
D. No se recomienda observar a los pacientes tras el tratamiento con rtPA endovenoso para constatar beneficio clínico antes de programar el tratamiento endovascular (Clase III, Nivel de evidencia B)
Se recomienda:
– Los stents retrievers antes que el dispositivo MERCI (Clase I, Nivel de evidencia A)
– El uso de dispositivos de TM diferentes a los stents retrievers o el empleo de trombo aspiración en las circunstancias en que el equipo lo considere necesario (Clase IIb, Nivel de evidencia B)
– El uso de un catéter guía con balón proximal o un catéter de gran calibre distal en lugar de un catéter guía cervical solo en conjunción con los stents retrievers, para evitar la embolia distal (Clase IIa, Nivel de evidencia C)
– Que el objetivo técnico de la trombectomía sea un resultado angiográfico mTICI 2b/3 para maximizar la probabilidad de un buen pronóstico funcional clínico (Clase I, Nivel de evidencia A)
– Puede valorarse la angioplastia/stent de estenosis u oclusiones de la carótida cervical en el momento de la TM, pero la utilidad de este proceder es desconocida (Clase IIb, Nivel de evidencia C)
– Puede valorarse el uso de rtPA intraarterial iniciada dentro de las 6 primeras horas desde el inicio del ACV en pacientes cuidadosamente seleccionados con contraindicaciones para el uso de rtPA intravenoso, pero las consecuencias son desconocidas (Clase IIb, Nivel de evidencia C)
– La utilización de sedación consciente más que la anestesia general durante la TM. Sin embargo, la selección de la técnica anestésica debe individualizarse en función de factores de riesgo, tolerancia al procedimiento y otras características clínicas (Clase IIb, Nivel de evidencia C)
Contraindicaciones específicas para la trombectomía mecánica
– Recuento de plaquetas < 30 000/mm3 – Tratamiento con heparina y TTPa mayor al doble – Tratamiento con anticoagulantes orales y RIN > 3
En caso de que se considere el uso de rtPA intraarterial las contraindicaciones son las mismas que para la terapia endovenosa.
Las medidas de rendimiento de todos los aspectos de la terapia endovascular para los pacientes con ACVi agudo con OGVC son cruciales para identificar y corregir las barreras institucionales que impiden la rapidez y seguridad en el tratamiento. Todas las medidas deben ser registradas y monitoreadas a través de una base de datos 144.
Incluyen:
1. Tiempo puerta-imagen: recomendado menor a 25 minutos
2. Tiempo imagen-punción femoral: recomendado menor a 60 minutos
3. Tiempo puerta-punción femoral: recomendado menor a 90 minutos
4. Tiempo punción arterial a primera recanalización (primer pasaje del dispositivo a través de punto de oclusión): recomendado menor a 30 minutos
5. Tiempo punción femoral a reperfusión (mTICI 2b/3) o fin de procedimiento: recomendado menor a 60 minutos
El monitoreo permanente de los resultados debería asegurar un rendimiento no menor al siguiente:
A. Tiempo puerta-ingle menor a 90 minutos en el 75% de los pacientes
B. Reperfusión mTICI 2b/3 mayor al 50% de los pacientes
C. Tasa de hemorragia intracraneal sintomática menor al 10%
D. mRS 6 a 90 días (mortalidad) menor al 25%
E. mRS 0-2 a 90 días (nula o mínima discapacidad) mayor al 30%
Tratamiento de la presión arterial
La hipertensión arterial (HTA) constituye un hallazgo frecuente en la presentación del paciente con ACVi. En un estudio observacional, la presión arterial superó los 140 mmHg en el 77% y más de 184 mmHg en el 15% de los asistidos en el servicio de urgencias 146. Estas elevaciones son más altas en aquellos individuos con historia previa de HTA. Algunas razones para esta elevación son atribuibles a la isquemia cerebral y a una respuesta ante la hipertensión endocraneana para mejorar la perfusión del tejido encefálico isquémico, aunque esto aumenta el riesgo de edema tisular y de trasformación hemorrágica 147.
El control de la presión arterial (PA) en ACVi constituye uno de los aspectos fundamentales. A pesar del desarrollo alcanzado en esta afección, todavía existen controversias en relación al nivel óptimo de presión arterial durante el período agudo 1. Se acepta que se deben tomar los recaudos necesarios para evitar la hipotensión arterial en la emergencia. El International Stroke Trial permitió comprender que la disminución de la presión arterial por debajo de 140 mmHg se asocia a un peor pronóstico, el cual se incrementa por cada descenso de 10 mmHg 147.
Criterios para tratar la hipertensión arterial
Se enfatiza el tratamiento ante la existencia de cifras elevadas, el monitoreo continuo y la pronta detección de efectos adversos en caso de requerirse la administración de antihipertensivos durante las primeras horas (Fig. 2).
En los que son candidatos a terapia con rtPA endovenoso resulta recomendable no superar los valores de presión arterial sistólica (PAS) de 185 mmHg o presión arterial diastólica (PAD) de 110 mmHg. Estos valores objetivo son más bajos en comparación con aquellos que no serán destinados al tratamiento de reperfusión 6,7. Las cifras por encima de las cuales se indica el tratamiento de la HTA corresponden a PAS de 185 mmHg y PAD de 105 mmHg, al menos durante las primeras 24 horas.
Con respecto a los que no son candidatos a terapia con rtPA endovenoso, no se recomienda una disminución rutinaria de la HTA, a menos que los valores alcanzados sean muy elevados, con cifras que superen los 220 mmHg de PAS o 120 mmHg de PAD, o bien que exista una condición médica simultánea que indique su inmediato descenso, como el infarto agudo de miocardio, la disección aórtica o la insuficiencia cardíaca 1, 19. En el caso que fuera necesario el tratamiento farmacológico, resulta razonable un descenso del 15% en relación a los valores previos a la terapia, durante las primeras 24 horas 1.
Tratamiento farmacológico
La forma de administración recomendada para el tratamiento farmacológico de la HTA es la vía intravenosa, recordando que los descensos deben ser progresivos durante las primeras 24 horas 24, 95. Una vez constatada la elevación de la PA arterial en un ACVi y posibilidades de recibir terapia de reperfusión, mediante la medición en dos oportunidades entre 5 y 10 minutos, se recomienda
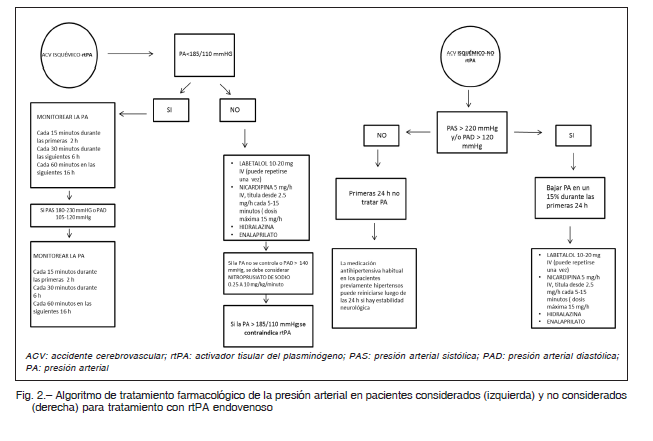
la administración de 10 a 20 mg de labetalol, en bolo intravenoso, durante 1 a 2 minutos 19. De no obtener los valores deseados, se puede administrar una segunda dosis de labetalol. En aquellos que fueron medicados con rtPA endovenoso, resulta recomendable el monitoreo de la TA cada 15 minutos durante la infusión y hasta las 2 horas desde el inicio del rtPA, luego cada 30 minutos por las siguientes 6 horas y a partir de ese momento, en forma horaria hasta cumplir las 24 horas. Si la elevación se produce durante la infusión de la medicación trombolítica, es posible repetir la administración de labetalol 10 a 20 mg en dosis intravenosa. En caso de que se prefiera emplear una posología mediante goteo en infusión continua se recomienda una dosis entre 2 y 8 mg/minuto19. Una alternativa farmacológica consiste en el nitroprusiato de sodio en dosis de 0.25 a 10 mcg/kg/min. En el caso de no poder controlar la PA, se desaconseja el inicio de la terapia trombolítica 19, 24.
Hipotensión arterial
Alrededor del 0.6 al 2.5% de los pacientes con ACVi presentan hipotensión arterial 148, 149. Esto obliga a descartar causas como falla cardíaca, disección aórtica o shock.
Los efectos de la hipotensión grave son perjudiciales debido a la reducida perfusión de múltiples órganos, empeorando la lesión isquémica aguda que se agrega a la autorregulación vascular comprometida 150-152. No está definido el concepto de hipotensión, tanto en valores absolutos como en valores habituales de cada paciente.
La administración de solución fisiológica intravenosa es una medida inicial razonable 19. En casos donde no se obtenga mejoría, se requiere la utilización de un fármaco vasoconstrictor, siendo los más utilizados los simpaticomiméticos intravenosos. Se deberá evitar la utilización de soluciones hipotónicas, como la solución salina al 0.45% o la de dextrosa al 5%, ya que se distribuyen preferentemente en el interior de la célula por lo que puede exacerbar el edema cerebral 19.
Se recomienda:
– Mantener la PAS < 185 mmHg y TAD < 110 mmHg para los candidatos a tratamiento con rtPA endovenoso (Clase I, Nivel de evidencia B)
– En los no candidatos a rtPA, se recomienda realizar cuando la PAS supere los 220 mmHg o la TAD supere los 120 mmHg (Clase I, Nivel de evidencia C)
– Utilizar las mismas indicaciones para el control de la HTA en aquellos candidatos a terapia endovascular (Clase I, Nivel de evidencia C)
– En el caso de pacientes tratados previamente al ACVi con fármacos antihipertensivos, la conducta de reiniciar la misma luego de trascurridas las primeras 24 horas resulta segura, teniendo en cuenta la estabilidad neurológica (Clase IIa, Nivel de evidencia B)
– Actualmente no existen datos suficientes para guiar la selección de fármacos antihipertensivos durante el tratamiento agudo del ACVi (Clase IIa, Nivel de evidencia C)
– Corregir la hipotensión y la hipovolemia para asegurar la perfusión cerebral durante el ACVi (Clase I, Nivel de evidencia C)
– Corregir la hipotensión arterial secundaria a hipovolemia mediante solución de ClNa 0.9% (Clase I, Nivel de evidencia C)
– En caso de no poder corregirse la hipotensión con fluidos, utilizar fármacos vasopresores con riguroso monitoreo neurológico y cardiológico (Clase I, Nivel de evidencia C)
Uso de antitrombóticos – Anticoagulación
Heparina no fraccionada
En el estudio IST se probó heparina no fraccionada (HNF) vía subcutánea en dosis de 5000 o 25 000 U/día iniciadas dentro de las 48 horas posteriores al ACV 153. Aproximadamente la mitad de los que recibieron heparina, también recibieron aspirina. No se efectuó monitoreo del nivel de anticoagulación ni ajuste de dosis. Aunque la heparina fue eficaz en la reducción del riesgo de recurrencia de ACV, el beneficio se vio disminuido debido al aumento de la tasa de complicaciones hemorrágicas 154. En un ensayo de un único centro, se administró heparina intravenosacomenzando con una dosis en bolo, dentro de las 3 horas posteriores al inicio del ACV con ajustes en respuesta al KPTT 155. Trece de 208 tratados con HNF tuvieron complicaciones hemorrágicas sintomáticas (6.2%, 7 mortales), mientras que 3 de 210 en el grupo control (1.4%) tuvieron hemorragia intracerebral (HIC) espontánea. Se informaron resultados favorables a los 90 días en 81 tratados con HNF (38.9%) y en 60 dentro del grupo control (28.6%). Por ende, la administración temprana de heparina en ACV de etiología cardioembólica se relacionó con un aumento de la tasa de complicaciones hemorrágicas 156. En un estudio europeo multicéntrico se administró heparina a 32 pacientes y aspirina a 35 157. Sandercock 158 realizó una revisión sistemática de anticoagulantes en el tratamiento del ACVi agudo, concluyendo que la anticoagulación inmediata no se asoció con ningún beneficio neto a corto o largo plazo.
Un metaanálisis que evaluó la utilización de anticoagulantes en ACVi de probable causa cardioembólica, demostró asociación con una reducción no significativa en la tasa de recurrencia temprana de ACV, mayor riesgo de HIC y ausencia de reducción de riesgo de muerte o discapacidad 159.
La seguridad y la eficacia de la utilización de HNF previo al inicio de la anticoagulación oral fue evaluada en un estudio observacional 160. La heparina no logró reducir el riesgo de eventos tromboembólicos ni aumentó el riesgo de las complicaciones hemorrágicas, pero prolongó el tiempo de hospitalización. Parte del aumento del riesgo de sangrado asociado podría estar relacionado al desarrollo de trombocitopenia inducida por heparina 161.
Heparinas de bajo peso molecular
La utilidad de las heparinas de bajo peso molecula (HBPM) en el tratamiento del ACVi agudo fue evaluada en diferentes ensayos clínicos. En la mayoría de estos estudios se la administró de forma subcutánea. En algunos ensayos se compararon estos fármacos con HNF o aspirina, mientras que en otros fueron comparados con controles o placebo. La mayoría de los resultados fueron negativos y se evidenció un aumento del riesgo de hemorragia, superando al beneficio en la prevención temprana de eventos.
Bath y col. 162 realizaron un metaanálisis de HBPM versus aspirina en ACV y encontraron que las HBPM redujeron significativamente el riesgo de tromboembolismo venoso, pero aumentaron el riesgo de hemorragia sintomática. Otro ensayo comparó enoxaparina o HNF para la prevención de eventos tromboembólicos en ACVi; los dos tratamientos fueron igualmente efectivos 163.
En el estudio de prevención de tromboembolismo venoso después del ACVi agudo con enoxaparina (PREVAIL), se estudió la utilidad de la administración subcutánea de heparina o enoxaparina para la prevención de la TVP sintomática, asintomática o embolia pulmonar 164. El riesgo de tromboembolismo venoso fue significativamente menor con enoxaparina (68 [10%] vs. 121 [18%], RR, 0.57; IC del 95%, 0.44-0.76; p = 0.001). Las tasas de hemorragia fueron similares en ambos grupos. Este estudio demostró la superioridad de la HBPM en la prevención del tromboembolismo venoso después del ACVi.
En 2008, Sandercock y col. 165 publicaron una revisión sistemática comparando la utilidad de la HNF y la HBPM. Encontraron que las HBPM eran eficaces para la reducción del riesgo de TVP, pero los datos fueron insuficientes para determinar si estos medicamentos eran superiores a la HNF cuando se analizaron otros potenciales objetivos terapéuticos.
Antitromboticos como terapia adjunta a trombolisis sistemica
La administración de agentes antiplaquetarios o anticoagulantes se encuentra contraindicada durante las primeras 24 horas después del tratamiento con rtPA IV por el aumento del riesgo de sangrado y transformación hemorrágica 123. Sin embargo, puede producirse oclusión arterial luego de la recanalización con fibrinólisis IV 166-168.
En los estudios con uroquinasa intraarterial juntamente con heparina, comparado con un grupo control que recibió solo heparina 169-172, aumentaron tanto el éxito de la recanalización como el riesgo de hemorragia entre los que recibieron la mayor de las dos dosis de heparina adyuvante, por lo que no se recomienda este tratamiento.
Adicionalmente, se evaluó la administración de heparina IV después de la administración del rtPA 171, 173, sin informarse incremento de las complicaciones hemorrágicas.
Anticoagulantes orales directos
Los inhibidores directos de trombina pueden ser útiles en la isquemia aguda y ACV debido a que limitan la trombosis. Pueden ser una alternativa a los anticoagulantes y se podrían administrar a aquellas personas que desarrollaron trombocitopenia inducida por heparina. El dabigatrán, el rivaroxabán, el apixabán y el edoxabán demostraron seguridad y eficacia comparado con warfarina, en estudios aleatorizados para la reducción de ACVi con FA no valvular.
El dabigatrán, un inhibidor directo de la trombina, ha sido evaluado para la prevención de eventos tromboembólicos en pacientes sometidos a procedimientos ortopédicos.
En el estudio RE-LY el tratamiento con dabigatrán demostró ser beneficioso en comparación a warfarina para la prevención del ACVi o embolia sistémica con FA no valvular 174. En dosis de 110 mg cada 12 horas, el dabigatrán no fue inferior a la warfarina y demostró menores complicaciones hemorrágicas. En dosis de 150 mg cada 12 horas, el dabigatrán fue más efectivo que la warfarina en la prevención de eventos isquémicos, pero con un riesgo de hemorragia similar. El rivaroxabán, un inhibidor del factor Xa, fue aprobado para la reducción de riesgo de ACV y embolia sistémica en FA no valvular, con una dosis de 20 mg una vez al día en aquellos con función renal normal y 15 mg en pacientes con clearence de creatinina menor a 50 ml/min 175. El apixabán demostró una menor tasa de incidencia anual de ACV y embolismo sistémico que warfarina en FA no valvular, siendo aprobado con una dosis de 5 mg dos veces al día, ajustándose a 2.5 mg dos veces al día en pacientes con dos o más de los siguientes criterios: edad mayor a 80 años, creatinina sérica mayor a 1.5mg/dl y peso menor a 60 kg 176.
Edoxabán fue aprobado en 2015 para la prevención de ACV y embolismo sistémico en FA no valvular, con una dosis de 60 mg una vez al día en EE. UU. 177, Japón 178 y la Unión Europea 179, aún no fue aprobado en la Argentina.
Otras drogas como el betrixabán se encuentran en evaluación 180.
Un metaanálisis de anticoagulantes orales directos en FA demostró menores tasas de sangrados mayores con los nuevos anticoagulantes en comparación con warfarina en los estudios RE-LY 181 y ARISTOTLE 176, siendo neutral en el estudio ROCKET-AF 175. Los anticoagulantes orales directos redujeron el riesgo relativo de sangrado intracraneal en comparación con warfarina. Sin embargo, rivaroxabán y dabigatrán mostraron un aumento de la tasa de sangrado gastrointestinal mayor en comparación con warfarina en los mismos estudios 182. Otros metaanálisis de estudios poblacionales y registros mostraron resultados similares 183.
Actualmente, se encuentran en desarrollo diversos antídotos específicos para los anticoagulantes orales directos, con el objetivo de revertir la actividad anticoagulante y restablecer una adecuada hemostasia en caso de hemorragia grave o necesidad de realizar procedimientos invasivos de urgencia. Entre ellos se encuentran el idarucizumab para dabigatrán, andexanet alfa para rivaroxabán, apixabán, edoxabán, HBPM y fondaparinux y aripazine para rivaroxabán, apixabán, edoxabán, dabigatrán, HNF, HBPM y fondaparinux 184.
El dabigatrán, el apixabán, el rivaroxabán y el edoxabán han sido aprobados para la prevención de ACV y embolia sistémica en FA no valvular. No hay evidencia firme sobre seguridad y eficacia de los anticoagulantes orales directos en ACV cardioembólico dentro de los 7 a 14 días de instalado el mismo. Estos agentes tienen efecto más rápido con menor tasa de complicaciones hemorrágicas en comparación con warfarina, además de proveer una anticoagulación efectiva en pacientes ACVI cardioembólico. Estudios a futuro como el Triple AXEL permitirían una mejor evaluación de su efectividad en este contexto 185. El momento de inicio de anticoagulación después del ACV no ha sido establecido. La única recomendación de expertos es “la regla del 1-3-6-12” que propone la European Heart Rhythm Association, iniciando la anticoagulación en el primer día en el caso de AIT, tercer día en ACVi no discapacitante, sexto día en ACVi moderados y a los 12 días o más en ACV extensos 186.
No se recomienda:
– El inicio de anticoagulación urgente con el objetivo de prevenir la recurrencia precoz de ACV, detener el deterioro neurológico o mejorar las consecuencias del ACV en el tratamiento del ACVi agudo (Clase III, Nivel de evidencia A)
– La anticoagulación urgente para la atención de las condiciones no cerebrovasculares en ACV moderado a grave, dado el alto riesgo de complicaciones hemorrágicas intracraneales graves (Clase III, Nivel de evidencia A)
– El inicio de la terapia anticoagulante dentro de las 24 horas del tratamiento con rtPA intravenoso (Clase III, Nivel de evidencia B)
– La eficacia y seguridad de los anticoagulantes orales directos no está aún bien establecido en ACVi agudo, por lo que se requieren nuevos ensayos clínicos (Clase IIb, Nivel de evidencia B)
Antiagregación
La aspirina es el agente antiplaquetario más extensamente probado. Dos grandes ensayos demostraron una tendencia no significativa en la reducción de muerte o discapacidad al iniciar el tratamiento con aspirina dentro de las primeras 48 horas del ACV 153, 187, con leve incremento de la tasa de complicaciones hemorrágicas. Al combinar los resultados obtenidos en ambos ensayos, se evidenció un beneficio estadísticamente significativo con la administración de aspirina, probablemente atribuible a la prevención de eventos recurrentes.
Existe experiencia limitada sobre el uso de clopidogrel o dipiridamol en ACV agudo. El inicio de clopidogrel en una dosis diaria de 75 mg no produce una adecuada inhibición de la agregación plaquetaria hasta los 5 días 188. Esta demora plantea un problema para el tratamiento del ACVi agudo, motivo por el cual debe administrarse una dosis en bolo de 300 a 600 mg de clopidogrel para inhibir rápidamente la agregación plaquetaria. Un estudio evaluó la administración de 325 mg de aspirina y 375 mg de clopidogrel dentro de las 36 horas de ACVi o AIT 189. La combinación de estas drogas demostró ser segura. Otro estudio halló que la combinación de aspirina y dipiridamol también podía ser administrada de manera segura dentro de las 48 horas del ACV 190. Sin embargo, no existe evidencia sólida sobre la utilidad de estos antiplaquetarios en ACV agudo.
Dos ensayos han investigado el uso temprano de antitrombóticos en el ACV agudo. El EARLY fue un estudio alemán abierto, aleatorizado, multicéntrico, de pacientes con ACVi agudo que recibieron 100 mg de aspirina como monoterapia o 25 mg de aspirina más 200 mg de dipiridamol de liberación prolongada dentro de las 24 horas de un ACV o AIT o después 7 días de monoterapia con aspirina 191. De los 543 enrolados en ambos grupos, el 56% que recibió el tratamiento combinado alcanzaró un mRS de 0 o 1 a los 90 días, en comparación con el 52% que recibió monoterapia con aspirina. En el estudio FASTER también se reclutaron pacientes con ACVi o AIT, pero solo se enrolaron aquellos con ACV menor (NIHSS < 4) 192. Recibieron aleatoriamente clopidogrel o placebo y simvastatina o placebo dentro de las 24 horas de su inclusión. El estudio fue detenido prematuramente. Los que recibieron clopidogrel tuvieron un riesgo de ACV de 7.1% a los 90 días en comparación con el 10.8% en la rama placebo (RR, -3.8%, p = 0.019). Estos estudios sugieren que en los que recibieron rtPA para el tratamiento agudo, el inicio temprano de la terapia antitrombótica para la prevención secundaria de recurrencia de ACV parece ser tan segura como su inicio posterior.
En el estudio CHANCE, aleatorizado, doble ciego, se incluyeron 5170 pacientes de 114 centros de China con ACVi menor o AIT de alto riesgo. Se evaluó el uso de clopidogrel 75 mg más aspirina 100 mg vs. aspirina 100 mg dentro de las primeras 24 horas de su instalación para prevención de recurrencia. Se demostró la superioridad de la combinación de clopidogrel más aspirina vs. aspirina sola para la reducción de riesgo de ACV en los 90 días subsiguientes, sin incrementar el riesgo de hemorragia 193. El estudio SAMPRISS comparó el tratamiento médico agresivo vs. stenting más tratamiento médico agresivo en ACVi secundario a estenosis intracraneal sintomática enrolados dentro de los primeros 30 días del evento índice. El tratamiento médico intensivo compuesto por aspirina 325 mg, clopidogrel 75 mg y estatinas a altas dosis, junto al estrictico control de los factores de riesgo vascular, tuvo similar efectividad con menor riesgo de complicaciones que el asociado a colocación de stent intraraneano 194.
Por otro lado, el estudio SOCRATES, aleatorizado, doble ciego y controlado, que incluyó 13199 pacientes con ACVi menor o AIT de alto riesgo que no recibieron trombolisis endovenosa y considerados de etiología no cardioembólica, comparó ticagrelor vs. aspirina. El ticagrelor no mostró superioridad con respecto a la aspirina, por lo que no se recomienda el uso de ticagrelor sobre aspirina en ACVi 195.
Agentes antiplaquetarios intravenosos
Los inhibidores del receptor plaquetario de glicoproteína IIb/IIIa han sido considerados para el tratamiento del ACVi agudo porque pueden aumentar la tasa de recanalización y mejorar la permeabilidad de la microcirculación 196,197. Diferentes estudios analizaron la utilización de abciximab, tirofiban o eptifibatida. Estos fármacos fueron evaluados como monoterapia o terapia adjunta a otras intervenciones de recanalización para el tratamiento de ACVi agudo. La mayoría de los informes incluyeron pequeñas series 198-202. Aunque el uso de abciximab para el tratamiento del ACVi evidenció más hemorragias, el tirofiban no aumentó la incidencia de transformación hemorrágica, pero parece haber disminuido la mortalidad a los 5 meses en un ensayo de fase II 203. Zinkstok y col. 204 compararon la seguridad y la eficacia de la administración temprana de aspirina endovenosa dentro de los 90 minutos del inicio de la administración intravenosa de rtPA en comparación a administración de rtPA intravenosa sola en un estudio multicéntrico, aleatorizado y abierto. El ensayo fue terminado prematuramente debido a un exceso de HIC en el grupo con aspirina. Los pacientes con terapia combinada de aspirina intravenosa y rtPA presentaron el doble de probabilidad de desarrollo de HIC que el grupo que recibió rtPA IV sola (4.3% vs. 1.6% respectivamente; p = 0.04).
Se recomienda:
– La administración de aspirina vía oral (dosis inicial de 160-325 mg seguida de 100 mg/día) dentro de las 24 a 48 horas posteriores a la aparición del ACV para el tratamiento de la mayoría de los pacientes (Clase I, Nivel de evidencia A)
– Utilizar la combinación de aspirina más clopidogrel por un lapso de tres meses, junto a terapia de alta eficacia de estatinas en ACVi secundario a estenosis intracraneana (Clase I, Nivel de evidencia B)
No se recomienda:
– La aspirina como sustituto de otras intervenciones agudas para el tratamiento del ACV, incluyendo rtPA IV y trombectomía mecánica (Clase III, Nivel de Evidencia B)
– La administración de otros fármacos antiplaquetarios intravenosos que inhiban el receptor de la glicoproteína IIb / IIIa (Clase III, Nivel de Evidencia B)
– La administración de aspirina (u otro antiagregante plaquetario) como terapia adjunta, en las 24 horas siguientes a la administración de rtPA endovenoso (Clase III, Nivel de evidencia C)
Infarto maligno
El infarto maligno de la ACM constituye el 1 al 10 % de los infartos supratentoriales. Está asociado con una mortalidad del 50% llegando hasta el 80% en pacientes no tratados debido a edema cerebral, aumento de la presión intracraneana y subsecuente herniación cerebral. La principal causa de muerte es el edema cerebral focal, el cual ocurre habitualmente entre el segundo y quinto día 205,206. El deterioro neurológico también puede ser atribuido a la hidrocefalia obstructiva secundaria a la compresión del cuarto ventrículo del tronco encefálico, secundaria a la herniación transtentorial 207.
Tres estudios aleatorizados controlados, el francés DECIMAL 208, el alemán DESTINY 209 y el holandés HAMLET 210 y posteriormente un análisis global de los mismos, han mostrado beneficio de la craniectomía descompresiva en infarto extenso. El NNT para disminuir la mortalidad fue de 2207. Sin embargo, no se hallaron diferencias significativas en la evolución neurológica funcional 208-210.
El tiempo óptimo a la craniectomía descompresiva sigue en discusión, dado que no todos los infartos malignos de la ACM desarrollan efecto de masa grave y herniación. Ninguno de los tres estudios europeos trató este tema satisfactoriamente. En el estudio DECIMAL el tiempo promedio a la descompresión quirúrgica fue de 30 horas, en el DESTINY de 36 y en el HAMLET 96, pero solo 25 pacientes fueron craniectomizados después de las 48 horas, y un análisis secundario de este último demostró que el tiempo menor a 48 horas disminuía la probabilidad de una evolución desfavorable con una escala mRS mayor o igual a 5208-211. Un metaanálisis publicado en 2014 demostró que la craniectomía descompresiva temprana, realizada dentro de las 48 horas de comenzados los síntomas, disminuye la mortalidad (OR 0.14, IC95% 0.08- 0.25; p 0.0001) y la pobre evolución funcional (mRS > 3) (OR 0.38, IC95% 0.20-0.73; p 0.004) en el seguimiento a 12 meses 212.
La mayoría de los estudios multicéntricos aleatorizados indican inequívocamente que la edad es el predictor más fuerte de discapacidad. En el análisis global realizado de los tres estudios europeos se incluyeron pacientes de 18 a 60 años 208. El estudio DESTINY II estudió mayores de 60 y demostró un aumento significativo en la probabilidad de supervivencia en mayores de 60 con infarto de la ACM, pero la mayoría de los sobrevivientes con discapacidad sustancial.
Se describieron predictores clínicos asociados al desarrollo de edema cerebral en infarto de ACM, como ser la escala del NIHSS > 20 en territorio dominante o > 15 en territorio no dominante 213, así como la presencia de nauseas o vómitos. También hay criterios a tener en cuentra mediante los estudios por imágenes, entre los que se encuentran la presencia de hipodensidad en más del 50% del territorio correspondiente a la ACM en TC inicial, el compromiso de territorios vasculares adicionales 206 y la presencia de anormalidades tempranas y extensas en la secuencia de difusión en la RM inicial 208, 214, 215.
Con el fin de la pronta identificación y evaluación se proponen los criterios de inclusión, aún no validados, denominados “S.T.A.T.E.” (Tabla 11), que pueden ser utilizados para identificar mediante factores clínicos y radiológicos los casos con alto riesgo de desarrollar edema fatal al ingreso, asistiendo en la decisión de realizar la craniectomía descompresiva a tiempo. Si se reúnen todos los criterios, se recomienda la craniectomía descompresiva dentro de las 48 horas de iniciados los síntomas.
Medición del volumen del infarto
El volumen del infarto predice la evolución. La medición por medio de la RM es más sensible que la TC dentro de las primeras 24 horas del inicio de los síntomas. Se utilizan el T2, la imagen en difusión y se puede utilizar el software ANALIZE. Se estudió la valoración por medio del modelo ABC/2 utilizado en hematoma cerebral en la cuantificación del volumen del infarto en RM con buena confiabilidad, aunque no fue estudiado en infartos agudos dentro de las 9 horas en TC 216.
Hemicraniectomía de emergencia
Se indica la hemicraniectomía de emergencia si se presentan signos tempranos de herniación como la asimetría en el tamaño pupilar o desviación de la línea media mayor a 10 mm (a nivel del septum pellucidum) o mayor a 5 mm (a nivel de la glándula pineal) 206,217.
Tratamiento trombolítico previo
La realización previa de tratamiento con rtPA IV o intraarterial no descarta la necesidad de hemicraniectomía posterior. Debe considerarse la hemicraniectomía en pacientes que desarrollen HIC o edema cerebral maligno posterior a la administración de trombolíticos, en consenso con los servicios de neurología y neurocirugía. La hemicraniectomía descompresiva solo debe ser realizada con posterioridad a la normalización en los parámetros de coagulación y fibrinógeno.
Técnica quirúrgica
La descompresión quirúrgica basada en la craniectomía fronto-parieto-témporo-occipital con duroplastia es una terapia efectiva para el edema cerebral fatal 218, 219. La craniectomía debe ser entre 12-13 cm por 8-9 cm y para lograr adecuada descompresión de las cisternas basales se recomienda alcanzar la fosa temporal. La duraplastia es imprescindible para lograr una adecuada expansión del cerebro edematizado. La duramadre es fijada a los márgenes de la craniectomía para evitar el sangrado epidural 220 y la resección del músculo temporal solo debe ser considerada como opción terapéutica individualizada.
Se recomienda:
– Monitoreo neurológico intensivo en los primeros días del ACVi maligno (Clase I, Nivel de Evidencia C)

– Considerar al deterioro del estado de conciencia por edema cerebral como signo clínico que indique necesidad de craniectomía (Clase IIa, Nivel de evidencia A)
– En pacientes = 60 años con ACVi de la ACM que se deterioran neurológicamente dentro de las 48 horas a pesar del tratamiento médico, la craniectomía descompresiva con expansión dural es razonable (Clase IIa, Nivel de evidencia A)
– En menores de 18 años, o entre los 60 y 65 años, se deberá evaluar cada caso según el mRS y las comorbilidades previas (Clase II, Nivel de Evidencia C)
– Realizar el procedimiento tanto en infartos del hemisferio cerebral derecho o izquierdo (Clase I, Nivel de evidencia A)
– Craniectomía descompresiva de fosa posterior en infartos cerebelosos extensos, con el objetivo de prevenir y evitar la herniación y compresión del tronco (Clase I, Nivel de evidencia B)
– En ACVi de fosa posterior, de requerir colocación de derivación ventricular externa, que la misma sea realizada posteriormente a la craniectomía descompresiva (Clase I, Nivel de evidencia C)
Prevención de complicaciones
Las complicaciones médicas que puede padecer un paciente internado por ACV constituyen un fuerte predictor de su supervivencia, tanto en lo que respecta a riesgo de muerte como dependencia futura.
Tromboembolismo venoso
Los pacientes hospitalizados por un ACV que presentan movilidad reducida tienen un riesgo elevado de tromboembolismo venoso, entendido como la entidad que abarca la TVP y el tromboembolismo pulmonar. Este riesgo es máximo durante los primeros 3 meses. Los métodos disponibles con evidencia para profilaxis son: la HNF, la HBPM y los dispositivos de compresión mecánica intermitente 48, 221, 222. La HNF y HBPM han demostrado reducir la incidencia de TEV a expensas de aumentar el riesgo de sangrado cuando se compara con un grupo control. La dosis considerada profiláctica en HNF es de 10 000 a 15 000 UI/día dividida en 2 o 3 dosis. La dosis de HBPM es de 3000 a 6000 UI/día. El comienzo de la profilaxis con heparina debe diferirse 24 horas cuando el paciente recibió trombolíticos y su duración es tema de debate. En principio debe mantenerse hasta el alta o la recuperación de movilidad 221. La compresión mecánica intermitente es efectiva para prevenir TVP en pacientes inmovilizados con ACV con escasos efectos adversos 223.
Se debe comenzar dentro de los 3 días de producido el ACV y está contraindicado su uso en úlceras o isquemia de miembros inferiores e insuficiencia cardíaca. Es útil en pacientes con alto riesgo de sangrado, pero como desventaja es difícil la adherencia para su uso.
Se recomienda:
– En ACVi con movilidad restringida, profilaxis con HNF, HBPM o compresión mecánica intermitente por sobre la no profilaxis (Clase I, Nivel de evidencia B)
Evaluación de la disfagia
La alteración de la deglución se observa en un 30 al 50% de los casos de ACV y se asocia con alto riesgo de neumonía, deshidratación y malnutrición. La presencia de deterioro del sensorio, pérdida del reflejo deglutorio, ausencia de reflejo tusígeno, disfonía, oclusión labial incompleta, compromiso de pares craneanos o alto puntaje de NIHSS, son signos de alerta y requieren evaluación por un equipo multidisciplinario. Debe realizarse tamizaje de disfagia como parte de la evaluación inicial dentro de las primeras horas de internado o antes de iniciar hidratación, medicamentos o alimentación por vía oral. Actualmente están validados distintos protocolos como Toronto Bedside Swallowing Sreening Test, Water-Swallow-Test y Multiple-Consistency-Test (previamente llamado GUSS). Si existe sospecha de alteración en la deglución, debe realizarse video-fluoroscopía (gold standard para estudio de la disfagia) o video-endoscopia de la deglución (FEES) para valorar el trastorno funcional y prescribir el tratamiento dietético y/o rehabilitador más adecuado 224-226.
Se recomienda:
– Evaluación de la deglución antes de que el paciente empiece a comer, beber o recibir medicamentos por vía oral (Clase I, Nivel de Evidencia C)
– Realizar una evaluación instrumental de la deglución en todos los ACV que no superen la prueba de disfagia (Clase IIa, Nivel de evidencia B)
– En ACVi sin hallazgos patológicos en el rastreo inicial de disfagia, una evaluación adicional de la deglución si existen otros predictores clínicos, como déficit neurológico grave, disartria o afasia marcada (Clase IIa, Nivel de evidencia B)
Hidratación y nutrición
Si el tamizaje de disfagia lo permite, la alimentación por vía oral debe ser de elección y temprana. Cuando la ingesta de alimentos no es posible en la etapa inicial, se debe comenzar con alimentación enteral de forma temprana, usualmente dentro de las 72 horas. La vía de elección es nasogástrica, a través de una sonda de pequeño calibre; siendo necesario corroborar su posición con radiología o aspiración de contenido gástrico y medición de pH antes del inicio de la alimentación. La alimentación nasogástrica no confiere mayor riesgo de neumonía con respecto a la duodenal o yeyunal. Si la alimentación enteral se prolonga por más de 2 a 3 semanas en pacientes clínicamente estables es razonable la colocación de una gastrostomía percutánea endoscópica. La colocación de sonda nasogástrica no interfiere en el tratamiento de la disfagia y se puede utilizar en forma paralela a la alimentación por vía oral 48, 222, 226.
Se recomienda:
– Que la alimentación se inicie lo antes posible, idealmente dentro de las primeras 48 horas luego de la admisión (Clase I, Nivel de evidencia B)
– Que los que no puedan recibir alimentos sólidos y líquidos por boca reciban alimentación enteral por sonda nasogástrica, sonda nasoduodenal o gastrostomía percutánea para mantener la hidratación y la nutrición mientras se rehabilita la deglución (Clase I, Nivel de evidencia B)
– Un consumo oral suficiente que cumpla con los niveles calóricos recomendados durante la fase aguda del ACVi, y de ser necesaria la nutrición enteral se administrará preferentemente a través de una sonda nasogástrica (Clase I, Nivel de evidencia A)
– La alimentación nasoenteral es preferible sobre la gastrostomía percutánea endoscópica en quienes no pueden ingerir líquidos o sólido por vía oral hasta 2 a 3 semanas después del inicio del ACV. Si se prevé dificultad en la deglución mayor a dicho tiempo, es razonable la colocación de gastrostomía percutánea (Clase IIa; Nivel de evidencia C)
Prevención de infecciones
Las complicaciones infecciosas más frecuentemente asociadas al ACV son las del tracto urinario y la neumonía, ésta ocurre en casos con mayor inmovilidad y pérdida de la tos. La movilización temprana y el tamizaje de la disfagia disminuyen la frecuencia 48, 222.
La infección del tracto urinario se presenta en 15 al 60% en ACV, debe ser sospechada si existe fiebre y/o deterioro neurológico de causa no explicada. Hay que evitar la colocación de sonda vesical.
Se recomienda:
– La movilización temprana para prevenir complicaciones (Clase I, Nivel de evidencia C)
– El tratamiento antibiótico ante la sospecha de neumonía o infección del tacto urinario (Clase I, Nivel de evidencia A)
– La implementación de protocolos de higiene oral para reducir el riesgo de neumonía (Clase II, Nivel de evidencia B)
No se recomienda:
– El uso rutinario de antibióticos profilácticos (Clase III, Nivel de evidencia B)
– La colocación rutinaria de sonda vesical debido al riesgo de infección del tracto urinario asociada al catéter (Clase III, Nivel de evidencia C)
Delirium
Se asocia a aumento de la morbi-mortalidad, prolongación de la estancia hospitalaria y de la institucionalización posterior al alta. Existen diversos factores que lo predisponen: edad mayor de 65 años, deterioro cognitivo, antecedente de delirium, depresión, dependencia funcional, inmovilidad, deshidratación, desnutrición, polifarmacia, múltiples comorbilidades y alteraciones metabólicas. Las complicaciones infecciosas, la carga de estrés ambiental, la sobrecarga y la privación sensorial, son complicaciones del ACV durante la internación, que pueden desarrollar delirium 227.
Se recomienda:
– La prevención del delirum en ACV, para lo cual es útil un enfoque integral que incluya una evaluación de factores de riesgo y la intervención temprana sobre ellos (Clase I, Nivel de evidencia C)
Prevención de aparición de úlceras por presión
La inmovilidad luego de un ACV favorece la aparición de úlceras por presión, en especial afectando zonas con prominencias óseas. Condiciones como edad avanzada, desnutrición o edemas, diabetes, deterioro cognitivo, incontinencia urinaria y/o fecal y pérdida de la sensibilidad predisponen a mayor riesgo. El 95% de las úlceras son prevenibles por lo que se debe evaluar regularmente la integridad de la piel en las zonas de presión, coloración, cambios de temperatura, firmeza y humedad, como así también el dolor o disconfort. Existen escalas clínicas que evalúan el riesgo de padecer úlceras por presión, pero ninguna demostró ser más eficaz que el juicio clínico 228, 229.
Se recomienda:
– Evaluar el riesgo y tomar medidas para evitar la aparición de úlceras por presión (Clase I, Nivel de evidencia C)
El cuidado estándar suele incluir los cuidados de la piel (higiene, lociones, cremas), una nutrición adecuada y el reposicionamiento corporal (rotación a 30° o 90°) a intervalos variables (cada 2, 4 o 6 horas). La evidencia es insuficiente para definir si estas maniobras son eficaces, no obstante, no deben ser abandonadas. En lo que respecta a tipo de apósitos locales y agentes tópicos para prevención de úlceras por presión (hidrocoloides, espuma, film), hay insuficiente evidencia para recomendar o refutar su uso para protección de la piel expuesta.
Rehabilitación temprana
Organización de la rehabilitación temprana
El tratamiento neurorrehabilitador será provisto por un equipo multidisciplinario, con especial entrenamiento enfermería, terapia ocupacional, kinesiología, fonoaudiología, salud mental y trabajo social), liderados por un neurólogo con entrenamiento en neurorrehabilitación o un médico fisiatra 230. Entre los beneficios relacionados a una atención temprana se destacan una mejor adherencia al plan y la reducción de las complicaciones a largo plazo.
No debe demorarse la evaluación de los posibles déficits: limitación de actividades y discapacidades cognitivas, comunicativas, compromisos psicológicos y trastornos de la deglución. Una completa determinación de las capacidades resulta de utilidad antes del alta hospitalaria mediante herramientas estandarizadas como la escala mRS, el Índice de Barthel 88, 89 o la Medida de Independencia Funcional (FIM) 231. Se recomienda que los pacientes sean provistos de herramientas formales para medir sus actividades de vida diaria, habilidades de comunicación y capacidad funcional 231. De acuerdo al grado de requerimientos se decidirá su posterior destino. La neurorrehabilitación y el lugar donde se realizará se planean según los requerimientos de cada caso (Tabla 12).
Alteraciones de la movilidad y prevención de las caídas
El 60% de los pacientes con hemiparesia desarrollan contracturas en los miembros superiores, con importantes dificultades para la recuperación de la funcionalidad de la mano dentro del primer año 231, 232. La presencia de estas contracturas representa un serio problema para el desempeño de actividades básicas, como el cuidado y la higiene. La forma más apropiada para la prevención de las contracturas musculares consiste en la movilización pasiva en conjunto con el grupo familiar, a partir de las primeras 24 horas desde el inicio del ACV, una apropiada posición de las articulaciones y la temprana rotación externa del miembro superior por treinta minutos diarios 233,234.
Otras medidas útiles son: evaluación musculoesquelética, detección de cualquier espasticidad, identificar posibles subluxaciones y realizar pruebas de la sensibilidad regional.
La utilización de ortesis externas que involucre el pie y a la articulación del tobillo puede mejorar la marcha, su empleo en casos de poca capacidad para caminar (no ambulatorios) en posición de 90 grados contribuye también a la prevención de las contracturas.
Para la atención de las alteraciones motoras, el balance y la función de las extremidades, se preconiza la aplicación de herramientas objetivas de medición y cuantificación de la discapacidad en el momento del alta. La escala de independencia funcional (FIM) es un indicador básico de la gravedad de la discapacidad, posible de ser empleado por cualquier efector sanitario, validado y diseñado para su utilización mediante una escala de 7 niveles que representan los grados de comportamiento dependiente e independiente y estiman la magnitud de la ayuda que requiere la discapacidad 88, 235. Contiene 18 ítems, cada uno puntúa de 1 (dependencia completa) a 7 (independencia completa) y consta de dos partes diferenciadas: la motora y la cognitiva, que pueden utilizarse
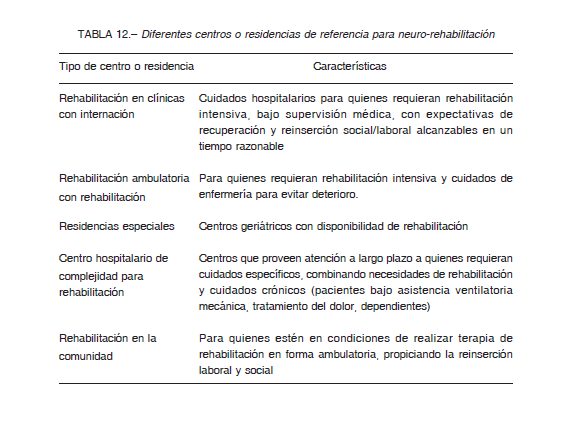
como escalas independientes. Las subescalas de FIM motor evalúan las funciones de: cuidado personal, control de esfínteres, movilidad y locomoción y las de FIM cognitivo miden la dependencia en las funciones de comunicación e interacción social. El rango de puntuación es de 18 (asistencia total en todas las áreas) a 126 (independencia completa en todas las áreas). Se ha de realizar dentro de las 72 horas previas al alta hospitalaria y, como máximo, a las 72 horas del ingreso en neurorrehabilitación. Se ha de puntuar lo que el paciente hace normalmente. Ningún ítem puede quedar sin puntuar: cuando no pueda evaluarse una función, o ésta requiera a dos personas, se asignará la puntuación más baja. Si la puntuación varía según el momento del día o el ambiente, se otorgará también la puntuación más baja.
Trastornos psiquiátricos
La existencia de trastornos psiquiátricos compromete el pronóstico, por lo que también influye en la rehabilitación.
La probabilidad de depresión aumenta con la gravedad del daño producido por el ACV 236 y se encuentra hasta en el 33% de los pacientes, muy por encima de la población general 237. Ciertas condiciones predicen el riesgo de depresión: sexo femenino, discapacidad importante previa al episodio agudo de ACV, historia familiar de enfermedad psiquiátrica y presentación con alteraciones cognitivas 238-241. La depresión afecta negativamente en la participación activa durante la rehabilitación 242, coexistiendo frecuentemente con el trastorno de ansiedad 243. La actividad física contribuye a la mejoría de los síntomas de la depresión 244-246. Por lo tanto, un tratamiento temprano de la depresión puede tener un efecto positivo en la rehabilitación.
Trastornos cognitivos
Las alteraciones cognitivas luego de un ACV, afecta a más de un tercio de los pacientes entre los 3 y 12 meses posteriores al evento 247. Estas alteraciones persisten por años en algunos individuos y se asocian a menor supervivencia, mayor discapacidad y mayores índices de institucionalización 248,249. Su evaluación debe ser una rutina establecida.
Los dominios más afectados son la memoria, orientación, lenguaje y atención. Un examen formal neuro-psicológico completo debe ser sensible para la detección de un amplio rango de discapacidades cognitivas, en especial las relacionadas a la realización de tareas ejecutivas y dependientes de atención. Es conveniente incluir las siguientes áreas: velocidad de procesamiento, atención simple y compleja y habilidades vinculadas con el lenguaje (recepción, expresión y repetición). Es necesario evaluar la praxia, la capacidad de habilidades visoespaciales, las diferentes modalidades de la memoria incluyendo las basadas en el lenguaje, la orientación visoespacial y el reconocimiento, la función ejecutiva (organización, priorización de tareas y alerta sobre fortaleza y debilidades), la capacidad para la resolución de problemas, la regulación emocional y el mantenimiento de las tareas 250.
Está recomendada la aplicación de herramientas objetivas para la evaluación cognitiva y cuando se encuentren alteraciones, deben ser estudiadas de manera específica y de forma más detallada 231. Con respecto al momento óptimo para su realización, sería razonable que la evaluación se realice una vez externado el paciente en las primeras consultas de seguimiento.
Rehabilitación y telemedicina
La implementación de las tecnologías de comunicación en la rehabilitación temprana (telerrehabilitación) representa una estrategia alternativa a incorporar, facilitando la comunicación e información cuando existe una considerable distancia de los efectores de salud. Cuenta con poca evidencia para efectuar una recomendación fuerte 251. En un estudio para evaluar un programa de telerrehabilitación, no hubo diferencias a los seis meses de su implementación en cuanto a la discapacidad y riesgo de caídas, aunque sí existieron diferencias a favor de la misma en cuanto al nivel de satisfacción 252,253. También existen experiencias a través de programas de automanejo a distancia, los cuales muestran resultados positivos en relación a la satisfacción por pacientes y cuidadores 254.
Todas las disciplinas implicadas en la rehabilitación del ACV deberían considerar la posible utilidad de la telemedicina para el tratamiento y asesoramiento 255.
Planificación del alta hospitalaria
Los cuidados transicionales son un conjunto de acciones destinadas a asegurar la coordinación y continuidad en la atención de salud. La planificación al alta es fundamental en este proceso 256. La coordinación entre los diferentes niveles de atención, la comunicación entre los profesionales y la educación al paciente y su familia o cuidadores, son factores determinantes.
La transición en la atención mejora la calidad de vida, la función física y la satisfacción, a la vez que logra disminuir los costos y las reinternaciones 254. El plan de cuidados debe ser adaptado a las necesidades del paciente y cuidadores. Se deben considerar posibles problemas que pudiesen retrasar el alta y acordar la misma. Evaluar las necesidades psicosociales, educación en prevención secundaria, evaluación del domicilio para identificar eventuales modificaciones de accesibilidad y seguridad., y otorgar un plan de acción para la recuperación y entrenamiento de habilidades 256.
Se recomienda:
– Iniciar la rehabilitación durante la internación, tan pronto como el paciente esté listo y pueda tolerarla (Clase I, Nivel de evidencia A)
– Que el paciente con ACVi reciba una rehabilitación interdisciplinaria, coordinada y organizada (Clase I, Nivel de evidencia B)
– Realizar durante la internación una evaluación para valorar los déficits instaurados, los requerimientos de rehabilitación y los cuidados necesarios, así como el grado de contención familiar y social (Clase I, Nivel de evidencia B)
– Una evaluación formal que incluya lenguaje, praxias, memoria y respuestas emotivas, para detectar en forma precoz alteración cognitiva (Clase IIa, Nivel de evidencia C)
– Que el plan de cuidados sea revisado con regularidad en función de los cambios en el estado de salud del paciente, sus necesidades, objetivos y evolución clínica y funcional (Clase I, Nivel de evidencia C)
No se recomienda:
– La movilización intensa y precoz (dentro de las 24 horas de iniciado los síntomas), ya que puede reducir las posibilidades de un buen pronóstico (Clase III, Nivel de evidencia B)
Telemedicina
La telemedicina es un método para la atención médica y soporte a otros profesionales a través del uso de tecnologías de telecomunicación. Puede adaptarse a distintas opciones (por ejemplo, videoconferencia y aplicaciones en celulares). Este enfoque se ha expandido en los últimos años y en distintas especialidades, entre ellas en la atención del ACV. Esto se lo conoce como “telestroke” o “tele-ACV” 257, 258. Su utilidad radica en la posibilidad de incrementar el acceso a la trombolisis endovenosa en la etapa aguda del ACVi. El sistema de tele-ACV permite conectar centros en áreas rurales o suburbanas con centros regionales que atiendan con mayor frecuencia el ACV agudo 259.
Beneficios del tele-ACV
Mediante la telemedicina, las instituciones podrán beneficiarse de un soporte para el tratamiento del ACVi agudo las 24 h del día, los 365 días del año. De esta manera, un mayor número de pacientes tendrán acceso al tratamiento de reperfusión sin demoras innecesarias, iniciándolo en el hospital de origen y, en caso de ser necesario, acceder al hospital de referencia para técnicas neurointervencionistas 260. Posee utilidad para la ayuda en la interpretación de las neuro-imágenes, la mejora en los tiempos intrahospitalarios de atención y en la toma decisión de traslado a centros de mayor complejidad 261.
Elementos necesarios para su implementación
Habitualmente, los modelos disponibles de tele-ACV se conocen como “spoke and hub”. “Spoke” hace referencia al centro solicitante de la consulta, habitualmente un centro primario con menor experiencia en tratamiento de reperfusión intravenosa (desde ahora, centro remoto).
La comunicación se establece con un centro de mayor experiencia llamado “hub” (desde ahora, centro integral), que permitirá la evaluación inicial para determinar si se puede iniciar un tratamiento de reperfusión intravenosa 262.
Para establecer la conexión se utiliza un equipo audiovisual bidireccional que permite presenciar el examen detallado, combinado con un sistema para transmitir de manera fiable los resultados de las imágenes. La videoconferencia incluirá imagen y sonido de alta resolución y se realizará a través de un servidor en el que se utilizarán claves y contraseñas propias para establecer una conexión segura, permitiendo la confidencialidad de datos. En el área de observación del centro remoto estará instalado un equipo informático móvil, que incluye una videocámara de alta resolución, con el que se realizará la conexión de videoconferencia. De igual modo, el centro integral tendrá instalado un equipo informático con videocámara y audio 263.
El médico con mayor responsabilidad durante una consulta de tele-ACV es el que se encuentra junto al paciente en el sitio desde donde se origina la consulta. La decisión de realizar el tratamiento es tomada a través del consenso entre el médico en el sitio receptor, el especialista consultor, el paciente y su familia, luego de haber explicado los beneficios y los riesgos. El médico consultor del sitio integral debe estar disponible para consultas posteriores al tratamiento hiperagudo y proveer, finalizada la consulta, un resumen por escrito del proceso, para ser incluido en la historia clínica.
Se recomienda:
– La implementación, regulación y promoción de leyes destinadas a la organización de un sistema de tele-ACV a nivel nacional (Clase I, Nivel de Evidencia C)
– Que la red de tele-ACV le permita al centro remoto el acceso a un neurólogo con experiencia en ACV para realizar consultas, diagnóstico y tratamiento, incluyendo la administración de tratamiento de reperfusión con trombolisis endovenosa (Clase I, Nivel de evidencia B)
– Protocolos estandarizados para un trabajo coordinado y eficiente del servicio de tele-ACV y que tanto el médico consultante como el personal del centro remoto tengan entrenamiento en la realización de la escala NIHSS (Clase IIa, Nivel de evidencia B)
– Que el médico del centro integral tenga acceso en tiempo real a los métodos de diagnóstico por imágenes durante la consulta (Clase I, Nivel de evidencia A)
– Que el médico consultor se encuentre accesible para guiar la atención posterior luego de la administración de trombolisis endovenosa, así como en la internación y al momento de la planificación del alta (Clase IIb, Nivel de evidencia C)
– Contar con documentación estandarizada, tanto en el sitio remoto como en el sitio integral, que se adapte a los procesos hospitalarios vigentes, la legislación de cada jurisdicción y las regulaciones médicas aceptadas para el tratamiento del ACV en la etapa aguda (Clase I, Nivel de evidencia C)
En conclusión, la enfermedad cerebrovascular es la tercera causa de muerte en el mundo occidental y es la primera causa de discapacidad permanente. De ahí la importancia del tratamiento correcto para reducir la mortalidad y morbilidad. El ACV es una urgencia médica que precisa atención hospitalaria inmediata para prevenir las complicaciones y evitar las recurrencias; para ello es imprescindible un diagnóstico etiológico certero, que permita realizar el tratamiento en la fase aguda y establecer una prevención secundaria adecuada a cada caso. Aunque existen consensos y guías internacionales de excelencia, algunas de las recomendaciones no son aplicables a nuestro medio por falta de disponibilidad de algunas drogas, requerimientos técnicos o de infraestructura. Es por eso que un grupo integrado por nueve sociedades médicas realizó este consenso adaptando la mejor evidencia disponible a nuestra realidad asistencial.
Agradecimientos: A los revisores externos (por orden alfabético): Sebastián F. Ameriso 1, Nicolás Ciarrochi 4, Francisco Klein 3, María Cristina Zurrú 1,4,5, y la revisora de estilo Claudia Alonzo 4.
Conflicto de intereses: Ninguno para declarar
Bigliografía
1. Casaubon LK, Boulanger JM, Glasser E, et al. Canadian Stroke Best Practice Recommendations: Acute Inpatient Stroke Care Guidelines, Update 2015. Int J Stroke 2016; 11: 239-52.
2. Cumbler E, Wald H, Bhatt DL, et al. Quality of care and outcomes for in-hospital ischemic stroke: findings from the National Get With The Guidelines-Stroke. Stroke 2014; 45: 231-8.
3. World Stroke Organization (WSO) Stroke Guideline Development Handbook 2009. En: http://www.world-stroke. org/; consultado julio 2018.
4. Feigin VL, Forouzanfar MH, Krishnamurthi R, et al. Global and regional burden of stroke during 1990–2010: findings from the Global Burden of Disease Study 2010. Lancet 2014; 383: 245-55.
5. Feigin V, Lawes C, Bennett D, Anderson C. Stroke epidemiology: a review of population-based studies of incidence, prevalence, and case-fatality in the late 20th century. Lancet Neurol 2003; 2:43-53.
6. Sudlow CL, Warlow CP. Comparing stroke incidence worldwide: what makes studies comparable? Stroke 1996; 27: 550-8.
7. Malmgren R, Warlow C, Bamford J, Sandercock P. Geographical and secular trends in stroke incidence. Lancet 1987; 2: 1196-200.
8. Saposnik G, Del Bruto OH. Stroke in South America: A Systematic Review of Incidence, Prevalence, and Stroke Subtypes. Stroke 2003; 34: 2103-7.
9. Díaz AA, Antía MF, Roldán E, Gonorazky SE. Seasonal variation and trends in Stroke hospitalizations and mortality in South American Community Hospital. J Stroke Cerebrovasc Dis 2013; 22:e66-9.
10. Echevarría-Martín G, Gonorazky SE, Gaspari M, Valussi C, Femminini R. Primer episodio de hemorragia subaracnoidea no traumática. Estudio epidemiológico de su incidencia y de la hipertensión arterial como un factor de riesgo Rev Neurol 2003; 37: 425-30.
11. Melcon CM, Melcon MO. Prevalence of stroke in an Argentine community. Neuroepidemiology 2006; 27:81-8.
12. Bahit MC, Coppola ML, Riccio PM, et al. First-ever stroke and transient ischemic attack incidence and 30-day casefatality rates in a population-based study in Argentina. Stroke 2016; 47: 1640-2.
13. Clementti P, Wajser B, Szulman C, et al. Tratamiento con alteplasa en infarto cerebral en la Unidad de Stroke (Registro TAICUS). Rev Fed Arg Cardiol 2008; 37:41-7.
14. Atallah A, Fustinoni O, Zurru M, et al. Identifying barriers in acute stroke therapy in Argentina. ARENAS registry. Neurology 2014; 82 (10 Supplement): P2.014.
15. Sposato L, Esnaola MM, Zamora R, Zurrú MC, Fustinoni O, Saposnik G. Quality of ischemic stroke care in emerging countries. Stroke 2008; 39: 3036-41.
16. Rodríguez GE, González LA, Luraschi AN, Melamud L, Lepera SM, Rey RC. Atención del stroke agudo en una unidad de stroke y una sala general. Neurol Arg 2010; 2:8-13.
17. Somoza MJ, Melcon MO. Número de neurólogos y carga de enfermedades neurológicas en Argentina. Neurol Arg 2015; 7: 89-94.
18. Estadísticas vitales, información básica. Ministerio de Salud de la Nación. 2015. En: http://www.deis.msal. gov.ar/wp-content/uploads/2016/12/Serie5Numero59.pdf; consultado marzo 2018.
19. Jauch EC, Saver JL, Adams HP, et al. Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke 2013; 44: 870-947.
20. Jørgensen HS, Kammersgaard LP, Houth J, et al. Who benefits from treatment and rehabilitation in a stroke unit? A community-based study. Stroke 2000; 31: 434-9.
21. Stroke Unit Trialists’ Collaboration. Organised inpatient (stroke unit) care for stroke. Cochrane Database Syst Rev 2013; 11: CD000197.
22. Glader E, Stegmayr B, Johansson L, Hulter-Åsberg K, Wester PO. Differences in long-term outcomes between patients treated in stroke units and in general wards. A 2-year follow-up of stroke patients in Sweden. Stroke 2001; 32: 2124-30.
23. Saver JL. Time is brain-quantified. Stroke 2006; 37: 263-6.
24. Esnaola MM, Gregori L, Ferrante D. Protocolo de manejo inicial del ataque cerebro-vascular isquémico agudo. Ministerio de Salud de la Nación. 2015. En: http://www. msal.gob.ar/ent/images/stories/programas/pdf/2015-11_ protocolo-ACV_3Nov2015.pdf; consultado mayo 2018.
25. Jauch EC, Cucchiara B, Adeoye O, et al. 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2010; 122 (suppl 3): S818-28.
26. Peberdy MA, Callaway CW, Neumar RW, et al. Part 9: post-cardiac arrest care: 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2010; 122 (Suppl 3): S768-86.
27. Walter S, Kostopoulos P, Haass A, et al. Diagnosis and treatment of patients with stroke in a mobile stroke unit versus in hospital: a randomized controlled trial. Lancet Neurol 2012; 11: 397-404.
28. Kunz A, Ebinger M, Geisler F, et al. Funtcional outcomes of pre-hospital thrombolysis in a mobile stroke treatment unit compared with conventional care: an observational registry study. Lancet Neurol 2016; 15: 1035-43.
29. Kidwell CS, Starkman S, Eckstein M, Weems K, Saver JL. Identifying stroke in the field: prospective validation of the Los Angeles prehospital stroke screen (LAPSS). Stroke 2000; 31: 71-6.
30. Kothari RU, Pancioli A, Liu T, Brott T, Broderick J. Cincinnati Prehospital Stroke Scale: reproducibility and validity. Ann Emerg Med 1999; 33: 373-8.
31. Real Academia Española. Diccionario de la lengua española. 23ma. Edición (versión digital). En: http://dle.rae. es/?id = abWBvDs y en http://dle.rae.es/?id = abnDzsc; consultado abril 2018.
32. Gomez Jiménez J. Clasificación de pacientes en los servicios de urgencias y emergencias: hacia un modelo de triaje estructurado de urgencias y emergencias. Emergencias 2003; 15: 165-74.
33. Lindsay P, Furie KL, Davis SM, Donnan GA, Norrving B. World Stroke Organization global stroke services guidelines and action plan. Int J Stroke 2014; Supl A100: 4-13.
34. Meteroja A, Strbian D, Mustanoja S, Tatlisumak T, Lindsberg PJ, Kaste M. Reducing in-hospital delay to 20 minutes in stroke thrombolysis. Neurology 2012; 79: 306-13.
35. Meteroja A, Weir L, Ugalde M, et al. Helsinki model cut stroke thrombolysis delays to 25 minutes in Melbourne in only 4 months. Neurology 2013; 81:1071-6.
36. Mackway-Jones K. Emergency Triage: Manchester Triage Group. London: BMJ Publishing Group, 1997.
37. Beveridge R. The Canadian Triage and Acuity Scale: a new and critical element in health care reform. Canadian Association of Emergency Physicians. J Emerg Med 1998; 16: 507-11.
38. Wuerz R, Milne L, Eitel D, Wiencek J, Simonds W. Pilot phase reliability of a new five-level triage algorithm. Acad Emerg Med 1999; 6: 398-9.
39. Wuerz RC, Travers D, Gilboy N, Eitel DR, Rosenau A, Yazhari R. Implementation and refinement of the Emergency Severity Index. Acad Emerg Med 2001; 8: 170-6.
40. Australasian College of Emergency Medicine. Policy document: A National Triage Scale. Emerg Med 1994; 6: 145-6.
41. Schuetz P, Hausfater P, Amin D, et al. Optimizing triage and hospitalization in adult general medical emergency patients: the triage project. BMC Emerg Med 2013; 13: 12.
42. Zachariasse JM, Seiger N, Rood PP, et al. Validity of the Manchester Triage System in emergency care: A prospective observational study. PLoS One 2017; 12: e0170811.
43. van Dishoeck, A. Measuring Quality Improvement in Acute Ischemic Stroke Care: Interrupted Time Series Analysis of Door-to-Needle Time. Cerebrovasc Dis Extra 2014; 4: 149-155
44. Ching-Yi L, Han-Chie H, Pi-Shan S, Chih-Hung C. “Triage Stroke Code” program with series of training lessons shorten the time to thrombolysis in emergency department setting. J Stroke Cerebrovasc Dis 2017; 26: 899-900.
45. Stroke Foundation Australia. Pre-hospital care. Clinical guidelines for stroke management 2017. En: https:// strokefoundation.org.au/What-we-do/Treatment-programs/ Clinical-guidelines; consultado junio 2018.
46. NICE. National Clinical Guideline for Stroke Prepared by the Intercollegiate Stroke Working Party. 5t Edition. 2016. En: https://www.strokeaudit.org/SupportFiles/Documents/ Guidelines/2016-National-Clinical-Guideline-for-Stroke- 5t-(1).aspx; consultado junio 2018.
47. Anderson JA. The golden hour. Performing an acute ischemic stroke workup. Nurse Pract 2014; 18; 39:22-9.
48. Powers WJ, Rabinstein AA, Ackerson T, et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke 2018; 49: e46-110.
49. National Institute of Neurological Disorders and Stroke Symposium. Improving the chain of recovery for acute stroke in your community: task force reports. Bethesda, MD: National Institutes of Health, Department of Health and Human Services; 2003. En: https://searchworks. stanford.edu/view/5530931; consultado mayo 2018.
50. European Stroke Organization (ESO) Executive Committee, ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25: 457-507.
51. Domínguez R, Vila JF, Augustovski F, et al. Spanish cross-cultural adaptation and validation of the National Institutes of Health Stroke Scale. Mayo Clin Proc 2006; 81: 476-80.
52. Villalobos E, Barnes SR, Qureshi IA, Cruz-Flores S, Maud A, Rodriguez GJ. Spanish Version of the National Institutes of Health Stroke Scale: Awareness and Use in United States. A Survey Study. J Vasc Interv Neurol 2017; 9: 1-6.
53. Montaner J, Álvarez-Sabín J. La escala de ictus del National Institute of Health (NIHSS) y su adaptación al español. Neurología 2006; 1: 192-202.
54. Nedeltchev K, Renz N, Karameshev A, et al. Predictors of early mortality after acute ischaemic stroke. Swiss Med Wkly 2010; 140: 254-9.
55. Weimar C, König IR, Kraywinkel K, Ziegler A, Diener HC, German Stroke Study Collaboration. Age and National Institutes of Health Stroke Scale Score within 6 hours after onset are accurate predictors of outcome after cerebral ischemia. Stroke 2004; 35: 158-62.
56. Hénon H, Godefroy O, Leys D, et al. Early predictors of dath and disability after acute cerebral ischemic event. Stroke 1995; 26: 392-8.
57. Johnston KC, Connors AFJr, Wagner DP, et al. A predictive risk model for outcomes of ischemic stroke. Stroke 2000; 31: 448-55.
58. Duncan PW, Zorowitz R, Bates B, et al. Management of adult stroke rehabilitation care. A clinical practice guideline. Stroke 2005; 36:e100-43.
59. Blacquiere D, Lindsay MP, Foley N, et al. Canadian Stroke Best Practice Recommendations: Telestroke Best Practice Guidelines Update 2017. Int J Stroke 2017; 12: 886-95.
60. Fonarow GC, Saver JL, Smith EE, et al. Relationship of national nnstitutes of health stroke scale to 30-day mortality in medicare bene?ciaries with acute ischemic stroke. J Am Heart Assoc 2012; 1: 42-50.
61. Ministerio de Salud. Gobierno de Chile. Guía Clínica Accidente Cerebro Vascular Isquémico. En: https://www. minsal.cl/portal/url/item/7222754637e58646e04001011f 014e64.pdf; consultado abril 2018.
62. Cooray C, Fekete K, Mikulik R, Lees KR, Wahlgren N, Ahmed N. Threshold for NIH stroke scale in predicting vessel occlusion and functional outcome after stroke thrombolysis. Int J Stroke 2015; 10: 822-9.
63. Wahlgren N, Moreira T, Michel P, et al. Mechanical thrombectomy in acute ischemic stroke: Consensus statement by ESO-Karolinska Stroke Update 2014/2015, supported by ESO, ESMINT, ESNR and EAN. Int J Stroke 2016; 11: 134-47.
64. Heldner MR, Zubler C, Mattle HP, et al. National Institutes of Health stroke scale score and vessel occlusion in 2152 patients with acute ischemic stroke. Stroke 2013; 44: 1153-7.
65. Demaerschalk BM, Kleindorfer DO, Adeoye OM, et al. Scientific rationale for the inclusion and exclusion criteria for intravenous alteplase in acute ischemic stroke. A statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2016; 47: 581-641.
66. McTaggart RA, Ansari SA, Goyal M, et al. Initial hospital management of patients with emergent large vessel occlusion (ELVO): report of the standards and guidelines committee of the Society of Neuro Interventional Surgery. J Neurointerv Surg 2017; 9: 316-23.
67. Fonarow GC, Alberts MJ, Broderick JP, et al. Stroke outcomes measures must be appropriately risk adjusted to ensure quality care of patients. Stroke 2014; 45: 1589-601.
68. The National Institute of Neurological Disorders and Stroke rtPA Stroke Study Group. Tissue Plasminogen Activator for Acute Stroke. N Engl J Med 1995; 333: 1581-7.
69. Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359: 1317-29.
70. Romano JG, Smith EE, Liang L, et al. Outcomes in mild acute ischemic stroke treated with intravenous thrombolysis. A retrospective analysis of the get with the guidelinesstroke registry. JAMA Neurol 2015; 72: 423-31.
71. Saposnik G, Fang J, Kapral MK, et al. The iScore predicts effectiveness of thrombolytic therapy for acute ischemic stroke. Stroke 2012; 43: 1315-22.
72. Saposnik G, Guzik AK, Reeves M, Ovbiagele B, Johnston SC. Stroke prognostication using age and NIH stroke scale. SPAN-100. Neurology 2013; 80: 21-8.
73. Strbian D, Engelter S, Michel P, et al. Symptomatic intracranial hemorrhage after stroke thrombolysis: the SEDAN score. Ann Neurol 2012; 71: 634-41.
74. Mazya M, Egido JA, Ford GA, et al. Predicting the risk of symptomatic intracerebral hemorrhage in ischemic stroke treated with intravenous alteplase: safe implementation of Treatments in Stroke (SITS) symptomatic intracerebral hemorrhage risk score. Stroke 2012; 43: 1524-31.
75. Lou M, Safdar A, Mehdiratta M, et al. The HAT Score. A simple grading scale for predicting hemorrhage after thrombolysis. Neurology 2008; 71: 1417-23.
76. Souza LC, Yoo AJ, Chaudhry ZA, et al. Malignant CTA collateral profile is highly specific for large admission DWI infarct core and poor outcome in acute stroke. Am J Neuroradiol 2012; 33: 1331-6.
77. Rothwell PM, Giles MF, Flossmann E, et al. A simple score (ABCD) to identify individuals at high early risk of stroke after transient ischaemic attack. Lancet 2005; 366: 29-36.
78. Johnston SC, Rothwell PM, Nguyen-Huynh MN, et al. Validation and re?nement of scores to predict very early stroke risk after transient ischaemic attack. Lancet 2007; 369: 283-92.
79. Perry JJ, Sharma M, Sivilotti MLA, et al. Prospective validation of the ABCD2 score for patients in the emergency department with transient ischemic attack. CMAJ 2011; 183: 1137-45.
80. Giles MF, Albers GW, Amarenco P, et al. Early stroke risk and ABCD2 score performance in tissue-vs time-defined TIA. Neurology 2011; 77: 1222-8.
81. Redgrave JN, Coutts SB, Schulz UG, Briley D, Rothwell PM. Systematic review of associations between the presence of acute ischemic lesions on diffusion-weighted imaging and clinical predictors of early stroke risk after transient ischemic attack. Stroke 2007; 38: 1482-8.
82. Barber PA, Demchuk AM, Zhang J, Buchan AM. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score. Lancet 2000; 355: 1670-4.
83. Powers WJ, Derdeyn CP, Biller J, et al. 2015 American Heart Association/American Stroke Association Focused Update of the 2013 Guidelines for the Early Management of Patients With Acute Ischemic Stroke Regarding Endovascular Treatment: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke 2015; 46: 3020-35.
84. Saver JL, Goyal M, van der Lugt A, et al. Time to treatment with endovascular thrombectomy and outcomes from ischemic stroke: a meta-analysis. JAMA 2016; 316: 1279-88.
85. Schröder J, Thomalla G. A critical review of Alberta Stroke Program Early CT Score for evaluation of acute stroke imaging. Front Neurol 2017; 7: 245.
86. Berkhemer OA, Fransen PS, Beumer D, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Eng J Med 2015; 372: 11-20.
87. Spiotta AM, Vargas J, Hawk H, et al. Impact of the ASPECT scores and distribution on outcome among patients undergoing thrombectomy for acute ischemic stroke. J Neurointerv Surg 2014; 7: 551-8.
88. Mahoney FI, Barthel DW. Functional evaluation: the Barthel Index. Md State Med J 1965; 14: 61-5.
89. Collin C, Wade DT, Davies S, Horne V. The Barthel ADL Index: a reliability study. Int Disabil Stud 1988; 10: 61-3.
90. Baztán JJ, Pérez del Molino J, Alarcón T, San Cristóbal E, Izquierdo G, Manzarbeitia I. Índice de Barthel: instrumento válido para la valoración funcional de pacientes con enfermedad cerebrovascular. Rev Esp Geritr Gerontol 1993; 28: 32-40.
91. Kasner SCE. Clinical interpretation and use of stroke scales. Lancet Neurol 2006; 5: 603-12.
92. van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJA, van Gijn J. Interobserver agreement for the assessment of handicap in stroke patients. Stroke 1988; 19: 604-7.
93. Quinn TJ, Dawson J, Walters MR, Lees KR. Functional outcome measures in contemporary stroke trials. Int J Stroke 2009; 4: 200-6.
94. Quinn TJ, Dawson J, Walters M, Lees K. Variability in modified Rankin scoring across a large cohort of international observers. Stroke 2008; 39: 2975-9.
95. Ministerio de Salud de la República de Chile. Guía Clínica AUGE. Año 2013. En: https://www.minsal.cl/portal/url/ite m/7222754637e58646e04001011f014e64.pdf; consultado abril 2018.
96. Liu L, Xu A, Wong L, et al. Chinese Consensus Statement on the Evaluation and Intervention of Collateral Circulation for Ischemic Stroke. CNS Neurosci Ther 2014; 20: 202-8.
97. Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014; 45: 2160-236.
98. Habib G, Hoen B, Tornos P, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the ESC. Eur Heart J 2009; 30: 2369-413.
99. Dzialowski I, Hill MD, Coutts SB, et al. Extent of early ischemic changes on computed tomography (CT) before thrombolysis: prognostic value of the Alberta Stroke Program Early CT Score in ECASS II. Stroke 2006; 37: 973-8.
100. Saur D, Kucinski T, Grzyska U, et al. Sensitivity and interrater agreement of CT and diffusion-weighted MR imaging in hyperacute stroke. Am J Neuroradiol 2003; 24: 878-85.
101. von Kummer R, Nolte PN, Schnittger H, Thron A, Ringelstein EB. Detectability of cerebral hemisphere ischaemic infarcts by CT within 6 h of stroke. Neuroradiology 1996; 38: 31-3.
102. Hacke W, Kaste M, Fieschi C, et al. Intravenous thrombolysis with recombinant tissue plasminogen activator for acute hemispheric stroke. The European Cooperative Acute Stroke Study (ECASS). JAMA 1995; 274: 1017-25.
103. Pexman JH, Barber PA, Hill MD, et al. Use of the Alberta Stroke Program Early CT Score (ASPECTS) for assessing CT scans in patients with acute stroke. Am J Neuroradiol 2001; 22: 1534-42.
104. Barber PA, Demchuk AM, Zhang J, Buchan AM. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy: ASPECTS Study Group: Alberta Stroke Programme Early CT Score. Lancet 2000; 355: 1670-4.
105. Kidwell CS, Alger JR, Di Salle F, et al. Diffusion MRI in patients with transient ischemic attacks. Stroke 1999; 30: 1174-80.
106. Truwit CL, Barkovich AJ, Gean-Marton A, Hibri N, Norman D. Loss of the insular ribbon: another early CT sign of acute middle cerebral artery infarction. Radiology 1990; 176:801-6.
107. von Kummer R, Meyding-Lamade U, Forsting M, et al. Sensitivity and prognostic value of early CT in occlusion of the middle cerebral artery trunk. Am J Neuroradiol 1994; 15: 9-15.
108. Tomsick T, Brott T, Barsan W, et al. Prognostic value of the hyperdense middle cerebral artery sign and stroke scale score before ultraearly thrombolytic therapy. Am J Neuroradiol 1996; 17: 79-85.
109. Barber PA, Demchuk AM, Hudon ME, Pexman JH, Hill MD, Buchan AM. Hyperdense sylvian fissure MCA “dot” sign: a CT marker of acute ischemia. Stroke 2001; 32: 84-8.
110. Bash S, Villablanca JP, Jahan R, et al. Intracranial vascular stenosis and occlusive disease: evaluation with CT angiography, MR angiography, and digital subtraction angiography. Am J Neuroradiol 2005; 26: 1012-21.
111. Qureshi AI, Cinnamon J, Fountain J, et al. Magnetic resonance angiography in patients with brain infarction. J Neuroimaging 1998; 8: 65-70.
112. Breuer L, Schellinger PD, Huttner HB, et al. Feasibility and safety of magnetic resonance imaging-based thrombolysis in patients with stroke on awakening: initial single-centre experience. Int J Stroke 2010; 5: 68-73.
113. Smith WS, Roberts HC, Chuang NA, et al. Safety and feasibility of a CT protocol for acute stroke: combined CT, CT angiography, and CT perfusion imaging in 53 consecutive patients. Am J Neuroradiol 2003; 24: 688-90.
114. Wintermark M, Reichhart M, Thiran JP, et al. Prognostic accuracy of cerebral blood ow measurement by perfusion computed tomography, at the time of emergency room admission, in acute stroke patients. Ann Neurol 2002; 51: 417-32.
115. Oliveira-Filho J, Martins SCO, Pontes-Neto OM, et al. Guidelines for acute ischemic stroke treatment: part I. Arq Neuropsiquiatr 2012; 70: 621-9.
116. Chalela JA, Kidwell CS, Nentwich LM, et al. Magnetic resonance imaging and computed tomography in emergency assessment of patients with suspected acute stroke: a prospective comparison. Lancet 2007; 369: 293-8.
117. Mlynash M, Olivot JM, Tong DC, et al. Yield of combined perfusion and diffusion MR imaging in hemispheric TIA. Neurology 2009; 72: 1127-33.
118. Wintermark M, Sanelli PC, Albers GW, et al. Imaging recommendations for acute stroke and transient ischemic attack patients: a joint statement by the American Society of Neuroradiology, the American College of Radiology, and the Society of NeuroInterventional Surgery. Am J Neuroradiol 2013; 34: E117-27.
119. Albers GW, Thijs VN, Wechsler L, et al. Magnetic resonance imaging profiles predict clinical response to early reperfusion: the diffusion and perfusion imaging evaluation for understanding stroke evolution (DEFUSE) study. Ann Neurol 2006; 60: 508-17.
120. Kidwell CS, Chalela JA, Saver JL, et al. Comparison of MRI and CT for detection of acute intracerebral hemorrhage. JAMA 2004; 292: 1823-30.
121. Boulanger JM, Coutts SB, Eliasziw M, et al. Cerebral microhemorrhages predict new disabling or fatal strokes in patients with acute ischemic stroke or transient ischemic attack. Stroke 2006; 37: 911-4.
122. Fiehler J, Albers GW, Boulanger JM, et al. Bleeding Risk Analysis in Stroke Imaging before Thrombolysis (BRASIL): pooled analysis of T2*-weighted magnetic resonance imaging data from 570 patients. Stroke 2007; 38: 2738-44.
123. National Institute of Neurological Disorders and Stroke rtPA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333: 1581-7.
124. American College of Emergency Physicians, American Academy of Neurology. Clinical Policy: use of intravenous tPA for the management of acute ischemic stroke in the emergency department. Ann Emerg Med 2013; 61: 225-43.
125. Lees KR, Bluhmki E, von Kummer R, et al. ECASS, ATLANTIS, NINDS and EPITHET rt-PA Study Group. Time to treatment with intravenous alteplase and outcome in stroke: an updated pooled analysis of ECASS, ATLANTIS, NINDS, and EPITHET trials. Lancet 2010; 375: 1695-703.
126. IST-3 Collaborative Group. The benefits and harms of intravenous thrombolysis with recombinant tissue plasminogen activator within 6 h of acute ischaemic stroke: a randomized controlled trial. Lancet 2012; 379: 2352-63.
127. Qureshi, A. Buffalo Metropolitan Area and Erie County Stroke Study Group. Time to hospital arrival, use of thrombolytics, and in-hospital outcomes in ischemic stroke. Neurology 2005; 64: 2115-20.
128. De Keyser J, Gdovinová Z, Uyttenboogaart M, Vroomen PC, Luijckx GJ. Intravenous alteplase for stroke: beyond the guidelines and in particular clinical situations. Stroke 2007; 38: 2612-8.
129. Smith EE, Abdullah AR, Petkovska I, Rosenthal E, Koroshetz WJ, Schwamm LH. Poor outcomes in patients who do not receive intravenous tissue plasminogen activator because of mild or improving ischemic stroke. Stroke 2005; 36: 2497-9.
130. Barber PA, Zhang J, Demchuk AM, Hill MD, Buchan AM. Why are stroke patients excluded from TPA therapy? An analysis of patient eligibility. Neurology 2001; 56: 1015-20.
131. García-Moncó JC, Pinedo A, Escalza I, et al. Analysis of the reasons for exclusion from tPA therapy after early arrival in acute stroke patients. Clin Neurol Neurosurg 2007; 109: 50-3.
132. Laloux P, Thijs V, Peeters A, Desfontaines P. Obstacles to the use of intravenous tissue plasminogen activator for acute ischemic stroke: is time the only barrier? Acta Neurol Belg 2007; 107: 103-7.
133. Rajajee V, Kidwell C, Starkman S, et al. Early MRI and outcomes of untreated patients with mild or improving ischemic stroke. Neurology 2006; 67: 980-4.
134. Hill MD, Buchan AM; Canadian Alteplase for Stroke Effectiveness Study (CASES) Investigators. Thrombolysis for acute ischemic stroke: results of the Canadian Alteplase for Stroke Effectiveness Study. CMAJ 2005; 172: 1307-12.
135. Wahlgren N, Ahmed N, Dávalos A, et al. Thrombolysis with alteplase for acute ischaemic stroke in the Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS-MOST): an observational study. Lancet 2007; 369: 275-82.
136. Hill MD, Lye T, Moss H, et al. Hemi-orolingual angioedema and ACE inhibition after alteplase treatment of stroke. Neurology 2003; 60: 1525-7.
137. Hill MD, Barber PA, Takahashi J, Demchuk AM, Feasby TE, Buchan AM. Anaphylactoid reactions and angio edema during alteplase treatment of acute ischemic stroke. CMAJ 2000; 162: 1281-4.
138. Kamal N, Benavente O, Boyle K, et al. Good is not good enough: the benchmark stroke door-to-needle time should be 30 minutes. Can J Neurol Sci 2014; 41: 694-6.
139. Saqqur M, Uchino K, Demchuk A, et al. Site of arterial occlusion identified by transcranial Doppler predicts the response to intravenous thrombolysis for stroke. Stroke 2007; 38: 948-54.
140. Campbell B, Mitchell PJ, Kleinig TJ, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015; 372: 1009-18.
141. Saver JL, Goyal M, Bonafe A, et al. Stent-retriever thrombectomy after intravenous t-PA vs.t-PA alone in stroke. N Engl J Med 2015; 372: 2285-95.
142. Jovin TG, Chamorro A, Cobo E, et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med 2015; 372: 2296-306.
143. Goyal M, Demchuk AM, Menon BK, et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372: 1019-30.
144. English JD, Yavagal DR, Gupta R, et al. Mechanical Thrombectomy-Ready Comprehensive Stroke Center Requirements and Endovascular Stroke Systems of Care: Recommendations from the Endovascular Stroke Standards Committee of the Society of Vascular and Interventional Neurology (SVIN). Interv Neurol 2016; 4: 138-50.
145. Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018; 378: 11-21.
146. Qureshi AI, Ezzeddine MA, Nasar A, et al. Prevalence of elevated blood pressure in 563,704 adult patients with stroke presenting to the ED in the United States. Am J Emerg Med 2007; 25: 32-8.
147. Martins SC, Freitas GR, Pontes-Neto OM, et al. Guidelines for acute ischemic stroke treatment: part II: stroke treatment. Arq Neuropsiquiatr 2012; 70: 885-93.
148. Ahmed N, Wahlgren N, Brainin M, et al. Relationship of blood pressure, antihypertensive therapy, and outcome in ischemic stroke treated with intravenous thrombolysis. Retrospective analysis from Safe Implementation of Thrombolysis in Stroke-International Stroke Thrombolysis Register (SITS-ISTR). Stroke 2009; 40: 2442-9.
149. Vemmos KN, Spengos K, Tsivgoulis G, et al. Factors influencing acute blood pressure values in stroke subtypes. J Hum Hypertens 2004; 18: 253-9.
150. Castillo J, Leira R, García MM, Serena J, Blanco M, Dávalos A. Blood pressure decrease during the acute phase of ischemic stroke is associated with brain injury and poor stroke outcome. Stroke 2004; 35: 520-6.
151. IST Collaborative Group. Blood pressure and clinical outcomes in the International Stroke Trial. Stroke 2002; 33: 1315-20.
152. Okumura K, Ohya Y, Maehara A, Wakugami K, Iseki K, Takishita S. Effects of blood pressure levels on case fatality after acute stroke. J Hypertens 2005; 23: 1217-23.
153. IST Collaborative Group. The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. Lancet 1997; 349: 1569-81.
154. Saxena R, Lewis S, Berge E, Sandercock PA, Koudstaal PJ. Risk of early death and recurrent stroke and effect of heparin in 3169 patients with acute ischemic stroke and atrial fibrillation in the International Stroke Trial. Stroke 2001; 32: 2333-7.
155. Camerlingo M, Salvi P, Belloni G, Gamba T, Cesana BM, Mamoli A. Intravenous heparin started within the first 3 hours after onset of symptoms as a treatment for acute non-lacunar hemispheric cerebral infarctions. Stroke 2005; 36: 2415-20.
156. Micheli S, Agnelli G, Caso V, et al. Clinical benefit of early anticoagulation in cardioembolic stroke. Cerebrovasc Dis 2008; 25: 289-96.
157. Chamorro A, Busse O, Obach V, et al. The rapid anticoagulation prevents ischemic damage in acute stroke: final results from the writing committee. Cerebrovasc Dis 2005; 19: 402-4.
158. Sandercock PA, Counsell C, Kamal AK. Anticoagulants for acute ischaemic stroke. Cochrane Database Syst Rev 2008; (4): CD000024.
159. Paciaroni M, Agnelli G, Micheli S, Caso V. Efficacy and safety of anticoagulant treatment in acute cardioembolic stroke: a meta-analysis of randomized controlled trials. Stroke 2007; 38: 423-30.
160. Audebert HJ, Schenk B, Tietz V, Schenkel J, Heuschmann PU. Initiation of oral anticoagulation after acute ischaemic stroke or transient ischaemic attack: timing and complications of overlapping heparin or conventional treatment. Cerebrovasc Dis 2008; 26: 171-7.
161. Kawano H, Toyoda K, Miyata S, et al. Heparin-induced thrombocytopenia: a serious complication of heparin therapy for acute stroke. Cerebrovasc Dis 2008; 26: 641-9.
162. Bath P, Leonardi-Bee J, Bath F. Low molecular weight heparin versus aspirin for acute ischemic stroke: a systematic review. J Stroke Cerebrovasc Dis 2002; 11: 55-62.
163. Hillbom M, Erilä T, Sotaniemi K, Tatlisumak T, Sarna S, Kaste M. Enoxaparin vs heparin for prevention of deepvein thrombosis in acute ischaemic stroke: a randomized, double-blind study. Acta Neurol Scand 2002; 106: 84-92.
164. Sherman DG, Albers GW, Bladin C, et al. The efficacy and safety of enoxaparin versus unfractionated heparin for the prevention of venous thromboembolism after acute ischaemic stroke (PREVAIL Study): an open-label randomised comparison. Lancet 2007; 369: 1347-55.
165. Sandercock PA, Counsell C, Tseng MC. Low-molecularweight heparins or heparinoids versus standard unfractionated heparin for acute ischaemic stroke. Cochrane Database Syst Rev 2008; (3): CD000119.
166. Alexandrov AV, Grotta JC. Arterial reocclusion in stroke patients treated with intravenous tissue plasminogen activator. Neurology 2002; 59: 862-7.
167. Janjua N, Alkawi A, Suri MF, Qureshi AI. Impact of arterial reocclusion and distal fragmentation during thrombolysis among patients with acute ischemic stroke. AJNR Am J Neuroradiol 2008; 29: 253-8.
168. Qureshi AI, Hussein HM, Abdelmoula M, Georgiadis AL, Janjua N. Subacute recanalization and reocclusion in patients with acute ischemic stroke following endovascular treatment. Neurocrit Care 2009; 10: 195-203.
169. Furlan A, Higashida R, Wechsler L, et al. Intra-arterial prourokinase for acute ischemic stroke: the PROACT II study: a randomized controlled trial: Prolyse in Acute Cerebral Thromboembolism. JAMA 1999; 282: 2003-11.
170. del Zoppo GJ, Higashida RT, Furlan AJ, Pessin MS, Rowley HA, Gent M. PROACT: a phase II randomized trial of recombinant pro-urokinase by direct arterial delivery in acute middle cerebral artery stroke. Stroke 1998; 29: 4-11.
171. Furlan AJ, Kanoti G. When is thrombolysis justified in patients with acute ischemic stroke? A bioethical perspective. Stroke 1997; 28: 214-8.
172. Schmülling S, Rudolf J, Strotmann-Tack T, et al. Acetylsalicylic acid pretreatment, concomitant heparin therapy and the risk of early intracranial hemorrhage following systemic thrombolysis for acute ischemic stroke. Cerebrovasc Dis 2003; 16: 183-90.
173. Grond M, Rudolf, J, Neveling M, Stenzel C, Heiss WD. Risk of immediate heparin after rt-PA therapy in acute ischemic stroke. Cerebrovasc Dis 1997; 7: 318-23.
174. Wallentin L, Yusuf S, Ezekowitz MD, et al. RE-LY investigators. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalized ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial. Lancet 2010; 376: 975-83.
175. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365: 883-91.
176. Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365: 981-92.
177. SAVAYSATM (edoxaban) tablets for oral use. Full Prescribing Information. En: https: //www.accessdata.fda.gov/drugsatfda_docs/label/2015/206316lbl.pdf; consultado marzo 2018.
178. LIXIANA (edoxaban tosilate hydrate tablets). En: https: // www.ema.europa.eu/docs/en_GB/document_library/Public_ assessment_report/human/002629/WC500189047. pdf; consultado marzo 2018.
179. LIXIANA (edoxaban). Package Leaflet. En: https: //www. hpra.ie/img/uploaded/swedocuments/3d45-4459-a582- b6425092e432.pdf; consultado marzo 2018.
180. Tummala R, Kavtaradze A, Gupta A, Ghosh RK. Specific antidotes against direct oral anticoagulants: A comprehensive review of clinical trials data. Int J Cardiol 2016; 214: 292-8.
181. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139-51.
182. Sardar P, Chatterjee S, Lavie CJ, et al. Risk of major bleeding in different indications for new oral anticoagulants: insights from a metaanalysis of approved dosages from 50 randomized trials. Int J Cardiol 2015; 179: 279-87.
183. Ntaios G, Papavasileiou V, Makaritsis K, et al. Realworld setting comparison of nonvitamin-K antagonist oral anticoagulants versus vitamin-K antagonists for stroke prevention in atrial fibrillation. A systematic review and meta-analysis. Stroke 2017; 48: 2494-503.
184. Gómez-Outes A, Lecumberri R. Antídotos de los nuevos anticoagulantes orales: realidad y expectativas. Medicina Clínica 2016; 146: 488-90.
185. Froio NL, Montgomery RM, David-Neto E, Aprahamian I. Anticoagulation in acute ischemic stroke: A systematic search. Rev Assoc Med Bras 2017; 63: 50-6.
186. Heidbuchel H, Verhamme P, Alings M, et al. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace 2013; 15: 625-51.
187. CAST (Chinese Acute Stroke Trial) Collaborative Group. CAST: randomized placebo-controlled trial of early aspirin use in 20,000 patients with acute ischaemic stroke. Lancet 1997; 349: 1641-9.
188. Qureshi AI, Luft AR, Sharma M, Guterman LR, Hopkins LN. Prevention and treatment of thromboembolic and ischemic complications associated with endovascular procedures: part I: pathophysiological and pharmacological features. Neurosurgery 2000; 46: 1344-59.
189. Meyer DM, Albright KC, Allison TA, Grotta JC. LOAD: a pilot study of the safety of loading of aspirin and clopidogrel in acute ischemic stroke and transient ischemic attack. J Stroke Cerebrovasc Dis 2008; 17: 26-9.
190. Chairangsarit P, Sithinamsuwan P, Niyasom S, Udommongkol C, Nidhinandana S, Suwantamee J. Comparison between aspirin combined with dipyridamole versus aspirin alone within 48 hours after ischemic stroke event for prevention of recurrent stroke and improvement of neurological function: a preliminary study. J Med Assoc Thai 2005; 88: S148-54.
191. Dengler R, Diener HC, Schwartz A, et al. Early treatment with aspirin plus extended release dipyridamole for transient ischaemic attack or ischaemic stroke within 24 h of symptom onset (EARLY trial): a randomised, open-label, blinded-endpoint trial. Lancet Neurol 2010; 9: 159-66.
192. Kennedy J, Hill MD, Ryckborst KJ, et al. Fast assessment of stroke and transient ischaemic attack to prevent early recurrence (FASTER): a randomized controlled pilot trial. Lancet Neurol 2007; 6: 961-9.
193. Wang Y, Wang Y, Zhao X, et al; for the CHANCE Investigators. N Engl J Med 2013; 369: 11-9.
194. Chimowitz MI, Lynn MJ, Derdeyn CP, et al. Stenting versus aggressive medical therapy for intracranial arterial stenosis. N Engl J Med 2011; 365: 993-1003.
195. Johnston SC, Amarenco P, Albers GW, et al. Ticagrelor versus aspirin in acute stroke or transient ischemic attack. N Engl J Med 2016; 375: 35-43.
196. Lapchak PA, Araujo DM. Therapeutic potential of platelet glycoprotein IIb/IIIa receptor antagonists in the management of ischemic stroke. Am J Cardiovasc Drugs 2003; 3: 87-94.
197. Seitz RJ, Siebler M. Platelet GPIIb/IIIa receptor antagonists in human ischemic brain disease. Curr Vasc Pharmacol 2008; 6: 29-36.
198. Bukow SC, Daffertshofer M, Hennerici MG. Tirofiban for the treatment of ischaemic stroke. Expert Opin Pharmacother 2006; 7: 73-9.
199. Del Pace S, Scheggi V. Acute ischaemic stroke treated with combined intra-arterial thrombolysis and intravenous tirofiban despite oral anticoagulant therapy at an international normalised ratio > or = 2.0. Intern Emerg Med 2006; 1: 250-2.
200. Mangiafico S, Cellerini M, Nencini P, et al. Intravenous glycoprotein IIb/IIIa inhibitor (tirofiban) followed by intraarterial urokinase and mechanical thrombolysis in stroke. AJNR Am J Neuroradiol 2005; 26: 2595-601.
201. Mangiafico S, Cellerini M, Nencini P, et al. Intravenous tirofiban with intra-arterial urokinase and mechanical thrombolysis in stroke: preliminary experience in 11 cases. Stroke 2005; 36: 2154-8.
202. Seitz RJ, Meisel S, Moll M, Wittsack HJ, Junghans U, Siebler M. The effect of combined thrombolysis with rtPA and tirofiban on ischemic brain lesions. Neurology 2004; 62: 2110-2.
203. Siebler M, Hennerici MG, Schneider D, et al. Safety of tirofiban in acute ischemic stroke: the SaTIS trial. Stroke 2011; 42: 2388-92.
204. Zinkstok SM, Roos YB, ARTIS investigators. Early administration of aspirin in patients treated with alteplase for acute ischaemic stroke: a randomised controlled trial. Lancet 2012; 380: 731-7.
205. Hacke W, Schwab S, Horn M, Spranger M, De Georgia M, von Kummer R. “Malignant” middle cerebral artery territory infarction. Arch Neurol 1996; 53: 309-15.
206. Kasner SE, Demchuk AM, Berrouschot J. Predictors of fatal brain edema in massive hemispheric ischemic stroke. Stroke 2001; 32: 2117-23.
207. Michel P, Arnold M, Hungerbuhler HJ, et al. Decompressive craniectomy for space occupying hemispheric and cerebellar ischemic strokes: Swiss recommendations. Int J Stroke 2009; 4: 218-23.
208. Vahedi K, Hofmeijer J, Juettler E, et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomised controlled trials. Lancet Neurol 2007; 6: 215-22.
209. Jüttler E, Schwab S, Schmiedek P, et al. Decompressive Surgery for the Treatment of Malignant Infarction of the Middle Cerebral Artery (DESTINY): a randomized, controlled trial. Stroke 2007; 38: 2518-25.
210. Hofmeijer J, Kappelle LJ, Algra A, et al. Surgical decompression for space-occupying cerebral infarction (the Hemicraniectomy After Middle Cerebral Artery infarction with Life-threatening Edema Trial [HAMLET]): a multicentre, open, randomised trial. Lancet Neurol 2009; 8: 326-33.
211. Vahedi K, Vicaut E, Mateo J, et al. Sequential-design, multicenter, randomized, controlled trial of early decompressive craniectomy in malignant middle cerebral artery infarction (DECIMAL Trial). Stroke 2007; 38: 2506-17.
212. Lu X, Huang B, Zheng J, et al. Decompressive craniectomy for the treatment of malignant infarction of the middle cerebral artery. Sci Rep 2014; 4: 7070.
213. Krieger DW, Demchuk AM, Kasner SE, et al. Early clinical and radiological predictors of fatal brain swelling in ischemic stroke. Stroke 1999; 30: 287-92.
214. Oppenheim C, Samson Y, Manai R, et al. Prediction of malignant middle cerebral artery infarction by diffusionweighted imaging. Stroke 2000; 31: 2175-81.
215. Thomalla GJ, Kucinski T, Schoder V, et al. Prediction of malignant middle cerebral artery infarction by early perfusion and diffusion-weighted magnetic resonance imaging. Stroke 2003; 34: 1892-9.
216. Sims JR, Gharai LR, Schaefer PW, et al. ABC/2 for rapid clinical estimate of infarct, perfusion, and mismatch volumes. Neurology 2009; 72: 2104-10.
217. Merenda A, DeGeorgia M. Craniectomy for acute ischemic stroke: how to apply the data to the bedside. Curr Opin Neurol 2010; 23: 53-8
218. Huttner HB, Schwab S. Malignant middle cerebral artery infarction: clinical characteristics, treatment strategies, and future perspectives. Lancet Neurol 2009; 8: 949-58.
219. Kjellberg RN, Prieto A. Bifrontal decompressive craniotomy for massive cerebral edema. J Neurosurgery 1971; 34: 488-93. 220. Torbey MT, Bösel J, Rhoney DH, et al. Evidence-based guidelines for the management of large hemispheric infarction. Neurocrit Care 2015; 22: 146-64.
221. Lansberg MG, O’Donnell MJ, Khatri P, et al, American College of Chest Physicians. Antithrombotic and thrombolytic therapy for ischemic stroke: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed. Chest 2012; 41 (2 Suppl): e601S.
222. Venous thromboembolism: reducing the risk for patients in hospital. 2015. En: http: //www.nice.org.uk; consultado julio 2018.
223. Park J, Lee JM, Lee JS et al. Pharmacological and Mechanical Tromboprophylaxis in Critically Ill Patients: a Network Meta-Analysis of 12 Trials. J Korean Med Sci. 2016;31 (11): 1828-1837
224. Baijens LW, Clavé, P. European Society for Swallowing Disorders – European Union Geriatric Medicine Society white paper: oropharyngeal dysphagia as a geriatric syndrome. Clin Interv Aging 2016; 11: 1403-28.
225. Mendez-Sanchez, I. Oropharyngeal dysphagia. Algorithm and diagnostic techniques. RAPD 2017; 40: 132-40.
226. Wirth R, Smoliner C, Jäger M, et al. Guideline clinical nutrition in patients with stroke. Exp Transl Stroke Med 2013; 5: 14.
227. Song J, Lee M, Jung D. The effects of delirium prevention guidelines on elderly stroke patients. Clin Nurs Res 2017; 27: 967-83.
228. Qaseem A, Mir TP, Starkey M, Denberg TD. Risk assessment and prevention of pressure ulcers: a clinical practice guideline from the American College of Physicians. Ann Intern Med 2015; 162: 359-69.
229. Cooper L, Vellodi C, Stansby G, Avital L. The prevention and management of pressure ulcers: summary of updated NICE guidance. J Wound Care 2015; 24: 179-81.
230. Winstein CJ, Stein J, Arena R, et al. Guidelines for adult stroke rehabilitation and recovery. A guideline for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2016; 47: e98-169.
231. Ravaud, J. Construct validity of the functional independence measure (FIM): questioning the unidimensionality of the scale and the “value” of FIM scores. Scand J Rehabil Med 1999; 31: 31-41.
232. Malhotra S, Pandyan AD, Rosewilliam S, Roffe C, Hermens H. Spasticity and contractures at the wrist after stroke: time course of development and their association with functional recovery of the upper limb. Clin Rehabil 2011; 25: 184-91.
233. Ada L, Goddard E, McCully J, et al. Thirty minutes of positioning reduces the development of shoulder external rotation contracture after stroke: a randomized controlled trial. Arch Phys Med Rehabil 2005; 86: 230-4.
234. de Jong LD, Nieuwboer A, Aufdemkampe G. Contracture preventive positioning of the hemiplegic arm in subacute stroke patients: a pilot randomized controlled trial. Clin Rehabil 2006; 20: 656-67.
235. Ottenbacher KJ Hsu Y, Granger CV, Fiedler RC. The reliability of the reliability independence measure: a quantitative review. Arch Phys Med Rehabil 1996; 12: 1226-32.
236. Hackett ML, Pickles K. Part I: frequency of depression after stroke: an updated systematic review and meta-analysis of observational studies. Int J Stroke 2014; 9: 1017-25.
237. Paolucci S, Gandolfo C, Provinciali L, Torta R, Toso V, DESTRO Study Group. The Italian multicenter observational study on post-stroke depression (DESTRO). J Neurol 2006; 253: 556-62.
238. Hackett ML, Anderson CS, House AO. Management of depression after stroke: a systematic review of pharmacological therapies. Stroke 2005; 36: 1098-103.
239. Ried LD, Jia H, Cameon R, et al. Does prestroke depression impact poststroke depression and treatment? Am J Geriatr Psychiatry 2010; 18: 624-33.
240. Tenev VT, Robinson RG, Jorge RE. Is family history of depression a risk factor for poststroke depression? Metaanalysis. Am J Geriatr Psychiatry 2009; 17: 276-80.
241. Snaphaan L, van der Werf S, Kanselaar K, de Leeuw FE. Post-stroke depressive symptoms are associated with post-stroke characteristics. Cerebrovasc Dis 2009; 28: 551-7.
242. Chollet F, Acket B, Raposo N, et al. Use of antidepressant medications to improve outcomes after stroke. Curr Neurol Neurosci Rep 2013; 13: 318.
243. Vuletic V, Sapina L, Lozert M, Lezaic Z, Morovic S. Anxi – ety and depressive symptoms in acute ischemic stroke. Acta Clin Croat 2012; 51: 243-6.
244. Mead GE, Morley W, Campbell P, et al. Exercise for depression. Cochrane Database Syst Rev 2009: CD004366.
245. Sjösten N, Kivelä SL. The effects of physical exercise on depressive symptoms among the aged: a systematic review. Int J Geriatr Psychiatry 2006; 21: 410-8.
246. Eng JJ, Reime B. Exercise for depressive symptoms in stroke patients: a systematic review and meta-analysis. Clin Rehabil 2014; 28: 731-9.
247. McClure JA, Salter K, Foley N, Mahon H, Teasell R. Adherence to Canadian Best Practice Recommendations for Stroke Care: vascular cognitive impairment screening and assessment practices in an Ontario inpatient stroke rehabilitation facility. Top Stroke Rehabil 2012; 19: 141-8.
248. Patel MD, Coshall C, Rudd AG, Wolfe CD. Cognitive impairment after stroke: clinical determinants and its associations with long-term stroke outcomes. J Am Geriatr Soc 2002; 50: 700-6.
249. Patel MD, Coshall C, Rudd AG, Wolfe CD. Natural history of cognitive impairment after stroke and factors associated with its recovery. Clin Rehabil 2003; 17: 158-66.
250. Mysiw WJ, Beegan JG, Gatens PF. Prospective cognitive assessment of stroke patients before inpatient rehabilitation: the relationship of the Neurobehavioral Cognitive Status Examination to functional improvement. Am J Phys Med Rehabil 1989; 68: 168-71.
251. Laver KE, Schoene D, Crotty M, George S, Lannin NA, Sherrington C. Telerehabilitation services for stroke. Cochrane Database Syst Rev 2013; (12): CD010255
252. Chumbler NR, Quigley P, Li X, Morey M, et al. Effects of telerehabilitation on physical function and disability for stroke patients: a randomized, controlled trial. Stroke 2012; 43: 2168-74.
253. Chumbler NR, Li X, Quigley P, et al. A randomized controlled trial on Stroke rehabilitation: the effects on falls self-efficacy and satisfaction with care. J Telemed Telecare 2015; 21: 139-43.
254. Taylor DM, Cameron JI, Walsh L, et al. Exploring the feasibility of videoconference delivery of a self-management program to rural participants with stroke. Telemed J E Health 2009; 15: 646-54.
255. Blacquiere, D. Canadian Stroke Best Practice Recommendations. Telestroke Best Practice Guidelines Update 2017. Int J Stroke 2017; Jan 1: 1-10.
256. Le Berre M, Maimon G, Sourial N. Impact of transitional care services for chronically ill older patients: a systematic evidence review. J Am Geriatr Soc 2017; 65: 1597- 608.
257. Blacquiere D, Lindsay MP, Foley N, et al. Canadian Stroke Best Practice Recommendations: Telestroke Best Practice Guidelines Update 2017. Int J Stroke 2017; 12: 886-95.
258. Demaerschalk B, Berg J, Chong B, et al. American Telemedicine Association: Telestroke Guidelines. Telemed J E Health 2017; 23: 376-89.
259. Canadian Stroke Best Practice. Recommendations: Managing transitions of care following Stroke, Guidelines. Update 2016. Int J Stroke 2016; 11: 807-22.
260. Shepperd S, Lannin NA, Clemson LM, McCluskey A, Cameron ID, Barras SL. Discharge planning from hospital to home. Cochrane Database Systematic Rev 2013; (1): CD000313.
261. Shyu Y, Kuo L, Chen M, Chen S. A clinical trial of an individualised intervention programme for family caregivers of older stroke victims in Taiwan. J Clin Nurs 2010; 19: 1675-85.
262. Wechsler LR, Demaerschalk BM, Schwamm LH, et al. Telemedicine quality and outcomes in stroke: a scientific statement for healthcare professionals rrom the American Heart Association/American Stroke Association. Stroke 2017; 48: e3-25.
263. Schwamm L, Audebert H, Amarenco P, et al. Recommendations for the implementation of telemedicine within stroke systems of care: a policy statement from the American Heart Association. Stroke 2009; 40: 2635-60.
ANEXO
Escala de evaluación prehospitalaria del accidente cerebrovascular de Los Ángeles (LAPSS)
Se valoran elementos de la historia clínica para descartar otros diagnósticos y medición de la glucemia, junto con síntomas y signos presentes.
Sensibilidad (IC 95%): 78%
Especificidad (IC 95%): 85%

Escala pre-hospitalaria para accidente cerebrovascular de Cincinnati (CPSS)
Se valora la presencia de uno o varios de los siguientes síntomas: asimetría facial, pérdida de fuerza en los brazos y afasia/disartria.
• Asimetría facial: solicitar al paciente que muestre los dientes o sonría
o Respuesta normal: ambos lados de la cara se mueven de la misma forma
• Descenso del brazo: solicitar al paciente que cierre los ojos y extienda los brazos, manteniéndolos elevados con las palmas hacia arriba, durante 10 segundos
o Respuesta normal: los brazos se mantienen en la posición inicial, o se mueven de igual modo. También pueden ser útiles otros hallazgos, como evaluar la fuerza en la prensión de manos
• Habla anormal: solicitar al paciente que diga alguna frase o trabalenguas.
o Respuesta normal: utiliza las palabras correctas, sin arrastrarlas
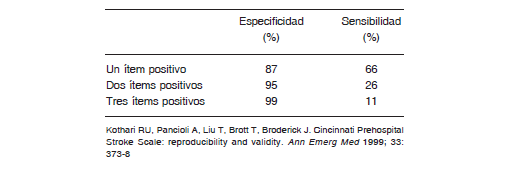
La “hora de oro” en la evaluación y atención del paciente con accidente cerebrovascular isquémico
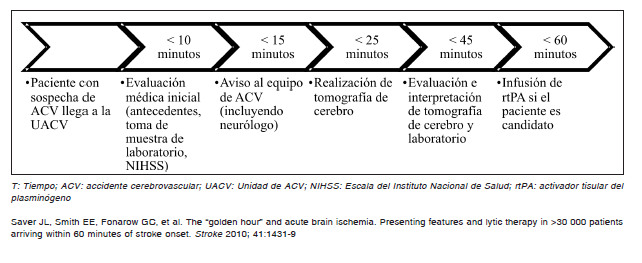
Escala de accidente cerebrovascular del Instituto Nacional de Salud (NIHSS)
1. NIVEL DE CONCIENCIA
1a. Alerta
Alerta con respuestas normales: 0
No alerta, pero responde a mínimos estímulos verbales: 1
No alerta, pero responde a estímulos repetidos o dolorosos (no reflejos): 2
No responde a estímulos dolorosos o lo hace solo con movimientos reflejos. Paciente en coma: 3
1b. Preguntas (Preguntar el mes actual y la edad. Puntuar solo la primera respuesta)
Ambas respuestas correctas: 0
Solo una respuesta es correcta: 1
Ninguna correcta: 2
1c. Órdenes (Cerrar y abrir los ojos; cerrar y abrir la mano)
Realiza ambas órdenes: 0
Realiza solo una orden: 1
No realiza ninguna orden: 2
2. Mirada (Explorar solo la mirada horizontal voluntaria o con reflejos óculo-cefálicos)
Normal: 0
Parálisis parcial de la mirada o paresia periférica de un nervio óculo-motor: 1
Parálisis total o desviación forzada de la mirada conjugada: 2
3. Campos visuales (Explorados por confrontación. Explorar los cuadrantes superiores e inferiores)
Sin pérdida visual: 0
Hemianopsia parcial: 1
Hemianopsia completa: 2
Hemianopsia bilateral (ceguera, incluyendo ceguera cortical): 3
4. Paresia facial (Enseñar los dientes o elevar las cejas. Si no colabora se puede explorar con un estímulo doloroso)
Movimiento normal (simetría): 0
Mínima asimetría (alteración en el surco nasogeniano, asimetría en la sonrisa): 1
Parálisis de la zona inferior de una hemicara: 2
Parálisis de las zonas inferior y superior de una hemicara: 3
5. Fuerza del brazo (Levantar y extender el brazo a 90°. Paciente en decúbito, extender el brazo a 45°. Se evalúa primero el miembro no afectado)
a. Brazo izquierdo. b. Brazo derecho
Mantiene la posición durante 10 segundos: 0
Claudica en menos de 10 segundos sin tocar la cama: 1
Claudica en menos de 10 segundos y la extremidad toca la cama: 2
Existe movimiento, pero no alcanza la posición o cae inmediatamente: 3
Plejía de la extremidad: 4
6. Fuerza de la pierna (Levantar la pierna extendida a 30º. Se evalúa primero el miembro no afectado)
a. Pierna izquierda. b. Pierna derecha
Mantiene la posición durante 5 segundos: 0
Claudica en menos de 5 segundos sin tocar la cama: 1
Claudica en menos de 5 segundos y la extremidad toca la cama: 2
Existe movimiento, pero no alcanza la posición o cae inmediatamente: 3
Plejía de la extremidad: 4
7. Ataxia de miembros (Dedo-nariz y talón-rodilla, realizar con los ojos abiertos)
Ausente: 0
Ataxia en una extremidad: 1
Ataxia en dos extremidades: 2
8. Sensibilidad (Explorar la cara, los brazos, el tronco, el abdomen y las piernas. En paciente obnubilado
evaluar la retirada al estímulo doloroso)
Normal, sin pérdida sensitiva: 0
Hipoestesia de leve a moderada, el paciente nota el estímulo, pero con diferencia entre ellos: 1
Pérdida sensitiva grave o total: 2
9. Lenguaje
Normal: 0
Afasia leve o moderada: 1
Afasia grave: 2
Mutismo, afasia global: 3
10. Disartria
Normal: 0
Leve o moderada (se puede entender con alguna dificultad): 1
Grave, paciente ininteligible o mudo: 2
11. Extinción e inatención (Se aplican estímulos bilaterales simultáneos y el paciente no es capaz de percibirlos
a la vez)
Sin alteraciones: 0
Inatención o extinción en una modalidad (visual, táctil, espacial o corporal): 1
Inatención o extinción en más de una modalidad. No reconoce su propia mano o solo reconoce una parte del espacio: 2
Escala ABCD2
A (Age – Edad): 1 punto por edad > 60 años
B (Blood pressure – Presión arterial > 140/90 mmHg): 1 punto por hipertensión al momento de la evaluación
C (Clinical features – Características clínicas): 2 puntos por déficit motor unilateral, 1 punto por trastorno del habla
sin déficit motor
D (Duration – Duración): 1 punto por 10-59 minutos, 2 puntos por > 60 minutos,
D (Diabetes): 1 punto
El riesgo de ACV a los 2, 7 y 90 días después de un accidente isquémico transitorio será, según esta escala:
Puntaje 0-3: riesgo bajo
Puntaje 4-5: riesgo moderado
Puntaje 6-7: riesgo elevado
Johnston SC, Rothwell PM, Nguyen-Huynh MN, et al. Validation and refinement of scores to predict very early stroke
risk after transient ischaemic attack. Lancet 2007; 369:283-92
Alberta Program Early CT Score (ASPECTS)
Escala de tomografía computada temprana del Programa de Alberta
Se calcula la puntuación sobre un valor máximo de 10 puntos (equivale a tomografía computada normal, sin signos
de isquemia). Se restará sobre este máximo de 10, un punto por cada área en que se observen signos de isquemia
reciente en el territorio de la arteria cerebral media (ACM).
La valoración se realiza sobre dos cortes axiales de la tomografía:
• El primer corte a nivel del tálamo y ganglios de la base (NIVEL GANGLIONAR)
• El segundo corte adyacente al borde superior de los ganglios de la base, sin que se visualicen los mismos
(NIVEL SUPRAGANGLIONAR)
Las áreas que se deben valorar son las siguientes:
– 3 áreas de las estructuras subcorticales:
o Caudado (C)
o Lenticular (L)
o Cápsula interna en rodilla y brazo posterior (CI)
– 7 áreas de la corteza cerebral:
o Ganglionar: corteza insular (I), M1 (corteza anterior de ACM), M2 (corteza lateral adyacente al ribete insular),
M3 (corteza posterior de la ACM)
o Supraganglionar: M4, M5 y M6 (territorio anterior, lateral y posterior de la ACM)
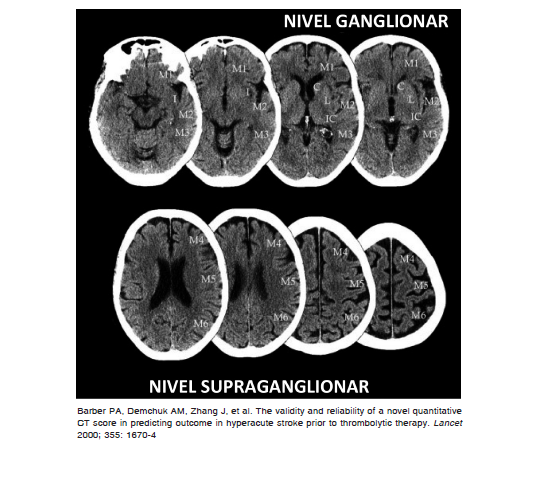
Posterior Circulation Acute Stroke Prognosis Early CT score (pc-ASPECTS)
Escala de tomografía computada temprana para pronóstico del accidente cerebrovascular en circulación posterior
Se inicia con 10 puntos (tomografía normal) y se sustraen uno o dos puntos por cada cambio isquémico visualizado
en las áreas establecidas.
Resta 1 o 2 puntos:
• Tálamo derecho o izquierdo
• Cerebelo
• Territorio de arteria cerebral posterior
Resta 2 puntos: Cualquier zona del mesencéfalo o protuberancia
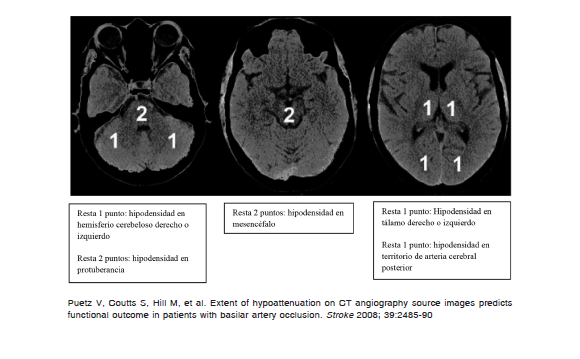
Escala de Rankin Modificada (mRS)
0: Asintomático
1: Incapacidad no significativa pese a persistencia de síntomas. Capaz de realizar tereas diarias y actividades habituales
2: Incapacidad leve. No realiza todas sus actividades previas, pero no precisa ayuda para las actividades diarias.
Puede quedarse solo en casa durante períodos moderados sin problema (una semana o más)
3: Incapacidad moderada. Requiere alguna ayuda, pero puede caminar sin asistencia
Por ejemplo: Utiliza bastón para movilizarse. Si bien puede vestirse, asearse o alimentarse por su cuenta, requiere
ayuda para actividades más complejas como ir de compras, cocinar o limpiar. Necesita ser visitado más frecuentemente
que una vez por semana.
4: Incapacidad moderada-grave. Requiere de ayuda para caminar y para atender sus necesidades. No puede quedarse
solo regularmente en períodos largos durante el día.
5: Incapacidad grave. Postrado en cama. Incontinente. Requiere cuidado diario y atención permanente.
6: Muerte
van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJ, van Gijn J. Interobserver agreement for the assessment of handicap in stroke patients.
Stroke 1988; 19:604-7
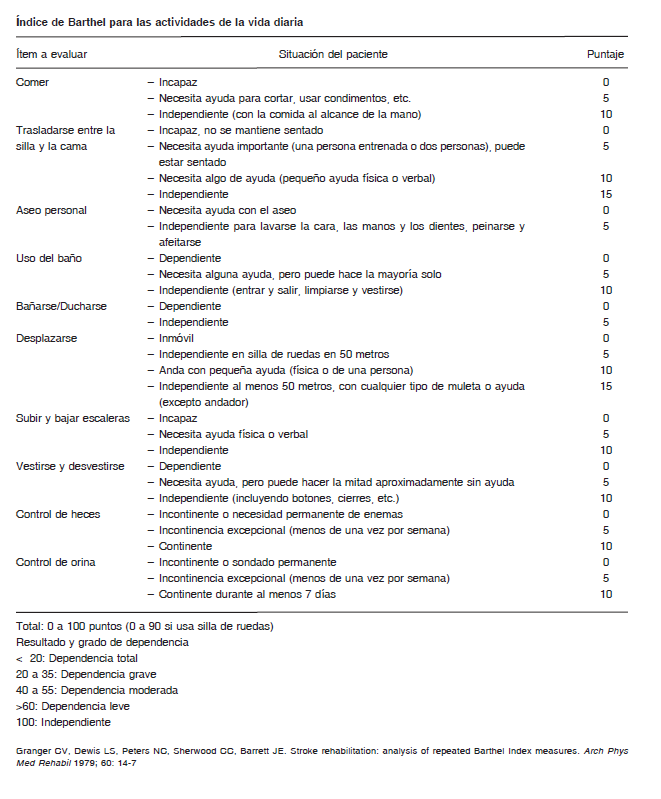
HAT (hemorrhage after thrombolysis) score
Escala de hemorragia después del tratamiento con activador tisular del plasminógeno (rtPA)
Se utiliza para predecir el riesgo de hemorragia luego de la administración de rtPA endovenoso.
1) Antecedente de diabetes o glucemia inicial >200 mg/dl
a. No: 0 puntos
b. Sí: 1 punto
2) Escala de NIHSS previo a la administración de rtPA
a. < 15: 0 puntos b. 15 a 20: 1 punto c. > 20: 2 puntos
3) Hipodensidad fácilmente identificable en la TC de cerebro inicial
a. No: 0 puntos
b. Sí, pero menos de 1/3 de territorio de ACM: 1 punto
c. Sí, más de 1/3 de territorio de ACM: 2 puntos
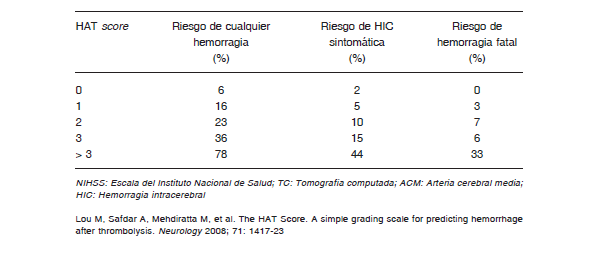
Computed Tomography Angiography (CTA) Score
Escala de Angiografía por Tomografía Computada
A través de angio-tomografía computada (angio-TC) se establece el grado de circulación colateral presente en el
territorio vascular correspondiente a la arteria cerebral media ocluida.

mTICI score (Modified treatment in cerebral ischaemia)
Escala modificada del tratamiento en isquemia cerebral
El score mTICI fue desarrollado por un grupo de consenso en 2013, para establecer un parámetro al momento de
evaluar la reperfusión cerebral luego del tratamiento endovascular

