ANNA SANS-FITÓ 1, ANNA SOLERDELCOLL 1, CRISTINA BOIX-LLUCH 2, CRISTINA SERRA-AMAYA 2, JOSEP MARIA SERRA-GRABULOSA 1, 3, XAVIER CALDÚ 3
1Unidad de Neurodesarrollo y Aprendizaje. Hospitales Universitarios Sagrat Cor y General de Cataluña, 2Unidad de Trastorno del Aprendizaje Escolar (UTAE), Hospital Universitario Sant Joan de Déu, 3Departament de Psicologia i Psicobiologia Clínica, Universitat de Barcelona, Barcelona, España
Resumen La exposición prenatal al alcohol es causa de alteraciones somáticas, cognitivas y conductuales que se agrupan bajo el término de trastorno del espectro alcohólico fetal (TEAF). La evolución a largo plazo de los sujetos afectados a menudo es desfavorable, especialmente a nivel académico y adaptativo social. En el perfil neuropsicológico es característica la disfunción ejecutiva a menudo asociada a trastornos de la conducta que evolucionan en muchos casos hacia la delincuencia a partir de la adolescencia y en la edad adulta. Se han descrito también déficits de las habilidades sociales y la empatía. La exposición prenatal al alcohol constituye la causa más frecuente de trastorno del neurodesarrollo adquirido y prevenible.
Palabras clave: trastorno del espectro alcohólico fetal, exposición prenatal al alcohol, trastorno del neurodesarrollo
Abstract Fetal alcohol spectrum disorder. An underdiagnosed neurodevelopment disorder of uncertain prognosis. Prenatal exposure to alcohol is the cause of cognitive and behavioural disorders grouped
under the term fetal alcohol spectrum disorders (FASD). The long-term evolution of subjects with FASD is often unfavourable, especially in social and academic fields. Executive dysfunction is a hallmark deficit for children with FASD with increased rates of externalizing behaviours, such as aggressiveness and frequently delinquency in adolescence and adulthood. Deficits in social skills, empathy and communication ability are frequent observed among FASD. Prenatal exposure to alcohol is the most frequent cause of acquired and preventable neurodevelopmental disorder.
Key words: fetal alcohol spectrum disorders, prenatal exposure to alcohol, neurodevelopment disorder
Direccion postal: Anna Sans-Fitó, Unidad de Neurodesarrollo y Aprendizaje, Hospital Universitari Sagrat Cor, C/París, 83-87, 4a planta, 08029 Barcelona, España e-mail: anna.sans.fito@gmail.com
Los efectos negativos del alcohol sobre el feto durante el embarazo se conocen desde hace casi 50 años1. En 1973 fue descrito el síndrome alcohólico-fetal (SAF), como un síndrome que asociaba trastornos del neurodesarrollo con malformaciones congénitas y anomalías dismorfológicas2. A pesar de los esfuerzos de responsables sanitarios en difundir el efecto deletéreo para el desarrollo fetal del consumo de alcohol durante la gestación, el consumo entre las mujeres embarazadas oscila entre un 14% en la población general hasta más del 50% en determinadas poblaciones y países3. Con el tiempo, se ha constatado que los efectos de la exposición prenatal al alcohol son un continuum de manifestaciones clínicas agrupadas bajo el término de trastorno del espectro alcohólico fetal (TEAF), que abarca un amplio espectro de manifestaciones cognitivas, conductuales, adaptativas y dismorfológicas. No es infrecuente que en la práctica clínica se contemple este diagnóstico solo en presencia de signos físicos dismorfológicos.
Sin embargo, se calcula que entre un 80 y 90% de los individuos con TEAF no presenta signos físicos, especialmente faciales o de crecimiento4. Esta realidad deriva en una dificultad significativa en la detección de individuos con TEAF y explica que a menudo los afectados no estén correctamente diagnosticados.
En la última versión del Manual Diagnóstico y Estadístico de los Trastornos Mentales de la Asociación Americana de Psiquiatría (DSM 5) se contempla el trastorno neuroconductual asociado a exposición prenatal al alcohol (NC-EPA) y puede utilizarse tanto en pacientes con hallazgos fenotípicos o sin ellos5.
Estudios prospectivos muestran como, muy probablemente, el TEAF esté infradiagnosticado6. El TEAF afecta a todas las etnias y niveles socioeconómicos, aunque en determinadas comunidades la prevalencia es más alta.
Sin embargo, la prevalencia, especialmente de aquellos TEAF sin signos dismorfológicos en los que el diagnóstico
es difícil, no es del todo conocida. En EE.UU. se informan prevalencias de SAF de 2 a 7/1000 y de TEAF de hasta
20-50 casos/1000, mientras que en Canadá se calcula entre 1-2 casos/100 de SAF y 9-10/1000 de TEAF. Existen estudios europeos de prevalencia, concretamente en Italia y Croacia,que dan cifras de 25-45 casos/1000. En un estudio poblacional en una comunidad remota de Australia se comunica una prevalencia del 19% en el grupo de edad de 7.5 a 9.6 años. Es conocida también la elevada prevalencia en poblaciones adoptivas, especialmente en niños con necesidades especiales de algunos orfanatos de Rusia, donde la prevalencia se ha cifrado entre 427 y 680 casos/10007,8. En España, las adopciones internacionales, en muchos casos procedentes de países con un elevado consumo de alcohol entre las mujeres gestantes, ha he- cho que la población de niños con TEAF haya aumentado considerablemente en los últimos 10-15 años. Landgren y col. estudiaron, a los 5 años de su adopción, a un grupo de 71 sujetos procedentes de países de Europa del Este y reportaron la presencia de trastornos del neurodesarrollo en el 95% de ellos y específicamente se realizó el diagnóstico de TEAF en el 52% de sujetos de la muestra9.
La prevalencia promedio mundial de TEAF se ha estimado en 9-20/1000 recién nacidos, y en los países industrializados se considera la causa adquirida y evitable más frecuente de trastorno del neurodesarrollo.
Durante años se ha prestado más atención a la descripción de las anomalías fenotípicas, fundamentalmente dismorfológicas y de crecimiento, que a la caracterización de las manifestaciones cognitivas y conductuales. Estas últimas, además, pueden ser comunes a otras disfunciones cerebrales no relacionadas con el alcohol, como son el daño cerebral secundario a traumatismo craneoencefálico o la discapacidad intelectual en relación a etiologías distintas a la de la exposición prenatal al alcohol. Por otra parte, la superposición de signos clínicos de la esfera cognitiva y conductual a menudo presenta coincidencias con las manifestaciones de otras entidades como el trastorno del déficit de atención e hiperactividad (TDAH), el trastorno oposicionista desafiante (TOD) y el trastorno de conducta (TC).
Manifestaciones clínicas
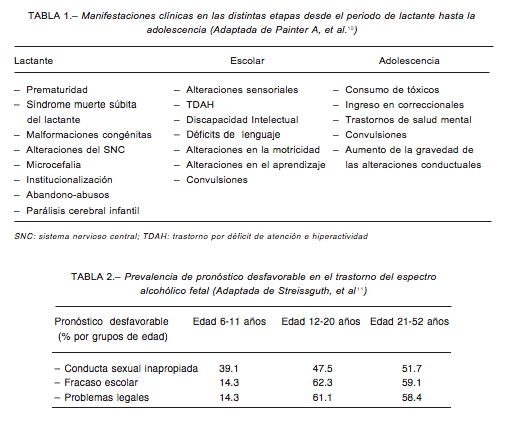
El TEAF abarca un amplio espectro de manifestaciones cognitivas, conductuales, adaptativas y dismorfológicas. En la Tabla 1, adaptada de Painter y col., se enumeran las distintas manifestaciones desde el período de lactancia hasta la adolescencia10.
Las manifestaciones conductuales, probablemente son las que determinan un peor pronóstico, a nivel adaptativo, en la vida adulta. Streissguth y col. informaron una elevada prevalencia de pronóstico desfavorable a nivel adaptativo social11 (Tabla 2).
Entre las manifestaciones dismorfológicas se encuentran la presencia de epicantus, microcefalia, fisuras palpebrales pequeñas, raíz nasal plana, surco en forma de doble carril en los pabellones auriculares, nariz respigona, filtrum liso y labio superio fino. Estas dismorfias pueden estar presentes en otras tres entidades dismorfológicas, considerándose las más específicas de la exposicion prenatal al alcohol las fisuras palpebrales pequeñas, filtrum liso y labio superior fino. También el retraso del crecimiento es frecuente en el TEAF, utilizándose como punto de corte el percentil 10 en peso y/o talla que puede estar presente ya al nacimiento, durante los primeros años de vida o de forma persistente durante la niñez. A menudo el retraso del crecimiento va atenuandose a medida que transcurre la infancia y especialmente en la adolescencia10.
Desde el punto de vista del neurodesarrollo, el TEAF puede presentar un amplio abanico de deficiencias que afectan a distintos dominios: función adaptativa, atención, funciones ejecutivas, conductas externalizadas, funciones motoras, cognición social y aprendizaje verbal y no verbal. Dichas manifestaciones se pueden agrupar en tres categorías: neurocognición, autorregulación y función adaptativa. En relación a los aspectos conductuales, muchos de los niños con TEAF reciben el diagnóstico de TDAH. Sin embargo, la sintomatología suele ser más compleja y heterogénea, además de presentar habitualmente una peor evolución, a menudo con otras enfermedades psiquiátricas asociadas. Esta peor evolución también sucede en casos de TDAH relacionados con daño cerebral adquirido precoz, como son los traumatismos craneales graves en edades tempranas. Al ser las funciones ejecutivas las últimas en desarrollarse, a menudo su afectación y repercusión en la conducta adaptativa va poniéndose de manifiesto con los años12.
Entre las manifestaciones conductuales es común la alteración de las habilidades sociales, habiéndose comunicado alteración en las pruebas que valoran la Teoría de la Mente13.
Con relación a las funciones cognitivas, éstas se encuentran afectadas en varios dominios neuropsicológicos incluyendo el rendimiento cognitivo global, las funciones ejecutivas, el aprendizaje y la memoria, habilidad visuoespacial, motricidad y atención14.
Diagnóstico
Bajo el término de TEAF se incluyen cuatro categorías diagnósticas cuyos criterios se refieren en la Tabla 3: 1) Síndrome alcohólico fetal (SAF), 2) Síndrome alcohólico fetal parcial (SAFP), 3) Trastorno del neurodesarrollo relacionado con el alcohol (TNRA) y 4) Malformaciones congénitas o defectos fetales relacionadas con el alcohol (DFRA)15.
Recientemente, se ha propuesto que TEAF se utilice no solo como un “término paraguas” sino con un “término diagnóstico” especificándose la presencia o ausencia de anomalías asociadas, fundamentalmente dismorfológicas faciales16.
La falta de marcadores biológicos y, en muchos casos, la dificultad para documentar con certeza la ingesta de alcohol, dificulta el diagnóstico y es la causa de que el TEAF esté, muy probablemente, infradiagnosticado.
Lussier y col. recientemente han descrito patrones de metilación del ADN asociados al TEAF, que no están presentes en otros trastornos del neurodesarrollo, y que podrían ser un paso hacia el desarrollo de marcadores epigenéticos de esta entidad17. Los hallazgos en otros exámenes complementarios estan lejos de ser específicos y, por tanto no constituyen herramientas definitvas para apoyar el diagnóstico.
La exposición prenatal al alcohol interfiere en el desarrollo cerebral por distintos mecanismos que incluyen la proliferación y la migración neuronal, la regulación de factores de transcripción, hipoxia y muerte celular. Estas alteraciones se traducen en la neuroimagen en hallazgos diversos, fundamentalmente disminución del volumen cerebral global, adelgazamiento de la corteza cerebral, anomalías del cuerpo calloso, ganglios basales e hipocampo18.
Es frecuente que en aquellos casos de TEAF en los que está documentada la ingesta de alcohol, exista también exposición al tabaco y otros tóxicos así como un deficiente control de la gestación. Por tanto, las anomalías cerebrales asociadas al TEAF no pueden atribuirse única y exclusivamente a la exposición pre- natal al alcohol19.
Como en la mayoría de trastornos del neurodesarrollo, en el TEAF la intervención terapéutica precoz parece asociarse a un mejor pronóstico20. De ahí la extraordinaria utilidad de disponer de marcadores biológicos que ayuden al diagnóstico.
En conclusión, el TEAF es un trastorno prevalente e infradiagosticado y constituye la primera causa de trastorno del neurodesarrollo adquirida y evitable. Las importantes repercusiones a nivel personal, familiar y social, implican la necesidad de aumentar el conocimiento e intentar establecer marcadores clínicos que permitan la detección, diagnóstico e intervenciones terapéuticas basadas en estudios controlados. Asimismo, la prevención debe ser una prioridad para las autoridades sanitarias
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Lemoine P, Harousseau HH, Borteyru JP, Menuet JC. Les enfants des parents alcoholiques. Anomalies observés. A propos de 127 cas. Quest Medical 1968; 25: 476-82.
2. Jones KL , Smith DW, Ulleland CN, Streissguth P. Pattern of malformation in offspring of chronic alcoholic mothers. Lancet 1973; 1: 1267-71.
3. Popova S, Lange S, Burd L, Chudley AE, Clarren SK, Rehm J. Cost of fetal alcohol spectrum disorder diagnosis in Canada. PLoS One 2013; 8: e60434.
4. Chudley AE. Fetal alcohol spectrum disorder: counting the invisible-mission imposible? Arch Dis Child 2008; 93:
721-2.
5. Kable JA, O’Connor MJ, Olson HC, et al. Neurobehavioral disorder associated with prenatal alcohol exposure (ND- PAE): proposed DSM-5 diagnosis. Child Psychiatry Hum Dev 2016; 47: 335-46.
6. Burd L, Christensen T. Treatment of fetal alcohol spectrum disorders: are we ready yet? J Clin Psychopharmacol
2009; 29: 1-4.
7. Popova S, Lange S, Shield K, et al. Comorbidity of fetal alcohol spectrum disorder: a systematic review and meta- analysis. Lancet 2016; 387: 978-87.
8. Tsang TW, Carmichael Olson H, Latimer J, et al. Behaviour in children with fetal alcohol spectrm disorders in remote
Australia: a population-based study. J Dev Behav Pediatr 2017; 38: 528-37.
9. Landgren M, Svensson L, Strömland K, Andersson Grön- lund M. Prenatal alcohol exposure and neurodevelopmen- tal disorders in children adopted from Eastern Europe. Pediatrics 2010; 125: e1178-85.
10. Painter A, Williams AD, Burd L. Fetal alcohol spectrum dis orders: implications for child neurology, art 2: diagnosis and management. J Child Neurol 2012; 27: 355-62.
11. Streissguth AP, Bookstein FL, Barr HM, Sampson PD, O’Malley K, Young JK. Risk factors for adverse life out- comes in fetal alcohol syndrome and fetal alcohol effects. J Dev Behav Pediatrics 2004; 25: 228-38.
12. Sans A, Colome R, López-Sala A, Boix C. Aspectos neu ropsicológicos del daño cerebral adquirido en la edad
pediátrica. Revista de Neurología 2009; 48 (Supl 2): S23-6.
13. Lindinger NM, Malcolm-Smith S, Dodge NC, et al. Theory of mind in children with fetal alcohol spectrum disorders. Alcohol Clin Exp Res 2016; 40: 367-76.
14. Mattson SN, Crocker N, Nguyen TT. Fetal alcohol spectrum disorders: neuropsychological and behavioral features. Neuropsychol Rev 2011; 21: 81-101.
15. Hoyme HE, Kalberg WO, Elliott AJ. Updated clinical guide lines for diagnosing fetal alcohol spectrum disorders.
Pediatrics 2016; 138. pii: e20154256.
16. Lange S, Rovet J, Rehm J, Popova S. Neurodevelopmental profile of fetal alcohol spectrum disorder: a systematic review. BMC Psychol 2017; 5: 22.
17. Lussier AA, Bodnar TS, Mingay M, et al. Prenatal alcohol exposure: profiling developmental DNA methylation pat- terns in central and peripheral tissues. Front Genet 2018; 9: 610.
18. Treit S, Zhou D, Chudley AE, et al. Relationships between head circumference, brain volume and cognition in chil- dren with prenatal alcohol exposure. PLoS One 2016; 11: e 0150370.
19. Jarmasz JS, Basalah DA, Chudley AE, Del Bigio MR. Human brain abnormalities associated with prenatal alcohol exposure and fetal alcohol spectrum disorder. J Neuropatholog Exp Neurol 2017; 76: 813-33.
20. Paley B, O’Connor MJ. Intervention for individuals with fetal alcohol spectrum disorders: treatment approaches and case management. Dev Disabil Res Rev 2009; 15: 258-67.
