GONZALO PIN ARBOLEDAS
Unidad de Pediatría Integral y Sueño, Hospital Quirónsalud, Valencia, Grupo de Sueño de la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), España
Resumen El sueño adecuado es necesario para el desarrollo sináptico y la maduración cerebral, un sueño de mala calidad tiene efectos perjudiciales en las funciones cognitivas, de atención, memoria y conducta de los niños. La preocupación sobre la alta prevalencia de los problemas del sueño es amplia en todo el mundo; las consecuencias de estos problemas son incluso más importantes en los niños portadores de trastornos del neurodesarrollo; estos niños a menudo tienen dificultades de inicio y mantenimiento del sueño y despertares nocturnos frecuentes que afectan a sus problemas de conducta. El propósito de este escrito es revisar el estado del arte de los problemas del sueño en los niños con trastornos del neurodesarrollo. En este punto, es importante tener en cuenta el ritmo circadiano, un reloj que genéticamente dirige los ritmos celulares de transcripción, traslación y metabolismos. Este reloj se combina con el ambiente diurno y nocturno coordinando estos mecanismos durante los ciclos luz/oscuridad, sueño/vigilia, frío/calor, ingesta/ayuno, tanto diariamente como en las diferentes estaciones. En conclusión, los problemas del sueño son un factor condicionante de la evolución y calidad de vida de los niños con trastornos del neurodesarrollo, que debe ser tenido en cuenta en todos los casos y ocupar un lugar preferente tanto en la etapa diagnóstica como en la terapéutica.
Palabras clave: trastornos del espectro autista, insomnio, biorritmos, ciclo circadiano, melatonina
Abstract The sleep in children with neurodevelopmental disorders. Adequate sleep is of critical need for a typical synaptic development and brain maturation, a poor quality sleep can have detrimental effects on children’s’ cognitive attention, memory, mood regulation, and behavior functions. Great concern has been voiced out regarding the high prevalence of poor sleep in children worldwide, the effects of poor sleep may be even more pronounced in children with neurodevelopmental disorders; these children often have difficulties with falling and staying asleep and with night awakenings, this has a strong association with daytime behavior problems. The purpose of this article is to provide an overview of the state of the science of sleep in children with a neurodevelopmental disorder. In this context, it is important to take the circadian cycle into account, a genetically encoded clock that drives cellular rhythms of transcription, translation and metabolism. The circadian clock interacts with the diurnal and nocturnal environment that also drives transcription and metabolism during light/dark, sleep/wake, hot/cold and feast/fast daily and seasonal cycles In conclusion, the sleep problems are a conditioning factor in the evolution and quality of life of children with neurodevelopmental disorders that must be taken into account in all cases and occupy a preferential place in both the diagnostic and the therapeutic stages.
Key words: autism spectrum disorders, insomnia, biological rhythms, circadian cycle, melatonin
Dirección postal: Gonzalo Pin Arboledas, Unidad de Pediatría Integral y Sueño, Hospital Quirónsalud, Av. Blasco Ibáñez 14, 46010 Valencia, Españ.
e-mail: gonzalo.pin@quironsalud.es
Los problemas del sueño (PS) conllevan problemas emocionales, conductuales y cognitivos, especialmente en el área ejecutiva afectando funciones como la flexibilidad mental, inhibición cognitiva y memoria de trabajo.
El incremento de la variabilidad de la atención momento a momento ocasionado por un déficit crónico de sueño (teoría del estado de inestabilidad), puede alterar las funciones ejecutivas y emocionales como consecuencia de la interacción entre la tendencia homeostática a dormir, la tendencia circadiana a la vigilia y el esfuerzo compensatorio. Esta afectación sucede desde la primera infancia como lo demuestra el hecho de que los niños con sueño “corto” antes de los 40 meses de edad tienen mayor riesgo de impulsividad-hiperactividad y rendimiento cognitivo disminuido a los 6 años, si se les compara con niños que duermen 11 horas cada noche1.
Estos efectos negativos de los PS afectan la cognición y la conducta incluso años después de su desaparición.
De manera que, un tiempo de sueño adecuado y de buena calidad es fundamental para un desarrollo satisfactorio.
Al valorar el sueño debemos tener presente además del sueño en sí dos aspectos: 1. Ritmo circadiano: Muchas funciones de nuestro organismo tienen ciclos de alrededor de 24 horas llamados ciclos circadianos regulados por el núcleo supraquiasmático. Cada individuo tiene un ritmo circadiano endógeno; la sincronización de estos ritmos varía a través de individuos dando lugar a diferentes cronotipos. Aquellos niños con cronotipo vespertino, también llamados “búhos” (tendencia a dormirse y levantarse algo más tarde) tienen mayor prevalencia de problemas de conducta y problemas emocionales que los niños con un cronotipo matutino o “alondras” (tendencia a dormirse y levantarse más pronto). 2. Higiene del sueño: La higiene del sueño y sus rutinas favorecen una buena calidad de sueño y abarcan tanto acciones realizadas para iniciar el sueño como los hábitos de vida, entre los que destaca el uso de la tecnología; los niños con trastorno del espectro autista (TEA), por ejemplo, están diariamente más tiempo que sus coetáneos con desarrollo estándar delante de las pantallas con videojuegos, si bien pasan menos tiempo en “redes sociales”. La influencia negativa del uso de la tecnología en tiempo cercano a la hora de acostar es mayor en niños con trastornos del neurodesarrollo que en niños con desarrollo estándar.
Los hábitos de sueño erróneos se han relacionado con irritabilidad, autolesiones, negativismo y agresión; es por ello, que mejorar nuestros conocimientos sobre el sueño y sus problemas en cuanto a etiología, prevención y tratamiento en estas poblaciones, es de la mayor importancia. En sentido contrario, la mejoría del sueño mediante el incremento de la higiene del sueño (especialmente el cuidado de las tecnologías) favorece una mejoría en la conducta de los niños con trastornos del neurodesarrollo2.
Estos problemas relacionados con el sueño no solo afectan al sujeto portador del trastorno del neurodesarrollo sino de manera importante a todo su entorno familiar.
Esta íntima relación cronotipo, problemas conductuales, emocionales y sueño refuerzan la importancia del sueño y del cronotipo en neurociencia.
Características del sueño en los niños con trastornos del neurodesarrollo
Los PS tienen una prevalencia de hasta el 86% en sujetos con trastornos del neurodesarrollo siendo los más frecuentes
el insomnio de inicio, los despertares nocturnos y la disminución del tiempo total de sueño (TTS)3.
Estos PS son semejantes pero diferentes según el trastorno. Por ejemplo, los niños con trastorno por déficit de atención e hiperactividad (TDAH) tienen una mayor prevalencia de cronotipo vespertino (“búho”)4 y, por su parte, en los niños con TEA se asocian a alteraciones en la producción y ritmo de la melatonina por una alteración de la regulación del reloj biológico5. Esto es, mientras en los niños con TEA los problemas con el sueño están relacionados fundamentalmente con la higiene del sueño, en los niños con TDAH están más condicionados por el cronotipo vespertino.
Trastorno del espectro autista y sueño
Los PS afectan al 50-80% de los niños con TEA6; a pesar de ello, las múltiples preocupaciones de los padres en relación con la conducta hace que muchos padres no manifiesten sus preocupaciones sobre el sueño a sus médicos7. Los PS usualmente comienzan a la misma edad que la regresión en el desarrollo, lo que sugiere una mayor vulnerabilidad en este período de la vida.
Los niños con TEA tienen diferencias objetivables en la evolución cronológica y estructural del sueño8, 9.
1. Cronología: Durante los primeros 30 meses no hay diferencia en el tiempo total de sueño. La diferencia es máxima a los 6 años (43 minutos menos) y se mantiene a los 11 años (20 minutos menos). La tendencia a sueño más corto se relaciona con más dificultades en la comunicación social desde los 42 a los 140 meses.
2. Estructura: Las principales diferencias radican en una latencia de sueño más larga (11 minutos); 30 minutos menos de TTS por ir a la cama más tarde y despertar más pronto; menor eficacia del sueño (2%) y mayor número de despertares nocturnos (13% a los 30 meses lo hacen tres o más veces cada noche frente al 5% los niños con desarrollo estándar). No hay diferencias en el tiempo de sueño diurno.
Por otro lado, la remisión espontánea de los PS en niños con TEA es de un 8.3% vs. 52.4% en niños con desarrollo estándar.
Las causas de los PS son multifactoriales10:
– Factores intrínsecos (neurotransmisores):
– Serotonina, relacionada con arousals corticales que está elevada en el 25% de los niños por un trastorno metabólico primario de su receptor o una alteración en su eliminación por alteración en su trasportador.
– Baja concentración de melatonina plasmática por déficit primario de la actividad de la acetilserotonina metiltransferasa.
– Factores médicos (epilepsia, alteraciones gastrointestinales…).
– Conductuales (deficiente higiene de sueño).
Trastorno de déficit de atención con hiperactividad y sueño
El sueño se caracteriza:
a) Objetivamente:
– Estudios con polisomnografía:
Se aprecia aumento de la fase N3 (sueño de ondas lentas, la más profunda del sueño) relacionado probablemente con el déficit de noradrenalina y/o dopamina, importantes en el mantenimiento de la vigilia y/o a un retraso madurativo de la disminución progresiva del sueño N3, que sucede espontáneamente con la edad.
Cortese y col.11 encuentran más movimientos durante el sueño de manera estadísticamente significativa. En España,
el 20% de los niños con TDAH tienen el diagnóstico definitivo de piernas inquietas y un 5% de probable12.
En la microestructura del sueño existen más cambios de estadio en N3 (28.7 ± 13.2 vs. 19.6 ± 6.7 de los controles)
y mayor índice de microdespertares en el último tercio de la noche (6.1 ± 4.3 vs. 3.7 ± 2.0). Estos cambios
se han relacionado con un mayor número de errores y mayor variabilidad del tiempo de reacción (r = 0.61 y 0.76
respectivamente)13.
La frecuencia de patrón cíclico alternante (CAP), que consiste en una oscilación a niveles microestructurales del sueño, en forma de episodios de despertar o arousal transitorios, es menor durante el N2, y el índice A1 está reducido en estadios 1 y 2 traduciendo un estado de hipoarousal14.
En el test de latencias múltiples para valoración de somnolencia diurna, la latencia media de sueño es menor y un significativo número de niños se duermen durante el test (Odds ratio de quedarse dormidos es 8 veces mayor).
– Estudios con actigrafía y determinación del inicio de la secreción nocturna de melatonina: retraso de inicio de secreción nocturna de melatonina junto a un retraso de inicio y finalización del sueño. Datos que sugieren la presencia de un retraso de fase entre las causas del insomnio cuando éste está presente15.
Su tendencia diurna a un hipoarousal se caracteriza por una mayor actividad tetha (especialmente en las áreas frontales), disminución de actividad alfa y beta y un aumento de las ratios theta/alfa y theta/ beta. Estudios con medidas objetivas han encontrado una mayor somnolencia diurna16.
b) Subjetivamente:
Se detecta una mayor resistencia a la hora de dormir, mayores dificultades de inicio, despertares nocturnos así como dificultades para despertarse por la mañana, trastornos respiratorios del sueño y somnolencia diurna. En el cuestionario de Hábitos de Sueño tienen puntuaciones más altas y la duración del sueño referida por los padres es más corta17.
c) Respuesta al tratamiento con metilfenidato:Los niños con una mala eficiencia del sueño previa experimentan una mejoría más evidente en las medidas de vigilancia y rendimiento con el tratamiento.
Esta diferencia se ha relacionado con el incremento de su nivel de arousal con la consiguiente mejora del rendimiento.
Se desconocen los factores que favorecen estas diferencias en calidad de sueño, mientras es conocido que estas diferencias favorecen la sintomatología TDAH-likey pueden afectar el rendimiento; por ello, es conveniente incluir evaluaciones del sueño rutinariamente en todos los niños con sospecha clínica de TDAH.
Síndrome de Smith-Magenis y el sueño18
La frecuencia del síndrome de Smith-Magenis (SSM) es de alrededor de 1/25 000 nacimientos.
La clínica se caracteriza por conductas maladaptativas, autolesiones, baja sensibilidad al dolor y estereotipias motoras.
El sueño se caracteriza por:
a) Estudios con actigrafía:
– Sueño fragmentado y reducido desde los 6 meses de edad. Este patrón persiste hasta los 6-8 años en los que típicamente duermen 1-2 horas menos que sus pares y tienen uno a tres despertares por noche; cada despertar dura al menos media hora. Reducción de un 57% de TTS.
– Hora media de despertar por la mañana: 5 h 30 m; de manera que algunos problemas de conducta se correlacionan con el déficit de sueño nocturno.
– Ataques de sueño al final del día y persistencia de siestas a cualquier edad.
b) Estudios mediante polisomnografía:
– Marcada reducción de estadio 3, REM (rapid eye movement) reducido en el 43-50% de los pacientes con incremento de arousal y presencia de actividad muscular tónica en el EMG.
– Despertares prolongados en el 75% de los casos.
– Frecuencia de alteraciones del sueño alta (más del 80%); disminuye con la edad (menos común en mayores de 18 años).
Resumiendo, los hallazgos polisomnográficos: baja eficiencia de sueño, latencia larga, tiempo total de sueño corto, aumento de la vigilia intrasueño, disminución del REM, pocos spindles y complejos K.
c) Subjetivamente:
Refieren patrones irregulares de sueño/vigilia, siestas excesivas, conductas nocturnas problemáticas, tales como risas nocturnas (es el más frecuente y su intensidad se relaciona con una mayor deleción genética), bruxismo, gritos y/o llanto inconsolable, convulsiones nocturnas, terrores del sueño y soliloquia. La tendencia a la obesidad favorece los trastornos respiratorios del sueño.
d) Secreción de melatonina:
Ritmo circadiano alterado de la melatonina (Tabla 1).

El cortisol, hormona de crecimiento y prolactina siguen un patrón circadiano usual en los valores normales. En un pequeño grupo de pacientes se administró acebutolol pronto en la mañana para suprimir la secreción diurna de melatonina, acompañada de administración a última hora del día de melatonina para mejorar el ciclo vigilia sueño.
Tratamiento de los problemas del sueño en niños con trastornos del neurodesarrollo:
“Programa 4-4-90”
Cada enfermedad puede caracterizarse por una alteración específica del sueño. Los objetivos terapéuticos deben ser realistas, claramente definidos y medibles de manera objetiva.
Durante los últimos cuatro años venimos desarrollando un programa de tratamiento en grupo denominado “Programa 4-4-90”. Los fundamentos del programa son:
Introducción de un ritmo vigilia-sueño regular
– Valoración del cronotipo: Cada niño tiene su propio ritmo vigilia-sueño. Los niños matutinos o “alondras” están más
activos y receptivos en las primeras horas del día, son más sensibles a los efectos de la luz por las mañanas y
tienen tendencia dormirse pronto en la noche mientras los niños vespertinos o “búhos” tienen tendencia a dormirse
tarde, están más activos a última hora del día, presentan mayor sensibilidad vespertina a la luz y prefieren despertarse
tarde siendo menos sensibles a los efectos de la luz por las mañanas. Estas preferencias están controladas por el reloj biológico hipotalámico compuesto por miles de neuronas, cada una con su oscilador circadiano, que generan y mantienen un ritmo endógeno que debe ser sincronizado con el horario solar de una manera regular día a día preferentemente por la luz y actividades sociales regulares (horario de comidas, horario de sueño, etc.): la introducción de ritmos y rutinas regulares es básica para su funcionamiento apropiado.
– El ritmo biológico de una persona puede cambiar a lo largo de la vida pero no ocurren cambios bruscos. El cambio a retraso de fase de sueño del adolescente ocurre gradualmente hasta la edad de 20 años en la que comienza de nuevo a adelantarse.
– Valorar el nivel de ansiedad: Un 56-70% de los niños con TEA tienen un mayor grado de ansiedad y SOR (sensory
over-responsivity) que predispone a PS.
Ajustar las horas de inicio de sueño a las necesidades individuales de sueño
– Los mayores cambios madurativos del sueño se producen en los primeros años. El momento en el que un niño dado duerme durante toda la noche depende de su proceso de maduración funcional y no tanto de su edad cronológica.
– Hay una gran variabilidad interindividual en las necesidades de sueño, pero pocas variabilidades a corto plazo en un niño determinado.
– Las necesidades de sueño se refieren tanto al sueño diurno como al nocturno. Unas siestas muy tardías en el día pueden ocasionar una escasa carga de sueño en la hora de acostar (homeostasis del sueño) y un retraso del inicio de sueño.
– Ajustar el tiempo en cama/cuna a la necesidad individual de sueño: un desajuste favorece dificultades para iniciar el sueño, incremento de despertares nocturnos y/o despertar matinal muy precoz. El momento de acostarlo y la predisposición innata a dormir se deben ajustar y acomodar.
– Despertares nocturnos cortos: son un comportamiento normal del sueño.
Ayudar al niño a dormirse por sí mismo: fase de la desactivación (previa a la rutina del sueño)
– Antes de acostar al niño evitar juegos estimulantes, activación cognitiva, luces brillantes, sonidos fuertes para preparar al niño al sueño. Implementar rutinas del sueño semejantes todos los días.
– El niño puede utilizar objetos transicionales que le ayudan a calmarse y sentirse seguro.
– Asociaciones con el sueño inapropiadas potencian las dificultades con el sueño y los despertares nocturnos.
Desarrollo del programa
El programa consta de 4 sesiones cada 4 semanas con una duración cada una de ellas de 90 minutos (“Programa 4-4-90”).
El paso previo es la identificación clara de los objetivos terapéuticos, evaluación de posibles elementos colaboradores al mantenimiento del problema y el diseño de expectativas realistas siendo modestos y creando un ambiente rutinario, tranquilo, oscuro, con temperatura adecuada, no estimulante y con escasos o nulos estímulos auditivos o visuales (tecnología).
Cada sesión consta de dos partes:
a) Charla teórica por parte de un profesional.
b) Valoración por el grupo de las agendas de sueño individuales con intercambio de experiencias y opiniones de todos los asistentes a la sesión y la elaboración de propuestas por parte del grupo para aplicar en cada caso.
El grupo es heterogéneo en edad y comorbilidad buscando el enriquecimiento de las experiencias y ampliar las perspectivas en el tiempo.

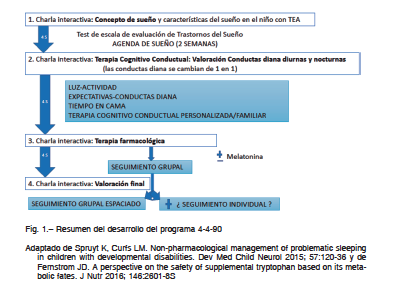
Durante las 4 semanas que dura el proceso se mantienen contacto mediante correo electrónico semanal y, si es necesario, se planifican sesiones individuales.
En la Figura 1 se resume el desarrollo de todo el programa.
Previamente se han descartado causas orgánicas contributivas: epilepsia, reflujo gastro-esofágico (RGE), deficiencia Fe, síndrome de apneas-hipopneas del sueño (SAHS), movimiento periódico de los miembros o alteraciones del ritmo circadiano, así como causas genéticas que pueden predisponer a estos niños a alteraciones del sueño.
Tratamiento farmacológico
Pese a que el tratamiento farmacológico es muy utilizado, son escasos los trabajos bien diseñados y controlados sobre su eficacia, tolerabilidad, dosificación y seguridad.
Es necesario tener en cuenta ciertas consideraciones generales19, 20, así como las posibles interacciones con otros fármacos (antiepilépticos):
- Valorar la medicación tomada previamente y las prescripciones homeopáticas o la fitoterapia.
- Edad del niño y su historia clínica previa.
- Agenda de sueño previa.
- Establecer previamente junto con los padres y/o el propio niño los objetivos del tratamiento. El objetivo inmediato es mejorar y no eliminar radicalmente el problema del sueño.
- Evitar la interrupción aguda de cualquier medicación relacionada con el sueño y monitorizar el tratamiento farmacológico teniendo en cuenta la tendencia natural de los padres a dar menos dosis de las recomendadas.
- Elección del fármaco guiada por una evaluación detallada del problema (dificultad de inicio, despertares nocturnos, etc.) y una detallada historia familiar.
Los tres grandes retos del tratamiento farmacológico son evitar la sedación residual, la tolerancia potencial y el mantenimiento de la mejora del sueño.
Los fármacos más utilizados en la actualidad se resumen en la Tabla 2.
En conclusión, los PS son un factor condicionante de la evolución y calidad de vida de los niños con trastorno del neurodesarrollo que debe ser tenido en cuenta en todos los casos y ocupar un lugar preferente tanto en la etapa diagnóstica como en la terapéutica.
Conflicto de intereses: Ninguno para declarar.
Bibliografía
1. Touchette E, Petit D, Tremblay RE, Montplaisir JY. Risk factors and consequences of early childhood dyssomnias: new perspectives. Sleep Med Rev 2009; 13: 355-61.
2. Keshavarzi Z, Bajoghli H, Mohamadi MR, et al. In a ran- domized case-control trial with 10-year olds suffering from attention deficit/hyperactivity disorder (ADHD) sleep and psychological functioning improved during a 12-week sleep-training program. World J Biol Psychiatry 2014; 15: 609-19.
3. van der Heijden KB, Stoffelsen JA, Popma,Swaab H. Sleep, chronotype, and sleep hygiene in children with attention- deficit-hyperactivity disorder, autism spectrum disorder, and controls. Eur Child Adolesc Psychiatry 2018; 27: 99-111.
4. Gruber R, Fontil L, Bergmame L, et al. Contributions of circadian tendencies and behavioral problems to sleep onset problems of children with ADHD. BMC Psychia- try 2012; 12: 212.
5. van der Heijden KB, Stoffelsen RJ, Popma A, Swaab H.
Sleep, chronotype, and sleep hygiene in children with attention-deficit/hyperactivity disorder, autism spectrum disorder, and controls. Eur Child Adolesc Psychiatry
2018; 27: 99-111.
6. Mayes SD, Calhoun SL. Variables related to sleep prob- lems in children with autism. Res Autism Spectr Disord
2009; 3: 931-41.
7. Malow BA, Byars K, Jhonson K, et al. Sleep Committee of the autism treatment network. A practice pathway for the identification, evaluation, and management of insomnia in children and adolescents with autism spectrum disorders. Pediatrics 2012; 130 Suppl 2: S106-24.
8. Elrod MG, Hood BS. Sleep differences among children with autism spectrum disorders and typically developing peers: a meta-analysis. J Dev Behav Pediatr 2015; 36: 166-77.
9. Sivertsen B, Posserud MB, Gillberg C, Lundervold AJ, Hys- ing M. Sleep problems in children with autism spectrum problems: a longitudinal population-based study. Au- tism 2012; 16: 139-50.
10. Reynolds AM, Malow BA. Sleep and autism spectrum disorders. Pediatr Clin North Am 2011; 58: 685-98.
11. Cortesse S, Konofal E, Yateman N, Mouren M, Lecendreux M. Sleep and alertness in children with ttention-decicit/ hyperactivity disorder: a systematic review of the litera- ture. Sleep 2006; 29: 505-11.
12. Merino Andreu M, Martinez Bermejo M, Casas Rivero J, Velarquez Fraguas R, Arcas Martinez J. Restless legs syndrome is a common finding in children with attention- deficit/hyperactivity disorder (Abstract). J Sleep Research
2008; 17 (Suppl 1): 135.
13. Labrose M, Gingras M, Guay M, Godbout R. Sleep insta- bility and sustained attention in children with attention deficit/hyperactivity disorder (Abstract). J Sleep Res 2008;
17, (Suppl 1): 132-3.
14. Miao S, Bruni O, Pagani J, et al. NREM sleep instability is reduced in children with attention-deficit/hyperactivity disorder (Abstract). J Sleep Res 2006; 15 (Suppl 1): 123.
15. Van Der Heijden KB, Smits MG, Van Someten EJ, Rid- derinkhof KR, Gunning WB. Effect of melatonin on sleep, behaviour, and cognition in ADHD and chronic sleep- onset insomnia. J Am Acad Child Adolesc Psychiatry
2007; 46: 233-41.
16. Golan N, Sahar E, Ravid S, Pillar G. Sleep disorders and daytime sleepiness in children with Attention´ Deficit/ Hyperactivity Disorder. Sleep 2004; 27: 261-6.
17. Owens JA, Maxim R, Nobile C, McGuinn M, Msall M.
Parental and self-report of sleep in children with atten- tion-deficit/hyperactivity disorder. Arch Pediatr Adolesc Med 2000; 154: 549-55.
18. Angriman M, Novelli L, Bruni O. Sleep in children with neurodevelopmental disabilities. Neuropediatrics 2015;
46: 199-210.
19. Pin Arboledas G, Soto Insuga V, Jurado Luque MJ, et al. Insomnio en niños y adolescentes. Documento de consenso. Ann Pediatr (Barc) 2017; 86: 165.e1-e11.
20 Bruni O, Angriman M, Calisti F, et al. Practitioner review: treatment of chronic insomnia in children and adolescents with neurodevelopmental disabilities. J Child Psychol Psychiatry 20
