Resumen Para evaluar los procesos atencionales a estímulos visuales que no requieren repuesta motora, se llevó a cabo un estudio con potenciales evocados a 17 niños con trastornos del déficit de atención/ hiperactividad (TDAH-I) con predominio inatento y a 15 controles de edades entre 7 y 11 años. Se analizó la latencia y localización de fuentes de los potenciales evocados visuales tempranos P100 y N100 durante la realización de una tarea oddball visual (20% rayas horizontales y 80% verticales) en que las rayas verticales no exigían respuesta motora. Los resultados indican que los niños con TDAH-I procesan la información visual que no requiere respuesta motora con un mayor aumento de la actividad cerebral y mediante la vía temporal ventral mientras que el grupo control lo hace mediante la vía parietal dorsal. Este proceso neurobiológico de procesamiento de la información visual vía temporal ventral de los niños con TDAH-I podría deberse a alteraciones en los procesos emocionales que influyen directamente en el reconocimiento visual o a un déficit en el control de los procesos atencionales por parte de la vía parietal dorsal.
Palabras clave: TDAH-I, potenciales evocados tempranos, P100, N100, percepción visual
Abstract Differences in early visual cerebral processing in children with attention deficit / hyperactivity disorders with predominance of no attention. To evaluate attentional processes to visual stimuli that do not require motor response, a study with evoked potentials was carried out on 17 children with attention deficit disorder predominantly inattentive (ADDH-I) and 15 controls between the ages of 7 and 11 years. The latency and localization of sources of the early visual evoked potentials P100 and N100 were analyzed during the performance of a visual oddball task (20% horizontal and 80% vertical lines) where the vertical lines did not require motor response. The results indicate that ADDH-I group process visual information that does not require motor response with a greater increase in brain activity and through the ventral temporal pathway, while the control group does so by means of the dorsal parietal stream. This neurobiological process of visual information processing by ventral temporal pathway of ADDH-I group could be due to alterations in emotional processes that directly influence visual recognition or as consequence of deficit in the control of attentional processes by the dorsal parietal pathway.
Key words: ADDH-I, early evoked potentials, P100, N100, visual perception
Dirección postal: Tomás Ortiz Alonso. Departamento de Medicina Legal, Psiquiatría y Patología. Facultad de Medicina, Universidad Complutense, Avda Complutense s/n, 28040 Madrid. España.
e-mail: tortiz@ucm.es
El trastorno por déficit de atención con predominio inatento (TDAH-I-I) se basa en alteraciones de las funciones ejecutivas, primordialmente la atención, aunque hasta el momento no conocemos estudios que se hayan dedicado a medir neurobiológicamente los primeros estadios de los procesos atencionales de este trastorno durante estímulos que no requieren respuesta motora. Una forma de medir la atención con variables neurobiológicas, es por los potenciales evocados relacionados con eventos. Los potenciales evocados son mediciones electrofisiológicas relacionadas con procesos que tienen que ver con ciertas funciones cognitivas. Existen muchos estudios con potenciales evocados, aunque la mayoría de ellos se centran en potenciales evocados de larga latencia, asociados con atención voluntaria1. Los estudios sobre los primeros componentes, como P100 y N100, son escasos, aunque están directamente relacionados con los primeros procesos atencionales, como el componente P100, que podría estar involucrado en el primer proceso atencional temprano de reconocimiento de patrones, mientras que el componente N100 estaría relacionado con la capacidad atencional para separar los estímulos target de los distractores, necesario para la memoria de trabajo2. En esta línea de investigación diferentes estudios3, 4 han demostrado la importancia de los procesos bottom up, identificados en este primer componente P100 de los potenciales evocados asociados con la atención temprana, así como con la mejora de la actividad cerebral de componentes tempranos de los potenciales evocados en áreas parietales, asociadas con los procesos básicos de atención y análisis y reconocimiento sensorial después de un periodo de entrenamiento, tanto en niños controles como en niños con TDAH-I5, 6.
A la vista de estos datos nuestro objetivo es analizar estos primeros componentes neurobiológicos de los potenciales evocados, P100 y N100, en niños con trastorno por déficit de atención con predominio inatento, durante una prueba de reconocimiento visual a aquellos estímulos frecuentes (no go) del paradigma oddball a los que el sujeto no tiene que dar respuesta motora.
Materiales y métodos
1. Muestra
La muestra final fue de 32 niños de colegios de los colegios CIP Rayuela, Gredos Las Suertes y Gredos Moratalaz de la Comunidad de Madrid, de los cuales un grupo de 17 sujetos de ambos sexos (12 niños y 5 niñas), de edades comprendidas entre 7 y 11 años (media = 8.9 años, desviación típica (DS) = 1.2 años) estaban diagnosticados de trastorno por déficit de atención. El proceso de selección se llevó a cabo de entre los niños diagnosticados de TDAH-I que se encontraban escolarizados en cada uno de los colegios, que no tuviesen asociado ningún tipo de enfermedad neuropediátrica o neuropsiquiátrica y con cocientes intelectuales normales (entre 100 y 115). El grupo control también estuvo compuesto por 15 niños con similares características al grupo experimental en cuanto a edad (media = 9.1 años, DS = 1.3 años), 10 niños y 5 niñas, y nivel de escolarización. Todos los padres de estos niños firmaron el consentimiento informado y el estudio fue aprobado por el Comité de Ética de Investigación Clínica (CEIC) del Hospital Clínico San Carlos. Los criterios de inclusión fueron los siguientes: diagnóstico clínico con criterios de TDAH-I, DSM-V (Manual Diagnóstico y Estadístico de los Trastornos Mentales, Asociación Americana de Psiquiatría), firma de consentimiento informado por el padre/madre/tutor. Los criterios de exclusión fueron: niños con trastorno generalizado del desarrollo o cualquier tipo de daño cerebral o retraso mental, EEG alterado y/o epilepsia, dificultades en el aprendizaje y/o altas puntuaciones en hiperactividad. Ambos grupos fueron balanceados según edad, sexo, escolaridad y nivel sociocultural. Con el fin de no contaminar los resultados con la medicación, se eligió el grupo de niños con TDAH-I con predominio inatento que no estuviesen medicados, para evitar el sesgo que pudiese darse con diferentes fármacos o dosis.
2. Procedimiento
El diagnóstico se llevó a cabo mediante la entrevista clínica de acuerdo a DSM-V, para el diagnóstico del TDAH-I, y la entrevista diagnóstica mediante el Kiddie-Schedule for Affective Disorders & Schizophrenia, Present & Lifetime, versión traducida, adaptada y validada al español, la ADHD Rating Scale IV (https://psiquiatria.com/TDAH-I/ propiedades-psicometricas-adhd-rating-scale-iv-en-formato- autoreporte/) Una vez seleccionada la muestra se llevó a cabo un estudio de potenciales evocados mediante EEG durante el reconocimiento visual. La prueba oddball consistió en dos estímulos visuales que eran líneas verticales y horizontales: la horizontal, considerada como el estímulo target o diana, se producía en un 20% de los estímulos, aleatoriamente distribuidos a lo largo de la prueba (20% de las veces), y la otra línea, vertical, considerada el estímulo estándar, con una frecuencia de 80%. Las líneas eran de 0.5 cm de ancho y 10 cm de largo con una duración de 300 milisegundos (ms) y un tiempo de respuesta de 700 ms. El niño tenía que responder pulsando la barra espaciadora cada vez que aparecía en la pantalla la línea horizontal (estímulo target).
3. Análisis de datos de EEG
El registro de los potenciales evocados se llevó a cabo mediante el sistema de electroencefalografía ATI-Pentatek® utilizando un casco de Neuroscan de 128 canales. Las impedancias se mantuvieron por debajo de 5kΩ. Se incluyeron canales adicionales para monitorear el movimiento del ojo (cantus laterales derecho e izquierdo y orbitales superiores e inferiores del ojo izquierdo). Los electrodos de referencia se colocaron en ambos mastoides. Se utilizó un filtro de paso de banda de 0.05-30 Hz, y una frecuencia de muestreo de 512 HZ. El análisis de localización de fuentes se llevó a cabo con 123 electrodos, al ser eliminados los electrodos de los movimientos oculares. Los artefactos de movimiento ocular y muscular se identificaron mediante inspección visual y se eliminaron antes de tener el promedio de datos y realizar el análisis de los potenciales evocados. Los canales ruidosos fueron reemplazados mediante interpolación de los canales limpios adyacentes. Las latencias de los componentes P100 y N100 se obtuvieron en el intervalo de tiempo de 80-150 ms para el componente P100 y de 150-250 ms para el componente N100. Las localizaciones de fuentes se obtuvieron analizando 40 ms, 20 anteriores y 20 posteriores al pico de mayor amplitud del electrodo Pz. En este estudio se analizaron las respuestas cerebrales asociadas con el estímulo más frecuente (línea vertical), a las que el sujeto no tenía que pulsar para dar una respuesta motora.
La actividad cerebral del potencial evocado P100 y N100 se localizó a través de la solución de LORETA (Low Resolu- tion Tomography) para el cálculo de la tomografía eléctrica cerebral. A partir de las fuentes calculadas en el potencial evocado se aplicó el programa Statistical Parametric Mapping (SPM) para calcular los mapas en función de una distribución T2 de Hotelling voxel a vóxel contra cero, para estimar las fuentes estadísticamente significativas del potencial evocado. Los mapas de probabilidad resultantes se representaron en el cerebro promedio de acuerdo con el sistema de coordenadas del Instituto Neurológico de Montreal (MNI).
4. Análisis estadísticos
Se usaron las pruebas de Kolmogorov-Smirnov y Shapiro-Wilk para contrastar la normalidad de las componentes P100 y N100 en ambos grupos. Para contrastar la homogeneidad de las varianzas de ambas componentes en los dos grupos, utilizamos la prueba de Levene. Para explorar la posible interacción latencia-grupo se utilizó un modelo de ANOVA de medidas repetidas. El factor entre-sujetos fue el grupo (TDAH-I y control), mientras que las medidas repetidas dentro- sujetos fueron las componentes P100 y N100. Para el cálculo de los tamaños muestrales se fijaron los siguientes niveles: α = 0.05, potencia del contraste 1-β = 0.95, tamaño del efecto (effect size) d = 0.25 (moderado). Para estas especificaciones el modelo de medidas repetidas requería 18 niños por grupo, según el software elegido7. La muestra inicial debía contener 12 niños y 6 niñas en cada grupo. La muestra final, después de algunas pérdidas, quedó en 32 individuos.
Los análisis estadísticos se llevaron a cabo usando el software estadístico SPSS 25.
Resultados
1. Normalidad y homogeneidad de varianzas de las componentes P100 y N100
Las pruebas de Kolmogorov-Smirnov y Shapiro-Wilk mostraban que ambos componentes P100 y N100, en ambos grupos, TDAH-I y control, satisfacían la hipótesis de normalidad (todos los valores p > 0.18). Igualmente, las varianzas de ambas componentes se mostraban homogéneas según los valores de los estadísticos de Levene (todos los valores p > 0.3 para la distribución F1,30). Estos resultados confirmaban la adecuación del modelo de medidas repetidas.
2. Latencias del potencial evocado P100/N100
La onda de los potenciales evocados de ambos grupos evidenciaba un componente P100 de baja amplitud, seguido de un componente negativo N100 de gran amplitud, registrado en el electrodo Pz (Figura 1). Los resultados descriptivos mostraban una latencia media del componente
P100 de 139.53 (DT 16.73) para el grupo TDAH-I, frente a una latencia media de 152.53 (DT 23.88) para el grupo control, y N100 latencia media de 220.59 (DT 16.86) para el grupo TDAH-I frente a una latencia de 206.00 (DT 19.76) para el grupo control. Los resultados correspondientes al componente N100 fueron 220.59 (DT = 16.86) para el grupo TDAH frente a 206.00 (DT = 19.76) para el grupo control. Cuando se analizó el gráfico de medias de las latencias (Figura 2) se observó un comportamiento claramente divergente (falta de paralelismo de las dos rectas, ambas se cortan) como consecuencia de la relación inversa de las diferencias entre los grupos TDAH y control de las componentes P100 y N100, lo cual anticipaba una clara interacción latencia-grupo. El análisis estadístico, ANOVA de medidas repetidas, mostraba el efecto significativo de la interacción (F1,30 =14.32,
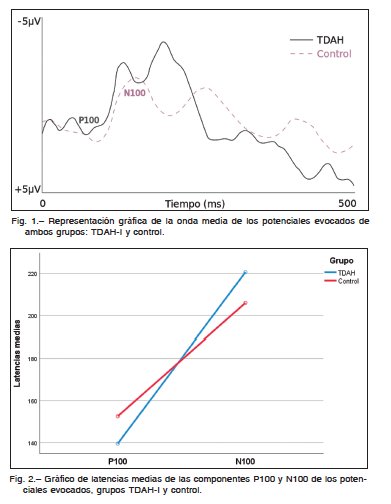
p = 0.001) así como el efecto entre latencias N100-P100 (F1,30 = 340.42, p < 0.001). Como cabía esperar, el efecto del grupo globalmente no resultó significativo (p = 0.892).
Los resultados estadísticos por grupos separados mostraban diferencias estadísticamente significativas entre las componentes N100 y P100 en el grupo TDAH-I (t16 = 18.22, p < 0.001) y en el grupo control (t14 = 9.05, p < 0.001). Los intervalos de confianza 95% para ambas diferencias, N100- P100, fueron, respectivamente (71.63; 90.49) y (40.80; 66.14) para los grupos TDHA y control respectivamente.
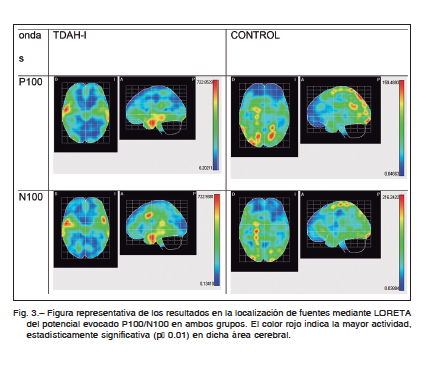
3. Localización de fuentes del potencial evocado P100/N100
Los resultados indicaban una actividad mayor en los niños con TDAH-I (P100: T2722.8529 y N100: 722.9381) frente al grupo control (P100 T2 159.4893 y N100: 216.2422). De hecho la magnitud obtenida con la prueba T2 de Hotelling muestra (dado el mismo número de muestras en todos los mapas) una mayor activación de estas áreas en el grupo con TDAH-I (Figura 3).
Las diferencias significativas del mapa medio del grupo con TDAH-I en el reconocimiento visual en el componente P100 se encontraron, en áreas temporales inferiores derechas (coordenadas MNI: X 53, Y -3 y Z -32, T2 628.505), áreas temporales medias derechas (coordenadas MNI: X 54, Y -2 y Z -24, T2 709.496) y áreas temporales medias izquierdas (coordenadas MNI: X -66, Y -30 y Z -8, T2 709.496) mientras que en el grupo control las áreas más activas significativamente fueron el área parietal superior izquierda (coordenadas MNI: X -18, Y -70 y Z 56, T2 158.889), área parietal superior derecha (coordenadas MNI: X 18, Y -70 y Z 56, T2 151.036) , área occipital inferior derecha (coordenadas MNI: X 29, Y -93 y Z -12, T2 146.136), área occipital medial derecha (coordenadas MNI: X 34, Y -83 y Z 32, T2 138.627), cuneus derecha (coordenadas MNI: X 16, Y -82 y Z -45, T2 128.327), área parietal superior izquierda (coordenadas MNI: X -16, Y -79 y Z 44, T2 120.932), área angular derecha (coordenadas MNI: X 57, Y -53 y Z 28, T2 140.982) y área frontal superior derecha (coordenadas MNI: X -19, Y 2 y Z 68, T2 131.223) (Figura 2).
Las diferencias significativas del mapa medio del grupo con TDAH-I en el reconocimiento visual en el componente N100 se encontraron, en áreas temporales superiores derechas (coordenadas MNI: X 54, Y 2 y Z – 25 T2 710.595), área precentral izquierda (coordenadas MNI: X -50, Y 7 y Z 39, T2 120699.975) mientras que en el grupo control las áreas más activas significativamente fueron el área precentral derecha (coordenadas MNI: X 22, Y -19 y Z 72 T2 204.476), postcentral derecha (coordenadas MNI: X 22, Y -38 y Z 72 T2 188.876), occipital inferior derecha, (coordenadas MNI: X 30, Y -92 y Z -12 T2 194.426), occipital inferior izquierda, (coordenadas MNI: X -18, Y -95 y Z -12 T2 177.946) y frontal superior derecha (coordenadas MNI: X 25, Y 3 y Z 64 T2 164.842 (Figura 3).
Discusión
La diferencia en las latencias del grupo control, N100- P100, que se acorta significativamente entre P100-N100 frente al grupo TDAH-I, se debe principalmente a un aumento de la capacidad atencional y la velocidad de procesamiento cognitivo de este grupo. La temporalidad en el procesamiento de la información mediante potenciales evocados tempranos ha sido asociada con los primeros procesos atencionales3 y su acortamiento con una mayor eficiencia neuronal. En los componentes más tempranos de los potenciales evocados este acortamiento podría asociarse con la detección y evaluación atencional de estímulos espaciales, con una mayor capacidad en los procesos de anticipación8,9 así como con entrenamiento cognitivo10.
La mayor actividad cerebral en ambos componentes P100 y N100 en el grupo TDAH-I nos indica que se produce un mayor aumento de recursos cerebrales para llevar a cabo la tarea de estímulos visuales simples a los que no el niño no tiene que dar una respuesta motora. En esta línea de investigación otros trabajos han justificado que el aumento de la amplitud de los potenciales evocados estaría asociado con el mayor esfuerzo cognitivo de la tarea, incluido para los estímulos frecuentes (non target)11. Una posible explicación es que el proceso de atención a los estímulos frecuentes, sea el mismo que los principios que rigen la búsqueda visual y que postulan que no existen diferencias cualitativas entre la búsqueda de características básicas y la búsqueda de combinaciones o interacciones en conjunto, por lo que se abandona la dicotomía estricta entre paralelo pre-atencional y serial- atencional12. En este sentido se considera que toda búsqueda visual puede situarse en un continuum de eficacia, rapidez y demanda de procesos de atención, dependiendo de las características y requerimientos específicos de cada tarea, tanto entre el estímulo objetivo y los estímulos distractores como entre los distractores entre sí13. El esfuerzo por parte del grupo con TDAH-I en estos potenciales tempranos vendría justificado por el tiempo y esfuerzo requerido para confirmar cuál de esos elementos es realmente el objetivo atencional.
En relación con reorganización cerebral en ambos componentes, P100 y N100, comprobamos que el grupo TDAH-I utiliza la vía ventral temporal, mientras que el grupo control utiliza la vía dorsal parietal ante estímulos visuales simples a los que el niño no tiene que dar respuesta motora. Esto podría deberse a que los niños con TDAH-I manifiestan déficits en procesos motivacionales y emocionales activados durante la toma de decisiones que tienen que llevar a cabo durante el reconocimiento de estímulos espaciales. La vía visual ventral, está asociada con el reconocimiento de objetos, emociones y conocimiento social, incluso de integración contextual y multisensorial14, 15.
Algunos estudios han demostrado que la N100 refleja la actividad selectiva del córtex visual ventral extraestriado16 que estaría bajo el control de retroalimentación procedente de áreas implicadas en procesos de control atencional por el córtex parietal, por lo que el grupo con TDAH-I, que muestra una mayor actividad de la vía ventral, ella podría deberse a una falta de eficiencia neuronal como consecuencia de no codificar la señal visual selectiva y poder así categorizarla rápidamente. Este hallazgo sugiere un retraso del procesamiento espacial selectivo en el córtex visual extraestriado, originado por la alteración de los mecanismos de control atencional del córtex parietal17. Los estudios previos de neuroimagen funcional justifican la interacción funcional de ambas vías, mediante la existencia de una gran conectividad funcional entre las regiones de la vía ventral temporal y las de la corteza parietal, que se produce cuando la acción es dirigida a la textura e información de objetos visuales18. Una justificación a esta propuesta vendría determinada por el hecho de que existe un gran déficit neurofuncional en la vía dorsal parietal que repercute en niños con TDAH-I19, que podría estar afectando directamente al procesamiento de la vía ventral temporal. En esta línea explicativa se ha comprobado que las conexiones entre la vía visual dorsal parietal y la vía ventral temporal pueden ser un factor importante en la explicación de los déficits perceptivos visuales en pacientes con lesiones parietales20.
La conclusión es que los niños con TDAH-I manifiestan una tendencia a procesar la información visual que no requiere atención voluntaria en forma de respuesta motora de forma más rápida, mediante la vía visual temporal ventral, mientras que el grupo control lo hace mediante la vía parietal dorsal, este proceso neurobiológico podría deberse a alteraciones en los procesos emocionales que influyen directamente en el reconocimiento visual o a un déficit en el control de los procesos atencionales por parte de la vía parietal dorsal, por posibles déficits neurofuncionales de la misma en el grupo con TDAH-I.
Agradecimientos: Este trabajo ha sido financiado por la Fundación para el Conocimiento Madri+d de la Comunidad de Madrid
Conflicto de intereses: los autores declaran no tener ningún conflicto de intereses.
Bibliografía
Frank Y, Seiden JA, Napolitano B. Event-related potentials to an ‘oddball’ paradigm in children with learning disabilities with or without attention deficit hyperactivity disorder. Clin Electroencephalogr 1994; 25: 136-41.
2. Taylor, JG. On the neurodynamics of the creation of con- sciousness, Cogn Neurodyn 2007; 1: 97-118.
3. Carrasco M. Visual attention: the past 25 years. Vis Res 2011; 51: 1484–525.
4. Isoglu-Alkac U, Ermutlu MN, Eskikurt G, Yücesir İ, Demirel Temel S, Temel T. Dancers and fastball sports athletes
have different spatial visual attention styles. Cogn Neurodyn 2018; 12: 201-9.
5. Llorente C, Oca J, Solana A, Ortiz T. Estudio piloto para la mejora de los procesos neurofuncionales atencionales. Participación educativa 2012; 48-59
6. Soria-Claros M, Serrano-Marugan I, Quintero J, Ortiz T. The effect of passive tactile stimulation in the brain activity of children with attention deficit. Rev Neurol 2016; 62 Suppl 1: S103-7.
7. Power GP. 3.1.9.2. Heinrich Heine University, Dusseldorf University. 28 March 2014 En: http://www.psycho.uniduesseldorf.de/abteilungen/aap/gpower3/download-and- register, consultado diciembre 2018.
8. Jin H, Xu G, Zhang JX, et al. Event-related potential effects of superior action anticipation in professional badminton players. Neuroscience Letters 2011; 492: 139-44.
9. Zwierko T, Lubinski W, Lubkowska A, Niechwiej-Szwedo E, Czepita D. The effect of progressively increased physical efforts on visual evoked potentials in volleyball players and non-athletes. Journal of Sports Sciences 2011; 29:
1563-72.
10. Küper K, Gajewski PD, Frieg C, Falkenstein M. A Randomized controlled ERP study on the effects of multidomain cognitive training and task difficulty on task switching performance in older adults. Front Hum Neurosci 2017; 11: 184.
11. Sanchez-Lopez J, Silva-Pereyra J, Fernandez T. Sustained attention in skilled and novice martial arts athletes: a study of event-related potentials and current sources. Peer Journal 2016; 4: e1614.
12. Leonards U, Palix J, Michel C, Ibanez V. Comparison of early cortical networks in efficient and inefficient visual search: an event-related potential study. J Cogn Neurosci 2003; 15: 1039-51.
13. Wolber M, Wascher E. Visual search strategies are indexed by event-related lateralizations of the EEG. Biol Psychol
2003; 63: 79-100.
14. Pehrs C, Zaki J, Taruffi L, Kuchinke L, Koelsch S. Hip- pocampal-temporopolar connectivity contributes to episodic simulation during social cognition. Scientific Reports 2018, 8: 9409.
15. Raz G , Jacob Y, Gonen T, et al. Cry for her or cry with her: context-dependent dissociation of two modes of cinematic empathy in network cohesion dynamics. Soc Cogn Affect Neurosci 2014; 9: 30-8.
16. Qu Z, Hillyard SA, Ding Y. Perceptual learning induces persistent attentional capture by nonsalient shapes. Cereb Cortex 2017; 27: 1512-23.
17. Cauchoix M, Crouzet SM, Denis Fize D, Serre T. Fast ventral stream neural activity enables rapid visual cat- egorization. Neuro Image 2016; 125: 280-90.
18. Bria Long, Chen-Ping Yua, Talia Konkle. Mid-level visual features underlie the high-level categorical organization of the ventral stream. PNAS 2018; 115: 38.
19. Bush G. Cingulate, frontal, and parietal cortical dysfunction in attention-deficit/hyperactivity disorder. Biol Psychiatry
2011; 69: 1160-7.
20. Lanyon LJ, Denham SL. Modelling visual neglect: com- putational insights into conscious perception. PLoS One
2010; 5(6): e11128.
