JULIETH A. SIERRA-DELGADO 1, 2*, PAULA K. BAUTISTA-NINO 2*, CLARA I. VARGAS-CASTELLANOS 1, NORMA C. SERRANO DIAZ 2, 3, MELVIN Y. RINCON 2
1 Universidad Industrial de Santander, Bucaramanga, Santander, 2 Dirección de Investigaciones, Fundación Cardiovascular de Colombia, Floridablanca, Santander, 3 Hospital Internacional de Colombia, Piedecuesta, Santander, Colombia
* Estos autores contribuyeron igualmente a este trabajo
Resumen En los últimos años la terapia génica se ha posicionado como una opción real y segura en el desarrollo de alternativas terapéuticas para la cura y la prevención de diferentes enfermedades. Consiste en la inserción de material genético en un tejido o célula defectuosa, mediante el uso de un vector. Existen varias consideraciones para seleccionar el vector más apropiado, incluyendo el potencial de unión y entrada a la célula diana, la capacidad de transferencia del material genético al núcleo, la habilidad de expresión del inserto y la ausencia de toxicidad. En el panorama actual, los vectores virales más utilizados son los derivados de los virus adenoasociados (AAV). Características como su bioseguridad, baja toxicidad y tropismo selectivo, han posibilitado su evaluación como opción terapéutica en un amplio número de enfermedades monogénicas o complejas. A pesar de sus ventajas, los vectores AAV presentan inconvenientes, siendo el más importante la respuesta inmune del paciente al vector, especialmente la respuesta mediada por anticuerpos neutralizantes (NAb). Los NAb disminuyen la transducción del vector e impiden la expresión del gen que transporta, limitando su aplicación clínica. Por lo tanto, identificar y cuantificar la presencia y actividad de los NAbs, es el primer paso en cualquier protocolo de terapia génica con vectores AAV. La presencia de NAb depende principalmente de la exposición al virus en la naturaleza y varía drásticamente según edad, localización geográfica y estado de salud de la persona evaluada.
Palabras clave: sistema inmunitario, anticuerpos neutralizantes, vector viral adenoasociado, terapia génica
Abstract In recent years, gene therapy has been positioned as a real and safe option in the development of therapeutic alternatives for the cure and prevention of different diseases. It consists in the insertion of genetic material in a defective tissue or cell, through the use of a vector. There are several considerations for selecting the most appropriate vector, including the potential for binding and entry to the target cell, the ability of the genetic material to transfer to the nucleus, the ability to express the insert, and the absence of toxicity. In the current scenario, the most commonly used viral vectors are those derived from adeno-associated viruses (AAV). Characteristics such as biosafety, low toxicity and selective tropism have enabled its evaluation as a therapeutic option in many monogenic or complex diseases. Despite their advantages, AAV vectors have drawbacks, the most important being the patient’s immune response to the vector, especially the response mediated by neutralizing antibodies (NAb). NAbs decrease the transduction of the vector and prevent the expression of the gene it transports, limiting its clinical application. Therefore, identifying and quantifying the presence and activity of NAbs is the first step in any gene therapy protocol with AAV vectors. The presence of NAbs depends mainly on exposure to the virus in nature and varies drastically according to age, geographic location and health status of the person evaluated.
Key words: immune system, neutralizing antibodies, adeno-associated viral vector, gene therapy
Dirección postal: Melvin Y. Rincon, Carrera 5 # 6-33 Esquina, 681003 Floridablanca, Santander, Colombia
e-mail: rinconmy@gmail.com
La terapia génica es una disciplina que busca la inserción de material genético para el tratamiento o corrección de una enfermedad. Esta inserción puede realizarse ex vivo, tratando células del individuo con el gen de interés en el contexto del laboratorio, siendo posteriormente suministradas al paciente. Esta modalidad fue utilizada en los primeros tratamientos para la inmunodeficiencia grave combinada ligada a X durante la década de 1990 e inicios del siglo 21. En la modalidad in vivo la inserción del material genético se realiza de manera directa utilizando un vector 1. La terapia génica in vivo tiene el potencial de aumentar la eficiencia y aumentar el espectro de aplicaciones con respecto a la terapia ex vivo 2.
Las estrategias de transferencia génica in vivo se caracterizan por tres elementos: el gen a transferir, el tejido blanco en el que se introduce el gen, y el vector, el cual se utiliza para facilitar la entrada del gen 3. Existen varias consideraciones para escoger el vector más apropiado, como el potencial de unión y entrada a la célula diana, la transferencia adecuada del material genético al núcleo, la habilidad de expresión prolongada del inserto y la ausencia de toxicidad 4.
Dentro de los vectores que se pueden utilizar para la transferencia del material genético se encuentran los virus y vectores no virales. Algunos de los vectores virales utilizados han sido lentivirus, adenovirus, virus adenoasociados (AAV) y virus de herpes simplex 1, 5. Los vectores no virales incluyen inyección directa de ácido desoxirribonucleico (ADN), ya sea en plásmidos o productos desnudos de reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) utilizando dispositivos como electroporación, sonoporación, magnetofección o pistolas de genes para facilitar su entrada a la célula y núcleo 1.
Debido a su pobre inmunogenicidad, su bajo riesgo de mutagénesis insercional y su buen perfil de seguridad, los vectores AAV constituyen una gran opción terapéutica.
Actualmente son ampliamente utilizados en terapia génica para la transferencia de genes de interés en estudios preclínicos y ensayos clínicos de patologías monogénicas 5.
A finales de 2017 la terapia de reemplazo genético del gen RPE65 para el tratamiento de la amaurosis congénita de Leber utilizando el serotipo AAV2 en administración sub-retinal (Luxterna, Spark therapeutics), se convirtió en la primera terapia génica con vectores AAV en ser aprobada por la Food and Drug Administration (FDA) en EE.UU. 6, 7. En mayo de 2019 la FDA aprobó la terapia de reemplazo genético del gen SMN1 utilizado el vector AAV9 para el tratamiento de la atrofia muscular espinal en pacientes menores de 2 años (Zolgensma, AveXis Inc.) 8, 9. La aprobación inicial es para la administración por vía intravenosa en pacientes de hasta 2 años de edad; sin embargo, AveXis está llevando a cabo estudios clínicos para la administración intratecal de zolgensma en pacientes con atrofia muscular espinal de hasta 5 años de edad 10. También se está evaluando la efectividad de la transferencia genética en pacientes con hemofilia A (BioMarin Pharmaceutical). En un estudio clínico fase I que evaluó el efecto de una dosis intravenosa única de un vector AAV5 optimizado, que codifica para el factor VIII, en nueve hombres con hemofilia A grave se observó la normalización sostenida de la actividad del factor VIII, con estabilización de la hemostasia y una profunda reducción en el uso del factor VIII 11. Todos estos resultados validan el potencial terapéutico de los vectores AAV para el tratamiento de diversas clases de enfermedades.
Características de los virus adenoasociados
Los AAV son virus de ADN, de 25 nm, de la familia Parvoviridae y el género Dependovirus. El genoma de los AAV es linear, de 4.7 kilobases (Kb), contiene dos secuencias palindrómicas invertidas en su región terminal (ITR, por sus siglas en inglés) flanqueando dos genes: el gen Rep, el cual codifica las enzimas necesarias para la replicación, la actividad endonucleasa y la actividad ATPasa y el gen Cap, que produce las tres proteínas de la cápside viral.
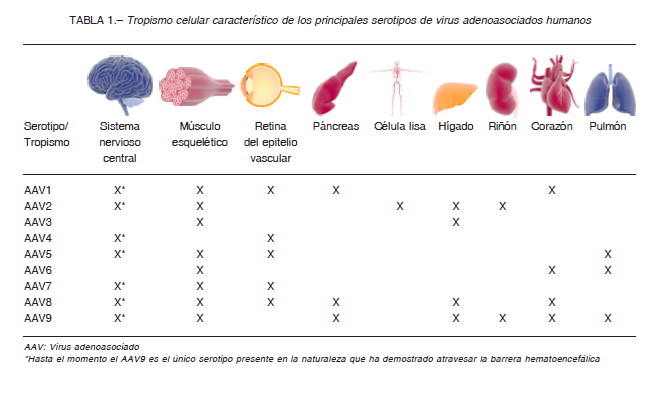
Estas proteínas en la cápside viral diferencian los serotipos de AAV y les confieren diversos tropismos tisulares 4, 12, 13. Hasta ahora se han descubierto 12 serotipos de AAV humanos (AAV1-AAV12) y 100 de primates no humanos, cada uno de ellos con un tropismo celular característico 4, 14 (Tabla 1).
El ciclo de vida de los AAV tiene dos etapas: lítica y lisogénica. Una infección productiva (ciclo lítico) por AAV solo puede ocurrir en presencia de un virus adyuvante, ya sea un adenovirus o herpesvirus; en esta etapa ocurre replicación activa, expresión de genes virales y producción de viriones. En ausencia del virus adyuvante el AAV entrará a ciclo lisogénico, en el cual se limita la replicación y la expresión de genes virales; en este ciclo el genoma de los AAV puede integrarse de manera específica al cromosoma 19 en la región q13.4, estableciendo latencia hasta que se produzca una infección por adenovirus o herpesvirus, en cuyo caso el AAV entrará a ciclo lítico. La integración específica del genoma viral al cromosoma 19 depende de proteínas codificadas por el gen Rep. Para evitar el riesgo de mutagénesis insercional, y debido al tamaño de la secuencia, cuando se diseña un vector viral utilizando AAV se reemplazan los genes Rep y Cap por el gen de interés conservando solo las regiones ITR, las cuales son fundamentales para la replicación del material genético 4.
Respuesta inmune contra los virus adenoasociados
A pesar de que la infección por AAV ha sido detectada en diversos tejidos, tanto en animales como en humanos, hasta el momento no se han asociado con ninguna patología 15. Los AAV se encuentran libremente en la naturaleza, por lo cual los humanos y los modelos animales de experimentación utilizados en investigación biomédica pueden haber tenido exposición previa a algunos de los serotipos de AAV y por tanto generar respuesta inmune celular y humoral 16, 17. A nivel inmunológico, la cápside del vector AAV es una réplica del virión encontrado en la naturaleza por lo que la administración del vector genera la activación de la respuesta inmune frente a proteínas de la cápside del virus tanto en los pacientes previamente expuestos a los AAV como en aquellos sin exposición previa 4, 17. La presencia de respuesta inmune contra la cápside impide el acoplamiento y entrada del material genético a las células de interés, por esta razón es una de las principales barreras, tanto para el tratamiento inicial como para a readministración del vector 18. No obstante la similaridad de la cápside entre los vectores y los AAV presentes en la naturaleza, la administración del vector difiere de la infección natural en tres aspectos: la introducción de un número mayor de partículas virales al organismo, la ruta de la administración (la exposición natural a AAV usualmente se lleva a cabo por vía aérea) y, por último, la no replicación activa del AAV dada a la ausencia de adyuvante, lo cual disminuye la respuesta inmune generada 15.
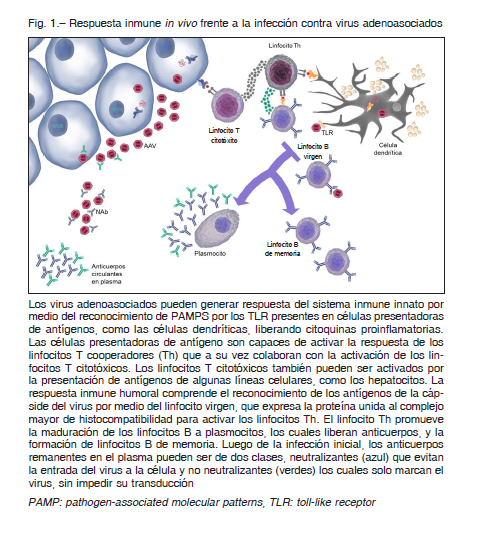
La primera línea de respuesta que desencadena la infección por AAV es mediada por el sistema inmune innato.
El sistema inmune innato reconoce secuencias evolutivamente conservadas ajenas al huésped (PAMPs por sus siglas en inglés, pathogen-associated molecular pattern) mediante receptores de reconocimiento de patógenos, generando un aumento en secreción de citoquinas y quimoquinas y un aumento de moléculas coestimulatorias, induciendo o modulando el sistema inmune adaptativo.
Los PAMPs presentes en los AAV son reconocidos por los Toll-like receptors tipos 2 y 9 generando respuesta inmune mediada por el factor nuclear Kappa Beta y secreción de interferón tipo I, respectivamente 17.
La infección por AAV también genera respuesta adaptativa celular mediada principalmente por linfocitos T-CD8+19. Estudios de monitoreo de reactividad de células T hacia la cápside del AAV2 muestran que alrededor de dos tercios de adultos mayores de 25 años presentan células T que responden a péptidos de la cápside del AAV2; de la misma manera, se han reportado frecuencias de 30% de células T reactivas contra epítopes de AAV1 en población sana 20, 21. Debido a que los vectores AAV son no replicativos, se asume que la cápside permanece inmunológicamente detectable en una célula por un período definido del tiempo, que varía de semanas a meses según el tejido diana, alterando la respuesta celular 20.
Se ha descrito que, la infusión de un vector derivado del serotipo AAV2 en hepatocitos provoca una expansión clonal de linfocitos T-CD8+ específicos para la cápside del virus 19. A pesar de este conocimiento, las implicaciones y mecanismos de esta respuesta inmune aún no están del todo dilucidados, y, por lo tanto, son necesarios mayores estudios sobre la naturaleza y potencia de la respuesta celular, tanto en infección natural, como en el contexto de terapia génica 21.
A pesar de que los vectores derivados de AAV pueden generar una respuesta celular, el principal obstáculo para la implementación de terapia génica con vectores AAV es la generación de inmunidad humoral 22. La inducción de anticuerpos por exposición natural a AAV y la repetida exposición a vectores virales en pacientes previamente seronegativos provocan una respuesta humoral potente que compromete la transducción del vector y su persistencia disminuyendo la expresión del transgen 23, 24.
La exposición natural a AAV resulta en la producción de anticuerpos tipo IgG, en especial de la subclase IgG1 25-27.
Esta respuesta humoral inmune puede ser de dos tipos: neutralizante o no neutralizante. Los anticuerpos neutralizantes (NAbs por sus siglas en inglés) reconocen epítopes en la cápside del virión inhibiendo la transducción del AAV a las células diana. Por otra parte, los anticuerpos no neutralizantes se unen al virus, marcándolo sin bloquear la transducción celular 15, 24. Los primeros ensayos clínicos que buscaban la transducción hepática de vectores AAV en pacientes con hemofilia B demostraron que los NAbs son el principal factor a superar para el establecimiento y mantenimiento de la terapia 19. Se ha descrito que títulos relativamente bajos, de hasta 1:17, neutralizan por completo grandes dosis de vector, por lo cual no hay detección de la expresión del gen28. Estudios posteriores sugieren que títulos incluso más bajos (1:5-1:10) pueden impedir la transducción completa del vector en el órgano diana y alterar su biodisponibilidad, aumentando la transducción en bazo y nódulos linfáticos 27, 29. Esta inhibición por NAbs también es dependiente de la vía de administración: la administración del vector por vía intratecal, o directamente en ojo o músculo parece ser menos susceptible a la acción de los NAbs 30. Debido al efecto de los NAbs en la respuesta terapéutica deseada al infectar con el transgen, pacientes con títulos positivos de anticuerpos (incluso tan bajos como 1:2) son inmediatamente excluidos de la mayoría de los ensayos clínicos con vectores AAV 31.
Resulta interesante que las respuestas humoral y celular a la infección con vectores AAV parecen no estar acopladas; sujetos positivos para anticuerpos contra AAV no presentan reactividad celular contra la cápside y, de igual manera, pacientes con reactividad celular tienen menores títulos de anticuerpos contra vectores AAV. Esto sugiere que, posterior a la exposición al AAV, ciertos individuos favorecen una respuesta Th1 al antígeno, mientras otros desarrollan una respuesta Th220. Un resumen de la respuesta inmune frente a la infección con AAV puede encontrarse en la Figura 1.
Estrategias para determinar los niveles de NAbs
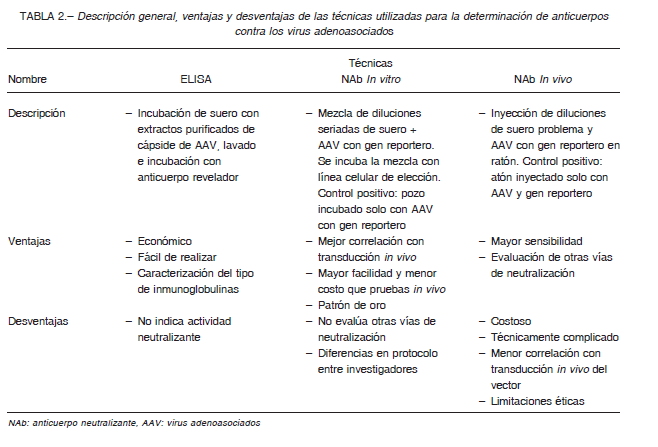
Una adecuada identificación no solo de la presencia de NAbs, sino de los títulos y actividad de los NAbs, es de vital importancia en las primeras fases de los ensayos clínicos con vectores AAV. Actualmente, se han descrito tres estrategias para determinarlos: el ensayo por inmunoabsorción ligado a enzimas (ELISA), la detección de NAbs in vitro y finalmente la detección in vivo16. En general, todas las técnicas utilizan suero como sustrato para la determinación debido a su facilidad de obtención y a que es altamente indicativo del estado humoral inmune del paciente, sin embargo, otros sustratos como tejidos o líquido sinovial pueden ser utilizados para la caracterización de los NAbs 30. La Tabla 2 presenta las ventajas y desventajas de cada técnica.
ELISA
La técnica de ELISA fue la primera empleada para el estudio de anticuerpos contra AAV, y fue ampliamente utilizada en los primeros reportes generados en la década de los ´70. Para el estudio de anticuerpos contra AAV se utiliza la variante técnica denominada ELISA indirecto, la cual emplea un sistema de detección de doble anticuerpo, con los antígenos de interés fijados en la superficie, un anticuerpo primario que en este caso corresponde al anticuerpo a evaluar y un anticuerpo secundario que revela la presencia de los complejos antígeno-anticuerpo 25. La reducción la señal de luminiscencia o fluorescencia dada por el anticuerpo secundario es la que determina la seropositividad, pues se toma como título positivo la primera dilución en la cual se logra una reducción de la señal en un 50% comparado con la señal emitida en el control.
Determinación de NAbs in vitro
La técnica utiliza diluciones seriadas del suero del paciente que son mezclados con un número fijo de vectores AAV que expresan el gen reportero. Las mezclas resultantes son incubadas con una línea celular permisiva. Posterior a la incubación se mide la eficacia de la transducción viral de acuerdo al nivel de expresión del gen reportero utilizado. El título de anticuerpos es reportado como la dilución más alta que inhibe la expresión del 50% del gen reportero con relación al control positivo 16,24,32.
Varios estudios han utilizado esta técnica, no solo para evaluar la presencia previa de NAbs en posibles candidatos a terapias sino también para evaluar posibilidad de reinyección en pacientes donde sea necesario administrar una nueva dosis de virus. Entre estos estudios se encuentran la mayoría de ensayos para terapia génica contra la hemofilia y más recientemente el estudio Cupid-2 en pacientes con falla cardíaca 26, 31.
Determinación de NAbs in vivo
Debido a que el ensayo in vitro no evalúa la neutralización por fagocitosis celular dependiente de anticuerpos y otros componentes sanguíneos y puede presentar problemas de reproducibilidad, algunos investigadores han desarrollado el ensayo de detección in vivo para evaluar la respuesta inmune y la actividad de los anticuerpos en un modelo animal 16, 24.
La técnica consiste en inyectar varios ratones, cada uno con una mezcla de diferentes diluciones del suero problema de manera posterior o simultánea a una infusión de AAV que expresa un gen reportero y se mide la actividad del gen reportero 24,33. El título de NAbs es definido como la dilución en la cual se redujo la expresión del transgen un 50% comparado con un ratón control inyectado sólo con el vector 24.
Prevalencia de anticuerpos neutralizantes en la población
Los primeros estudios para determinar la prevalencia de anticuerpos contra los AAV fueron realizados por Blacklow en 1968 34, 35. A partir de los primeros ensayos clínicos utilizando vectores derivados de AAV, se realizaron estudios de prevalencia de NAbs en población sana y en pacientes con enfermedades específicas 2 (Tabla 3). Los serotipos más comunes en investigación básica, preclínica y clínica son los AAV1, 2, 3, 4, 5, 6, 7, 8 y 9 y, por ende, los estudios poblacionales se han centrado en ellos.
Estudios poblacionales en EE.UU. y países de Asia, África, Oceanía y Europa han comunicado diferencias entre las prevalencias de NAbs según el serotipo evaluado y la población estudiada (Tabla 3). La prevalencia de NAbs en población sana, independiente del serotipo, es generalmente mayor en países en vía de desarrollo que en países desarrollados, con excepción de Francia, donde se reporta una alta prevalencia contra AAV1 y de Holanda, donde un estudio reportó un gran porcentaje de seropositividad contra los serotipos AAV1, AAV6, AAV7 y AAV8 21, 27 ,36. Los factores que pueden explicar este fenómeno incluyen variaciones en condiciones socioeconómicas, de vivienda, densidad poblacional, condiciones higiénicas y acceso a salud entre las poblaciones de los países y regiones y la diferencia en metodología, previamente expuesta, en el ensayo in vitro 24. Cabe anotar que hasta el momento solo se tienen datos de prevalencia de NAbs en población latinoamericana procedentes de un único estudio en población brasileña que empleó la técnica de ELISA 25. El proyecto ANVIAS, actualmente en curso, busca establecer la prevalencia para tres serotipos de AAV en individuos sanos y pacientes con falla cardíaca colombianos, por lo cual pronto se tendrán datos poblacionales de la región 37.
Varios estudios han encontrado diferencias significativas entre diferentes grupos etarios sin importar el serotipo evaluado 2, 23, 34, 35, 39, 40, 43, 46. Los títulos de anticuerpos aumentan con la edad y describen el siguiente comportamiento: desde el nacimiento hasta aproximadamente 6 meses los títulos se mantienen altos debido a la inmunidad pasiva materna, y luego disminuyen hacia los 7-11 meses de edad. Posterior a la maduración del sistema inmune, en el primer año de vida, los títulos comienzan a aumentar, coincidiendo con un aumento de exposición a los AAV presentes en la naturaleza 24.
Existe evidencia conflictiva sobre si hay o no diferencia en la prevalencia de NAbs de acuerdo al sexo. Algunos estudios han descrito prevalencias significativamente mayores de títulos de NAbs contra AAV1 en mujeres comparado con hombres 36, mientras que en otros no se ha encontrado diferencia significativa en las prevalencias o títulos entre hombres y mujeres 30, 42, 45.
Con respecto a la especificidad de la respuesta inmune humoral a la infección con AAV, se ha descrito una fuerte relación en la seropositividad entre diferentes serotipos de AAV. La gran mayoría de sueros (50-100%) presentan seropositividad frente a dos o más serotipos 23, 27, 41, 42, 45, 46.
Esta reactividad cruzada puede deberse a exposición a los diversos serotipos presentes en la naturaleza o bien a reactividad cruzada entre anticuerpos contra solo un serotipo, debido a la homología entre las proteínas de las cápsides 4, 41. Estudios longitudinales recientes con chimpancés parecen favorecer la segunda hipótesis, pues se ha encontrado que la infección por solo un serotipo de AAV induce anticuerpos neutralizantes capaces de neutralizar múltiples serotipos diferentes 49.
Estrategias para burlar la presencia de NAbs en la aplicación de terapia génica con vectores adenoasociados
Debido al alto porcentaje de individuos seropositivos y la presencia de reactividad cruzada, se han desarrollado diversas estrategias para la administración de vectores AAV a pacientes con títulos positivos de NAbs. La primera estrategia es la plasmaféresis, en la cual se remueve la sangre y se la separa en sus componentes. La fracción celular se retorna al cuerpo, mientras el plasma es desechado y reemplazado por albúmina. La plasmaféresis ha sido utilizada para reducir niveles de NAbs antes de la administración del vector, y resulta en una disminución de los títulos de 2 a 3 veces por cada sesión de aféresis.
Esta estrategia es especialmente útil en pacientes con bajos niveles de NAbs o pacientes que se seroconvirtieron y requieran readministración posterior del vector 20, 24.
Otra estrategia consiste en minimizar contacto del vector con los NAbs mediante el uso de vías de administración directa en el órgano diana y no en el sistema circulatorio. De esta manera se limita la exposición a NAbs circulantes en plasma, se limita la acción solo al tejido deseado y también se limita la dosis necesaria del vector, reduciendo así su inmunogenicidad. Esta táctica ha sido altamente efectiva utilizando vías de administración muscular, intratecal y ocular 20, 47, 50.
También se ha propuesto la inmunosupresión como un mecanismo para reducir la producción de anticuerpos neutralizantes mediante depleción farmacológica de células B, sin embargo, esta estrategia ha presentado resultados mixtos en modelos animales 20, 31.
Finalmente, se ha propuesto el diseño de cápsides específicas con una combinación de epítopes que no sea reconocida por los anticuerpos. Estas cápsides pueden ser diseñadas según los anticuerpos presentes en los pacientes (terapia personalizada) o para uso como terapia en la población general. Este diseño se basa en la utilización de librerías creadas por PCR prona error y generar vectores que no solo escapen a la neutralización mediada por anticuerpos sino también con tropismo para el tejido de interés. Por el momento la estrategia ha tenido buenos resultados en estudios in vivo con modelos murinos 33.
A pesar de estos resultados prometedores en modelos animales, ninguna de estas estrategias ha sido aplicada en los estudios clínicos para hemofilia, atrofia muscular espinal o amaurosis congénita de Leber, razón por la cual es importante continuar el estudio de estrategias para disminuir la respuesta inmune y que más pacientes puedan beneficiarse de la terapia génica basada en AAV 6, 8, 11.
En conclusión, los AAV cuentan con un amplio potencial para su uso como vector en terapia génica. El principal obstáculo para la implementación de una terapia con AAV está en la presencia de inmunidad humoral contra las cápsides del vector, cuya prevalencia cambia según la edad, localización geográfica, y estado inmunológico.
Se requieren más estudios poblacionales que midan más de un serotipo y evalúen diferencias entre variables socioeconómicas y clínicas para establecer posibles factores que se asocien a un incremento de la prevalencia AAV y puedan actuar como factores de riesgo en futuros estudios. De igual manera es recomendable tener un protocolo de detección de anticuerpos neutralizantes in vitro estandarizado con la misma línea celular, gen reportero, título de corte para seropositividad y estándares definidos. También es necesario iniciar estudios para evaluar la presencia de inmunidad celular previa, especialmente en pacientes con títulos negativos de anticuerpos neutralizantes.
Agradecimiento: Al Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología Francisco José de Caldas (COLCIENCIAS) por el apoyo financiero para la presente revisión (Proyecto código 656671250485, FP44842-307-2016).
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Misra S. Human gene therapy: a brief overview of the genetic revolution. J Assoc Physicians India 2013; 61:127-33.
2. Chirmule N, Propert K, Magosin S, Qian Y, Qian R, Wilson J. Immune responses to adenovirus and adeno-associated virus in humans. Gene Ther 1999; 6: 1574-83.
3. Di Pasquale G, Chiorini JA. AAV transcytosis through barrier epithelia and endothelium. Mol Ther 2006; 13:506-16.
4. Daya S, Berns KI. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev 2008; 21: 583-93.
5. Rincon MY, Vander Driessche T, Chuah MK. Gene therapy for cardiovascular disease: advances in vector development, targeting, and delivery for clinical translation. Cardiovasc Res 2015; 108: 4-20.
6. Russell S, Bennett J, Wellman JA, et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomised, controlled, open-label, phase 3 trial. Lancet 2017; 390: 849-60.
7. Ledford H. FDA advisers back gene therapy for rare form of blindness. Nature 2017; 550: 314.
8. Mendell JR, Al-Zaidy S, Shell R, et al. Single-dose genereplacement therapy for spinal muscular atrophy. N Engl J Med 2017; 377: 1713-22.
9. Food Drugs Administration. FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality. En: https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-genetherapy-treat-pediatric-patients-spinal-muscular-atrophyrare-disease; consultado mayo 2019.
10. Clinical Trials. Study of intrathecal administration of avxs-101 for spinal muscular atrophy (STRONG). En: https://clinicaltrials.gov/ct2/show/NCT03381729; consultado mayo 2019.
11. Rangarajan S, Walsh L, Lester W, et al. AAV5-factor VIII gene transfer in severe Hemophilia A. N Engl J Med 2017; 377: 2519-30.
12. Moskalenko M, Chen L, van Roey M, et al. Epitope mapping of human anti-adeno-associated virus type 2
neutralizing antibodies: implications for gene therapy and virus structure. J Virol 2000; 74: 1761-6.
13. Zincarelli C, Soltys S, Rengo G, Koch WJ, Rabinowitz JE. Comparative cardiac gene delivery of adeno-associated virus serotypes 1-9 reveals that AAV6 mediates the most efficient transduction in mouse heart. Clin Transl Sci 2010; 3: 81-9.
14. Gao MH, Lai NC, McKirnan MD, et al. Increased regional function and perfusion after intracoronary delivery of adenovirus encoding fibroblast growth factor 4: report of preclinical data. Hum Gene Ther 2004; 15: 574-87.
15. Calcedo R, Wilson JM. Humoral immune response to AAV. Front Immunol 2013; 4: 341.
16. Jungmann A, Muller O, Rapti K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods Mol Biol 2017; 1521: 109-26.
17. Mingozzi F, Buning H. Adeno-associated viral vectors at the frontier between tolerance and immunity. Front Immunol 2015; 6: 120.
18. Mingozzi F, High KA. Therapeutic in vivo gene transfer for genetic disease using AAV: progress and challenges. Nat Rev Genet 2011; 12: 341-55.
19. Mingozzi F, Hasbrouck NC, Basner-Tschakarjan E, et al. Modulation of tolerance to the transgene product in a nonhuman primate model of AAV-mediated gene transfer to liver. Blood 2007; 110: 2334-41.
20. Basner-Tschakarjan E, Mingozzi F. Cell-mediated immunity to AAV vectors, evolving concepts and potential solutions. Front Immunol 2014; 5: 350.
21. Veron P, Leborgne C, Monteilhet V, et al. Humoral and cellular capsid-specific immune responses to adenoassociated virus type 1 in randomized healthy donors. J Immunol 2012; 188: 6418-24.
22. Milani M, Annoni A, Bartolaccini S, et al. Genome editing for scalable production of alloantigen-free lentiviral vectors for in vivo gene therapy. EMBO Mol Med 2017; 9: 1558-73.
23. Halbert CL, Miller AD, McNamara S, et al. Prevalence of neutralizing antibodies against adeno-associated virus (AAV) types 2, 5, and 6 in cystic fibrosis and normal populations: Implications for gene therapy using AAV vectors. Hum Gene Ther 2006; 17: 440-7.
24. Louis Jeune V, Joergensen JA, Hajjar RJ, Weber T. Pre-existing anti-adeno-associated virus antibodies as a challenge in AAV gene therapy. Hum Gene Ther Methods 2013; 24: 59-67.
25. Erles K, Sebokova P, Schlehofer JR. Update on the prevalence of serum antibodies (IgG and IgM) to adenoassociated virus (AAV). J Med Virol 1999; 59: 406-11.
26. Murphy SL, Li H, Mingozzi F, et al. Diverse IgG subclass responses to adeno-associated virus infection and vector administration. J Med Virol 2009; 81: 65-74.
27. Boutin S, Monteilhet V, Veron P, et al. Prevalence of serum IgG and neutralizing factors against adeno-associated virus (AAV) types 1, 2, 5, 6, 8, and 9 in the healthy population: implications for gene therapy using AAV vectors. Hum Gene Ther 2010; 21: 704-12.
28. Manno CS, Pierce GF, Arruda VR, et al. Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response. Nat Med 2006; 12: 342-7.
29. Fitzpatrick Z, Leborgne C, Barbon E, et al. Influence of pre-existing anti-capsid neutralizing and binding antibodies on AAV vector transduction. Mol Ther Methods Clin Dev 2018; 9: 119-29.
30. Mingozzi F, Chen Y, Edmonson SC, et al. Prevalence and pharmacological modulation of humoral immunity to AAV vectors in gene transfer to synovial tissue. Gene Ther 2013; 20: 417-24.
31. Greenberg B, Butler J, Felker GM, et al. Prevalence of AAV1 neutralizing antibodies and consequences for a clinical trial of gene transfer for advanced heart failure. Gene Ther 2016; 23: 313-9.
32. Meliani A, Leborgne C, Triffault S, Jeanson-Leh L, Veron P, Mingozzi F. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Hum Gene Ther Methods 2015; 26: 45-53.
33. Li C, Wu S, Albright B, et al. Development of patientspecific AAV vectors after neutralizing antibody selection for enhanced muscle gene transfer. Mol Ther 2016; 24: 53-65.
34. Blacklow NR, Hoggan MD, Kapikian AZ, Austin JB, Rowe WP. Epidemiology of adenovirus-associated virus infection in a nursery population. Am J Epidemiol 1968; 88: 368-78.
35. Blacklow NR, Hoggan MD, Rowe WP. Serologic evidence for human infection with adenovirus-associated viruses. J Natl Cancer Inst 1968; 40: 319-27.
36. Calcedo R, Vandenberghe LH, Gao G, Lin J, Wilson JM. Worldwide epidemiology of neutralizing antibodies to adeno-associated viruses. J Infect Dis 2009; 199: 381-90.
37. Rincon MY, Prada CE, Lopez M, Castillo V, Echeverria LE, Serrano N. Determination of anti-adeno-associated viral vector neutralizing antibodies in patients with heart failure in the Cardiovascular Foundation of Colombia (ANVIAS): Study Protocol. JMIR Res Protoc 2016; 5: e102.
38. Wagner JA, Nepomuceno IB, Messner AH, et al. A phase II, double-blind, randomized, placebo-controlled clinical trial of tgAAVCF using maxillary sinus delivery in patients with cystic fibrosis with antrostomies. Hum Gene Ther 2002; 13: 1349-59.
39. Calcedo R, Morizono H, Wang L, et al. Adeno-associated virus antibody profiles in newborns, children, and adolescents. Clin Vaccine Immunol 2011; 18: 1586-8.
40. van der Marel S, Comijn EM, Verspaget HW, et al. Neutralizing antibodies against adeno-associated viruses in inflammatory bowel disease patients: implications for gene therapy. Inflamm Bowel Dis 2011; 17: 2436-42.
41. Li C, Narkbunnam N, Samulski RJ, et al. Neutralizing antibodies against adeno-associated virus examined prospectively in pediatric patients with hemophilia. Gene Ther 2012; 19: 288-94.
42. Liu Q, Huang W, Zhao C, et al. The prevalence of neutralizing antibodies against AAV serotype 1 in healthy subjects in China: implications for gene therapy and vaccines using AAV1 vector. J Med Virol 2013; 85: 1550-6.
43. Mimuro J, Mizukami H, Shima M, et al. The prevalence of neutralizing antibodies against adeno-associated virus capsids is reduced in young Japanese individuals. J Med Virol 2014; 86: 1990-7.
44. Ferla R, Claudiani P, Savarese M, et al. Prevalence of anti-adeno-associated virus serotype 8 neutralizing antibodies and arylsulfatase B cross-reactive immunologic material in mucopolysaccharidosis VI patient candidates for a gene therapy trial. Hum Gene Ther 2015; 26: 145-52.
45. Ling C, Wang Y, Feng Y, et al. Prevalence of neutralizing antibodies against liver-tropic adeno-associated virus serotype vectors in 100 healthy Chinese and its potential relation to body constitutions. J Integr Med 2015; 13: 341-6.
46. Harrington EA, Sloan JL, Manoli I, et al. Neutralizing antibodies against adeno-associated viral capsids in patients with mut methylmalonic acidemia. Hum Gene Ther 2016; 27: 345-53.
47. Gray SJ, Nagabhushan Kalburgi S, McCown TJ, Jude Samulski R. Global CNS gene delivery and evasion
of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates. Gene Ther 2013; 20: 450-9.
48. Ellsworth JL, OCallaghan M, Rubin H, Seymour A. Low seroprevalence of neutralizing antibodies targeting two Clade F AAV in humans. Hum Gene Ther Clin Dev February 2018.
49. Calcedo R, Wilson JM. AAV Natural infection induces broad cross-neutralizing antibody responses to multiple AAV serotypes in chimpanzees. Hum Gene Ther Clin Dev 2016; 27: 79-82.
50. Willett K, Bennett J. Immunology of AAV-mediated gene transfer in the eye. Front Immunol 2013; 4: 261.
