MARCOS J. LAS HERAS, INDALECIO CARBONI BISSO, IGNACIO FERNÁNDEZ CEBALLOS, ANA MONTSERRAT RIVERO, JOSÉ DIANTI, EDUARDO SAN ROMÁN
Servicio de Terapia Intensiva de Adultos, Hospital Italiano de Buenos Aires, Argentina
Resumen La membrana de oxigenación extracorpórea arteriovenosa se utiliza cuando ocurre falla hemodinámica y respiratoria refractaria al tratamiento convencional; brinda soporte hemodinamico transitorio, oxigenacion y remocion de CO2, y permite reposo pulmonar. Asimismo ofrece la posibilidad de realizar ventilación ultraprotectiva y evitar la generación de VILI (Ventilation-Induced Lung Injury). No ha sido demostrada su utilización como una terapia frecuente en los casos con insuficiencia hemodinámica secundaria a shock obstructivo por afectación mediastínica. Presentamos el caso de un paciente con shock obstructivo por una masa mediastínica de origen linfoproliferativo tratada con membrana de circulación arteriovenosa extracorpórea.
Palabras clave: linfoma, membrana de oxigenación extracorpórea, shock
Abstract The arteriovenous extracorporeal membrane is used in patients with hemodynamic and respiratory failure, unresponsive to conventional treatment. It provides transitory hemodynamic support, oxygenation and removal of CO2, allowing pulmonary rest. Moreover it offers the possibility of ultraprotective ventilation and avoids generation of VILI (Ventilation-Induced Lung Injury). It is not frequently used in patients with hemodynamic failure secondary to obstructive shock due to mediastinal compromise. We present the case of a patient with obstructive shock, mediastinal mass of lymphoproliferative origin that was treated with extracorporeal arteriovenous circulation membrane.
Key words: lymphoma, extracorporeal membrane oxygenation, shock
Dirección postal: Marcos J. Las Heras, Servicio de Terapia Intensiva, Hospital Italiano de Buenos Aires, Tte. Gral. J. D. Perón 4190, 1199 Buenos aires, Argentina
e-mail: marcos.lasheras@hospitalitaliano.org.ar
Los tumores mediastinales pueden tener distintas etiologías de acuerdo a su localización y forma de presentación; en 25 a 40% de los casos son malignos. Habitualmente se presentan con síntomas inespecíficos, lo que dificulta su diagnóstico temprano. El linfoma difuso de células grandes B es el más frecuente; constituye el 35% del total de casos de linfoma no Hodgkin 1. Su localización mediastinal corresponde al 2-3% de los linfomas no Hodgkin, y se presenta más usualmente en mujeres jóvenes como una masa mediastinal localmente invasiva. La supervivencia a los 5 años es del 65% luego de realizado el régimen CHOP (ciclofosfamida/vincristina/prednisona/adriamicina) asociado a radioterapia 2, 3.
Este tipo de tumores puede presentarse acompañado de tos, disnea, opresión precordial, síndrome de vena cava superior y, en un 30%, síntomas del linfoma difuso de células grandes B. El progreso y diseminación del tumor puede comprometer riñones, glándulas suprarrenales, hígado y más raramente el sistema nervioso central. En general, los síntomas dependen del sector del mediastino en el que se localiza el tumor, ya sea anterior, medio o posterior. Los tumores extensos en el mediastino anterior pueden causar tanto obstrucción extrínseca de la vía aérea como compromiso vascular, generando colapso hemodinámico e insuficiencia respiratoria aguda 4, 5.
La utilización de la membrana de oxigenación extracorpórea (ECMO) venoarterial como soporte cardiorrespiratorio, es una medida de rescate que busca generar estabilidad hemodinámica para instaurar un tratamiento médico con el fin de disminuir la masa tumoral y mejorar el componente obstructivo 6-8.
Comunicamos el caso de una mujer joven con una masa mediastinal anterior que requirió ECMO por shock
cardiogénico obstructivo refractario.
Caso clínico
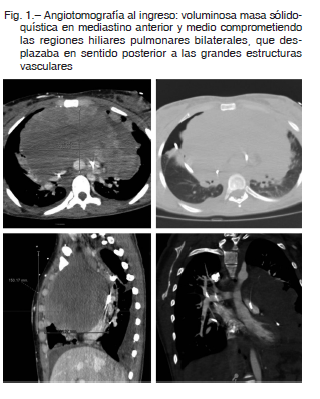
Mujer de 25 años de edad sin antecedentes relevantes, consultó por disnea progresiva clase funcional IV de 15 días de evolución. Al ingreso, presentaba mala mecánica ventilatoria, taquicardia, taquipnea, palabra entrecortada y edema en esclavina. La radiografía de tórax evidenció masa mediastinal de volumen considerable y derrame pleural bilateral. Se solicitó ecocardiograma transtorácico que mostró derrame pericárdico leve, ventrículo derecho gravemente dilatado con deterioro de la función sistólica e hipoquinesia global, y aurícula izquierda colapsada por una masa que la comprimía en forma extrínseca. Bajo sospecha de taponamiento cardíaco, se realizó pericardiocentesis y avenamiento pleural bilateral sin mejoría clínica.
Evolucionó con rapidez a insuficiencia respiratoria aguda con requerimiento de asistencia ventilatoria mecánica e inestabilidad hemodinámica refractaria a altas dosis de vasopresores.
En los exámenes de laboratorio se evidenció falla renal aguda, acidosis metabólica e hiperlactacidemia (9.5 mM/l).
Se interpretó el cuadro como shock obstructivo secundario a masa mediastinal de probable origen linfoproliferativo, por lo que se decidió iniciar soporte hemodinámico con ECMO en modo arteriovenoso. Se disecó la vena femoral con una cánula # 25 multiperforada con flujo inicial de 2.6 litros/minuto.
A pesar de la optimización de los parámetros hemodinámicos, continuó con bajo gasto cardíaco y con alto requerimiento de drogas vasoactivas. Se decidió aumentar el flujo agregando una vía arterial en subclavia izquierda con injerto de dracón, obteniendo un volumen de 3 litros/min a 2800 revoluciones. De esta manera, se logró alcanzar un flujo óptimo y se titularon los vasopresores.
Transcurridas 24 horas de soporte hemodinámico con ECMO arteriovenoso, la paciente evolucionó con un clearance de lactato adecuado, un ritmo diurético mayor a 0.5 ml/kg y menor requerimiento de drogas vasopresoras. Con el fin de diagnosticar el origen etiológico de la masa mediastinal, se realizó estudio citológico de líquido pericárdico con resultado negativo para células atípicas. La biopsia por punción de masa mediastinal informó abundante tejido fibroso. Los marcadores tumorales serológicos y la punción de médula ósea arrojaron resultados negativos, por lo que se decidió iniciar quimioterapia empírica con dexametasona y ciclofosfamida.
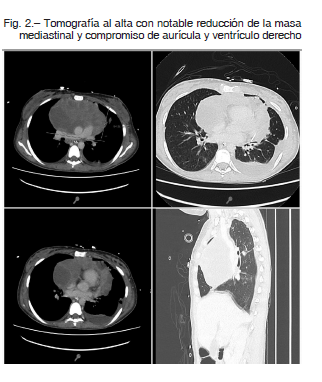
Al quinto día de soporte con ECMO el ecocardiograma demostró notable mejoría de la función ventricular derecha, con menor requerimiento de volumen de circulación, y con mínimo flujo de membrana; se inició la desvinculación de la membrana de circulación extracorpórea. En una nueva punción de la masa mediastinal guiada por ecografía con biopsia, se obtuvo celularidad de estirpe linfoproliferativa, por lo que se ajustó a quimioterapia dirigida con etopósido/ doxorrubicina/diclofosfamida/ vincristina/ prednisona/ rituximab en dosis ajustada (DA-EPOCH-R).
Al ingreso se obtuvo una puntuación APACHE II de 25 puntos, con una mortalidad estimada en 53%. Durante la estadía en la unidad de cuidados intensivos tuvo neutropenia febril y neumonía asociada a la ventilación mecánica.
Se logró desvinculación de la asistencia respiratoria en la cuarta semana de internación (30 días de AVM). A los 41 días se otorgó alta domiciliaria con buen estado general y seguimiento ambulatorio por oncohematología.
Discusión
El linfoma difuso de células grandes B mediastinal es una neoplasia que representa un porcentaje minoritario de los linfomas no Hodgkin. Su importancia radica en que suele presentarse clínicamente como urgencia oncológica, ya sea por compresión de la vena cava superior, de la vía aérea o por taponamiento cardíaco.
La paciente del caso presentó shock obstructivo sin respuesta a pericardiocentesis ni pleurocentesis, con requerimiento de dosis elevadas de drogas vasoactivas por masa mediastinal de volumen relevante que colapsó la aurícula izquierda y comprometía la cara anterolateral del ventrículo izquierdo. Evolucionó rápidamente con hipoxemia por lo que se decidió el uso de soporte respiratorio y hemodinámico con ECMO arterio venoso.
Existen en la literatura casuísticas que describen el uso de ECMO en situaciones similares con resultados satisfactorios. Se ha utilizado ECMO veno-venoso para soporte de pacientes con hipoxemia secundaria al compromiso del bronquio fuente izquierdo 9. Asimismo, la modalidad arteriovenosa ha sido utilizada para el soporte hemodinámico del paciente con shock cardiogénico secundario al efecto cardiotóxico de la quimioterapia asociado a un tumor que comprometía el miocardio 10.
En el caso descrito en el presente trabajo, se utilizó la membrana de oxigenación extracorpórea para otorgar soporte hemodinámico y respiratorio como puente al diagnóstico etiológico y al tratamiento oncológico. Debido a la dificultad de diagnóstico, durante la internación se realizó un tratamiento empírico con dexametasona y ciclofosfamida que redujo la masa mediastinal con consecuente mejoría en la función cardíaca, lo que permitió la desvinculación exitosa de la ECMO. Finalmente, se diagnosticó linfoma difuso de células B grandes, y se inició el tratamiento con quimioterapia específica.
La membrana de oxigenación extracorpórea es utilizada en forma exitosa como una herramienta que permite el soporte vital en pacientes con shock obstructivo secundario a una masa mediastinal sin diagnóstico etiológico, y sirve como puente al diagnóstico y al tratamiento definitivo de la misma.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Aboud A, Marx G, Sayer H, Gummert JF. Successful treatment of an aggressive non-Hodgkin’s lymphoma
associated with acute respiratory insufficiency using extracorporeal membrane oxygenation. Interact Cardiovasc Thorac Surg 2008; 7: 173-4.
2. Martelli M, Ferreri AJ, Agostinelli C, Di Rocco A, Pfreundschuh M, Pileri SA. Diffuse large B-cell lymphoma. Crit Rev Oncol Hematol 2013; 87: 146-71.
3. Worku B, DeBois W, Sobol I, Gulkarov I, Horn EM, Salemi A. Extracorporeal membrane oxygenation as a bridge through chemotherapy in B-cell lymphoma. J Extra Corpor Technol 2015; 47: 52-4.
4. Allain G, Hajj-Chahine J, Lacroix C, Jayle C. Primary cardiac lymphoma complicated by cardiogenic shock: successful treatment with chemotherapy delivered under extracorporeal membrane oxygenation support. Eur J Cardiothorac Surg 2015; 48: 968-70.
5. Tariq S, Gass A. Use of extracorporeal membrane oxygenation in refractory cardiogenic shock. Cardiol Rev 2016; 24: 26-9.
6. Estenssoro E, Dubin A. Síndrome de distress respiratorio agudo. Medicina (B Aires) 2016; 76: 235-41.
7. Zhong ZP, Wang H, Hou XT. Extracorporeal membrane oxygenation as a bridge for heart failure and cardiogenic shock. Biomed Res Int 2016; 1-6.
8. Makdisi G, Wang I W. Extra corporeal membrane oxygenation (ECMO) review of a lifesaving technology. J Thorac Dis 2015; 7: 66-76.
9. Hong Y, Jo KW, Lyu J, et al. Use of venovenous extracorporeal membrane oxygenation in central airway obstruction to facilitate interventions leading to definitive airway security. J Crit Care 2013; 28: 669-74.
10. Meltezer EC, Ivascu NS, Acres CA, Stark M, Furman RR, Fins JJ. Extracorporeal membrane oxygenation as a bridge to chemotherapy in an Orthodox Jewish patient. Oncologist 2014; 19: 985-9.
