MIRTA ROSES 1, PABLO E. BONVEHÍ 2
1 Academia Nacional de Ciencias de Buenos Aires, 2 Centro de Educación Médica e Investigaciones Clínicas Norberto Quirno (CEMIC), Buenos Aires, Argentina
Resumen La proporción de población de adultos se ha incrementado globalmente y las proyecciones muestran que para el año 2050 los mayores de 60 años representarán el 21.1%. Actualmente se dispone de vacunas dirigidas exclusivamente a adultos y otras que se aplican en niños pero que se deben actualizar a lo largo de la vida. Las vacunas en adultos se administran, no solo por el grupo de edad al que pertenecen, sino también por factores como ocupación, estilos de vida o estado de salud. Al mismo tiempo, la longevidad disminuye la respuesta inmune a las vacunas por el fenómeno de inmunosenescencia, lo cual representa un desafío para proteger adecuadamente a este grupo. Desde hace varios años la OMS, ha propiciado la utilización del término “Vacunación en el curso de la vida” lo cual permite extender la visión de la vacunación y considerar al adulto como una parte integral de los planes y calendarios de inmunización. Existen varias enfermedades prevenibles por vacunas en adultos, pero aquellas asociadas al virus de influenza y al neumococo, son las que comprenden el grupo más extenso. Diversas recomendaciones incluyen, además de estas vacunas, otras dirigidas a prevenir difteria, tétanos, tos convulsa, hepatitis A y B, meningococo, varicela, sarampión, rubéola, parotiditis, herpes zóster, virus del papiloma humano y otras enfermedades. Se reconocen muchos desafíos a superar para poder incorporar plenamente al adulto, incluyendo al personal de salud, y lograr que la vacunación sea una herramienta de prevención valorada ampliamente para el desarrollo de una vida saludable.
Palabras clave: vacunas, enfermedades prevenibles, programas de inmunización, adulto, adulto mayor
Abstract The proportion of adult population has increased globally and the current projections indicate that, by 2050, the group of 60 years and older will represent 21.1%. There are now vaccines exclusively designed for adults and others that are applied in early life but need to be updated later in life. Vaccines for adults are not only based on their respective age group but are also linked to risk factors like occupation, life style, health situation, among others. At the same time, longevity brings with it a weakening of the immune response to vaccines, a process known as immunosenescence representing an increasing challenge to adequately protect this age group. For some time, WHO has been promoting the term “Vaccination through the life course” allowing for an extension of the vaccination vision and taking adults as an integral part into the national vaccination programs and calendars. There are several vaccine preventable diseases affecting adults, but those associated with influenza virus and pneumococcus are the ones that affect the largest age group. Several recommendations include, additionally, others to prevent diphtheria, tetanus, whooping cough, hepatitis A and B, meningococcus, chickenpox, measles, rubella, mumps, herpes zoster, human papilloma virus and others. There are still many challenges to overcome in order to fully include adults, particularly health personnel, and to make vaccines extensively valued as a prevention tool in order to achieve a healthy life.
Key words: vaccines, preventable diseases, immunization programs, adult, elderly
Dirección postal: Mirta Roses, Avda. Pte. Quintana 494 7 A, 1129 Buenos Aires,Argentina
e-mail: rosesperiago@hotmail.com
Los adultos de cualquier edad están expuestos a distintas enfermedades infecciosas prevenibles por vacunas.
El riesgo de contraer alguna de esas enfermedades y la recomendación de vacunarse para prevenirlas depende de varios factores, como su estado de salud, edad, estilo de vida, aspectos epidemiológicos, exposición a riesgos como la ocupación o los viajes; en los niños, por el contrario, se basan, casi exclusivamente, en su edad 1-9.
El desarrollo científico y tecnológico ha producido varias vacunas dirigidas a los adultos, anteriormente no considerado como grupo objetivo, presentando un escenario más complejo para la prevención en este grupo.
Hay una baja percepción de riesgo entre los adultos, que se consideran sobrevivientes de las enfermedades de la infancia, y la mayoría de las muertes por enfermedades prevenibles por vacunas ha quedado concentrada hoy en países y comunidades en condiciones de pobreza.
Esto determina una muy baja cobertura global en los adultos, incluido el personal de salud 10-13. Sin embargo, desde el punto demográfico, la proporción de adultos y adultos mayores es la que crece más aceleradamente en el mundo. La proporción de personas > 60 años aumentó de 9.2% en 1990 a 12.7% en 2015 y alcanzaría 21.1% en el 2050, siendo el crecimiento más acelerado en los países menos desarrollados.
La longevidad genera una pérdida progresiva de los anticuerpos naturales adquiridos por haber padecido las enfermedades o por haberse vacunado 14. La inmunosenescencia es un fenómeno natural de envejecimiento del sistema inmunitario que puede agravarse por enfermedades, estrés emocional, mal nutrición, y otros factores.
Debido a la disminución de producción de tejido hematopoyético en la medula ósea y la capacidad de renovación de células tronco, la respuesta inmune nata, no especifica y de acción rápida, es afectada 15. Las barreras epiteliales son más permeables a la entrada de los agentes infecciosos, los neutrófilos presentan alteraciones funcionales y los macrófagos se vuelven ineficientes 16,17, lo que conduce a una respuesta disminuida de las personas mayores a las vacunas.
La respuesta a una vacuna depende del tipo de antígeno: las vacunas de virus vivos atenuados y de antígenos asociados a proteínas inducen la producción de anticuerpos en altos niveles, además de TCD8. Las vacunas de virus inactivados solamente inducen la producción de gran cantidad de anticuerpos. Por eso, la reducción en la producción de anticuerpos en la persona mayor resulta en menor respuesta a las vacunas de influenza, hepatitis B, difteria y tétanos. Se intenta aumentar la respuesta inmune de las personas mayores con diversas intervenciones: dosis de vacuna con mayor concentración de antígenos, dosis de refuerzo, utilización de vía subcutánea en lugar de la intramuscular, adyuvantes y utilizar vacunas conjugadas 18-22.
En 1989, la Asamblea Mundial de la Salud instó a eliminar el tétanos neonatal para 1995, iniciando así la vacunación de la embarazada. A finales de los 90, debido a la ocurrencia de epidemias de sarampión en adultos, se promovieron campañas de vacunación para adolescentes y adultos y, al mismo tiempo, las personas mayores comenzaron a recibir la vacuna influenza por medio de campañas anuales. Paulatinamente, fueron incluidos los profesionales de salud y personas con ciertas comorbilidades para recibir otras vacunas como hepatitis B, Hib y neumococo polisacáridos 23 valente (PPV23). Las infecciones respiratorias, virales y bacterianas, son más graves en los extremos de la vida y el neumococo y el virus de la influenza son los dos agentes predominantes 23-28.
Existen varias nuevas vacunas en desarrollo, como la del virus sincicial respiratorio y otras que contienen nuevos inmunógenos, más eficaces o con nuevas tecnologías, como la vacuna inactivada contra herpes zóster. Es cada vez más importante, tanto para la comunidad científica como para el conjunto de la sociedad, conocer el espectro de enfermedades prevenibles por vacunas en adultos para su uso óptimo y racional, contribuyendo así a disminuir la morbimortalidad de estas enfermedades, reducir los costos en salud y mejorar la calidad de vida.
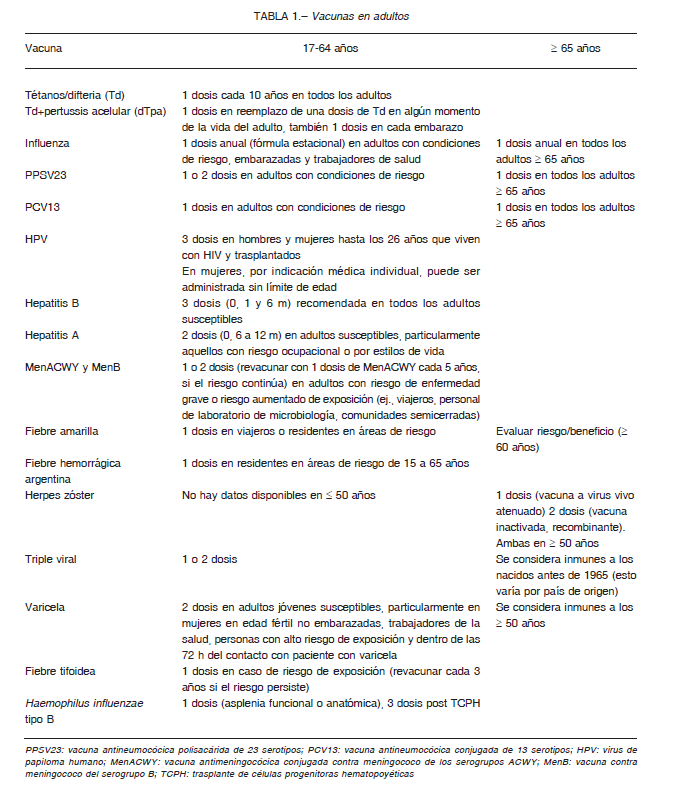
A nivel internacional, regional y local existen diversas recomendaciones de vacunas en adultos basadas en la evidencia 9-12. En dichas guías, se recomiendan habitualmente vacunas contra influenza, neumococo, difteria/tétanos (doble adultos) o tos convulsa/coqueluche, difteria y tétanos (triple acelular), hepatitis A y B, meningococo, varicela, sarampión / rubéola / parotiditis (triple viral), herpes zóster, virus del papiloma humano y otras, como aquellas dirigidas a personas que viven en determinadas áreas de riesgo o endémicas, como fiebre hemorrágica argentina o fiebre amarilla 1-3, 9, 11-14, 16, 17, 22-25.
Difteria
Es una enfermedad que ha reemergido recientemente en el continente americano a partir de casos en Haití, República Dominicana y Venezuela, la inmunidad se pierde progresivamente 21.
Tétanos
Se notifican casos anualmente en distintos países y, la mayoría de ellos, se presentan en adultos que no tienen actualizados los esquemas de vacunación 17.
Coqueluche (tos convulsa)
Se sugiere incorporar la vacuna triple acelular (dTpa), al menos una dosis en la vida, en reemplazo de la doble (dT), debido al incremento en la carga de la enfermedad producida por Bordetella pertussis que usualmente es de presentación leve o atípica en adultos y poco notificada, particularmente en los mayores de 65 años 17, 26, 27. Se ha incorporado la vacuna dTpa para su administración hacia el final de embarazo con el objetivo de transferir altos títulos de anticuerpos de la madre al niño, cercano al momento del parto con un impacto significativo, disminuyendo la mortalidad en lactantes, particularmente en los primeros seis meses de vida 28. Dentro de las indicaciones de la vacuna dTpa se debe incluir a los trabajadores de salud y familiares en contacto con recién nacidos porque pueden ser portadores y trasmisores de pertussis.
Gripe
La vacuna antigripal fue incorporada para los adultos mayores, embarazadas y adultos con enfermedades crónicas. Debido a los cambios antigénicos menores que sufre el virus anualmente, la composición de la vacuna contra influenza se actualiza todos los años en dos ocasiones, en febrero para el hemisferio norte y en septiembre para el hemisferio sur. La vacuna trivalente inactivada desarrollada en huevos embrionados, contiene dos subtipos del virus de influenza tipo A (H1N1 y H3N2) y un linaje del virus tipo B (Victoria o Yamagata).
La efectividad de la vacuna para prevenir influenza no complicada en adultos jóvenes es de aproximadamente el 70%, mientras que en adultos de 60 años o mayores la efectividad es menor y no supera el 53%. En este último grupo de edad la administración de la vacuna antigripal trivalente inactivada se asocia a una disminución en las hospitalizaciones por neumonía entre 32% y 45%, en la mortalidad hospitalaria por neumonía e influenza entre 31% y 65% y por enfermedades respiratorias del 43% al 50%, mientras que la reducción en la mortalidad por todas las causas oscila entre el 27% y 30% 18. En la mujer embarazada la vacuna contra influenza trivalente inactivada reduce la incidencia de enfermedad tipo influenza en un 36% y tiene una efectividad del 63% en la disminución de casos de influenza en niño menores de 6 meses 29. En las comorbilidades más prevalentes en adultos, como las asociadas a enfermedades pulmonares o cardiovasculares crónicas, como así también en diabetes, la vacuna antigripal ha demostrado que disminuye el riesgo de complicaciones de estas durante la temporada de circulación del virus de influenza, como ser, la posibilidad de un nuevo infarto agudo de miocardio o la tasa de hospitalización en diabéticos 30. Uno de los desafíos de la vacuna contra influenza es obtener una mayor eficacia en el grupo de adultos mayores de 60 años que es el que presenta la mayor tasa de hospitalización y mortalidad. Las vacunas trivalentes inactivadas con adyuvantes o con alta dosis de antígeno (60 microgramos en lugar de los 15 microgramos que contiene habitualmente) han permitido aumentar la eficacia y la efectividad en este grupo etario en aproximadamente un 25% 19. Desde el año 2013 y, debido a las diferencias antigénicas de los dos linajes del virus B circulantes con el contenido en la vacuna trivalente y al impacto de este virus en la enfermedad, la OMS recomendó el desarrollo de vacunas cuadrivalentes que contengan los dos linajes 31. La vacuna cuadrivalente, comparada con la trivalente, ha demostrado inmunogenicidad superior para los componentes B y similar para el resto de las cepas, tanto en niños como en adolescentes, adultos jóvenes y adultos mayores, mientras que los datos de efectividad muestran que ésta es mayor en niños y adultos jóvenes 32-37.
Otras vacunas disponibles para su utilización en adultos son: la producida con tecnología ADN recombinante y las desarrolladas en líneas celulares. La primera previene las mutaciones o cambios adaptativos que puede sufrir el virus al replicarse en huevos embrionados y es de más rápida producción. Esta vacuna ha sido desarrollada inicialmente como vacuna trivalente, actualmente se dispone como vacuna cuadrivalente, contiene 45 microgramos de cada uno de los antígenos y está aprobada en algunos países para su administración en adultos 38, 39. Las vacunas desarrolladas en líneas celulares no dependen de la disponibilidad de huevos embrionados para su elaboración, lo cual permite mayor rapidez y volumen de producción. Algunas de estas ya se encuentran licenciadas en Europa y EE.UU. para su administración en adultos 40.
Neumonía
La enfermedad neumocócica invasiva, que se puede presentar como bacteriemia, meningitis u otras localizaciones profundas, es una forma de presentación que afecta más frecuentemente al adulto mayor o a los adultos con comorbilidades, en particular a los inmunocomprometidos, o con distintos hábitos de vida como el tabaquismo o alcoholismo.
Por otro lado, Streptococcus pneumoniae es el agente infeccioso que más comúnmente se identifica como productor de neumonía adquirida en la comunidad (NAC), que es la infección más frecuente en el adulto. Desde la década del 80 se dispone de una vacuna antineumocócica de 23 polisacáridos (PPS23) que contiene los serotipos 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F y 33F, que brinda cobertura para más del 85% de los serotipos que producen formas invasivas de enfermedad neumocócica. Al ser una vacuna de polisacáridos capsulares produce una respuesta independiente de células T, por lo cual no es inmunogénica en menores de 2 años. Distintos estudios de efectividad en adultos han demostrado que previene las formas invasivas de la enfermedad neumocócica, mientras que su rol en la prevención de la neumonía adquirida en la comunidad es el de atenuar la gravedad de la misma, sin evidencia aún de que sirva para prevenirla 16, 41.
El desarrollo más reciente de vacunas antineumocócicas conjugadas con una proteína transportadora, inicialmente 7 valente, luego 10 y 13 valente, ha permitido el desarrollo de respuesta inmune dependiente de células T y ha demostrado eficacia en menores de 2 años para la prevención de formas invasivas, neumonía y otitis media producidas por S. pneumoniae. Las vacunas congujadas también disminuyen la portación nasofaríngea, lo cual trae como consecuencia un efecto rebaño que se ha documentado a través de la reducción de casos de enfermedad invasiva por S.pneumoniae en adultos mayores no vacunados.
La vacuna 13 valente conjugada (PCV13) contiene los serotipos 1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F que comparte con la vacuna PPS23 y un serotipo propio que es el 6A. Los estudios de la vacuna PCV13 en adultos, comparada con la PPS23, demostraron una respuesta inmunogénica superior para la mayoría de los serotipos que comparten ambas vacunas, con mejor respuesta inmunogénica cuando se administra primero PCV13 en el caso que se administren ambas vacunas.
Esta vacuna demostró eficacia cercana al 50% para prevenir la NAC por los serotipos incluidos en la vacuna en un estudio aleatorizado, doble ciego, comparado con placebo, en adultos mayores.
A pesar de la carga de enfermedad que produce el S. pneumoniae en adultos mayores y adultos con comorbilidades, de los datos de efectivad de PSV23 y PCV13 en adultos, como así también del efecto rebaño a través de la vacunación pediátrica, no hay uniformidad o consenso en las recomendaciones de vacuna antineumocócica en adultos a nivel internacional. Como ejemplo se puede mencionar que las recomendaciones del GTA (Grupo Técnico Asesor) de vacunas de OPS/OMS enfatiza la importancia del efecto rebaño a través de la vacunación pediátrica e insta a los países de la región a incrementar las coberturas y, de esta forma, proteger a los adultos mayores. El ACIP (Advisory Committee on Immunization Practices) del CDC de EE.UU. ha recomendado para adultos mayores y con comorbilidades el denominado esquema secuencial que incluye la administración de ambas vacunas, PCV13 y PPS23 42.
A este mismo esquema ha adherido el Ministerio de Salud de Argentina en el año 2017 y, en ambos casos, se reevaluará de acuerdo al efecto que tenga la vacunación pediátrica en la incidencia de enfermedad invasiva y NAC por los serotipos de la vacuna conjugada en adultos, a través del efecto rebaño. En Alemania, el STIKO, que es el Comité local de recomendaciones de vacunas, recomienda la administración solo de vacuna de polisacáridos (PPS23) en adultos a partir de los 60 años y con revacunación cada 6 años 41. En el horizonte se encuentran en desarrollo nuevas vacunas antineumocócicas conjugadas de 15 y 20 serotipos lo cual permitirá extender la protección de este tipo de vacunas. Es esperable que se pueda establecer claramente cuáles son las mejores alternativas para la protección de la enfermedad neumocócica invasiva en adultos mayores y con comorbilidades y de la NAC que es muy frecuente en esta población (Tabla 1).
Herpes zóster
La vacuna contra herpes zóster está dirigida a la prevención de una enfermedad que es casi exclusiva del adulto, en particular a partir de la quinta y sexta década de la vida, y que trae como consecuencia más frecuente la neuralgia post herpética de difícil manejo y alto impacto en la calidad de vida. La primera vacuna fue a virus vivos atenuados, que contiene la misma cepa que la vacuna contra varicela, pero en una mayor concentración. Esta vacuna administrada en una sola dosis por vía subcutánea en personas de 50 años o más, ha demostrado una eficacia del 51.3% para prevenir un episodio de herpes zóster y del 66.5% para prevenir la neuralgia post-herpética. Más recientemente, la vacuna que contiene subunidades virales (HZ/su) recombinante, que utiliza la glicoproteína E y el adyuvante AS01B, para ser administrada en dos dosis por vía intramuscular con un intervalo de 2 meses, ha demostrado una eficacia superior al 90% para prevenir un episodio de herpes zóster y mayor del 88% para evitar la neuralgia post-herpética 43.
Otras vacunas para considerar en población de adultos incluyen las vacunas contra fiebre amarilla 44, hepatitis B y A 45, sarampión/rubeola/parotiditis (triple viral), fiebre hemorrágica argentina 46, meningitis por meningococo 47, fiebre tifoidea 48, encefalitis japonesa y encefalitis por picadura de garrapatas 49.
Conclusiones
A partir de una iniciativa de la OMS, se ha comenzado a usar el término “Vacunación en el curso de la vida” que trata sobre la vacunación desde el inicio hasta el final de la vida. Esta estrategia permite extender la visión de la vacunación y considerar al adulto como una parte integral de los planes y calendarios de inmunización. Hay muchos desafíos a superar para poder incorporar plenamente al adulto y que la vacunación sea una herramienta de prevención valorada ampliamente para el desarrollo de una vida saludable. Dentro de esos desafíos se incluyen: la insuficiente información y conocimiento médico sobre prevención a través de las vacunas, la gran cantidad de medidas preventivas en los adultos que dejan a las vacunas en un segundo plano, la falta de conciencia de los adultos sobre este tema, el temor a los efectos adversos, mitos acerca de las vacunas e incertidumbre sobre la eficacia de las mismas, los obstáculos para un fácil acceso, ya que los centros de vacunación en muchos casos solo están preparados para recibir a población pediátrica, la falta de oportunidades de vacunación en el sistema de salud y de financiación.
Estos son, entre otros, las barreras a vencer. Los adultos bien vacunados protegen a los niños, a otros adultos y a los adultos mayores y, de manera importante, son ejemplo influyente para el resto de la sociedad, demostrando que confían, aprecian y demandan estar al día con sus vacunas.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Asociación Española de Pediatría. Comité Asesor de Vacunas. Manual de Vacunas en Línea. Seguridad de las Vacunas. Cap. 3: Contraindicaciones y Precauciones. 2016; En: http://vacunasaep.org; consultado septiembre 2019.
2. Brasil. Sociedade Brasileira de Geriatria e Gerontologia. Sociedade Brasileira de Imunizações. Guia de Vacinação Geriatria 2016/2017; SBIm SBGG. SBIM Immunizacoes, 2016; 9:32-5. En: https://sbim.org.br/publicacoes/guias; consultado septiembre 2019.
3. México. Academia Nacional de Medicina. Vacunación en el adulto mayor: Perspectiva de Curso de Vida. Documento de Postura. Editores: Luis Miguel F. Gutiérrez Robledo y Lourdes García García; México DF: CONACYT, 2015. En: https://www.ifa-fiv.org/wp-content/uploads/2016/04/Vacunacion-en-el-Adulto-Mayor-Perspectiva-de-Cursode-Vida-Book.pdf; consultado septiembre 2019.
4. Organización Panamericana de Salud. Informe final de la XXIII Reunión del Grupo Técnico Asesor (GTA) sobre Enfermedades Prevenibles por Vacunación de la Organización Panamericana de la Salud, 1-3 julio 2015, Varadero, Cuba. En: http://www.paho.org/hq/index.php?option=com_content&view=article&id=1862&Itemid=39430&lang=es; consultado septiembre 2019.
5. Organización Panamericana de Salud. Informe final de la XXII Reunión del Grupo Técnico Asesor (GTA) sobre Enfermedades Prevenibles por Vacunación de la Organización Panamericana de la Salud, 1-2 julio 2014, Washington, DC, EUA. En: http://www.paho.org/hq/index.php?option=com_content&view=article&id=1862&Itemid=39430&lang=es; consultado septiembre 2019.
6. Organización Panamericana de Salud. Informe final de la XXI Reunión del Grupo Técnico Asesor (GTA) sobre Enfermedades Prevenibles por Vacunación de la Organización Panamericana de la Salud, 3-5 julio 2013; Quito, Ecuador. En: http://www.paho.org/hq/index.php?option=com_content&view=article&id=1862&Itemid=39430&lang=es; consultado septiembre 2019.
7. Organización Panamericana de Salud. Informe final de la XX Reunión del Grupo Técnico Asesor (GTA) sobre Enfermedades Prevenibles por Vacunación de la Organización Panamericana de la Salud, octubre 2012;
Washington, DC, EUA. En: http://www.paho.org/hq/index.php?option=com_content&view=article&id=1862&Itemid=39430&lang=es; consultado septiembre 2019.
8. Organización Panamericana de Salud. Boletín de Inmunización. Volumen XXXIV. No. 4. Washington, DC, Agosto 2014. En: https://www.paho.org/hq/dmdocuments/2013/SNS3404.pdf; consultado septiembre 2019
9. Ministerio de Salud. Recomendaciones Nacionales de Vacunación, Argentina 2012. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000451cnt-2013-06_recomendaciones-vacunacion-argentina-2012.pdf; consultado octubre 2019.
10. V Sociedade Brasileira de Imunizações (SBIm) – 2016/2017. Calendários de Vacinação SBIm gestante.
SBIM Immunizacoes 2016; 9: 32-5.
11. Kim DK, Hunter P. Advisory Committee on Immunization Practices Recommended Immunization Schedule for
Adults Aged 19 Years or Older – United States, 2019. MMWR Morb Mortal Wkly Rep 2019; 68: 115-8.
12. Esposito S, Bonanni P, Maggi S, et al. Recommended immunization schedules for adults: Clinical practice guidelines by the Escmid Vaccine Study Group (EVASG), European Geriatric Medicine Society (EUGMS) and the World Association for Infectious Diseases and Immunological Disorders (WAidid). Hum Vaccin Immunother 2016; 12: 1777-94.
13. Kim DK, Riley LE, Harriman KH, Hunter P, Bridges CB; Advisory Committee on Immunization Practices. Recommended Immunization Schedule for Adults Aged 19 Years or Older, United States, 2017. Ann Intern Med 2017; 166: 209-19.
14. Triglav TK, Poljak M. Vaccination indications and limits in the elderly. Acta Dermatoverol Alp Pannonica Adirat 2013; 22: 65-70.
15. Toniolo Neto J, Toniolo Zenatti C, de Abreu Toniolo P. Imunossenescencia e vacinação. Revista Imunizações. Publicação da Sociedade Brasileira de Imunizações 2016; 9:10-2. En: https://sbim.org.br/images/revistas/revista-imuniz-sbim-v9-n3-2016.pdf; consultado septiembre 2019.
16. Porchia BR, Bonanni P, Bechini A, Bonaccorsi G, Boccalini S. Evaluating the costs and benefits of pneumococcal vaccination in adults. Exp Rev Vaccines 2017; 16: 93-107.
17. Weston WM, Friedland LR, Wu X, Howe B. Vaccination of adults 65 years of age and older with tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine (Boostrix(®)): results of two randomized trials.Vaccine 2012; 30: 1721-8.
18. Gross PA, Hermogenes AW, Sacks HS, Lau J, Levandowski RA. The efficacy of influenza vaccine in elderly persons. A meta-analysis and review of the literature. Ann Intern Med 1995; 123: 518-27.
19. Mannino S, Villa M, Apolone G, et al. Effectiveness of adjuvanted influenza vaccination in elderly subjects in northern Italy. Am J Epidemiol 2012; 176: 527-33.
20. Lee JKH, Lam GKL, Shin T, et al. Efficacy and effectiveness of high-dose versus standard-dose influenza vaccination for older adults: a systematic review and meta-analysis. Expert Rev Vaccines 2018; 17: 435-43.
21. PAHO/WHO. Epidemiological update diphtheria. Oct 18, 2019. En: https://reliefweb.int/sites/reliefweb.int/files/resources/2019-oct-18-phe-epi-update-diphtheria%20
%281%29.pdf; consultado octubre 2019.
22. Tseng HF, Sy LS, Qian L, et al. Safety of a tetanus-diphtheria-acellular pertussis vaccine when used off-label in an elderly population. Clin Infect Dis 2013; 56:315-21.
23. Nichol KL, Nordin J, Mullooly J, Lask R, Fillbrandt K, Iwane M. Influenza vaccination and reduction in hospitalizations for cardiac disease and stroke among the elderly. N Engl J Med 2003; 348: 1322-32.
24. Andrews N, Stowe J, Miller E. No increased risk of Guillain-Barré syndrome after human papilloma virus vaccine: A self-controlled case-series study in England. Vaccine 2017; 35:1729-32.
25. Ordoñez JE, Orozco JJ. Cost-effectiveness analysis of pneumococcal conjugate vaccine 13-valent in older adults in Colombia. BMC Infect Dis 2014; 14: 172.
26. de Melker HE, Versteegh FG, Schellekens JF, Teunis PF, Kretzschmar M. The incidence of Bordetella pertussis infections estimated in the population from a combination of serological surveys. J Infect 2006; 53: 106-13.
27. Zepp F, Heininger U, Mertsola J, et al. Rationale for pertussis booster vaccination throughout life in Europe. Lancet Infect Dis 2011;11: 557-70.
28. Ministerio de Salud. Presidencia de la Nación. Fundamentos de la vacunación de mujeres embarazadas
con vacuna triple bacteriana acelular (dTpa). Argentina 2012. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000439cnt-2011-10_lineamientos-vacunadTpa-embarazadas.pdf ; consultado octubre 2019.
29. Zaman K, Roy E, Arifeen SE, et al. Effectiveness of maternal influenza immunization in mothers and infants. N Engl J Med 2008; 359: 1555-64.
30. Naghavi M, Barlas Z, Siadaty S, Naguib S, Madjid M, Casscells W. Association of influenza vaccination and reduced risk of recurrent myocardial infarction. Circulation 2000; 102: 3039-45.
31. Hannoun C. The evolving history of influenza viruses and influenza vaccines. Expert Rev Vaccines 2013; 12: 1085-94.
32. Jain VK, Domachowske JB, Wang L, et al. Time to change dosing of inactivated quadrivalent influenza vaccine in young children: evidence from a phase III, randomized, controlled trial. J Pediatric Infect Dis Soc 2017; 6: 9-19.
33. Ando S. Effectiveness of quadrivalent influenza vaccine based on the test-negative control study in children during the 2016-2017 season. J Infect Chemother 2018; 10: 782-8.
34. Lu C-Y, Ferracin C, Chiu C-H, Lavis N, Huang C-H, Huang L-M. Immunogenicity and safety of a quadrivalent influenza vaccine in children and adolescents in Taiwan: A phase III open-label trial. Trials Vaccinol 2016; 5:48-52.
35. Pepin S, Szymanski H, Rochín Kobachi IA, et al. Safety and immunogenicity of an intramuscular quadrivalent influenza vaccine in children 3 to 8 y of age: A phase III randomized controlled study. Hum Vaccin Immunother 2016; 12: 3072-8.
36. Sesay S, Brzostek J, Meyer I, et al. Safety, immunogenicity, and lot-to-lot consistency of a split-virion quadrivalent influenza vaccine in younger and older adults: A phase III randomized, double-blind clinical trial. Hum Vaccin Immunother 2018; 14: 596-608.
37. Tisa V, Barberis I, Faccio V, et al. Quadrivalent influenza vaccine: a new opportunity to reduce the influenza burden. J Prev Med Hyg 2016; 57: E28-33.
38. Pebody RG, Zambon M, Ramsay M. Flu vaccines: an annual challenge. BMJ 2018; 361: k2705.
39. Kreijtz JH, Osterhaus AD, Rimmelzwaan GF. Vaccination strategies and vaccine formulations for epidemic and pandemic influenza control. Hum Vaccin 2009; 5: 126-35.
40. Grohskopf LA, Sokolow LZ, Broder KR, Walter EB, Fry AM, Jernigan DB. Prevention and control of seasonal influenza with vaccines: Recommendations of the Advisory Committee on Immunization Practices-United States, 2018-19 Influenza Season. MMWR Recomm Rep 2018; 67: 1-20.
41. Kwetkat A, Hagel S, Forstner C, Pletz MW. Pneumococcal vaccination for prevention of pneumonia. Z Gerontol Geriatr 2015; 48:614-8.
42. Tomczyk S, Bennett NM, Stoecker C, et al. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine among adults aged ≥ 65 years: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2014; 63: 822-5.
43. Brosio F, Masetti G, Matteo G, Stefanati A, Gabutti G. A novel nonlive, adjuvanted herpes zoster subunit vaccine: a report on the emerging clinical data and safety profile. Infect Drug Resist 2018; 11: 1401-11.
44. Monath TP, Gershman M, Staples JE, Barrett ADT. Yellow fever vaccine. En: Plotkin SA, Orenstein WA, Offitt PA, (eds). Vaccines, 6th ed. Edinburgh: Elsevier Saunders, 2013, Chapter 38.
45. Van Damme P, Leroux-Roels G, Suryakiran P, Folschweiller N, Van Der Meeren O. Persistence of antibodies 20 y after vaccination with a combined hepatitis A and B vaccine. Hum Vaccin Immunother 2017; 13: 972-80.
46. Saavedra MDC, Riera LM, Bottale AJ, Mariani MA, Maiza AS, Ambrosio AM. Estabilidad de la vacuna candid#1 para prevenir la fiebre hemorrágica argentina. Medicina (B Aires) 2017; 77: 353-7.
47. Badahdah AM, Rashid H, Khatami A. Update on the use of meningococcal serogroup C CRM197-conjugate vaccine (Meningitec) against meningitis. Expert Rev Vaccines 2016; 15 :9-29.
48. Zuckerman JN, Hatz C, Kantele A. Review of current typhoid fever vaccines, cross-protection against paratyphoid fever, and the European guidelines. Expert Rev Vaccines 2017; 16: 1029-43.
49. Rego ROM, Trentelman JJA, Anguita J, et al. Counterattacking the tick bite: towards a rational design of anti-tick vaccines targeting pathogen transmission. Parasit Vectors 2019; 12: 229.
– – – –
Así nace el círculo vicioso. Si se oye repetir muchas veces que se es un sabio, cualquiera que no tenga una buena autocrítica, termina creyéndoselo. Después son los discípulos que llegados con pocos conocimientos científicos ratifican el concepto de “maestro” y cuando en el transcurso de los años entrevén un poco la falacia del juicio, los intereses creados y un poco de self-defense contribuyen a que ellos sigan engrosando el coro de alabanzas. De ahí a afirmar que estamos en el mejor de los ambientes científicos, no hay más que un paso. Después llegan las apoteosis.
Alfredo Lanari (1910-1985)
De los homenajes (1940). El Día Médico Vol. XII, No. 38, 1940. En: Vocación y convicción. Fundación Alfredo Lanari; Buenos Aires, 1995, p 23
