CAROLINE A. LAMB 1, SILVIA I. VANZULLI 2, CLAUDIA LANARI 1
1Laboratorio de Carcinogénesis Hormonal, Instituto de Biología y Medicina Experimental (IBYME-CONICET), 2 Instituto de Investigaciones Hematológicas, Academia Nacional de Medicina, Buenos Aires, Argentina
Resumen El 70 por ciento de los carcinomas mamarios son luminales y expresan receptores de estrógenos alfa (RE). Desde hace varias décadas, su expresión se utiliza como blanco terapéutico en pacientes con cáncer de mama. Estas terapias están dirigidas a bloquear el RE o a inhibir la síntesis del ligando. La expresión de receptores de progesterona (RP) se evalúa como factor pronóstico junto con los RE. Se ha comprobado que existen dos isoformas predominantes de RP de distinto peso molecular, isoforma A e isoforma B, que no se distinguen por técnicas de inmunohistoquímica. Las evidencias indican que la proporción de isoformas de RP podría tener tanto un valor pronóstico como predictivo de la respuesta a un tratamiento con antiprogestágenos. En tumores mamarios luminales, los receptores de andrógenos (RA) se expresan en un alto porcentaje y la proporción de RA/RE o RA/RP podría ser un factor pronóstico. En tumores RE-, la expresión de RA es indicador de mal pronóstico y se propone que serían susceptibles a un tratamiento con antiandrógenos. Por último, la expresión de receptores de glucocorticoides (RG) sería un indicador de buen o mal pronóstico en tumores luminales o RE-, respectivamente. En tumores RE-, las metástasis expresan mayores niveles de RG nuclear que los tumores primarios y las terapias que bloquean los RG podrían mejorar la eficacia de la quimioterapia. Dado los entrecruzamientos de vías gatilladas por distintos receptores hormonales es posible que en un futuro se pueda administrar un esquema terapéutico que contemple la expresión de RE, isoformas de RP, RA y RG.
Palabras clave: cáncer de mama, receptores de estrógenos, isoformas de receptor de progesterona, receptor de andrógenos, receptor de glucocorticoides
Abstract Seventy per cent of breast cancers are luminal carcinomas that express alpha estrogen receptors (ER). For several decades, its expression has been used as a therapeutic target in patients with breast cancer. These therapies are aimed at blocking ER or inhibiting ligand synthesis. The expression of progesterone receptors (PR) is evaluated as a prognostic factor together with ER. It has been shown that there are two predominant PR isoforms with different molecular weight, isoform A and isoform B, which are not distinguished by immunohistochemical techniques. The available evidence indicates that the PR isoform ratio may have both a prognostic and predictive value of the response to antiprogestin treatment. In luminal mammary tumors, androgen receptors (AR) are expressed in a high percentage and the AR/ER or AR/PR ratio could be a prognostic factor. In ER- tumors, AR expression is an indicator of poor prognosis and it is proposed that they may be susceptible to antiandrogen treatment. Finally, the expression of glucocorticoid receptors (GR) would be an indicator of good or bad prognosis in luminal or ERtumors, respectively. In ER- tumors, metastases express higher levels of nuclear GR than primary tumors and therapies that block GR could improve the efficacy of chemotherapy. Given the crosstalk of pathways triggered by different hormone receptors, it is possible that in the future, a therapeutic scheme can be administered that contemplates the expression of ER, PR isoforms, AR and GR.
Key words: breast cancer, estrogen receptors, progesterone receptor isoforms, androgen receptors, glucocorticoid
receptors
Dirección postal: Claudia Lanari, Laboratorio de Carcinogénesis Hormonal (LCH), Instituto de Biología y Medicina Experimental (IBYME), Vuelta de Obligado 2490, 1428 Buenos Aires, Argentina
e-mail: lanari.claudia@gmail.com
Las estadísticas indican que una de cada 8 mujeres desarrollará cáncer de mama a lo largo de su vida. Desde el punto de vista clínico, es fundamental conocer la edad, los antecedentes personales y familiares de cáncer de mama y ovario, así como también el tamaño tumoral, la presencia de nódulos axilares y el tiempo transcurrido desde el primer síntoma hasta la consulta. Una vez realizada la biopsia, o la cirugía, se procede al examen histopatológico que permite clasificar el tipo tumoral y establecer el grado histológico. Estas características, junto con los biomarcadores, aportan el diagnóstico y son de valor pronóstico y predictivo de respuesta terapéutica.
Una vez categorizado el tumor y estadificada la paciente, es posible evaluar el riesgo de recaída para tomar las decisiones terapéuticas adecuadas en cada caso particular.
Los biomarcadores que se utilizan actualmente incluyen la determinación de receptores hormonales (receptores de estrógenos alfa y de progesterona, RE y RP, respectivamente), sobreexpresión del receptor de factor de crecimiento epidérmico de tipo 2 (HER2 o c-erb-B2) y el nivel de expresión del marcador de proliferación celular Ki-67. Estos marcadores se evalúan por técnicas de inmunohistoquímica (IHQ) y, cuando el resultado de HER2 es dudoso, se verifica la amplificación génica mediante técnicas de hibridación in situ. En el caso que los tumores expresen receptores hormonales y tengan un índice de Ki-67 moderado, de manera que se dificulte la decisión sobre el beneficio de una quimioterapia, se utilizan plataformas moleculares que informan una puntuación de alto o bajo riesgo que colabora con el oncólogo en la toma de decisiones. Actualmente, la prueba genómica más utilizada y aceptada en la Argentina es el Oncotype DX.
Este ensayo permite medir la expresión de 21 genes por amplificación génica (RT-PCR). Se evalúa la expresión de 16 oncogenes y 5 genes de referencia y a los resultados se les asigna una puntuación que permite orientar sobre el riesgo de recurrencia de la enfermedad. Si la puntuación es menor a 26 el riesgo de recurrencia sería bajo y, por lo tanto, no se aconseja la administración de quimioterapia
Por el contrario, si el puntaje obtenido es mayor o igual a 26 se recomienda la quimioterapia. Para pacientes premenopáusicas, existe una franja de incertidumbre para las muestras que presenten una puntuación entre 18 y 30 (breastcancer.org).
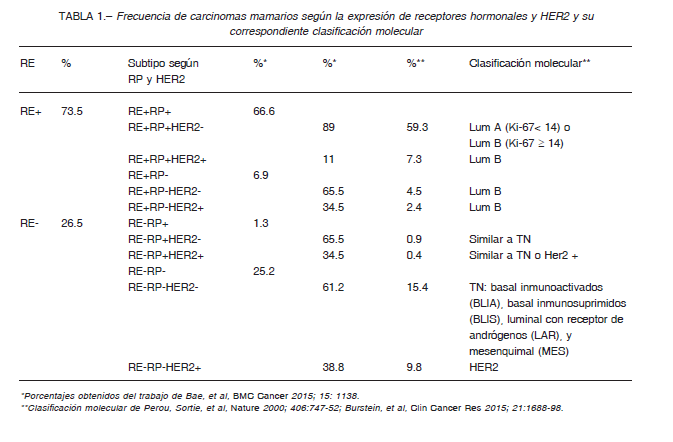
La mayoría (70-75%) de los carcinomas mamarios expresan RE y RP, y según la clasificación molecular estos tumores se corresponden con el tipo luminal. A su vez, estos tumores se subclasifican en luminales A (Lum A) o B (Lum B) de acuerdo a si tienen un bajo o alto índice de proliferación, respectivamente 1. Estos últimos, además de expresar RE y/o RP, pueden expresar HER2, y por lo general expresan menores niveles de RP que los Lum A.
Los carcinomas mamarios RE+/RP- también se incluyen en este grupo (Tabla 1). Desde el punto de vista clínico despiertan un interés especial, ya que tienen peor pronóstico que los tumores RE+/RP+. Se postula que estos tumores tienen exacerbada la señalización por factores de crecimiento y se han descripto mutaciones específicas asociadas a este fenotipo 2. Los tumores luminales tienen mejor pronóstico que el resto de los carcinomas mamarios y son capaces de responder tanto a terapias endocrinas dirigidas a bloquear al RE (tamoxifeno o fulvestrant) como a inhibir la producción endógena de sus ligandos naturales, los estrógenos (inhibidores de aromatasa). El grupo de tumores que no expresa RE, está conformado por un subgrupo que sobreexpresa HER2, y por lo tanto es susceptible a una terapia con anticuerpos dirigidos a bloquear dicho receptor, o por tumores denominados triple negativos (TN) ya que no expresan RE, RP ni HER2.
De acuerdo con la clasificación molecular, este grupo de tumores incluye a los tumores basales, que aún no cuentan con una terapia blanco dirigida estandarizada, siendo los de peor pronóstico1 (Tabla 1). Por otra parte, existe una controversia con respecto a los tumores RERP+.
Este grupo representa un porcentaje menor al 2% y la controversia está en que algunos los consideran como un grupo independiente con características propias, mientras que otros consideran que se tratan de errores de diagnóstico, ya que cuando se revisaron estos casos, muchos de ellos cambiaron de categoría 3. Asimismo, el estudio de este grupo de tumores determinó que el índice de proliferación, el porcentaje de mutaciones en P53 y la sobrevida de los pacientes se asemejan más a los tumores TN que a los luminales 4.
Receptores hormonales
Los RE, RP, receptores de andrógenos (RA), de mineralocorticoides, de glucocorticoides (RG), de ácido retinoico y otros receptores menos conocidos pertenecen a la superfamilia de receptores esteroideos. Comparten una estructura similar con sitios de unión a la hormona, de traslocación nuclear, de unión al ADN y de transactivación.
Estos receptores se activan al unir con alta afinidad a las hormonas y, una vez activos, se comportan como factores de transcripción uniéndose a los promotores de los genes blanco en sitios de pegado específicos. Alternativamente, pueden activarse en ausencia de ligando ya que pueden ser fosforilados por quinasas como MAPK y AKT, vías que suelen estar sobreactivadas en procesos neoplásicos.
Los receptores activados pueden a su vez actuar como coactivadores potenciando los efectos de otros factores de transcripción. En los últimos años se ha demostrado que los distintos receptores pueden interactuar entre sí en los promotores de los genes blanco mostrando un nivel de complejidad mayor de regulación de respuestas biológicas 5-8. Conocer el mecanismo de acción de las hormonas esteroideas ha sido de gran ayuda para comprender los mecanismos relacionados a la resistencia al tratamiento endocrino.
Teniendo en cuenta que las terapias endocrinas son mucho menos invasivas que las terapias inespecíficas como la quimioterapia, es sumamente importante conocer los mecanismos que utilizan las hormonas para regular el crecimiento tumoral y si el bloqueo, de otros receptores hormonales distintos del RE, podría constituir una alternativa terapéutica adicional para mejorar los efectos de las terapias endocrinas actuales.
Receptores de estrógenos
Se podría decir que Elwood Jensen (1920-2012) fue el padre de los receptores hormonales, en especial de RE. Luego, J. Gorski y G. Greene hicieron grandes aportes demostrando que estos receptores tenían una localización predominantemente nuclear (revisado en 9).
Actualmente, la presencia de RE en los carcinomas mamarios se determina mediante IHQ. Estos se consideran RE+ si la marca se localiza en el núcleo celular y se desestima su localización citoplasmática. Sin embargo, hace más de treinta años se evaluaban los receptores por técnicas de binding, es decir se medía la capacidad del receptor de unir hormona radioactiva con alta afinidad en un extracto celular. En ese momento, no se diferenciaba si había más de un tipo de receptor capaz de unirse a la hormona o, si varias poblaciones celulares diferentes podían unir estradiol con la misma afinidad. Posteriormente, en los años noventa, JanÅke Gustaffson descubrió un receptor de estrógenos diferente que une estrógenos con alta afinidad y para diferenciarlo se llamó RE alfa al ya conocido y beta al novel 10. Si bien estas dos isoformas están codificadas por genes localizados en distintos cromosomas, comparten una alta homología de secuencias. Aún no está claro el papel del RE beta en cáncer de mama y no se lo evalúa en la clínica.
Los anticuerpos que se utilizan en patología diagnóstica valoran en forma específica al RE alfa. Sin embargo, su detección por IHQ no permite distinguir si el receptor es funcional, está mutado, o es una isoforma de menor peso molecular que sigue manteniendo el epitope para ser reconocido por el anticuerpo.
Como mencionamos en párrafos anteriores, la determinación de los RE es importante no solo porque se trata de un marcador pronóstico independiente, sino también porque es un marcador predictivo de respuesta al tratamiento.
Se ha consensuado que pacientes portadores de tumores mamarios con una expresión de RE mayor o igual al 1% podrán ser tratados con una terapia endocrina. Sin embargo, queda claro que en un paciente con un tumor que presenta el 99% de las células RE-, no se espera la misma respuesta al tratamiento que aquel en el cual todas sus células expresan RE.
Desde hace tiempo, Fuqua y col. han postulado que uno de los mecanismos que explican la resistencia al tratamiento endocrino es la presencia de RE mutados 11. En su momento, no se encontró correlación entre la presencia de estas mutaciones y la respuesta al tratamiento, y esta teoría no se sostuvo. Curiosamente, en los últimos años resurgió este concepto al encontrarse que en muchos pacientes las metástasis expresan RE mutados que no estaban presentes en el tumor original 12.
Receptores de progesterona
¿Por qué se evalúan los RP si, hasta el momento, no hay un tratamiento dirigido a bloquear a los mismos?
¿Qué aporta su cuantificación? Se ha demostrado que, en los carcinomas mamarios RE+, la cuantificación de RP tiene valor pronóstico. Como mencionamos anteriormente, el subgrupo ER+/PR- es de peor pronóstico,
ya sea porque es una entidad diferente o porque implica que los RE no son funcionales, ya que uno de los efectos fisiológicos de RE es inducir la síntesis de RP.
De la misma manera que para los RE, antiguamente se los evaluaba por técnicas de unión al ligando y actualmente se los mide por IHQ. El gen de RP codifica para al menos dos proteínas principales, la isoforma B (RPB) de mayor peso molecular y la isoforma A (RPA) que es una proteína truncada a la que le faltan los primeros 161 aminoácidos. Dado que RPA está incluida dentro de RPB, es muy difícil tener anticuerpos que reconozcan exclusivamente a la RPA. Existen escasos trabajos en los cuales se ha cuantificado la expresión de ambas isoformas (revisado en 13). El consenso es que en la glándula mamaria normal se expresa la misma proporción de ambas isoformas, mientras que esta proporción se ve alterada en los tumores, donde frecuentemente predomina RPA sobre RPB. Algunos autores proponen que los tumores con mayor proporción de RPA que RPB tendrían menor respuesta al tamoxifeno y, por lo tanto, peor pronóstico (revisado en 13). Por el contrario, en nuestro laboratorio hemos demostrado que los tumores con mayor proporción de RPA que RPB comparten características con los tumores Lum A y, en consecuencia serían de mejor pronóstico que los que tienen la proporción opuesta, que son similares a los Lum B. Estos últimos, además, son tumores con mayor índice de proliferación y menor expresión de RP total 14. Asimismo, los resultados de nuestro laboratorio demuestran que los tumores con mayor proporción de RPA que RPB responden ex vivo al tratamiento con antiprogestágenos como la mifepristona 14. Estos estudios sugieren que el RP podría utilizarse también como blanco terapéutico para ser empleado en conjunto con la terapia endócrina actual en pacientes seleccionados por su perfil de isoformas de RP.
Por otra parte, cabe destacar que los progestágenos han sido utilizados en altas concentraciones en la década del ochenta y otros autores han propuesto su utilización en combinación con la terapia endocrina convencional.
Actualmente, hay varios estudios en la clínica ensayando el progestágeno, acetato de megestrol, en pacientes con cáncer de mama avanzado. El desafío en este campo es distinguir cuáles de los pacientes se beneficiarían de uno u otro tratamiento.
Receptores de andrógenos
Los RA no se miden de rutina en los pacientes con cáncer de mama. Se han descripto dos isoformas y varias variantes de splicing alternativo codificadas por el mismo gen.
La variante más comúnmente observada es la de mayor peso molecular, que se expresa aproximadamente en el 60-70% de los carcinomas mamarios 15. Considerando que se ha demostrado una interrelación entre RE y RA 16, resultó atractivo su estudio para explorar al RA no solo como un blanco terapéutico adicional, sino también como un biomarcador pronóstico en cáncer de mama. De hecho, estudios recientes han determinado que la relación RA/RE > 2 se asocia a una peor respuesta al tratamiento con tamoxifeno y a una peor sobrevida libre de enfermedad, de modo que la medición de esta relación podría tener valor pronóstico.
El consenso actual es que es un marcador de buen pronóstico en los tumores luminales y un marcador de peor pronóstico en los TN 17 (Tabla 2). A este subgrupo de tumores TN que expresan RA se los ha catalogado como subtipo LAR (según sus siglas en inglés, Luminal Androgen Receptor), y se ha observado que estos pacientes poseen una menor sobrevida libre de enfermedad en respuesta a tratamientos convencionales. Sin embargo, la expresión de RA en estos tumores podría hacerlos susceptibles a un tratamiento con antiandrógenos.
En 1988, la flutamida fue el primer antiandrógeno ensayado en pacientes con cáncer de mama, pero este no prosperó, probablemente debido a sus efectos colaterales y a la falta de respuesta clara. Años más tarde, se reavivó el interés con la determinación de los niveles de RA en cáncer de mama y el desarrollo de nuevas drogas para el cáncer de próstata. En ensayos con bicalutamida se obtuvieron mejores respuestas en pacientes seleccionados por tener más del 10% de RA y, actualmente, hay varios estudios que utilizan antiandrógenos de tercera generación como la enzalutamida y otros moduladores de RA como el enobosarm en combinación con inhibidores de aromatasa.
Receptores de glucocorticoides
Los RG se encuentran codificados por el gen NR3C1.
Este gen codifica para diversas isoformas con distinta localización celular y funciones biológicas diferentes. Al igual que los RA no se evalúan actualmente de rutina, sin embargo numerosos estudios sugieren que utilizar a estos receptores como blanco terapéutico podría tener ciertos beneficios.
En un estudio de metaanálisis retrospectivo con más de 1000 pacientes RE+ en estadios tempranos se observó que altos niveles de mRNA de RG estaban asociados a un mejor pronóstico en comparación con pacientes que presentaban niveles bajos o nulos de RG. Sin embargo, lo contrario se observó al evaluar 300 pacientes ER- en los cuales la expresión de RG estaba asociada a un peor pronóstico 18 (Tabla 2). Estos resultados son muy similares a los informados para RA. Asimismo, se demostró que existe una cooperación entre RE y RG, de modo que cuando ambos se activan hay un mayor posicionamiento de estos receptores en genes relacionados con diferenciación celular 19. Dado que la expresión de RG fue asociada a genes de sobrevida y de quimio-resistencia en los tumores TN, un estudio sugiere el tratamiento con antagonistas de RG junto con la quimioterapia con el fin de mejorar el efecto terapéutico 20.

En conclusión, dado el entrecruzamiento que existe entre las vías de señalización de los distintos receptores de esteroides, es sumamente importante evaluar la función que cumplen tanto en los tumores luminales como en los TN ya que, en ausencia de RE, los RA y RG podrían tener funciones opuestas. Vislumbramos que en un futuro la determinación de isoformas de RP, así como la determinación de RA y RG nos permitirá catalogar a los tumores como cuádruples o quíntuples positivos o negativos, agregando otros factores pronósticos y/o predictivos de tratamientos con agonistas / antagonistas endocrinos.
Agradecimientos: El trabajo fue financiado por ANPCYT, PICT 2015-1022; PICT 2017-2073, INC 2017, Fundación para el progreso de la Medicina de Córdoba, y Fundación Gador.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumours. Nature 2000; 406: 747-52.
2. Lopez G, Costanza J, Colleoni M, et al. Molecular insights into the classification of luminal breast cancers: The genomic heterogeneity of progesterone-negative tumors. Int J Mol Sci 2019; 20.
3. Schroth W, Winter S, Buttner F, et al. Clinical outcome and global gene expression data support the existence of the estrogen receptor-negative/progesterone receptorpositive invasive breast cancer phenotype. Breast Cancer Res Treat 2016; 155: 85-97.
4. Bae SY, Kim S, Lee JH, et al. Poor prognosis of single hormone receptor- positive breast cancer: Similar outcome as triple-negative breast cancer. BMC Cancer 2015; 15: 138.
5. Giulianelli S, Vaque JP, Soldati R, et al. Estrogen receptor alpha mediates progestin-induced mammary tumor growth by interacting with progesterone receptors at the cyclin d1/myc promoters. Cancer Res 2012; 72: 2416-27.
6. Mohammed H, Russell IA, Stark R, et al. Progesterone receptor modulates eralpha action in breast cancer. Nature 2015; 523: 313-17.
7. Sikora MJ. Family matters: Collaboration and conflict among the steroid receptors raises a need for group therapy. Endocrinology 2016; 157: 4553-60.
8. Giulianelli S, Vaque JP, Wargon V, et al. El receptor de estrógenos alfa como mediador del efecto proliferativi de progestágenos en cáncer de mama Medicina (B Aires) 2012; 72: 315-20.
9. O’Malley BW, Khan S. Elwood v. Jensen (1920-2012): Father of the nuclear receptors. PNAS 2013; 110: 3707-8.
10. Kuiper GG, Enmark E, Pelto-Huikko M, Nilsson S, Gustafsson JA. Cloning of a novel receptor expressed in rat prostate and ovary. PNAS 1996; 93: 5925-30.
11. McGuire WL, Chamness GC, Fuqua SA. Estrogen receptor variants in clinical breast cancer. Mol Endocrinol 1991; 5: 1571-77.
12. Toy W, Shen Y, Won H, et al. Esr1 ligand-binding domain mutations in hormone-resistant breast cancer. Nat Genet 2013; 45: 1439-45.
13. Lamb CA, Fabris VT, Jacobsen B, Molinolo AA, Lanari C. Biological and clinical impact of imbalanced progesterone receptor isoform ratios in breast cancer. Endocr Relat Cancer 2018.
14. Rojas PA, May M, Sequeira GR, et al. Progesterone receptor isoform ratio: A breast cancer prognostic and predictive factor for antiprogestin responsiveness. J Natl Cancer Inst 2017; 109.
15. Gucalp A, Traina TA. Targeting the androgen receptor in triple-negative breast cancer. Curr Probl Cancer 2016; 40: 141-50.
16. Peters AA, Buchanan G, Ricciardelli C, et al. Androgen receptor inhibits estrogen receptor-alpha activity and is prognostic in breast cancer. Cancer Res 2009; 69: 6131-40.
17. Vera-Badillo FE, Templeton AJ, de Gouveia P, et al. Androgen receptor expression and outcomes in early breast cancer: A systematic review and meta-analysis. J Natl Cancer Inst 2014; 106: djt319.
18. Pan D, Kocherginsky M, Conzen SD. Activation of the glucocorticoid receptor is associated with poor prognosis in estrogen receptor-negative breast cancer. Cancer Res 2011; 71: 6360-70.
19. West DC, Pan D, Tonsing-Carter EY, et al. Gr and er coactivation alters the expression of differentiation genes and associates with improved er+ breast cancer outcome. Mol Cancer Res 2016; 14: 707-19.
20. Skor MN, Wonder EL, Kocherginsky M, et al. Glucocorticoid receptor antagonism as a novel therapy for triple-negative breast cancer. Clin Cancer Res 2013; 19: 6163-72.
– – – –
Para el investigador básico, relatar sus experimentos no resulta tarea sencilla. Suele sumergirse en ellos, en la “torre de marfil”, aislado de la realidad cotidiana acompañado por la ahora infaltable computadora. Por lo general, el lego piensa que se trata de un varón, un xcéntrico distraído, nunca una mujer. Pero hubo mujeres científicas, de a cuenta gota en los tiempos lejanos, hasta que poco a poco penetraron en “el mundo del investigador” –como me gusta denominarlo– y hoy ya se destacan cada vez más.
Christiane Dosne Pasqualini
En: Quince mujeres recibieron el Premio Nobel en ciencia (Editorial). Medicina (B Aires) 2013; 73: 277-9
