MARIANELA DEL CARMEN SERRADELL, LUCÍA L. RUPIL, HUGO D. LUJÁN
Centro de Investigación y Desarrollo en Inmunología y Enfermedades Infecciosas (CIDIE), CONICET-UCCOR, Córdoba, Argentina
Resumen La propagación internacional de enfermedades infecciosas constituye un problema global de seguridad sanitaria. La vacunación es una de las intervenciones en salud más exitosas y efectivas. La administración por vía oral presenta ventajas significativas sobre la vía parental utilizada comúnmente. Protozoarios intestinales y de vida libre expresan en su superficie una densa capa de proteínas que los protegen de condiciones ambientales hostiles. La utilización de proteínas de superficie variante-específicas o VSPs (del inglés “Variant-specific Surface Proteins”) tales como las del protozoario intestinal Giardia lamblia constituye un enfoque eficiente para la generación de vacunas orales, dada su alta inmunogenicidad y su resistencia a cambios de pH y proteasas. En un trabajo reciente mostramos que estas propiedades pueden ser explotadas para proteger antígenos vacunales y potenciar su inmunogenicidad, facilitando así su administración oral. Como modelo inicial, generamos una vacuna oral contra el virus de la influenza compuesta por partículas similares a virus (VLPs, del inglés “virus-like particles”) que contienen en su envoltorio VSPs de G. lamblia y el antígeno HA (hemaglutinina del virus de la influenza). La administración oral a ratones de estas partículas recubiertas con VSPs y HA induce una respuesta inmune humoral (sistémica y de mucosa) y celular específica para HA sin la necesidad de adyuvantes externos. La respuesta inmune generada protege frente al desafío con el virus y también frente al desarrollo de tumores que expresan el antígeno vacunal HA.
Palabras clave: vacuna oral, protozoarios, proteínas de membrana, hemaglutinina viral, partículas de tipo viral
Abstract The international spread of infectious diseases is a global problem of health security. Vaccination is one of the most successful and profitable health interventions. Oral immunization has significant advantages over the widely used parental vaccines. Intestinal and free-living protozoa express on their surface a dense layer of proteins that protect them from hostile environmental conditions. The use of variable surface proteins (VSPs) such as those of the intestinal protozoan Giardia lamblia is a feasible mechanism for the generation of oral vaccines since they are highly immunogenic as well as resistant to changes in pH and proteases. In a recently published article, we showed that these properties of VSP can be exploited to protect and enhance the immunogenicity of vaccine antigens thus enabling their oral administration. We recently generated an oral vaccine against influenza virus composed of virus-like particles (VLPs) containing VSPs of G. lamblia and the HA antigen (viral hemagglutinin) in its envelope. When administered orally to mice, these coated particles elicit HA-specific humoral (systemic and local) and cellular responses, without the need of any additional adjuvant. Treated mice are protected against viral challenge and also against the development of tumors expressing the HA vaccine antigen.
Key words: oral vaccine, protozoan, membrane proteins, viral hemagglutinin, virus-like particles
Dirección postal: Hugo D. Luján, Av. Armada Argentina 3555, 5016 Córdoba Argentina
e-mail: hlujan@ucc.edu.ar
Giardia lamblia es un parásito unicelular que coloniza el intestino delgado superior de muchos vertebrados, incluido el hombre, y es el agente causante de la giardiasis.
Para sobrevivir en el intestino, la superficie del trofozoíto de Giardia está completamente cubierta por proteínas de superficie variante-específicas o VSPs (del inglés “variantspecific surface proteins”). Estas son proteínas integrales de membrana que contienen una región extracelular variable y rica en cisteínas (presentes principalmente en motivos CXXC), un único dominio transmembrana y un tallo citoplasmático altamente conservado 1. Las aproximadamente 200 VSPs codificadas en el genoma de Giardia están involucradas en el proceso de variación antigénica de tal modo que solo una se expresa en cada trofozoíto. Proteínas de superficie similares a VSPs (base de datos de la familia de proteínas PF03302) también están presentes en otros protozoarios parásitos como Entamoeba histolytica, que coloniza el intestino grueso, y en los ciliados de vida libre Paramecium tetraurelia y Tetrahymena thermophila, entre otros.
Las VSPs resisten el ambiente hostil del intestino
Anteriormente demostramos que, a través del silenciamiento de enzimas que participan en el mecanismo de regulación mediado por ARNs de interferencia, se generaban trofozoítos que expresaban más de una VSPs en
su superficie 2. La inmunización oral con VSPs purificadas de dichas células demostró proteger jerbos 3, perros y gatos 4 contra infecciones de Giardia. Esto confirmó la importancia inmunogénica de las VSPs, y también reveló que estas proteínas son capaces de sobrevivir en el ambiente adverso del intestino.
En un trabajo reciente 5 postulamos que las proteínas de superficie de microorganismos que viven en el ambiente hostil del intestino (cambios en el pH, y el potencial redox y presencia de enzimas proteolíticas) desempeñan un papel clave en su protección. En apoyo de esta hipótesis, demostramos que trofozoítos de G. lamblia, E. histolytica, T. thermophila y P. tetraurelia permanecen viables luego de la exposición a altas concentraciones de tripsina por más de una hora. Comprobamos también que tres VSPs recombinantes de dos aislamientos diferentes de Giardia resultan altamente resistentes a pH extremos y a la degradación in vitro por diversas enzimas proteolíticas presentes en el contenido estomacal e intestinal. Las características bioquímicas de las VSPs que les confieren estas propiedades implicarían la formación de enlaces inter-e intra-moleculares a través de coordinación de metales y/o puentes disulfuro, ya que el tratamiento con agentes reductores (2-mercaptoetanol) o con agentes quelantes (EDTA) disminuyó marcadamente su resistencia a la proteólisis.
Las VSPs activan tanto la inmunidad innata local como la sistémica
Las tres VSPs recombinantes fueron capaces de gatillar la señalización a través del receptor TLR-4 (del inglés “Toll-like receptor”) de la inmunidad innata, clave para la activación inmune frente a agentes infecciosos. Esta interacción con el sistema inmune innato se confirmó por la capacidad de estas proteínas de activar células dendríticas, las principales células presentadoras de antígeno profesionales. Estos nuevos descubrimientos aportan a la comprensión del mecanismo por el cual la vacuna oral anti-Giardia, compuesta por todo el repertorio de VSPs purificadas, desencadena su respuesta protectora en animales experimentales y domésticos 3, 4. Como es conocido, los patrones moleculares asociados a patógenos o PAMPs (del inglés “pathogen-associated molecular patterns”) están constituidos por estructuras conservadas y muy extendidas en diferentes patógenos 6. Por lo tanto, dada la capacidad de diferentes VSPs para interactuar con el sistema inmune innato a través del TLR-4 y el hecho de que estas proteínas de superficie, que comparten su alto contenido de motivos CXXC, se encuentran en diferentes protozoos, sugerimos que podrían ser consideradas un nuevo PAMP.
Las vacunas orales tienen ventajas sobre las parenterales
La mayoría de los patógenos infecciosos emergentes y reemergentes, como Vibrio cholerae, HIV, virus de la gripe y coronavirus, invaden e infectan al huésped a través de las superficies mucosas de las vías gastrointestinales, respiratorias y/o genitourinarias. La inmunidad de mucosas forma una primera línea de defensa por medio de IgA secretora (S-IgA) y células T citotóxicas contra estos patógenos 7. Sin embargo, la mayoría de las vacunas actuales generan respuestas efectivas en el compartimiento sistémico pero no en las mucosas porque son administradas por vía parenteral. Por el contrario, las vacunas administradas por vía oral o nasal han demostrado ser efectivas para inducir respuestas inmunes específicas de antígeno tanto a nivel sistémico como en las mucosas 8.
Además, las vacunas orales no requieren personal adiestrado, ya que pueden ser auto-administradas, no presentan riesgo de infecciones cruzadas, se suprimen los gastos de eliminación de jeringas y agujas, son indoloras y al constituir una técnica no invasiva resultan atractivas para su aplicación en programas de vacunación masiva.
Aunque la utilidad de las vacunas orales es clara, solo unas pocas están disponibles comercialmente debido a que en su recorrido se exponen directamente al medio degradante del tracto digestivo y al entorno inmunológicamente tolerogénico del intestino 9. Dado que las VSPs son inmunogénicas y resistentes a la proteólisis, planteamos que podrían ser utilizadas como un adyuvante oral y que formulaciones de vacunas que las incluyan podrían ser administradas con éxito por vía oral.
Las VSPs actúan a modo de blindaje sobre la vacuna quimérica
Para comprobar nuestra hipótesis, diseñamos y produjimos partículas similares a virus (VLPs) quiméricas que expresan los principales antígenos del virus de la gripe (HA y NA) y que contienen además VSPs en su superficie (VLPVSP-HA) a manera de “blindaje” (Fig. 1). Las VLPs (del inglés “virus like particles”) son estructuras altamente organizadas que se auto-ensamblan a partir de proteínas derivadas de un virus. Estas partículas subvíricas no infecciosas, estables y versátiles, son susceptibles de manipulación para transportar moléculas heterólogas, las cuales conservan su conformación antigénica nativa 10. Al contrario de los antígenos solubles, las VLPs pueden inducir una amplia respuesta inmune, incluidas las respuestas de células T y B. Por lo tanto, no solo son seguras, sino que son potentes inmunógenos, lo que las convierte en una plataforma ideal para el desarrollo de vacunas, tal como ha sido demostrado con las vacunas basadas en VLPs para hepatitis B o para el virus del papiloma humano, ya aprobadas para uso masivo 11.
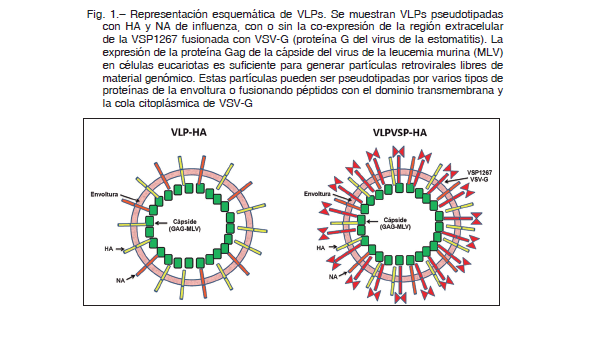
Las VSPs protegen al antígeno heterólogo y potencian su inmunogenicidad
En primera instancia, observamos que la presencia de VSPs en la superficie de las VLPs mejoraba sus propiedades inmunogénicas al promover la activación de células dendríticas de una manera dependiente de TLR-4. Además, observamos que cuando las VSPs estaban presentes en la superficie de las VLPs, no solo ellas mismas eran resistentes a la proteólisis, sino que HA y NA también fueron protegidas de la degradación por proteasas intestinales. Es la primera vez que se describe esta propiedad de las VSPs de proteger un antígeno heterólogo de la degradación. Con respecto al mecanismo de esta protección, actualmente solo estamos en condiciones de afirmar que las VSPs no actúan como inhibidores de proteasas, no protegen a los antígenos por “encubrimiento” frente a las enzimas proteolíticas, y que tanto las VSPs como el antígeno deben estar presentes en la misma partícula. Como mencionamos más arriba, postulamos que las interacciones intra e inter moleculares involucrando puentes disulfuro y/o coordinación de metales desempeñan funciones claves en la protección del antígeno.
Las vacunas quiméricas con VSPs son efectivas por vía oral
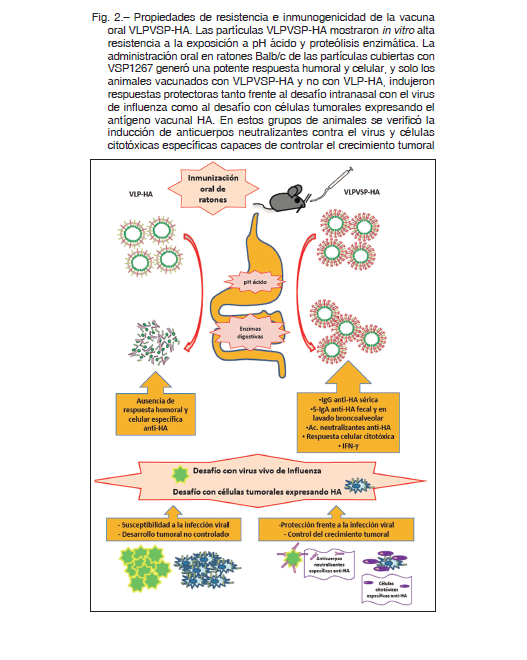
Para probar la capacidad de las VLPVSP-HA como vacunas de mucosas administramos las partículas por vía oral a ratones. Efectivamente, la inmunización oral de los animales con estas VLPVSP quiméricas conteniendo HA indujo respuestas inmunes robustas contra este antígeno vacunal. En contraste con las VLPs sin VSP (VLPs “desnudas”), las VLPs que expresaban VSP fueron eficientes para generar una respuesta de anticuerpos, que no solo estuvo presente en suero, sino que también prevaleció en muestras representativas de mucosas (lavado broncoalveolar y materia fecal). La presencia de anticuerpos en estos sitios de entrada de patógenos tiene importancia real, porque representa la primera barrera que encuentran los agentes infecciosos. Cabe destacar que la respuesta de S-IgA en lavado broncoalveolar y materia fecal solo se logró mediante la inmunización oral con las VLPVSP-HA y no por su administración parenteral. La S-IgA es clave en el sistema inmunitario de mucosas y se produce localmente en tejidos efectores 12. La presencia de S-IgA específica de HA en lavado broncoalveolar, sitio efector de mucosa distante al sitio inductivo (intestino), que es donde se produjo la administración inicial del antígeno, es una característica del sistema inmune de mucosas importante y muy útil para ser explotada. Además, debido a que la inmunización en mucosas induce no solo S-IgA en la mucosa sino también IgG sistémica, esta novedosa plataforma de vacunación oral se podría utilizar de la misma manera que las vacunas parenterales actualmente disponibles, brindando una doble protección contra los patógenos que ingresan al organismo por las mucosas, pero que luego se distribuyen en otros tejidos.
Las vacunas quiméricas con VSPs gatillan la respuesta humoral y celular
Idealmente, las vacunas están dirigidas a desencadenar respuestas inmunes celulares además de anticuerpos.
De hecho, nuestra vacuna VLPVSP-HA activó con éxito este brazo del sistema inmune, al aumentar la respuesta celular citotóxica e inducir la producción de células T específicas de HA productoras de IFN-γ. Observamos que esta respuesta celular prevaleció no solo en bazo, sino que también se llevó a cabo en ganglios linfáticos mesentéricos, sitios inductivos claves de las respuestas inmunes en las vacunas orales. Cabe destacar que el IFN-γ y el TNF-α secretados por células T CD8+ en la lámina propia desempeñan un papel importante al permitir que las células fagocíticas combatan de manera más efectiva los patógenos que han traspasado la barrera mucosa 13.
Las vacunas quiméricas con VSPs protegen contra tumores
En última instancia, estudiamos la efectividad de esta vacuna oral para generar protección in vivo mediante dos estrategias: desafío con virus vivos y con células tumorales. En el modelo de infección intranasal, los ratones vacunados con VLPVSP-HA mostraron estar completamente protegidos frente a la infección con el virus de la influenza, y que esta protección se correlacionaba con la generación de anticuerpos neutralizantes anti-HA. Por otra parte, el ensayo de desafío con células tumorales constituye una herramienta útil para evaluar la generación eficiente de respuestas celulares citotóxicas. Los ratones inmunizados por vía oral con VLPVSP-HA mostraron un control casi completo del crecimiento tumoral, al inocularles células derivadas de un mesotelioma maligno (línea celular AB1) que expresan el antígeno vacunal HA. Los esplenocitos aislados de estos animales mostraron una mayor citotoxicidad in vitro contra las células tumorales, comprobando la eficiente generación de células citotóxicas específicas contra las células cancerosas que expresan HA.
Las vacunas quiméricas con VSPs son estables
Finalmente, comprobamos que las partículas VLPVSP-HA son resistentes a procesos de congelación y descongelación, y se mantienen estables a diferentes temperaturas, sin perder sus propiedades inmunogénicas.
Conclusiones
Aprovechando y combinando las propiedades de alta resistencia a la degradación de moléculas de superficie de protozoarios y la alta inmunogenicidad y versatilidad de las VLPs, desarrollamos una plataforma para la generación de vacunas orales seguras, estables y eficientes.
La vacuna oral contra el virus de influenza así generada fue capaz de activar los distintos componentes del sistema inmune, generando anticuerpos en mucosa que evitan la unión e invasión de patógenos y neutralizan enterotoxinas, y anticuerpos séricos que controlan patógenos invasivos a nivel sistémico, además de una eficaz inmunidad celular (Fig. 2).
Estos resultados permitirán en el futuro cercano generar un amplio rango de vacunas orales, mejorar las campañas de vacunación masiva, llegar a regiones del planeta adonde el transporte refrigerado es impráctico y, por ende, mejorar ostensiblemente la prevención de enfermedades infecciosas.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Adam RD, Nigam A, Seshadri V, et al. The Giardia lamblia vsp gene repertoire: characteristics, genomic organization, and evolution. BMC Genom 2010; 11: 424.
2. Prucca CG, Slavin I, Quiroga R, et al. Antigenic variation in Giardia lamblia is regulated by RNA interference. Nature 2008; 456: 750-4.
3. Rivero FD, Saura A, Prucca CG, Carranza PG, Torri A, Lujan HD. Disruption of antigenic variation is crucial for effective parasite vaccine. Nat Med 2010; 16: 551-7.
4. Serradell MC, Saura A, Rupil LL, et al. Vaccination of domestic animals with a novel oral vaccine prevents Giardia infections, alleviates signs of giardiasis and reduces transmission to humans. NPJ Vaccine 2016; 1: 16018.
5. Serradell MC, Rupil LL, Martino RA, et al. Efficient oral vaccination by bioengineering virus-like particles with protozoan surface proteins. Nat Commun 2019; 10: 361.
6. Tang D, Kang R, Coyne CB, Zeh HJ, Lotze MT. PAMPs and DAMPs: signal 0s that spur autophagy and immunity. Immunol Rev 2012; 249: 158-75.
7. Brandtzaeg P. Induction of secretory immunity and memory at mucosal surfaces. Vaccine 2007; 25: 5467-84.
8. Lavelle EC, O’Hagan DT. Delivery systems and adjuvants for oral vaccines. Expert Opin Drug Deliv 2006; 3: 747-62.
9. Pabst O, Mowat AM. Oral tolerance to food protein. Mucosal Immunol 2012; 5: 232-9.
10. Naskalska A, Pyrc K. Virus-like particles as immunogens and universal nanocarriers. Pol J Microbiol 2015; 64: 3–13.
11. Ludwig C, Wagner R. Virus-like particles-universal molecular toolboxes. Curr Opin Biotechnol 2007; 18: 537-45.
12. Rose-John S, Winthrop K, Calabrese L. The role of IL-6 in host defence against infections: immunobiology and clinical implications. Nat Rev Rheumatol 2017; 13: 399-409.
13. Greczmiel U, Kräutler NJ, Pedrioli A, et al. Sustained T follicular helper cell response is essential for control of chronic viral infection. Sci Immunol 2017; 2(18): eaam8686.
