MARTÍN DE SANTIBAÑES 1, RODRIGO SANCHEZ CLARIÁ 2, EDUARDO DE SANTIBAÑES 1, JUAN PEKOLJ 1, OSCAR MAZZA 2
1 Sección Hígado-Vías Biliares-Páncreas, Servicio de Cirugía General, Sección de Trasplante Hepático, 2 Sección Hígado-Vías Biliares-Páncreas, Servicio de Cirugía General, Hospital Italiano de Buenos Aires, Argentina
Resumen El cáncer de páncreas localmente avanzado (CPLA) tiene varias definiciones, pero esencialmente es un tumor no metastásico, en el que la resección quirúrgica inicial no se considera beneficiosa debido a la extensa afectación vascular y la alta probabilidad de tener márgenes quirúrgicos con compromiso tumoral. La introducción de la quimioterapia con leucovorina cálcica, fluorouracilo, clorhidrato de irinotecán y oxaliplatino (FOLFIRINOX) y gemcitabina-nab-paclitaxel (paclitaxel acoplado a albúmina, lo que aumenta su solubilidad) ha tenido alcances muy importantes en el tratamiento de pacientes con CPLA. Después de 4 a 6 meses de quimioterapia de inducción, una gran proporción tiene enfermedad estable o incluso regresión tumoral, permitiendo rescatarlos quirúrgicamente, que de inicio no eran candidatos a una cirugía resectiva, con una supervivencia global de 30 a 35 meses.
Palabras clave: cáncer de páncreas localmente avanzado, FOLFIRINOX, neoadyuvancia, radioterapia, cirugía
Abstract Locally advanced pancreatic cancer (LAPC) has several definitions, but it is essentially a non-metastatic tumor, in which the initial surgical resection is not considered beneficial due to the extensive vascular involvement and consequent high chance of a nonradical resection. The introduction of chemotherapy with calcium leucovorin, fluorouracil, irinotecan hydrochloride and oxaliplatin (FOLFIRINOX) and gemcitabine-nab (nanoparticle albumin-bound)-paclitaxel (gem-nab) had very important implications for the management of patients with LAPC. After 4 to 6 months of induction chemotherapy, a large proportion of them have stable disease or even tumor regression, allowing to rescue those who initially were not candidates for surgery, with 30-35 months overall survival after surgery.
Key words: locally advance pancreatic cancer, FOLFIRINOX, neoadjuvant chemotherapy, radiotherapy, surgery
Dirección postal: Martín de Santibañes, Sección de Cirugía de Hígado-Vías Biliares-Páncreas, Servicio de Cirugía General, Sección de Trasplante Hepático, Hospital Italiano de Buenos Aires, Tte. Gral. Juan D. Perón 4190, 1199 Buenos Aires, Argentina.
e-mail: martin.desantibanes@hospitalitaliano.org.ar
El cáncer de páncreas (CP) representa actualmente la cuarta causa de muerte por cáncer y se prevé que para el 2030 supere a los de mama, próstata y colorrectal 1. En la actualidad, la resección quirúrgica en combinación con quimioterapia sistémica, ofrece la única esperanza de cura o supervivencia a largo plazo para aquellos pacientes con CP. La combinación de ácido folínico (leucovorina cálcica), fluorouracilo, irinotecan y oxaliplatino (FOLFIRINOX) demostró una supervivencia general más larga que la gemcitabina sola cuando se administra como tratamiento de primera línea luego de una resección quirúrgica 2. Sin embargo, solamente un 10% es diagnosticado con tumores que pueden ser operados de inicio con una resección quirúrgica estándar. Hasta un 60% van a ser excluidos de cirugía por presentar enfermedad metastásica o por situaciones clínicas que contraindiquen un procedimiento quirúrgico. El 30% restante se presentan con cáncer de páncreas localmente avanzados (CPLA) y por lo general son tratados como portadores de una enfermedad en estadio avanzado, mediante tratamiento paliativo 3. Los avances oncológicos de los últimos tiempos han permitido cambiar el enfoque terapéutico para esta población. Ofrece complejos esquemas de tratamientos de quimioterapia neoadyuvante, seguido de procedimientos quirúrgicos de alta complejidad, con tasas de supervivencia alejadas similares a las de una enfermedad resecable de inicio.
Definición de resecabilidad
La evaluación de la resecabilidad tumoral en el momento de diagnóstico de CP es de suma importancia para determinar la estrategia terapéutica más adecuada en cada paciente.
La tomografía computarizada multipista (MDCT), utilizando protocolos específicos de contraste de páncreas, representa el método mas difundido para establecer un diagnóstico de sospecha de CP. Permite una estadificación precisa de la enfermedad, determinando la resecabilidad tumoral. A su vez, la resonancia magnética puede ser un estudio de inicio o complementario, sobre todo para caracterizar lesiones dudosas o la presencia de metástasis hepáticas. Existen otros estudios tales como el PET-TC-18FDG, marcadores tumorales séricos (CEA o CA 19-9) o la eco-endoscopía (con eventual biopsia), que también juegan un rol relevante como estudios complementarios 4,5.
Históricamente, la enfermedad localizada de páncreas se ha clasificado como resecable (sin afectación vascular por métodos por imágenes) o localmente avanzado (irresecable, con afectación vascular de tipo arterial o venosa extensa). Más precisamente, el CPLA es aquel que presenta afectación de la arteria mesentérica superior o el tronco celíaco en más de 180° de la circunferencia vascular o compromiso de la aorta y/o compromiso de la vena mesentérica superior o la vena porta, que imposibiliten una resección y reconstrucción vascular adecuada en ausencia de enfermedad metastásica a distancia. Más recientemente, el término borderline se ha utilizado para describir tumores potencialmente resecables, pero que presentan algún grado de afectación vascular que pueda poner en peligro un margen de resección quirúrgica (R0).
En un intento de estandarizar este último concepto, un tumor borderline sería aquel con afectación venosa reconstruible (vena mesentérica superior o vena porta) y/o contacto en menos de 180° de la circunferencia vascular de estructuras arteriales 4, 6.
Neoadyuvancia
El tratamiento neoadyuvante, se administra como primer paso para reducir el tamaño del tumor antes del tratamiento principal que generalmente consiste en cirugía.
Existe un interés creciente en el uso de quimioterapia neoadyuvante sola o en combinación con radioterapia en pacientes con enfermedad resecable, borderline y localmente avanzada.
La racionalidad del tratamiento neoadyuvante en CP resecable estaría dada para el tratamiento de enfermedad micrometastásica en una etapa temprana y para aumentar la posibilidad de R0 con márgenes negativos, ya que los mismos están asociados con mejoras de la supervivencia global. A pesar de esto, no existe suficiente evidencia científica para justificar esta estrategia en esta población. Más aún, los prometedores resultados del estudio PRODIGE2, que utilizó terapia adyuvante con un régimen modificado de FOLFIRINOX luego de resección quirúrgica, demostraron tasas de supervivencia libre de enfermedad a 3 años de 39.7%, con una mediana de supervivencia global de 54.4 meses. En base a estos resultados, la estrategia de cirugía más adyuvancia en CP resecable es el estándar de tratamiento en la actualidad.
Los pacientes con CPLA son considerados generalmente como irresecables en su fase inicial. Incluso si la resección arterial fuera técnicamente factible, son procedimientos quirúrgicos de altísima complejidad que pueden estar asociados con elevado riesgo perioperatorio y una baja supervivencia alejada. Por ello, la opción inicial de cirugía estaría descartada.
El tratamiento intensivo neoadyuvante con quimioterapia, quimio-radiación, o ambas tienen el potencial de convertir la enfermedad irresecable a resecable. El tratamiento radiante con fluorouracilo sensibilizante o capecitabina, administrada en fracciones de 28 a 30 dosis para un total de 54 Gy durante 6 semanas, se conoce como quimio-radiación y representa una estrategia efectiva para lograr el control local tumoral en una variedad de cánceres, particularmente en el tracto gastrointestinal.
Sin embargo, el efecto de esta estrategia de tratamiento con relación a la supervivencia es menos claro. A su vez, muchos CPLA desarrollan metástasis rápidamente, por lo general debido a enfermedad peritoneal oculta.
En la actualidad, las guías recomiendan realizar una inducción de quimioterapia sistémica (si la quimioterapia es el tratamiento primario, cuyo propósito es un tratamiento único, se llama quimioterapia de inducción) seguida de una re-estadificación del paciente, para considerar luego la asociación de terapia radiante en ausencia de progresión de la enfermedad 5, 7.
Durante décadas, el 5-fluorouracilo (5-FU) fue el tratamiento paliativo estándar para el CP. En 1997, un ensayo controlado aleatorizado que incluía pacientes metastásicos o con CPLA, mostró una mejor supervivencia de 5.6 meses para los tratados con gemcitabina versus 4.4 meses con 5-FU (p=0.0025). En 2011, los resultados del estudio PRODIGE 4/ACCORD 11 encontraron una mediana de supervivencia global de 11.1 meses con FOLFIRINOX versus 6.8 meses con gemcitabina (p<0.0001) en aquellos con enfermedad metastásica 8. En los últimos años se han publicado grandes series de casos utilizando el esquema de FOLFIRINOX para pacientes con CPLA, con resultados muy alentadores de rescate quirúrgico y buenos resultados de supervivencia alejada. Un reciente metaanálisis de estudios retrospectivos, incluyó a 315 pacientes con CPLA a los cuales se los trató con FOLFIRINOX neoadyuvante, demostrando una tasa de resección R0 de 25.2% y una mediana de 24.2 meses de supervivencia global 9. Este estudio no incluyó en el análisis la opción de quimio-radioterapia, ni evaluó el rol de la neoadyuvancia para CP borderline.
La activación del sistema renina-angiotensina en fibroblastos aumenta la fibrosis tumoral y la desmoplasia, una característica clave de CPLA, a través de la vía del factor transformador de crecimiento β (TGF-β). El principal efector del sistema renina-angiotensina es la angiotensina II. La inhibición de la actividad del sistema renina-angiotensina se logra mediante los bloqueadores del receptor de angiotensina I, tal como el losartán. Estas drogas pueden reducir el potencial maligno de las células cancerosas y alterar el microambiente tumoral, activando la inmunidad y normalizando la matriz extracelular para optimizar la biodisponibilidad de la quimioterapia citotóxica. En función a estos conceptos, un reciente ensayo clínico fase 2 de una rama que incluyó a 49 pacientes con CPLA tratados con FOLFIRINOX durante 8 ciclos en combinación con losartán, seguido de quimioradioterapia, demostró una alta tasa de resección R0 (61%) y tasas de supervivencia prolongadas.
A su vez, se asoció con disminuciones significativas en los niveles plasmáticos de TSP1 y TGF-β, que es altamente sugestivo de actividad biológica 10.
En un estudio paralelo usando FOLFIRINOX (sin losartán) seguido de quimio-radioterapia en pacientes con tumores borderline, la resección se logró en 31 de 48 pacientes elegibles (65%). Sabemos que la tasa de resección quirúrgica es mayor por definición en enfermedad borderline en comparación con CPLA, la tasa de
resecciones márgenes R0 es muy similar para ambas poblaciones, lo cual también podría estar justificado
por el posible beneficio adicional del losartán. A su vez, esta suposición está respaldada por una mediana de progresión libre de enfermedad de 14.7 meses y una mediana de supervivencia global de 37.7 meses en la población con enfermedad borderline y resultados muy similares para aquellos con CPLA. Más aún, hubo 3 casos de respuesta patológica completa en el estudio de CPLA con losartán y ningún caso en el de tumores borderline 10, 11.
La quimioradioterapia también puede haber contribuido con estos resultados. El rol de la radiación neoadyuvante o adyuvante en CPLA sigue siendo cuestionada. El análisis interino de un estudio de quimioradioterapia neoadyuvante versus cirugía inmediata para tumores resecables y borderline (PREOPANC 1), muestran una mejoría significativa en la tasa de resección R0, tasa de recurrencia local y la mediana de supervivencia libre de enfermedad para el primer grupo de pacientes 12. Sin embargo, no es claro si el tratamiento de radioterapia de corta duración, utilizado para ese trabajo, sería adecuado en el contexto de afectación vascular. Por lo tanto, muchos centros optan por tratamientos de radioterapia de larga duración en el escenario de afectación vascular persistente, después de 4 meses de un esquema de FOLFIRINOX, para mejorar los resultados de una resección R0.
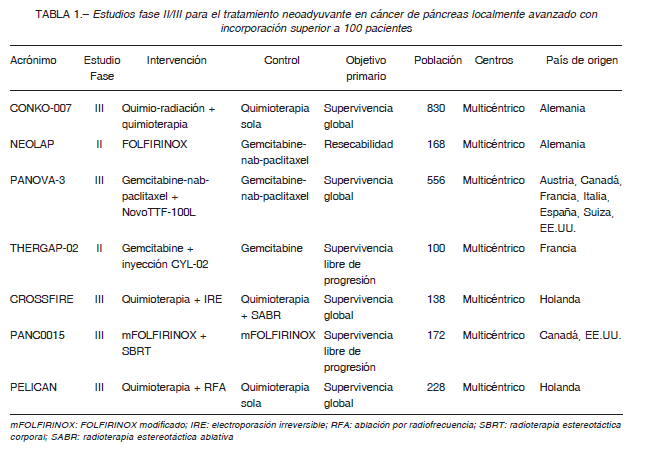
En la Tabla 1 se incluyen los principales estudios multicéntricos en curso para el tratamiento neoadyuvante
en CPLA.
Consideraciones clínicas
Drenaje biliar
La quimioterapia con FOLFIRINOX requiere un nivel de bilirrubina sérica inferior a 1.5 veces el límite superior normal. Por lo tanto, aquellos con hiperbilirrubinemia y un CP cefálico deben tener un drenaje biliar adecuado, preferiblemente a través de prótesis metálicas autoexpansibles.
Este tipo de prótesis metálicas han demostrado ser muy eficientes para paliar síntomas y tienen una menor tasa de complicaciones (oclusión de la prótesis o migración) en comparación con las prótesis plásticas 13. El drenaje biliar percutáneo se puede realizar como una alternativa a la colocación de una prótesis endoscópica, pero solo si la vía endoscópica no ha sido factible 4.
Quimioterapia de inducción
La terapia con FOLFIRINOX está reservada para pacientes con un buen estado funcional (puntuación de 0-1) y drenaje biliar adecuado, como se mencionó anteriormente.
De acuerdo con las guías de la NCCN 14 se recomienda la quimioterapia de inducción durante 8-12 ciclos (4-6 meses), que consiste en un programa semanal de 2 h de infusión intravenosa de oxaliplatino de 85 mg/m2, seguido de 2 h de infusión intravenosa de ácido folínico 400 mg/m2 concomitantemente con 90 minutos de infusión intravenosa de irinotecán 180 mg/m2, seguido posteriormente por 5-FU 400 mg/m2 como bolo y 2400 mg/m2 como un continuo de 46 h de infusión intravenosa. Durante el tratamiento con FOLFIRINOX es importante el monitoreo regular de las plaquetas, neutrófilos, función hepática y renal, lo que permite reducir las dosis de irinotecan u oxaliplatino (25-50%) en función a los hallazgos de toxicidad. En pacientes en los cuales se espera que no toleren FOLFIRINOX o que progresen bajo este tratamiento, se recomienda el esquema de gemcitabina-nab-paclitaxel (gemcitabina más paclitaxel, unido a nanopartículas de albúmina) 15.
Sin embargo, algunos centros prefieren gem-nab como tratamiento de primera línea sobre FOLFIRINOX, ya que este régimen generalmente es mejor tolerado 16.
Re-estadificación
Después de 3 a 6 meses de quimioterapia con FOLFIRINOX es recomendable realizar una nueva re-estadificación, habitualmente con MDCT. De acuerdo con las definiciones RECIST, la progresión requiere al menos un aumento del 20% en la suma de los diámetros tumorales en tres direcciones (y un aumento absoluto > 5 mm) o la aparición de nuevas lesiones. Respuesta parcial RECIST (regresión), requiere una reducción del tumor de al menos 30%. Enfermedad estable RECIST, se define por la ausencia de progresión y regresión, respectivamente.
Luego del tratamiento de inducción con FOLFIRINOX, la enfermedad estable RECIST es la más frecuentemente observada (60%), seguida de progresión RECIST en 20-30% y respuesta parcial RECIST en 10-20% 17. Además, deben medirse los valores plasmáticos de CA 19-9. Un aumento del CA 19-9 durante la re-estadificación puede ser considerado como un factor de mal pronóstico.
Selección de candidatos para cirugía
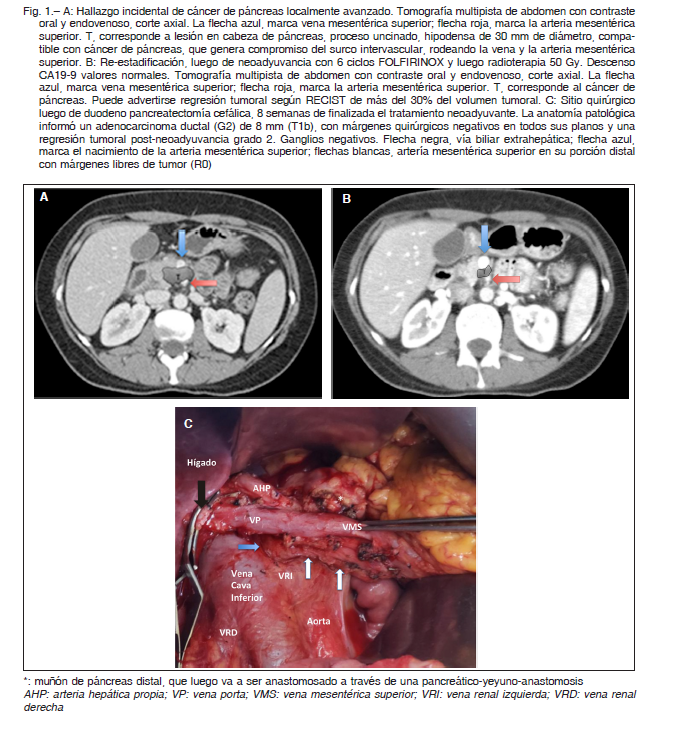
En centros de alto volumen de cirugía pancreática, la exploración quirúrgica podría indicarse en pacientes con enfermedad RECIST no progresiva (estable o de regresión) después de 2 a 4 meses de quimioterapia para evaluar la posibilidad de una resección pancreática. La MDCT puede subestimar la respuesta de FOLFIRINOX o gem-nab, ya que la discriminación entre fibrosis y tumor viable es muy compleja a la fecha. Como se mencionó anteriormente, el descenso del marcador tumoral CA 19-9 representa un factor de selección para indicar la exploración quirúrgica. Esta situación clínica queda ejemplificada en el caso presentado en la Figura 1: A, B y C.
Estudio patológico luego de tratamiento neoadyuvante
El examen histopatológico de una pieza de resección quirúrgica luego de la terapia neoadyuvante, representa un desafío en la evaluación del efecto del tratamiento. Actualmente, se basa en la clasificación de regresión tumoral, es decir, una evaluación semicuantitativa del alcance de la respuesta morfológica del tumor al tratamiento quimioterápico previo a la cirugía. Existe un profundo interés por establecer la relación del grado de regresión tumoral y los datos de supervivencia y tasas de rescate quirúrgico para poder seleccionar mejor aquellos pacientes que pueden beneficiarse con esta estrategia terapéutica.
Existen varios sistemas de valoración de regresión tumoral en CP luego de terapia neoadyuvante. La mayoría se basa en la evaluación de dos criterios principales: (i) la destrucción de células cancerosas viables y/o (ii) el grado de fibrosis inducida por el tratamiento. La valoración de ambos criterios suele ser semicuantitativa. La mayoría de los sistemas contemplan la cantidad de destrucción células cancerosas (o la cantidad de células tumorales residuales viables, respectivamente) en relación con el tamaño original del tumor o la cantidad de células cancerosas residuales viables en relación con la fibrosis inducida por el tratamiento 18. Otros cambios morfológicos tenidos en cuenta incluyen la presencia y extensión de necrosis, inflamación, depósitos de mucina o macrófagos, así como cambios citológicos regresivos de las células tumorales, como la eosinofilia citoplasmática, la vacuolización del citoplasma y núcleos irregulares 19.
Conclusión
El tratamiento del CPLA ha evolucionado en los últimos años. Los esquemas con FOLFIRINOX y gemcitabina-nab-paclitaxel permiten, basado en estudios por imágenes y determinación de marcadores tumorales, una tasa elevada de rescate quirúrgico con una mediana de supervivencia global de 30 meses en una población que antes era tratada solo de forma paliativa.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Rahib L, Smith BD, Aizenberg R, Rosenzweig AB, Fleshman JM, Matrisian LM. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res 2014; 74: 2913-21.
2. Conroy T, Hammel P, Hebbar M, et al. FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer. N Engl J Med 2018; 379: 2395-406.
3. Hartwig W, Werner J, Jäger D, Debus J, Büchler MW. Improvement of surgical results for pancreatic cancer. Lancet Oncol 2013; 14: e476-85.
4. de Santibañes M, Ocampo C, Mazza O, et al. Primer Consenso Argentino de Cáncer de Páncreas: Recomendaciones para el diagnóstico, estadificación, tratamiento y paliación. Rev Arg Cirug 2016; 108: 213-20.
5. van Veldhuisen E, van den Oord C, Brada LJ, et al. Locally advanced pancreatic cancer: work-up, staging, and local intervention strategies. Cancers (Basel) 2019; 11(7). pii: E976. doi: 10.3390/cancers11070976.
6. Bockhorn M, Uzunoglu FG, Adham M, et al. Borderline resectable pancreatic cancer: a consensus statement by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2014; 155: 977-88.
7. Klaiber U, Leonhardt CS, Strobel O, Tjaden C, Hackert T, Neoptolemos JP. Neoadjuvant and adjuvant chemotherapy in pancreatic cancer. Langenbecks Arch Surg 2018; 403: 917-32.
8. Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011; 364: 1817-25.
9. Suker M, Beumer BR, Sadot E, et al. FOLFIRINOX for locally advanced pancreatic cancer: a systematic review and patient-level meta-analysis. Lancet Oncol 2016; 17: 801-10.
10. Murphy JE, Wo JY, Ryan DP, et al. Total neoadjuvant therapy with FOLFIRINOX in combination with losartan followed by chemoradiotherapy for locally advanced pancreatic cancer: a phase 2 clinical trial. JAMA Oncol 2019; 5: 1020-7.
11. Murphy JE, Wo JY, Ryan DP, et al. Total neoadjuvant therapy with FOLFIRINOX followed by individualized chemoradiotherapy for borderline resectable pancreatic adenocarcinoma: a phase 2 clinical trial. JAMA Oncol
2018; 4: 963-9.
12. Van Tienhoven G, Versteijne E, Suker M, et al. Preoperative chemoradiotherapy versus immediate surgery for resectable and borderline resectable pancreatic cancer (PREOPANC-1): a randomized, controlled, multicenter phase III trial. J Clin Oncol 2018; 36:18_suppl, LBA4002.
13. Tol JA, van Hooft JE, Timmer R, et al. Metal or plastic stents for preoperative biliary drainage in resectable pancreatic cancer. Gut 2016; 65: 1981-7.
14. Tempero MA, Malafa MP, Chiorean EG, et al. Pancreatic adenocarcinoma, Version 1.2019. J Natl Compr Canc Netw 2019; 17: 202-10.
15. Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med 2013; 369: 1691-703.
16. Muranaka T, Kuwatani M, Komatsu Y, et al. Comparison of efficacy and toxicity of FOLFIRINOX and gemcitabine with nab-paclitaxel in unresectable pancreatic cancer. J Gastrointest Oncol 2017; 8: 566-71.
17. Vogel JA, Rombouts SJ, de Rooij, T et al. Induction chemotherapy followed by resection or irreversible electroporation in locally advanced pancreatic cancer (IMPALA): a prospective cohort study. Ann Surg Oncol 2017; 24: 2734-43.
18. Verbeke C, Häberle L, Lenggenhager D, Esposito I. Pathology assessment of pancreatic cancer following neoadjuvant treatment: Time to move on. Pancreatology 2018. pii: S1424-3903(18)30077-2. doi: 10.1016/j.pan.2018.04.010. [Epub ahead of print]
19. N Kalimuthu S, Serra S, Dhani N, et al. Regression grading in neoadjuvant treated pancreatic cancer: an interobserver study. J Clin Pathol 2017; 70: 237-43.
– – – –
[…] creemos que mantener a la familia cerca del enfermo no es un mal menor sino una ayuda psíquica importante que contribuye al bienestar y curación del enfermo. A veces lo es también para quienes tienen ocasión de devolver en instantes críticos de un ser querido mucho de la gratitud que no había encontrado cauce para expresarse. En “Brave new world” de Huxley hay una descripción de una sala de hospital en donde se muere con perfección y de acuerdo a la evolución de una humanidad que se ha desarrollado sólo técnicamente. Entre eso y el hospital de Lambarene queda un amplio campo en el que debe hallarse un camino que no esté desprovisto del hecho fundamental que el hospital está hecho para un enfermo que necesita la mejor atención de la ciencia médica pero también mucha simpatía humana.
Oscar C. Croxatto (1911-1920)
En: Aspectos de la asistencia hospitalaria – Humanizar al hospital (Editorial). Medicina (B Aires) 1963; 23: 225-6
