NORBERTO W. ZWIRNER 1, 2, MERCEDES B. FUERTES 1, CAROLINA I. DOMAICA 1
1Laboratorio de Fisiopatología de la Inmunidad Innata, Instituto de Biología y Medicina Experimental (IBYME-CONICET), 2 Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina
Resumen En tiempos recientes, nuestra comprensión del rol del sistema inmune en diferentes situaciones fisiopatológicas ha aumentado notablemente. En el compartimiento linfoide se ha descubierto un conjunto de células denominadas células linfoides innatas o innate lymphoid cells (ILC). Las ILC incluyen cinco grupos, clasificados según su similitud fenotípica y funcional con diferentes subpoblaciones de linfocitos T. A diferencia de los linfocitos T y B, las ILC no expresan receptores de antígeno ni sufren selección y expansión clonal cuando se activan. En cambio, responden rápidamente frente a citoquinas y señales de peligro en tejidos infectados o inflamados produciendo citoquinas que dirigen la respuesta inmune hacia un tipo adecuado para controlar la noxa original. Además, las ILC establecen un diálogo cruzado con otras células del microambiente que contribuye al mantenimiento y la restauración de la homeostasis tisular. Si bien muchas evidencias acerca de las ILC fueron obtenidas en modelos animales, existen datos sólidos que confirman su existencia en seres humanos y su papel en diversos trastornos inflamatorios. En este artículo, abordamos los nuevos conocimientos acerca de las ILC, y su rol en la homeostasis del sistema inmune y en diversas patologías inflamatorias, con el fin de presentar nuevos actores que regulan la inmunidad y la inmunopatología, lo que repercute en la salud humana.
Palabras clave: inmunidad innata, citoquinas, factores de transcripción, inflamación, homeostasis
Abstract In recent times, our understanding of the role of the immune system in different physiopathological situations has increased markedly. A new set of cells, generically known as innate lymphoid cells (ILC), has been discovered in the lymphoid compartment. Five ILC subsets can be recognized according to phenotypic and functional similarities with different subpopulations of T lymphocytes. Unlike T and B lymphocytes, ILC do not express antigen receptors nor undergo selection and clonal expansion upon activation. Instead, they respond rapidly to cytokines and danger signals in infected or inflamed tissues, producing cytokines that direct the immune response toward a type suitable for controlling the initial insult. In addition, ILC establish a crosstalk with other cells of the microenvironment that contributes to the maintenance and restoration of tissue homeostasis. Although many evidences on ILC were obtained from animal models, solid data confirm their existence in humans and their role in various inflammatory disorders. In this article, we address new knowledge on ILC, particularly on their role in the homeostasis of the immune system and in various inflammatory pathologies, in order to present new actors regulating immunity and immunopathology and affecting human health.
Key words: innate immunity, cytokines, transcription factors, inflammation, homeostasis
Dirección postal: Norberto W. Zwirner, Laboratorio de Fisiopatología de la Inmunidad Innata, Instituto de Biología y Medicina Experimental (IBYME-CONICET), Vuelta de Obligado 2490, 1428 Buenos Aires, Argentina
e-mail: nzwirner@ibyme.conicet.gov.ar
La inflamación aguda es un mecanismo de protección contra agentes infecciosos, pero la inflamación crónica contribuye con la progresión de múltiples procesos patológicos de origen infeccioso y no-infeccioso. Recientemente, se ha caracterizado una nueva familia de células de la inmunidad innata denominadas innate lymphoid cells (ILC) o células linfoides innatas que juegan un papel esencial en la iniciación, regulación y resolución de la inflamación.
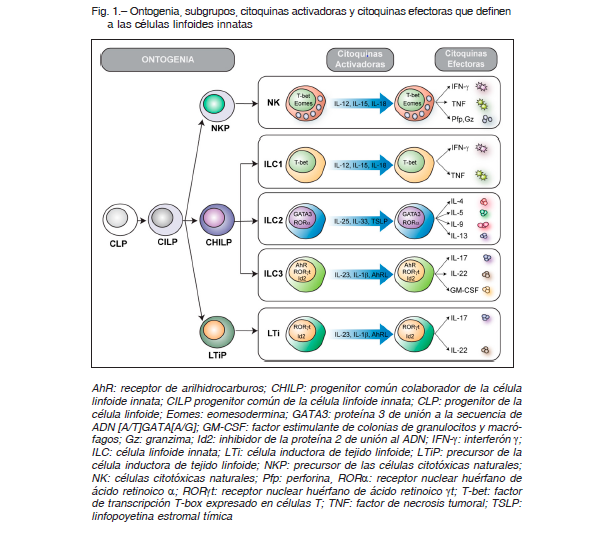
Las ILC carecen de receptor antigénico (a diferencia de los linfocitos T y B), son escasas en tejidos linfoides, pero están enriquecidas en mucosas y piel, sitios donde además contribuyen al mantenimiento y el restablecimiento de la integridad de las barreras epiteliales 1. En su mayoría, las ILC no expresan receptores de reconocimiento de patrones, por lo que no se activan directamente en respuesta a patrones moleculares asociados a patógenos. En cambio, responden a citoquinas, alarminas y mediadores inflamatorios derivados de células mieloides y epiteliales, y producen citoquinas inmunorregulatorias. Las ILC tampoco expresan marcadores de linaje T y B (son CD3-, CD19-, CD20-), células mieloides o granulocitos, y casi todas expresan CD132 (cadena gamma común del receptor de IL-2), CD127 (IL-7Rα), CD25 (cadena α del receptor de IL-2) y CD90 (Thy1). Las citoquinas producidas por las ILC también son capaces de activar células dendríticas mieloides por lo que ejercen efectos sobre la respuesta inmune adaptativa. Si bien en un contexto de infección estas funciones resultan beneficiosas para el huésped, en procesos patológicos las ILC pueden contribuir a potenciar procesos inflamatorios crónicos y daño tisular debido a la producción exacerbada de citoquinas. Recientemente se ha clasificado a las ILC en cinco subgrupos, según similitudes con los perfiles clásicos de expresión de citoquinas y funciones efectoras de los linfocitos T. Estos subgrupos son células NK (natural killer cells o células citotóxicas naturales), ILC1, ILC2, ILC3 y LTi (lymphoid tissue inducer cells o células inductoras de tejidos linfoides) (Fig. 1).
Células NK e ILC1
Ambos tipos se activan en respuesta a citoquinas proinflamatorias tales como IL-12, IL-15 e IL-18, producen interferón (IFN)-γ y factor de necrosis tumoral (TNF) y expresan los receptores activadores NKG2D y NKp46. A diferencia de las células NK, las ILC1 carecen en su mayoría de los receptores activadores e inhibitorios de la familia Ly49 y KIR 2 por lo que el sistema de reconocimiento de “lo propio ausente” (missing self recognition) es exclusivo de las células NK 3. Además, la maquinaria citotóxica de las células NK (expresión de granzimas y perforinas) está ausente de las ILC1, por lo que no son citotóxicas. Por ello, las células NK podrían ser consideradas la contraparte innata de los linfocitos T CD8 y las ILC1 la contraparte innata de los linfocitos CD4 Th1. Además, mientras que las ILC1 son células residentes en tejidos, las células NK mayormente recirculan en la sangre4. Por ello, las ILC tienen propiedades similares a las células T de memoria residentes en tejidos 5.
Ambos tipos celulares se caracterizan por expresar el factor de transcripción T-bet, el que regula muchas de sus funciones efectoras. El factor de transcripción Runx3 (que funciona en la generación de células T CD8) también es necesario para el correcto desarrollo y función de células NK, de ILC1 y de ILC3 pero no de ILC2 6. Sin embargo, solo las células NK expresan el factor de transcripción eomesodermina 2.
ILC2
Las ILC2 se localizan preferentemente en epitelios de intestino, pulmón y piel, y se activan en respuesta a citoquinas tales como IL-33, IL-25 y TSLP 7. Son células no citotóxicas secretoras de citoquinas características del perfil Th2 (IL-4, IL-5, IL-6, IL-9, IL-13 y anfirregulina o Areg), se caracterizan por expresar los factores de transcripción GATA-3 y RORα, y moléculas tales como ICOS, CD25 e IL-1RL1 (el receptor para IL-33) y el receptor de superficie KLRG1 1. Las ILC2 humanas expresan algunos receptores de tipo Toll y responden a la estimulación con los ligandos específicos produciendo IL-5 e IL-13.
Juegan un papel importante durante la respuesta inmune a helmintos intestinales, y en tejido adiposo regulan la homeostasis metabólica y la obesidad, ejerciendo efectos regulatorios sobre los eosinófilos y el desarrollo de macrófagos antiinflamatorios que regulan la sensibilidad a la insulina 8. Las ILC2 también regulan la diferenciación de progenitores de adipocitos hacia grasa blanca o parda, por lo que afectan la homeostasis térmica del organismo 9.
ILC3 y células LTi
Las células LTi se localizan en tejidos embrionarios, donde contribuyen con la organogénesis de ganglios linfáticos y tejidos linfoides asociados a mucosas. Las ILC3 se subdividen en dos poblaciones según la expresión de los receptores de citotoxicidad natural o natural cytotoxicity receptors (NCR) NKp46 o NKp44 10, que se denominan ILC3 NCR+ e ILC3 NCR- y se ubican en tejidos linfoides asociados a mucosas y en la lámina propia. Las ILC3 NCR+ producen IL-22, mientras que las células ILC3 NCR- producen IL-17, lo que indica que son la contraparte innata de las células Th22 y Th17. Las ILC3 y las LTi expresan el factor de transcripción RORγt 1, el que regula la expresión de IL-22, IL-17 y del receptor de arilhidrocarburo, un factor de transcripción que se activa por reconocimiento de ligandos que se encuentran en alimentos, microflora o células propias. Las células ILC3 NCR+ parecen jugar un papel importante en el mantenimiento de la microbiota intestinal y previniendo la colonización por bacterias patógenas, debido a que IL-22 actúa sobre células del epitelio intestinal, estimulando la reposición de enterocitos y la producción de péptidos antimicrobianos y moco. Las ILC3 NCR- productoras de IL-17 participan de la inmunidad contra Candida albicans en mucosa oral pero también pueden ejercer efectos patogénicos en la colitis 1, 3. Además, la IL-17 promueve la producción de péptidos antimicrobianos y el reclutamiento de neutrófilos.
Por lo tanto, el equilibrio en las subpoblaciones de ILC3 es crítico para el mantenimiento de la homeostasis en mucosas. También se ha demostrado que las ILC3 humanas responden a la estimulación con agonistas de receptores de tipo Toll por lo que podrían ser activadas directamente por estímulos microbianos.
Desarrollo de las ILC
Las ILC provienen de un progenitor linfoide común (common lymphoid precursor) y se desarrollan en los sitios hematopoyéticos habituales (hígado fetal, médula ósea). Este progenitor linfoide común se diferencia hacia un precursor común de ILC (common ILC precursor) que da lugar al precursor de células NK (NKP), al precursor de células LTi y al progenitor helper común (common helper ILC progenitor o CHILP), el que finalmente dará lugar a la generación de las ILC1, ILC2 e ILC3 (Fig. 1). Estos precursores de ILC son CD34+CD45RA+CD117+ y expresan los factores de transcripción TOX, Nfil3, TCF1 e Id2 1, 2, 7. Id2 es crítico para generar ILC debido a que su expresión sostenida evita la diferenciación hacia el linaje de los linfocitos T y B. Las ILC1 difieren de las células NK en que expresan CD127 (IL-7Rα) pero ambas expresan CD122 (cadena β del receptor para IL-15 e IL-2), siendo IL-15 necesaria para generar ambos linajes. La generación de ILC2 requiere de los factores de transcripción GATA-3, TCF1, RORα, ETS1 e Id2, del receptor Notch y de las citoquinas IL-25 e IL-33 10, 11. Notch, a través del reconocimiento de ligandos de Notch sobre células estromales de médula ósea, promueve la diferenciación hacia el linaje ILC2. Por su parte, IL-25R e IL-33R confieren la capacidad de sensar y responder a las alarminas IL-25 e IL-33 secretando citoquinas de perfil Th2 (IL-4, IL-5, IL-13)11. Además, el ácido retinoico derivado del metabolismo de la vitamina A es fundamental para la generación de las células LTi, ILC1 e ILC3 pero no ILC2 12, mientras que la expresión del factor de transcripción RORγt es crítica para la generación de ILC3 debido a que controla la expresión de IL-17 e IL-22.
La generación de ILC ocurre desde la vida embrionaria hasta la edad adulta y existe evidencia de que las ILC residentes en tejidos derivan de precursores que migran tempranamente durante la embriogénesis. Ya sea como multipotentes o comprometidas a cada linaje, estas células conservan la capacidad de autorrenovación local a lo largo de la vida del individuo 4.
Esta situación sería similar a la que ocurre con los macrófagos tisulares, los que se desarrollan a partir de células progenitoras del saco vitelino antes de la hematopoyesis definitiva y se autorrenuevan localmente a lo largo de la vida del individuo 13. No obstante, hay evidencias que indican que las ILCs generadas en la edad adulta por hematopoyesis también pueden repoblar diversos tejidos en respuesta a estímulos infecciosos o inflamatorios locales.
Plasticidad y regulación recíproca de las ILC
Se ha demostrado la existencia de plasticidad en las ILC semejante a la observada en linfocitos T CD4. IL-12 e IL-18 pueden promover la conversión de ILC3 en ILC1 productoras de IFN-γ e IL-17 puede prevenir este efecto 11.
IL-1β e IL-23 pueden promover la conversión de ILC1 en ILC3, mientras que IL-33 e IL-1β pueden promover la expresión de T-bet en ILC2 y conferirles la capacidad de producir IFN-γ en respuesta a IL-12. Estas ILC2 reprogramadas pueden conservar la expresión de GATA-3 y la producción de IL-13 (ILC2/1) o perder la expresión de GATA-3 y convertirse en ILC1 francas11. Además, las ILC1 son capaces de convertirse en células NK si se induce la expresión de eomesodermina 14.
También existe una regulación recíproca entre diferentes ILC de manera análoga a lo que ocurre entre subpoblaciones de linfocitos T CD4 efectores. Las ILC2 son inhibidas por IFN-γ y por IL-27, citoquinas que promueven la inmunidad de tipo 1, mientras que IL-25 y TSLP (que promueven la generación de ILC2) pueden suprimir la secreción de IL-22 por ILC3.
ILC en homeostasis y en enfermedades
Intestino
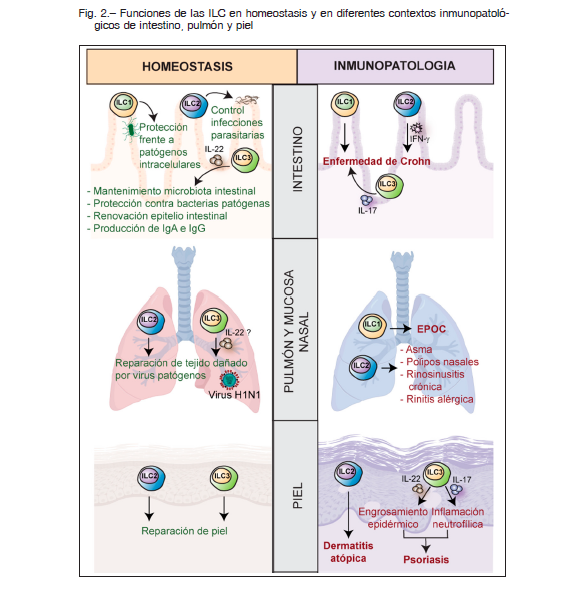
Las ILC2 son detectables en intestino fetal, pero su frecuencia en intestino adulto es muy baja, mientras que las ILC3 están presentes en intestino fetal y adulto. Asimismo, las ILC1 son apenas detectables en intestino fetal, y su desarrollo requiere del estímulo de la microbiota15. Las ILC más prevalentes en intestino humano son las ILC3 NCR+, productoras de IL-22, lo que contribuye a la contención de bacterias comensales y la renovación de las células epiteliales. Las ILC3 también favorecen la producción de IgA e IgG en mucosa y bazo porque contribuyen con la activación de linfocitos B produciendo citoquinas como BAFF y APRIL, y expresan CD40L16 (Fig. 2).
Las ILC1 en intestino humano se ubican en la lámina propia (LP ILC1, NCR-CD161+CD127+) o como ILC1
intraepiteliales (ieILC1, NCR+CD103+CD127-) y ambas participan de la inmunidad contra patógenos intracelulares que ingresan por mucosa 3.
La composición de las poblaciones de ILC en intestino humano inflamado cambia notablemente (Fig. 2). Las ILC3 productoras de IL-17 aumentan considerablemente en íleon y colon inflamados de pacientes con enfermedad de Crohn y de ratones con colitis experimental, y se cree que esta IL-17 contribuye con la enfermedad. En pacientes con enfermedad de Crohn también existe una acumulación de ILC1 (LP ILC1 e ieILC1)17 y la magnitud de este aumento en el íleon está asociada con la gravedad de la enfermedad 17. También se han descripto la presencia de ILC2 productoras de IFN-γ, lo evidencia la plasticidad de las ILC.
Pulmón
En el tejido pulmonar fetal humano, predominan las ILC3 NCR- productoras de IL-17 pero en el adulto, si bien las ILC3 siguen predominando, la frecuencia de ILC2 aumenta en comparación con la del tejido pulmonar fetal (Fig. 2). Estas ILC2 podrían mediar respuestas perjudiciales ya que la expresión aumentada de genes tales como IL-33 y su receptor, TSLP, IL-4, IL-5 e IL-13 (relacionados a ILC2) están asociados a la susceptibilidad a enfermedades atópicas como asma, dermatitis atópica y rinosinusitis crónica. Lesiones cutáneas o pólipos nasales de pacientes con dermatitis atópica o rinosinusitis crónica, muestran un enriquecimiento en ILC2 activadas 18, mientras que se ha detectado un mayor número de ILC2 en sangre periférica y líquido de lavado broncoalveolar de pacientes con asma19, lo que se correlaciona con una función respiratoria más deficiente20. También se ha observado un aumento de ILC2 en diferentes sitios en pacientes con asma eosinofílica grave sistémica, con rinitis alérgica sensibilizados contra diferentes alergenos o con asma alérgica 19. Se cree que las citoquinas TSLP, IL-4, IL-25 e IL-33 producidas por células epiteliales y eosinófilos estimulan a las ILC2 para producir IL-5 e IL-13, las que activan eosinófilos (abundantes en los pólipos nasales), creando un circuito de retroalimentación positiva para la inflamación crónica de tipo 2 (Fig. 2).
La IL-13 derivada de las ILC2 también afecta la función pulmonar ya que altera la contractilidad de las células del músculo liso de las vías respiratorias, aumenta la producción de moco por células epiteliales, polariza los macrófagos a un fenotipo anti-inflamatorio y aumenta la deposición de colágeno. Sin embargo, las ILC2 no sólo juegan un rol patogénico, sino que también promueven también la reparación del tejido en respuesta a la IL-33 producida después de la infección por el virus de la influenza.
En pacientes con enfermedad pulmonar obstructiva crónica (EPOC) se ha descripto una reducción en el número de ILC2 y un aumento en el número de ILC1 en tejidos pulmonares y sangre, el que sería producto de una reconversión de ILC2 en ILC1 18, 21 y este número se correlaciona con función pulmonar deficiente, enfermedad más grave y susceptibilidad a exacerbaciones agudas de la enfermedad 21 (Fig. 2).
Piel
Las ILCs humanas solo se encuentran en la dermis. En humanos, las ILC2 producen mediadores involucrados en la reparación de la piel, pero las ILC también parecen contribuir a respuestas inmunes desreguladas como las observadas en pacientes con dermatitis atópica y psoriasis.
Las ILC2 están enriquecidas en la piel con dermatitis atópica, afección que se asocia con niveles aumentados de IL-25, IL-33, TSLP y PGD2, todas las cuales promueven la activación de ILC2. Además, el engrosamiento epidérmico característico de la psoriasis se ha atribuido a la producción de IL-22, mientras que la inflamación neutrofílica se debe a la producción de IL-17, ambas citoquinas producidas localmente por ILC3. Concordantemente, se ha observado una acumulación de ILC3 en piel y sangre en pacientes con psoriasis 22 (Fig. 2).
Tumores
Aunque conocemos el papel de las células NK en la inmunidad anti-tumoral, existen pocos datos sobre el papel de las ILC en el rechazo de tumores. En humanos, las ILC3 NCR+ están enriquecidas en tumores de pulmón de células no pequeñas e impactan favorablemente en el curso de la enfermedad 23. En melanoma, se ha observado que las ILC3 NCR+ son estimuladas por IL-12 reconvirtiéndose en productoras de IFN-γ, lo que promueve el rechazo del tumor, mientras que, en un modelo de cáncer colorrectal, se observó que las ILC3 productoras de IL-22 dirigen la formación, la proliferación celular y el crecimiento de tumores inducidos por la inflamación crónica causada por la colitis. En un modelo de tumor mamario, se observó que la generación de células similares a las ILC1 que expresan granzima B es importante para el rechazo de tumores. En cáncer gástrico, un fenotipo predominantemente Th2 se correlaciona con un mal pronóstico. En cáncer hepático, la producción excesiva de IL-22 se asocia a crecimiento tumoral y metástasis, por lo que las ILC3 podrían estar involucradas en este tipo de cáncer. En resumen, existen evidencias preliminares que indican que las ILC tienen un papel dual en la inmunidad anti-tumoral 24. Sin embargo, los mecanismos por los cuales las ILC interactúan con las células malignas aún no se conocen.
Regulación metabólica
Se han descripto efectos perjudiciales mediados por ILC2 en la remodelación de tejidos en el contexto de fibrosis hepática, ya que la IL-13 producida en respuesta a IL-33 induce fibrosis mediada por células estrelladas del hígado 25. Por otra parte, el tejido adiposo blanco muestra enriquecimiento en ILC2, las que parecen prevenir el desarrollo de grasa parda a través de la producción de IL-5 e IL-13 que operan sobre la generación de adipocitos, promueven el reclutamiento y la activación local de eosinófilos y la generación de macrófagos anti-inflamatorios 1.
Por lo tanto, las ILC también participan de procesos relacionados a la regulación de la termogénesis en tejidos adiposos pero su importancia en el síndrome metabólico humano aún no se conoce a fondo.
Conclusiones
El descubrimiento de las ILC ha revelado un sistema inmune innato ancestral que dio lugar a la inmunidad adaptativa. Las células efectoras generadas, sean ILC o linfocitos T efectores, han preservado los mecanismos efectores (producción de citoquinas y respuestas citotóxicas) debido a que expresan un patrón similar de factores de transcripción, lo que les permite eliminar al patógeno y restaurar la homeostasis. La ventaja de las ILC es que traducen rápidamente las señales producidas por tejidos infectados o lesionados en citoquinas que activan y regulan las funciones efectoras innatas y adaptativas locales. Asimismo, las ILC, al igual que los linfocitos, también participan de diversas enfermedades con compromiso inflamatorio. Por otra parte, las ILC, como células residentes en tejidos, ejercen efectos regulatorios en diferentes sitios anatómicos. Por ello, las ILC emergen como potenciales blancos terapéuticos para manipular su actividad en favor de la salud humana.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Klose CSN, Artis D. Innate lymphoid cells as regulators of immunity, inflammation and tissue homeostasis. Nat Immunol 2016; 17: 765-74.
2. Robinette ML, Fuchs A, Cortez VS, et al. Transcriptional programs define molecular characteristics of innate lymphoid cell classes and subsets. Nat Immunol 2015; 16: 306-17.
3. Spits H, Bernink JH, Lanier L. NK cells and type 1 innate lymphoid cells: partners in host defense. Nat Immunol 2016; 17: 758-64.
4. Gasteiger G, Fan X, Dikiy S, Lee SY, Rudensky AY. Tissue residency of innate lymphoid cells in lymphoid and nonlymphoid organs. Science 2015; 350: 981-5.
5. Masopust D, Soerens AG. Tissue-resident T cells and other resident leukocytes. Annu Rev Immunol 2019; 37: 521-46.
6. Ebihara T, Song C, Ryu SH, et al. Runx3 specifies lineage commitment of innate lymphoid cells. Nat Immunol 2015; 16: 1124-33.
7 Kim BS, Wojno EDT, Artis D. Innate lymphoid cells and allergic inflammation. Curr Opin Immunol 2013; 25: 738-44.
8. Molofsky AB, Nussbaum JC, Liang H-E, et al. Innate lymphoid type 2 cells sustain visceral adipose tissue
eosinophils and alternatively activated macrophages. J Exp Med 2013; 210: 535-49.
9. Lee MW, Odegaard JI, Mukundan L, et al. Activated type 2 innate lymphoid cells regulate beige fat biogenesis. Cell 2015; 160: 74-87.
10. Zook EC, Kee BL. Development of innate lymphoid cells. Nat Immunol 2016; 17: 775-82.
11. Lim AI, Verrier T, Vosshenrich CA, Di Santo JP. Developmental options and functional plasticity of innate lymphoid cells. Curr Opin Immunol 2017; 44: 61-8.
12. Kim MH, Taparowsky EJ, Kim CH. Retinoic acid differentially regulates the migration of innate lymphoid cell subsets to the gut. Immunity 2015; 43: 107-19.
13. Hoeffel G, Ginhoux F. Ontogeny of tissue-resident macrophages. Front Immunol 2015; 6: 486.
14. Eomesodermin is sufficient to direct type 1 innate lymphocyte development into the conventional NK lineage. J Immunol 2016; 196: 1449-54.
15. Geremia A, Arancibia-Cárcamo CV. Innate lymphoid cells in intestinal inflammation. Front Immunol 2017; 8: 1296.
16. Tsuji M, Suzuki K, Kitamura H, et al. Requirement for lymphoid tissue-inducer cells in isolated follicle formation and T cell-independent immunoglobulin A generation in the gut. Immunity 2008; 29: 261-71.
17. Bernink JH, Peters CP, Munneke M, et al. Human type 1 innate lymphoid cells accumulate in inflamed mucosal tissues. Nat Immunol 2013; 14: 221-9.
18. Bal SM, Bernink JH, Nagasawa M, et al. IL-1β, IL-4 and IL-12 control the fate of group 2 innate lymphoid cells in human airway inflammation in the lungs. Nat Immunol 2016; 17: 636-45.
19. Smith SG, Chen R, Kjarsgaard M, et al. Increased numbers of activated group 2 innate lymphoid cells in the airways of patients with severe asthma and persistent airway eosinophilia. J Allergy Clin Immunol 2016; 137: 75-86.e8.
20. Christianson CA, Goplen NP, Zafar I, et al. Persistence of asthma requires multiple feedback circuits involving type 2 innate lymphoid cells and IL-33. J Allergy Clin Immunol 2015; 136: 59-68.e14.
21. Silver JS, Kearley J, Copenhaver AM, et al. Inflammatory triggers associated with exacerbations of COPD orchestrate plasticity of group 2 innate lymphoid cells in the lungs. Nat Immunol 2016; 17: 626-35.
22. Teunissen MBM, Munneke JM, Bernink JH, et al. Composition of innate lymphoid cell subsets in the human skin: enrichment of NCR(+) ILC3 in lesional skin and blood of psoriasis patients. J Invest Dermatol 2014; 134: 2351-60.
23. Carrega P, Loiacono F, Di Carlo E, et al. NCR(+)ILC3 concentrate in human lung cancer and associate with intratumoral lymphoid structures. Nat Commun 2015; 6: 8280.
24. Crinier A, Vivier E, Bléry M. Helper-like innate lymphoid cells and cancer immunotherapy. Semin Immunol 2019; in press.
25. McHedlidze T, Waldner M, Zopf S, et al. Interleukin-33-dependent innate lymphoid cells mediate hepatic fibrosis. Immunity 2013; 39: 357-71.
