PATRICIO CHREM MENDEZ 1, EZEQUIEL SURACE 2, YANINA BÉRGAMO 3, ISMAEL CALANDRI 1, SILVIA VAZQUEZ 3, GUSTAVO SEVLEVER 2, 4, RICARDO F. ALLEGRI 1, 5
1 Centro de Memoria y Envejecimiento, 2 Laboratorio de Biología Molecular, 3 Centro de Imágenes Moleculares (CIM), 4 Banco de Cerebro, Instituto de Investigaciones Neurológicas, FLENI, Buenos Aires, Argentina, 5 Departamento de Neurociencias, Universidad de la Costa (CUC), Colombia
Resumen La enfermedad de Alzheimer (EA) es uno de los mayores flagelos aún no resueltos que acompañan al aumento de la expectativa de vida. El gran cambio de paradigma en los últimos años fue consecuencia de descubrir que el depósito amiloideo se presenta hasta 20 años antes, y la degeneración neurofibrilar hasta 10 años antes, de que aparezca la sintomatología clínica típica de pérdida de memoria. La aparición de los biomarcadores permitió reestructurar el concepto de la EA, intentándose llegar a una definición molecular de la misma casi prescindiendo de la emblemática clínica. Existen distintos tipos de biomarcadores de EA disponibles en nuestro país. Cada uno nos habla de un proceso y un momento distinto de la enfermedad. Aunque su uso clínico aún se encuentra restringido por cuestiones de costos, existen escenarios particulares en donde sí se justifica, casi siempre en relación a presentaciones clínicas atípicas o de comienzo muy temprano. Sin embargo, hoy en día ya nadie discute que son imprescindibles en investigaciones clínicas sobre EA. La incorporación de biomarcadores en la práctica médica ha generado cambios significativos en la intervención terapéutica de los pacientes, incluso en un contexto en el que todavía no hay medicamentos modificadores de la enfermedad.
Palabras clave: enfermedad de Alzheimer, biomarcadores, etapas preclínicas, neuroimagen, técnicas de diagnóstico molecular
Abstract Alzheimer disease (AD) is one of the leading unresolved health burdens accompanying the increase in life expectancy. The great paradigm shift for this disease has resulte d from finding amyloid deposition and neurobrillary degeneration 20 years and 10 years, respectively, prior to onset of the typical clinical memory loss symptoms. The advent of AD biomarkers has enabled a molecular definition of AD, making the clinical definition almost dispensable. Various types of AD biomarkers are available in our country. Each biomarker reflects a particular process and stage of the disease. Although costs restrict their use, the biomarker analysis may be justified in certain clinical scenarios, such as an early onset or an atypical presentation of the disease. Today, the usefulness of biomarkers in AD clinical research is beyond question. Furthermore, the introduction of biomarkers into medical practice has led to significant changes in therapeutic interventions, even in the absence of disease-modifying drugs.
Key words: Alzheimer disease, biomarkers, preclinical, neuroimaging, molecular diagnostic techniques
Dirección postal: Patricio Chrem Mendez, Centro de Memoria y Envejecimiento, Instituto de Investigaciones Neurológicas, FLENI, Montañeses 2325, 1428 Buenos Aires, Argentina
e-mail: pchremmendez@fleni.org.ar
La enfermedad de Alzheimer (EA) es uno de los mayores flagelos aún no resueltos que acompañan al aumento de la expectativa de vida y se ha convertido en uno de los problemas principales de la Salud Pública 1. Uno de cada dos sujetos de más de 80 años la padece con el correspondiente efecto familiar, económico y social 2.
Uno de los principales mecanismos fisiopatológicos de la EA involucra el aumento de especies del péptido Aβ, con eventual depósito amiloideo extracelular, y posterior degeneración neurofibrilar por la hiperfosforilación de la proteína tau intraneuronal. En 2012, Bateman y col. 3 demostraron que el depósito amiloideo ocurre 20 años y la degeneración neurofibrilar 10 años antes de que aparezca la sintomatología clínica. Es así que, a partir de estos hallazgos, las etapas de la enfermedad han sido divididas en: 1) presintomática, 2) deterioro cognitivo leve y 3) demencia. El período presintomático se ha convertido en el gran objetivo de las investigaciones sobre la fisiopatología, el tratamiento y la prevención de la EA.
Así, hasta la aparición de los biomarcadores, el diagnóstico clínico (criterios NINCDS-ADRDA) se limitaba a EA probable o EA posible dado que el diagnóstico de certeza era solo posible mediante análisis anatomopatológico post-mortem 4.Los biomarcadores son definidos como parámetros que permiten evaluar en un sujeto vivo alguna característica de la fisiopatología de la enfermedad. Los biomarcadores actuales de EA se realizan a través del estudio 1) de las proteínas Aβ1-42, tau total y tau fosforilada en el líquido cefalorraquídeo (LCR), y 2) en las neuroimágenes estructurales como la RNM de cerebro y el estudio volumétrico del hipocampo, 3) en las neuroimágenes funcionales, como el estudio metabólico a través del PET con FDG (fluorodesoxiglucosa) y las neuroimágenes marcadoras de proteínas, como el PET con marcación amiloidea o de tau.
En base a la aparición de estos biomarcadores de EA el National Institute of Aging and Alzheimer’s Association NIA-AA) de los EE. UU. realiza una revisión de los criterios diagnósticos vigentes 5-8. Allí aparecen dos aspectos de relevancia que permiten: 1) la formalización de los diferentes estadios de la enfermedad, incluyendo el estadio de deterioro cognitivo leve, asegurando de esta manera una mayor sensibilidad y especificidad para la detección de la enfermedad en estadios más tempranos, y 2) la inclusión de los biomarcadores como un requisito indispensable para brindar diferentes niveles de certeza indicativos de un proceso neuropatológico subyacente de EA.
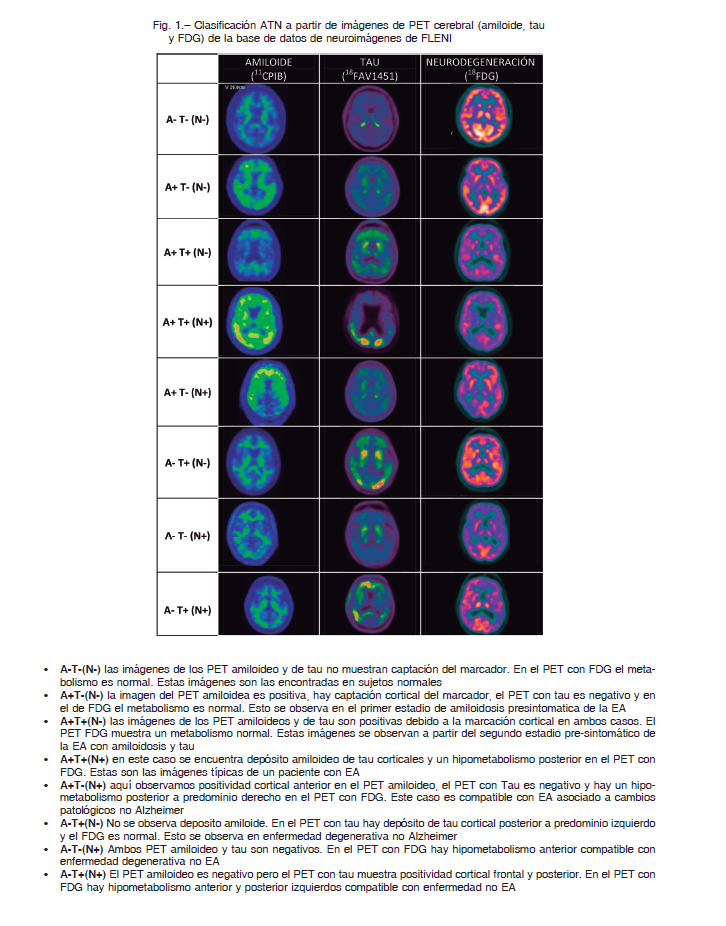
En 2018 se publicó una nueva clasificación biológica 9 en base a los biomarcadores de la enfermedad llamada A/T/N (Amiloide/Tau/ Neurodegeneración). En la misma, los biomarcadores de enfermedad amiloidea (A) son Aβ1-42 en LCR y/o marcación amiloidea en PET (PIB o compuestos fluorados); los biomarcadores de tau (T) son tau fosforilada en LCR y marcación de tau en PET; y los biomarcadores de neurodegeneración (N) son tau total en LCR, volumetría hipocámpica por RMN, PET con fluorodesoxiglucosa. Esta clasificación permite una descripción fisiopatológica y una predicción más clara de la evolución de los pacientes 9.
La inclusión de los biomarcadores en el diagnóstico de la EA tiene un significativo efecto en el diagnóstico, terapéutico y pronóstico, ya que promueve el acercamiento a etapas más tempranas de la enfermedad en individuos con síntomas incipientes de EA sin demencia (EA prodrómica) y aun en la etapa presintomática de la enfermedad.
En el último tiempo, con la posibilidad de tratamientos farmacológicos en las etapas muy tempranas de la enfermedad, el gran desafío es encontrar biomarcadores más sencillos. Esperamos que en un futuro no muy lejano el valor de su aplicación potencial se extienda a todos los ámbitos clínicos donde dichos marcadores estén disponibles.
Biomarcadores de enfermedad de Alzheimer en fluidos
El estudio de los procesos fisiopatológicos involucrados en la EA ha permitido el desarrollo de distintos tipos de biomarcadores en fluidos. El LCR se ha ubicado como la primera fuente viable de biomarcadores dado su íntimo contacto con el espacio extracelular cerebral. Sin embargo, la característica invasiva de la punción lumbar, la aceptación limitada por parte de los pacientes y la dificultad de poder contar con muestras seriadas, está impulsando el desarrollo y la validación de biomarcadores en sangre 10.
Actualmente, existen tres biomarcadores centrales para EA en LCR incluidos en varias guías y recomendaciones de investigación, a saber: beta-amiloide 42 (Aβ1-42), tau total (t-tau), y tau fosforilada en treonina 181 (p-tau). Se reconoce que la alteración de los niveles de estos biomarcadores en LCR es una evidencia diagnóstica de enfermedad cerebral subyacente compatible con EA 8. Asimismo, se ha informado que estas moléculas también podrían tener un valor pronóstico de progresión de la enfermedad tanto en individuos cognitivamente normales8 como en personas con deterioro cognitivo leve 6. Por su parte, los niveles de Aβ1-42 por sí solos tienen el potencial de diferenciar casos de EA de demencia frontotemporal.
Además de los biomarcadores mencionados, los últimos años han visto el surgimiento de biomarcadores que evidencian aspectos fisiopatológicos, como la disfunción vascular, la integridad neuronal y sináptica, la neuroinflamación, entre otros. En este sentido, se ha demostrado que el neurofilamento de cadena liviana (NfL), un filamento intermedio del citoesqueleto neuronal abundante en axones, es un marcador de daño neuronal, ya que sus niveles tanto en LCR como en sangre aumentan en diferentes enfermedades neurodegenerativas 11-14. Si bien no es un biomarcador específico de EA, la medición de NfL en sangre podría servir como método de tamizaje: aquellos individuos con NfL elevada serían candidatos para proceder con la evaluación de otros biomarcadores específicos de EA como Aβ1-42, t-tau o p-tau en LCR o PET-PiB. Otros biomarcadores como neurogranina (marcador de disfunción sináptica) o marcadores inflamatorios como TREM2 e YKL-40 necesitan ser validados con mayor exhaustividad antes de ser incorporados a un panel de biomarcadores de EA 12.
Junto con su uso en el diagnóstico clínico, los biomarcadores podrían ser próximamente herramientas indispensables en el desarrollo de terapias farmacológicas para EA. El rol de los mismos en ensayos clínicos incluye: clasificar correctamente los participantes según la enfermedad subyacente, ofrecer una categorización cuantitativa de la enfermedad, permitir evaluar el efecto de agentes terapéuticos en tiempos más cortos 13. Un paso previo básico para la implementación de nuevos biomarcadores consiste en su validación en distintas poblaciones y en la elección del contexto en el cual utilizarlos: tamizaje, diagnóstico, monitoreo de terapias, entre otros 15.
Biomarcadores de enfermedad de Alzheimer en neuroimágenes
Las imágenes morfológicas − resonancia magnética (RM) y tomografía computarizada (TC) −y las moleculares− tomografía por emisión de positrones (PET) y tomografía por emisión de fotón único (SPECT) −cumplen un papel importante en el diagnóstico precoz y el seguimiento evolutivo de los síndromes neurodegenerativos, in vivo y de manera no invasiva. Con PET pueden detectarse el depósito anómalo en el cerebro de las proteínas (Aβ y tau) y también objetivar la disfunción neuronal, medida con el metabolismo de la glucosa (FDG). EL SPECT evalúa la perfusión cerebral, con buen correlato con la alteración metabólica.
Si tomamos EA, la de mayor prevalencia, podemos delinear un perfil neuroimagenológico molecular y estructural.
Como se ha dicho, el depósito cortical y extraneuronal de amiloide, precede hasta 20 años la aparición de los síntomas clínicos, el PET con marcadores de amiloide (11C-PIB, 18F-Flutemetamol, y 18FAV45 entre otros), es una herramienta precoz y sensible; el frontal, parietal, temporal lateral y estriado, bilaterales, son las áreas cerebrales más afectadas. Si bien la detección de amiloide implica mayor riesgo de enfermedad o mayor certeza en el diagnóstico clínico, debe considerarse que hasta un 30% personas cognitivamente normales pueden tener depósito de amiloide.
La proteína tau es intraneuronal y forma parte de los ovillos neurofibrilares, y cuando se halla hiperfosforilada es específica de la enfermedad de Alzheimer. En PET puede ser detectada con distintos trazadores que aún están en desarrollo con resultados variables de sensibilidad y especificidad. En nuestro país se ha probado el flortaucepir (18FAV1451) en la población ADNI-Arg (del inglés Alzheimer Disease Neuroimaging Initiative – Argentina): la mayor concentración fue registrada en el temporal mesial de pacientes clínicamente diagnosticados con EA y seguidos por cinco años. La disfunción neuronal, evaluada con fluordesoxiglucosa (PET con FDG) es un marcador de neurodegeneración, y las áreas hipometabólicas son: temporal, precúneo, cíngulo posterior y parietal, bilaterales. Todos estos cambios pueden aparecer en etapas preclínicas, en la siguiente secuencia temporal: amiloide, tau y disfunción neurona l8. A modo de ejemplo, en la Figura 1 se observa las imágenes de PET cerebral características de la clasificación ATN.
La resonancia magnética (RM) cerebral estructural evalúa la disminución del volumen hipocampal, así como la atrofia cortical en áreas específicas (giro parahipocampal, amígdala, giros temporales superior, medio e inferior, lóbulo parietal superior y cíngulo posterior). Estos son también considerados biomarcadores de neurodegeneración, aunque más tardíos que los anteriores y en general en etapas sintomáticas de la enfermedad. Dichos mediciones se realizan mediante diferentes softwares en comparación con distintos atlas digitales que proporcionan datos cuantitativos. Los mismos son accesibles a la mayoría de los centros locales.
La técnica de más reciente incorporación es la RM funcional [resting state (rs-fMR)] en la cual, por medio de la técnica BOLD, se adquieren imágenes en estado de reposo (sin realizar ningún tipo de actividad). Este análisis permite evaluar las “conexiones” entre las diferentes regiones por la correlación de activación neuronal temporal entre distintas áreas corticales. Las regiones de mayor simultaneidad o correlación constituyen redes neuronales estrechamente vinculadas. Hasta ahora la rsfMRI ha demostrado patrones de conectividad diferentes en pacientes con Alzheimer comparados con controles normales, así como también en pacientes con deterioro cognitivo leve, e incluso en estadios preclínicos de la enfermedad 16.
Se debe pensar en una suma de eventos secuenciales y concurrentes espacial y temporalmente: la presencia de Aβ42, Tau fosforilada, la volumetría, las áreas hipometabólicas, la conectividad alterada. Estas herramientas de imágenes proporcionan información en distintos “momentos o etapas” dentro del proceso de EA, abriendo la posibilidad de distintos márgenes para una eventual intervención.
Utilidad clínica de los biomarcadores en enfermedad de Alzheimer
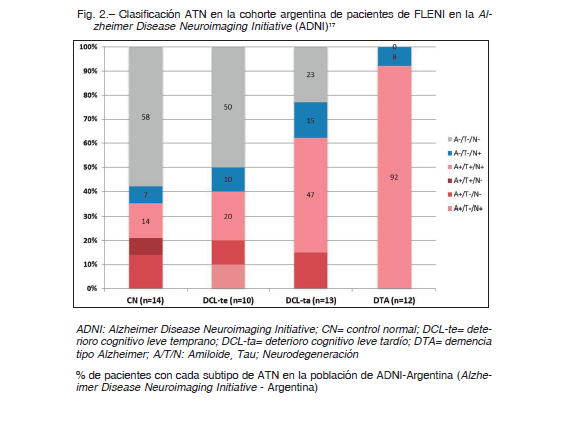
De lo expuesto, hasta ahora se podría decir que los biomarcadores han mejorado la capacidad diagnóstica de la EA, incluso a expensas de la clínica. Y nos han mostrado que el proceso de la enfermedad puede ser más largo en su etapa preclínica que cuando comienzan los síntomas 3, 8, 9, 13, 15. A modo de ejemplo en la Figura 2 se observan los resultados de la clasificación A/T/N en nuestra cohorte ADNI-Arg (controles normales, n = 14; pacientes con deterioro cognitivo leve temprano, n = 10; pacientes con deterioro cognitivo leve tardío, n = 13, y pacientes con demencia tipo Alzheimer, n = 12) 17.
En la actualidad, no existe discusión en cuanto a su utilidad en ensayos clínicos y estudios de investigación.
Sin embargo, se debe tener en cuenta que hay numerosas limitaciones a la hora de pretender incorporarlos en la rutina de la práctica clínica, sobre todo en países en desarrollo como los de Latinoamérica. Ya sea por los costos, la limitada validación y experiencia y un escaso acceso clínico en la mayoría de las regiones (en un relevamiento en Latinoamérica ya se los encuentra en uso en Argentina, Brasil, Colombia, Chile, México y Uruguay, entre otros18). Además, en un contexto en donde no existen aún drogas modificadoras de enfermedad, ¿qué sentido tendría utilizarlos? Varias publicaciones recomiendan su uso en situaciones específicas19. En general concuerdan en que todos aquellos casos de inicio temprano de EA (por debajo de 65 años), así como las presentaciones atípicas de EA, que también suelen comenzar antes de los 65 años, se podrían beneficiar del uso de biomarcadores, por los siguientes motivos: en general los pacientes tienen menos anosognosia y mayor inquietud en cuanto a su diagnóstico; se encuentran aún en etapas productivas de la vida y el diagnóstico les permitiría tomar decisiones de vida; a esa edad se debe hacer diagnóstico diferencial con otras enfermedades diametralmente opuestas; por ultimo, el diagnóstico puede tener implicancias genéticas para el resto de la familia (por ejemplo, EA hereditaria autosómica dominante). Se podría agregar grupos de pacientes en los que se sospecha EA pero tienen comorbilidad psiquiátrica pre-mórbida, lo cual dificulta enormemente el diagnóstico.
Si bien existen síndromes clínicos que concuerdan ampliamente con el hallazgo de amiloide (alta probabilidad pretest, por ejemplo, atrofia cortical posterior), en otros sucede lo contrario (baja probabilidad pretest) y de allí su uso 19. Recientemente, han sido publicados los hallazgos del protocolo IDEAS 20, realizado en centros de EE.UU. sobre 18 000 estudios con el objetivo de establecer cuál sería la utilidad clínica del uso de PET con marcador amiloide. En síntesis, el estudio ha demostrado que hasta 60% de los médicos había cambiado su tratamiento luego de conocer el resultado del mismo. Esto demuestra que ante la incertidumbre diagnóstica de EA, el hallazgo de biomarcadores tiene un gran efecto en la práctica diaria.
Discusión
La EA era definida, desde la propia descripción de Alois Alzheimer, sobre base neuropatológica en material de autopsia. El diagnóstico se basaba en la presencia, densidad y distribución de dos lesiones características: la placa amiloide de ubicación extracelular y la degeneración neurofibrilar intraneuronal. Estos criterios fueron refinados y cuantificados, con la intención de incorporar al modelo las otras lesiones que suelen coexistir en el cerebro anciano y que afectan la cognición. La aparición de los biomarcadores como agentes esenciales que informan in vivo acerca de estos depósitos ha cambiado el diagnóstico de la neurodegeneración. Sin embargo, como siempre ocurre en la biomedicina, los avances tecnológicos llevan implícito un cambio conceptual, probablemente de mayor importancia. En el caso de la EA, han llevado a la propia definición de la enfermedad, separándola de la demencia como hecho clínico, la cual puede ocurrir en el transcurso de distintas enfermedades, a veces concurrentes. La posibilidad de la detección de β-amiloide, tau y P-tau por los distintos métodos mencionados más arriba determinan hoy el diagnóstico. No sabemos si estas proteínas anómalas son la causa de la enfermedad, pero son las que la definen. Estos depósitos proteicos caracterizan la EA como un trastorno neurodegenerativo único y específico, desagregándolo de otras condiciones que pueden causar demencia. Esta segregación es esencial ya que permite analizar la secuencia temporal de los fenómenos que ocurren antes del efecto clínico cognitivo, en un espectro que incluye sujetos intactos con aproximaciones terapéuticas potenciales. Es posible imaginar que, en un tiempo cercano, las determinaciones de biomarcadores tengan consecuencias taxonómicas y en conceptos adicionales, relacionando la nosología con el trastorno molecular subyacente, el que, por otra parte, es el blanco potencial de las terapias dirigidas.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. World Health Organization and Alzheimer’s Disease International. Dementia: a public health priority. En: https://www.who.int/mental_health/publications/dementia_report_2012/en/; consultado marzo 2019.
2. Allegri RF, Vazquez S, Sevlever G. Enfermedad de Alzheimer: Nuevos paradigmas, 2da. ed. Buenos Aires:
Editorial Polemos, 2018.
3. Bateman RJ, Xiong C, Benzinger TL, et al. Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. N Engl J Med 2012; 367: 795-804.
4. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34: 939-44.
5. Jack CR Jr, Albert MS, Knopman DS, et al. Introduction to the recommendations from the National Institute on Aging – Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7: 257-62.
6. Albert MS, DeKosky ST, Dickson D, et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7: 270-9.
7. McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7: 263-9.
8. Sperling RA, Aisen PS, Beckett LA, et al. Toward defining the preclinical stages of Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011; 7: 280-92.
9. Jack CR Jr, Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement 2018; 14: 535-62.
10. Hansson O, Zetterberg H, Buchhave P, Londos E, Blennow K, Minthon L. Association between CSF biomarkers and incipient Alzheimer’s disease in patients with mild cognitive impairment: a follow-up study. Lancet Neurol 2006; 5: 228-34.
11. Niikado M, Chrem-Méndez P, Itzcovich T, et al. Evaluation of cerebrospinal fluid neurofilament light chain as a routine biomarker in a memory clinic. J Gerontol A Biol Sci Med Sci 2019; 74: 442-5.
12. Hampel H, O’Bryant SE, Molinuevo JL, et al. Blood-based biomarkers for Alzheimer disease: mapping the road to the clinic. Nat Rev Neurol 2018; 14: 639-52.
13. Hampel H, Vergallo A, Perry G, Lista S. The Alzheimer Precision Medicine Initiative. Alzheimer Precision Medicine Initiative (APMI). J Alzheimers Dis 2019; 68: 1-24.
14. Preische O, Schultz SA, Apel A, et al. Serum neurofilament dynamics predicts neurodegeneration and clinical progression in presymptomatic Alzheimer’s disease. Nat Med 2019; 25: 277-83.
15. Veitcha DP, Weiner MW, Aiseng PS, et al. Understanding disease progression and improving Alzheimer’s disease clinical trials: Recent highlights from the Alzheimer’s Disease Neuroimaging Initiative. Alzheimers Dement 2019; 15: 106-52.
16. Buckner RL, Andrews-Hanna JR, Schacter DL. The brain´s default network: anatomy, function, and relevance to disease. Ann NY Acad Sci 2008; 1124: 1-38.
17. Allegri RF, Pertierra L, Cohen G, et al. A biological classification for Alzheimer’s disease – Amyloid, Tau and Neurodegeneration (A/T/N): results from the Argentine-Alzheimer’s Disease Neuroimaging Initiative. Int Psychogeriatr 2019; 12: 1-2.
18. Parra MA, Baez S, Allegri R, et al. Dementia in Latin America: Assessing the present and envisioning the future. Neurology 2018; 90: 222-31.
19. Chrem Méndez P, Cohen G, Russo MJ, et al. Concordance between 11C-PIB-PET and clinical diagnosis in
a memory clinic. Am J Alzheimers Dis Other Demen 2015; 30: 599-606.
20. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA 2019; 321: 1286-94.
