EDITH GRYNSZPANCHOLC 1, VIRGINIA PINTO 1, ANDREA AYOROA 1, LETICIA GARCÍA 1, ARNALDO ARMESTO 2, GRACIELA DRAN 3
1 Fundación Natali Dafne Flexer, Argentina, 2 Instituto de Farmacología, Facultad de Medicina, Universidad de Buenos Aires, 3 Departamento Bioética, Facultad Latinoamericana de Ciencias Sociales FLACSO- CONICET, Buenos Aires, Argentina
Resumen En Argentina, la mortalidad por cáncer infantil es mayor que en países más desarrollados, siendo el diagnóstico tardío una de las posibles causas. Nuestro objetivo fue determinar la frecuencia de obstáculos al diagnóstico enfrentados por las familias de niños con cáncer asistidas por un Organismo No Gubernamental, y algunos factores demográficos, institucionales y médicos asociados. Se realizó un análisis retrospectivo observacional y cuantitativo del recorrido diagnóstico de los niños con cáncer asistidos por la Fundación N.D. Flexer, Argentina, entre el 1/1/2011 y el 31/12/2015. El resultado primario fue la presencia de obstáculos para acceder al diagnóstico. Se consideró que existió un obstáculo cuando tuvieron lugar consultas no orientativas, demora familiar, demora institucional, autoderivación y/o más de 30 días entre la aparición de síntomas y el diagnóstico. La frecuencia dentro de cada categoría se contrastó mediante la prueba de χ2. La influencia de distintas variables se evaluó mediante una regresión logística multivariada. De 1818 familias incluidas, 63.5% enfrentaron algún tipo de obstáculos. Resultaron moduladores negativos el diagnóstico antes del año, de tumor renal y la concurrencia a un hospital público de la Ciudad de Buenos Aires o de capital provincial como centro de primer contacto (todos p < 0.0001). Resultaron moduladores positivos el diagnóstico de tumor óseo (p = 0.009) y los centros de atención primaria (p < 0.0001) y consultorios particulares (p = 0.001) como centros de primer contacto. El principal factor no biológico asociado a la frecuencia de obstáculos al diagnóstico de cáncer infantil fue el tipo de centro de primer contacto.
Palabras clave: cáncer infantil, diagnóstico temprano, barreras de acceso, demora diagnóstica, oportunidad diagnóstica perdida
Abstract In Argentina, mortality from childhood cancer is higher than in more developed countries, with late diagnosis being one of the possible causes. Our objective was to determine the frequency of barriers to diagnosis faced by families assisted by a Non-Governmental Organization, and some associated demographic, institutional and medical factors. A retrospective observational and quantitative analysis of the diagnosis pathway of children with cancer assisted by the N.D. Flexer Foundation, Argentina, between 1/1/2011 and 12/31/2015 was carried out. The primary outcome was the presence of barriers to diagnosis. It was considered that there was a barrier when there were consultations without diagnostic suspicion, family delay, institutional delay, self-derivation and/or more than 30 days between the onset of symptoms and diagnosis. The frequency of barriers within each category was contrasted by the χ2 test. A multivariate logistic regression was used to examine its association with relevant variables. Among the 1818 families included, 63.5% faced delays/ barriers to diagnosis. Negative modulators were diagnosis at age younger than 1-year, renal tumor and first attention at a public hospital of the City of Buenos Aires or a provincial capital hospital (all p < 0.0001). Positive modulators were the diagnosis of bone tumor (p = 0.009) and first attention at a primary healthcare center (p< 0.0001) or private doctor’s office (p= 0.001). The main non-biological factor associated with the possibility of facing barriers to diagnosis was the type of first contact-health institution.
Key words: childhood cancer, early diagnosis, access barriers, diagnostic delays, missed opportunities
Dirección postal: Graciela I. Dran, Gaspar Campos 558, 1638 Vicente López, Buenos Aires, Argentina
e-mail: gcolodran@gmail.com
El cáncer es la primera causa de muerte por enfermedad en niños. En Argentina la tasa de incidencia en menores de 15 años es aproximadamente 130 casos anuales/ millón de niños 1, encontrándose dentro de las cifras referidas por la Organización Mundial de la Salud 2. La relación mortalidad/ incidencia (35.3 entre los años 2000 y 2008), en cambio, es mayor que aquella en países más desarrollados 3. Dado que los protocolos de tratamiento actuales y sus resultados son equiparables, las diferencias podrían atribuirse a condiciones sociales desfavorables, deficiencias del sistema de salud y/o a demoras en el diagnóstico (DX), entre otros factores 2-4.
Antes de arribar al tratamiento, el niño con cáncer y su familia atraviesan distintas etapas, desde las primeras consultas ante la aparición de signos y síntomas, la sospecha de cáncer y la confirmación diagnóstica, que en conjunto, conforman el “recorrido diagnóstico”. En cada una, pueden presentarse obstáculos o dilaciones innecesarias. A partir de una revisión de los estudios sobre demoras diagnósticas en cáncer infantil, Dang-Tan y col. las clasificaron en tres categorías 5: aquellas relacionadas con el paciente y su familia, que dependen de la situación demográfica, económica y cultural; las relacionadas con el sistema de asistencia sanitaria, que incluyen la disponibilidad de recursos médicos, institucionales, coberturas de salud, etc., y aquellas dependientes de la enfermedad, es decir, del tipo del cáncer, su localización, estadio y presentación de síntomas. En Argentina no existen hasta la fecha estudios que analicen específicamente las demoras diagnósticas en cáncer infantil.
Una barrera es toda aquella situación que dificulta el acceso en tiempo y forma a los cuidados y recursos, generando un desvío de la atención ideal 6. A la hora de analizar las barreras de acceso al diagnóstico (BDX), resulta importante contar con el relato del recorrido DX desde la perspectiva de la familia y del niño, recogido en un contexto con el tiempo y la contención necesarios. La Fundación Natalí Dafne Flexer (FNDF) es un organismo no gubernamental que brinda asistencia integral a niños con cáncer y sus familias desde diferentes disciplinas, a lo largo del transcurso de la enfermedad, DX, tratamiento y luego de él. El acompañamiento estrecho, a menudo, nos permite conocer a fondo las barreras enfrentadas.
El objetivo del presente estudio fue dar cuenta de la frecuencia, características y moduladores de las BDX en los niños asistidos por la FNDF en un lapso de 5 años.
Como resultado secundario, se comparó la población de estudio con aquella de niños con cáncer en el país,
informada por el Registro Oncopediátrico Hospitalario Argentino (ROHA) 1.
Materiales y métodos
Desde su inicio en 1994, la FNDF asistió a más de 10 000 niños y adolescentes con cáncer y enfermedades relacionadas, argentinos y de países limítrofes. Cuenta actualmente con 9 sedes distribuidas en 6 provincias. Proporciona asistencia social, atención psicológica, asesoramiento legal, ayuda con traslados y alojamiento, medicamentos, suplementos nutricionales, equipamiento ortopédico y médico y esparcimiento, entre otros recursos. Los datos recogidos durante las entrevistas de admisión y seguimiento, que incluyen un relato detallado del recorrido DX, características médicas, institucionales y socio-familiares, necesidades, solicitudes e intervenciones realizadas, se asientan en una Base de Gestión informatizada, que fue la fuente de datos primaria. La información adicional referente a instituciones, coberturas de salud y especificaciones médicas, se recabó a partir de informes y referencias de profesionales de los Hospitales Gutiérrez y Garrahan, de la Universidad Isalud y del Instituto Nacional del Cáncer.
Se realizó un estudio observacional retrospectivo y cuantitativo del recorrido DX en la población de niños asistidos por la FNDF entre el 1/1/2011 y el 31/12/2015. Se incluyeron todos los niños que en el periodo de estudio hubieran contactado a la FNDF en cualquier fase de la enfermedad y por cualquiera de los recursos que ella ofrece, cuyo DX y recorrido DX hayan sido registrados y asentados en detalle en la Base de Gestión, con DX de cáncer obtenido en edades entre 0 y 18 años, argentinos o residentes, y que hayan realizado el recorrido DX íntegramente en Argentina.
La variable principal de resultado fue la existencia de barreras de acceso al DX de cáncer o “BDX”. Según la bibliografía existente, se consideró que existió una BDX cuando, entre la aparición de los signos y síntomas más frecuentes en el niño con cáncer y el DX, tuvo lugar al menos una de las siguientes situaciones 5, 7-11. 1) Una o más consultas no orientativas al DX, es decir, aquellas consultas médicas sin evidencias de sospecha o no conducentes al DX de cáncer. Los casos se agruparon según se hayan presentado 1, 2, 3 o más consultas. 2) Demora institucional debida a falta de turnos o equipamiento médico. 3) Demora familiar, es decir, si del relato surge que los síntomas del niño no fueron interpretados como alarmantes por los padres/ cuidadores. 4) La familia se autoderivó para acceder al DX. 5) Transcurrieron más de 30 días.
Se analizaron la frecuencia de BDX y los factores demográficos, médicos e institucionales asociados. Para esto, dos trabajadores sociales entrenados revisaron independientemente el recorrido DX e identificaron aquellos casos donde se presentaron BDX en alguna etapa (grupo BDX). En aquellos casos donde no tuvo lugar ninguna de las situaciones enunciadas, se consideró que no se pudo determinar la existencia de BDX (grupo NBDX).
La cobertura de salud del niño al inicio del recorrido DX se clasificó en 3 categorías: Social [Obra Social (OS) Nacional, OS Provincial y Coberturas Especiales (establecidas por leyes especiales)], Privada y Salud Pública (para aquellos niños que no poseen ningún tipo de cobertura).
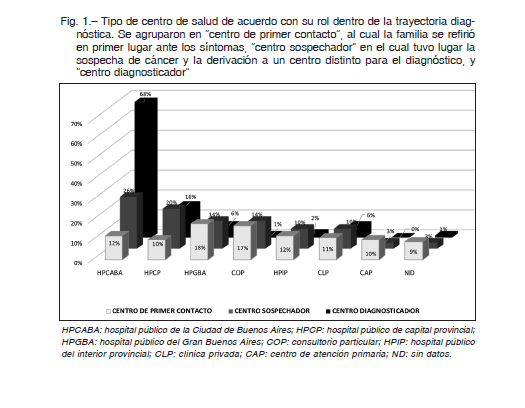
Las instituciones involucradas en el recorrido DX se clasificaron, según el tipo y localización, en Hospitales Públicos de la Ciudad de Buenos Aires (HPCABA), del Gran Buenos Aires (HPGBA), de las capitales provinciales (HPCP) o del interior provincial (HPIP), Centros de Atención Primaria (CAP), clínicas u hospitales privados (CLP) y consultorios particulares (COP). Además, las instituciones se clasificaron según su rol dentro del recorrido DX en “centro de primer contacto”, es decir, la institución médica a la que la familia acudió inicialmente ante los síntomas, “centros sospechador” o donde las consultas resultaron en sospecha de cáncer y derivación a un centro de mayor complejidad, y “centro diagnosticador”. Para cada tipo de institución se calculó el porcentaje de consultas no orientativas y de aquellas que resultaron en sospecha/DX de cáncer.
Los tipos de tumor se agruparon según la Clasificación Internacional de Cáncer Infantil (ICCC-III) 12.
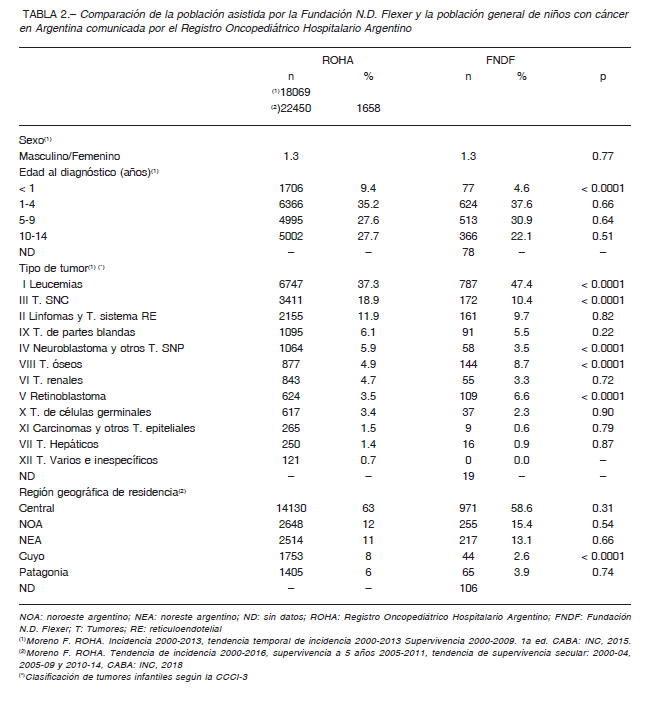
Como variable de resultado secundaria se analizó la similitud entre la población asistida por la FNDF y aquella de niños con cáncer en Argentina. Para esto, se compararon el género, la edad al diagnóstico, la región geográfica de residencia y el tipo de tumor entre la población de estudio y los reportes del ROHA 1, 13. Para equiparar los criterios de selección, se escogieron de la FNDF solo aquellos niños con DX de cáncer obtenido entre 0 y 14 años (1658/1818).
Se realizó la estadística descriptiva para examinar la distribución demográfica de los niños, los tipos de tumor, los centros de atención y las coberturas. Para las variables continuas se calcularos los promedios y desvíos estándar. La proporción de consultas no orientativas dentro de cada tipo de centro, de BDX dentro de cada categoría, y las características de la población de estudio y los datos del ROHA, se contrastaron mediante la prueba de χ2. La influencia de las variables de interés sobre la probabilidad de enfrentar BDX se analizó a través de una regresión logística multivariada, donde BDX fue la variable dependiente y las variables relevantes se seleccionaron por el método hacia atrás de razón de verosimilitudes. La fuerza de la asociación se expresó mediante el Odds Ratio (OR) con un intervalo de confianza del 95% (IC 95%). Las diferencias menores de 0.05 se consideraron estadísticamente significativas. Para el análisis se utilizó una combinación de software estadísticos (SPSS versión 15 y GraphPad Prisma 5).
Este estudio fue aprobado por el Comité de Ética en Investigación del Hospital Alemán (CE00054, 15 de diciembre 2015), y registrado en el Registro Nacional de Investigaciones en Salud (RENIS) N° IS001638.
Resultados
En el período de estudio, la FNDF asistió a 3013 niños y adolescentes y a sus familias. De ellos, 10.5% (316) no tenían DX, o bien el relato DX era incompleto. El 20.2% (610) no presentaban cáncer sino enfermedades relacionadas u otras patologías (anemia de Fanconi, neurofibromatosis, púrpura, anemias, aplasia medular, talasemia y otras), 4.9% (148) eran extranjeros no residentes, 1.2% (35) no habían realizado su recorrido DX íntegramente en Argentina y 2.8% (86) fueron diagnosticados luego de los 18 años. Se incluyeron para su análisis 1818 niños (60.3%) que cumplieron con los criterios de inclusión.
Al DX, 56% de los niños (1015) se encontraban cubiertos por Salud Pública, 37% (681) por Cobertura Social
(21% OS Nacional, 7% OS Provincial y 9% por coberturas especiales) y 5% (82) por cobertura privada; del restante 2% no se obtuvieron datos.
Todos los tipos de centros incluidos intervinieron como centro de primer contacto, siendo los más frecuentes, los hospitales públicos del Gran Buenos Aires –HPGBA– y consultorios particulares –COP–. La mayor parte de las sospechas y los DX se llevaron a cabo en un hospital público de la Ciudad de Buenos Aires –HPCABA– y, en segundo lugar, en uno de capital provincial –HPCP– (Fig. 1). El 98% de los DX realizados en un HPCABA tuvieron lugar, en orden decreciente, en los hospitales pediátricos Garrahan, Gutiérrez y Elizalde; 65% de los realizados en los HPCP ocurrieron en centros pediátricos de las provincias de Tucumán, Corrientes y Salta, y 84% de los realizados en un HPGBA tuvieron lugar en el Hospital Nacional Posadas.
En 63.5% de los casos (1154) se presentaron una o más de las 5 situaciones establecidas a priori como indicativas de BDX (Grupo BDX). De manera no excluyente, en 93% (1071) se verificaron consultas no orientativas al DX (1: 47%, 2: 24%; 3: 15%; 4 o más: 7%. Promedio por paciente: 2.1 ± 1; rango 1-11), en 5% (58) demora institucional, en 2.4% (28), demora familiar y 5.3% de las familias (61) se autoderivaron para acceder al DX. En el 66% de la población total (1199/1818), no se contó con una fecha clara de inicio de síntomas, o bien no figuraba la fecha del DX, por lo que no se pudo establecer la demora entre ambos eventos. Entre los 619 casos restantes, 15% (279) tuvo demora > 30 días, por lo que fueron incluidos en el grupo BDX, representando dentro de este, el 24%.
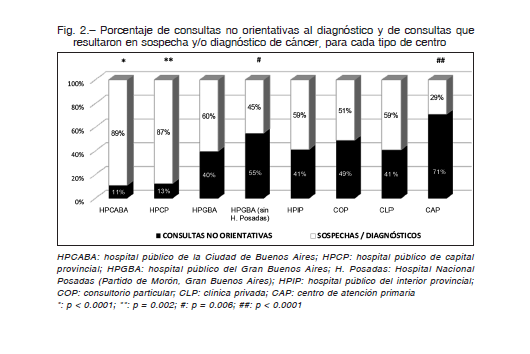
La proporción de consultas no orientativas fue significativamente mayor en los CAP (p < 0.0001) y menor en los HPCABA (p < 0.0001) y HPCP (p = 0.002) que en el resto de los tipos de centros. Dado que dentro del 40% de consultas no orientativas que tuvieron lugar en un HPGBA, solo 3% ocurrieron en el Hospital Nacional Posadas, se recalcularon los valores del grupo HPGBA sin considerar a este hospital, y en este caso, la proporción (55%) adquirió significancia estadística (p = 0.006) (Fig. 2).
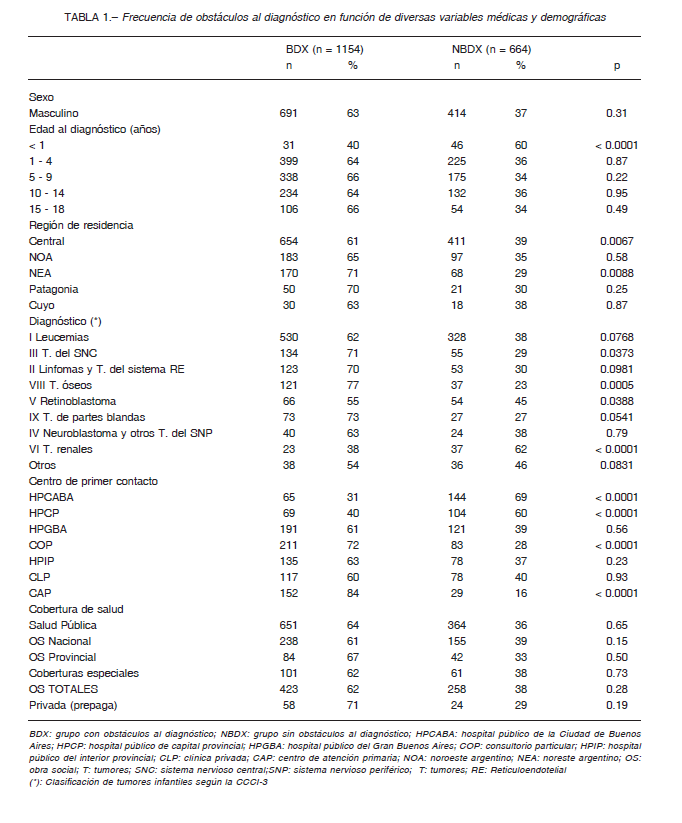
La frecuencia de BDX en función de los diferentes factores demográficos y médicos se muestra en la Tabla 1. Esta no varió con el sexo ni con la cobertura de salud. Los niños con diagnóstico antes del año, tumor renal, o que acudieron como centro de primer contacto a un HPCABA o HPCP, presentaron menor proporción de BDX. Aquellos residentes en la Región Central o NEA, con tumores del sistema nervioso central (SNC), óseos o retinoblastoma, y quienes acudieron a un CAP o COP como centro de primer contacto, enfrentaron BDX más frecuentemente. En un modelo multivariado, las siguientes covariables resultaron moduladores negativos de la posibilidad de enfrentar BDX (OR; IC 95%): diagnóstico antes del año (0.52; 0.11- 0.79), tumor renal (0.23; 0.00-0.56) y la concurrencia a un HPCABA (0.29; 0.08-0.66) o HPCP (0.34; 0.22-0.68) como centro de primer contacto (todos p < 0.0001). Resultaron moduladores positivos el diagnóstico de tumor óseo (5.31; 2.10-7.55; p = 0.0088) y los centros de primer contacto CAP (6.69; 3.79-17.22; p < 0.0001) y COP (2.62; 1.23-8.80; p = 0.0012). Se compararon las características de la población asistida por la FNDF con aquellas de la población general de niños con cáncer en el país 1,13 (Tabla 2). Ambas mostraron una distribución semejante en la mayoría de los parámetros, con algunas excepciones. Las leucemias, tumores óseos y retinoblastoma se encontraron más representados en la FNDF que en el país, mientras que los tumores del SNC y neuroblastoma, aquellos niños diagnosticados antes del año, y los residentes en la región de Cuyo se encontraron menos representados.
Discusión
El foco del estudio estuvo puesto en las barreras de acceso al DX (BDX) de cáncer infantil. Se identificaron dentro del recorrido DX, situaciones asociadas previamente con “demoras diagnósticas” 7-11. Según este conjunto de criterios, más del 60% de las familias enfrentaron BDX.
Somos conscientes de que en algunos casos, las BDX pueden reflejar una trayectoria percibida por el familiar como dificultosa, y no necesariamente que los tiempos o las consultas realizadas no fueran justificables. No obstante, tanto los datos numéricos como los relatos sugirieron fuertemente que la sospecha o el DX ocurrieron en un tiempo mayor que el razonable.
La mayoría de BDX consistió en consultas no orientativas, entendidas como aquellas donde los síntomas no generaron alarma, sospecha de cáncer o derivación para estudios especializados; también consultas a partir de las cuales los niños comenzaron tratamiento para otras enfermedades. Ocurrieron con más frecuencia en los CAP y HPGBA. La importancia de los HPGBA se reveló al excluir al Hospital Posadas; si bien éste es un hospital general, cuenta con un servicio de hemato-oncología pediátrica, probablemente aumentando el nivel de alerta de los profesionales. También se encontraron valores elevados (aunque no significativos) dentro de los CLP, COP y HPIP (41- 49%). Los datos señalarían deficiencias en el nivel de presunción diagnóstica en la mayoría de los tipos de centros incluidos. En algunos casos, el número de consultas previas a la sospecha resulta lógico. En efecto, el cáncer es una enfermedad rara en la infancia, e inicialmente muchos tumores son asintomáticos o presentan síntomas comunes a otras patologías 7, 11. En otros, una consulta no orientativa constituye sin duda una oportunidad diagnóstica perdida 14. Un interesante estudio determinó que el número de consultas de salud que atendieron los niños con cáncer en el año previo a su DX resultó ser mayor que en niños controles 15.
La demora atribuible a la familia representó una pequeña proporción de las BDX, sugiriendo que juega un rol mínimo. Esta observación coincide con el consenso de una mayor demora médica que familiar 7, 16, y con la percepción que nos brindaron los médicos consultados.
Otros estudios, sin embargo, tanto en países del primer mundo como de bajos o medianos ingresos, encuentran que la demora familiar es uno de los principales determinantes del retraso total 5, 7, 9, 17,18. En el primer caso, los resultados pueden entenderse en el marco de países donde las demoras médicas y de acceso a los recursos son mínimas. Por lo mismo, resulta esperable que en nuestro país, con marcadas inequidades en el acceso a los recursos, la demora familiar tenga un peso relativo menor sobre la demora total. En el segundo, los retrasos se relacionaron con las creencias y tradiciones de los padres, o con su bajo estatus económico y educativo, factores que no parecerían afectar la prontitud de las consultas de las familias en nuestro medio.
El porcentaje hallado de casos con un lapso superior a 30 días entre el inicio de síntomas y el DX no puede considerarse concluyente, dada la gran faltante de datos.
Esta dificultad fue descripta previamente. Los primeros síntomas o la sospecha de cáncer pueden no tener una fecha precisa en el recuerdo de los padres 5, 8. Los estudios recogen este lapso a partir de los registros hospitalarios, arrojando valores que oscilan entre 1 y 20 semanas, y que varían considerablemente con el sitio primario del tumor, sus propiedades biológicas, su agresividad, la gravedad de los síntomas, etc. 5, 17, 19.
Como era esperable, los DX se realizaron mayoritariamente en los hospitales públicos pediátricos de nivel terciario de la CABA, coincidiendo con los reportes nacionales, que señalan una marcada centralización, con más del 70% de los casos registrados en hospitales públicos, 50% de ellos tratados solo en tres centros de referencia, y valores de migración asistencial cercanos al 50% 1, 13.
Resultó habitual que, a pesar de venir con el DX desde su provincia, los niños hayan sido reevaluados en un HPCABA, confirmándose, y en ocasiones, corrigiéndose el mismo. En todo caso, se debe interpretar que la mayoría de los padres, según su percepción, obtuvieron una noción clara del DX cuando accedieron a un HPCABA.
Por su parte, todos los tipos de centro funcionaron como “centros de primer contacto” en un porcentaje
considerable, contrastando con otras regiones donde las consultas iniciales son absorbidas por los centros de atención primaria 8. El tipo de centro de primer contacto fue claramente influyente de la presencia de BDX, siendo los CAP y COP los principales moduladores positivos.
Respecto de la relación entre las BDX y el tipo de tumor, los hallazgos están en línea con datos previos y con los reportes nacionales, donde los tumores óseos y del SNC presentan las mayores demoras DX y los renales, una de las menores 1, 3, 5, 7-9, 20, 21. En retinoblastoma se señala consistentemente una elevada incidencia de DX tardíos, especialmente en países de bajos recursos 22, 23. En Argentina, se asociaron con el menor nivel educativo de los padres, la experiencia de los médicos consultados inicialmente y la residencia en zonas con bajo índice de desarrollo 24, 25. En la actualidad, sin embargo, resultaría esperable que estos valores se hayan modificado favorablemente.
Cerca del 70% de los niños con retinoblastoma son atendidos hoy en el Hospital Garrahan, donde funciona un servicio altamente especializado, y se realizan actividades de concientización y formación tendientes a la detección temprana. Si bien, según nuestro conocimiento, tales cambios aún no se documentaron en el país, este tipo de medidas impactó la celeridad del DX y el pronóstico en otros países 26.
La mayor frecuencia de BDX en el NEA no resulta sorprendente; la región presenta la tasa de pobreza más
elevada del país y es la más crítica en términos de pobreza infantil 27. La alta frecuencia de BDX en la Región Central, donde se concentran los principales centros especializados, podría responder a que la mayor proporción de casos (700/971 niños) provinieron del Gran Buenos Aires, donde el primer contacto tiene lugar predominantemente en los HPGBA, CAP y COP (datos no mostrados), centros con mayor proporción de BDX.
Por último, es conocido que la demora diagnóstica es menor en niños más pequeños 5, 7. Nuestro resultado en lactantes podría relacionarse con la mayor frecuencia y profundidad de los controles médicos, el predominio de leucemias, y/o localmente, con la existencia de planes específicos como el Materno-Infantil.
En su conjunto, los datos reflejan la influencia de factores demográficos y del tipo de tumor sobre la existencia de BDX, pero señalan también la importancia de componentes externos al niño y la familia. Principalmente aquellos relacionados con la institución en la cual se produce el primer contacto luego de que el niño ingresa al sistema de salud. En el contexto del país, donde las tasas de mortalidad son mayores en el NEA, en niños con tumores óseos o del SNC, nuestros datos permiten sugerir que las demoras diagnósticas podrían ser al menos uno de los componentes que contribuyen a esta realidad 3,28-30.
La distribución de coberturas de salud encontrada refleja aquella de las familias que concurren habitualmente a la FNDF, así como la de la población general del país 31. Si bien el tipo de cobertura no afectó la probabilidad de BDX, los datos no necesariamente reflejan la eficiencia de aquellas a la hora de sospechar o diagnosticar. Como se mencionó, independientemente de la cobertura, la atención se concentra en unas pocas instituciones públicas.
En nuestra experiencia, es frecuente que las familias decidan esto ante la falta de turnos o la desconfianza en los centros que disponen por su plan de salud. Otra probable explicación es que el término “consultorio” en los relatos, que se consideró como “consultorio particular (COP)”, se haya referido a un consultorio de obra social o de prepaga. Esto, junto con el hecho de que la FNDF recibe mayoritariamente niños de algunos hospitales públicos pediátricos dentro o cerca de los cuales tiene sus sedes, podría estar enmascarando la importancia de obras sociales y coberturas privados como fuente de BDX.
El ROHA cubre un porcentaje muy significativo de los casos de cáncer ocurridos en el país, por lo que fue nuestra referencia 32. Las diferencias encontradas en términos del tipo de tumor podrían relacionarse con los recursos que habitualmente provee la FNDF, como el acceso a prótesis y sillas de ruedas, el envío de muestras para el DX de leucemias y un intenso trabajo de información y atención de familias de niños con retinoblastoma.
Contrariamente, las dificultades de cuidado y movilidad de los pacientes con tumores del sistema nervioso, o la amplia cobertura de salud para los lactantes, pueden justificar su menor presencia en la FNDF. Por su parte, los niños con cáncer residentes en la Región de Cuyo son referidos mayoritariamente a la provincia de Mendoza, donde el Hospital Notti cuenta con suficientes recursos para tratar los casos en la región. No obstante estas diferencias puntuales, y el hecho de que los periodos abarcados por ambos análisis no son estrictamente los mismos, hubo un notable paralelismo, por lo que consideramos que la población de estudio fue en gran medida representativa de la población de niños con cáncer en el país.
Este estudio sugiere que una elevada proporción de familias enfrentaron barreras antes de arribar al DX. Cabe mencionar que los presentes datos no permiten inferir que la existencia de BDX resulte en un DX tardío; tampoco, que en el grupo NBDX haya tenido lugar un DX oportuno.
Una variedad de programas puestos en marcha desde organismos estatales como el Instituto Nacional del Cáncer y la Sociedad Argentina de Pediatría apuntan a cubrir las necesidades de esta población. Los informes, no obstante, mencionan la falta de datos concluyentes respecto de la dimensión de los DX tardíos. Desde las ONG tenemos la posibilidad de aportar evidencia especialmente sobre aquellos factores no biológicos, que son probablemente tan influyentes como los biológicos, y susceptibles de modificarse mediante políticas públicas. El estudio deja asimismo algunas preguntas importantes que merecen ser profundizadas. Por ejemplo, si aquellos centros donde se perdió una oportunidad diagnóstica podrían ser advertidos de esto, y si los hospitales llevan algún registro de la historia previa al DX de cada paciente. Esto podría ser útil, por ejemplo, para poder establecer fehacientemente la relación entre las demoras diagnósticas y la sobrevida, donde la evidencia no es concluyente 5, 33. Sería interesante también realizar mediciones similares solo para los tumores sólidos, donde se supone que la realidad de los retrasos diagnósticos es aún más grave 34.
El estudio presenta algunas limitaciones. Por su naturaleza retrospectiva hubo una considerable falta de datos. Probablemente, la estrategia utilizada de detección de BDX a partir de múltiples criterios haya permitido en parte contrarrestarla. En efecto, los criterios empleados se solapan y unos pueden ser consecuencia de otros. Así, las consultas no orientativas, demoras familiares o institucionales, determinan tiempos al DX más prolongados o la decisión de las familias de autoderivarse. El hecho de utilizar como fuente principal los relatos de los padres puede asimismo implicar una cierta parcialidad relacionada con la evocación preferencial de ciertos eventos5. Sin embargo, este enfoque constituye también una fortaleza.
Los datos a menudo reflejan la experiencia de familiares y niños, facilitando la comprensión de las necesidades y obstáculos más sentidos por ellos 35, 36.
Nuestros resultados apuntan a incrementar las estrategias para mejorar la presunción diagnóstica en todos los tipos de centros de atención. Además, creemos importante crear registros sistemáticos del recorrido DX dentro de los hospitales, y asegurar la retroalimentación de las instituciones que fallaron. A pesar de las limitaciones, este estudio proporciona un conocimiento inicial sobre las barreras de acceso al DX de un grupo representativo de los niños con cáncer en Argentina.
Agradecimientos: Este estudio fue financiado por el Instituto Nacional del Cáncer (INC), Ministerio de Salud, Presidencia de la Nación, a través del Subsidio de Asistencia Financiera a Proyectos de Origen Nacional de Investigación en Cáncer III.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Moreno F, Chaplin MA. Registro Oncopediátrico Hospitalario Argentino 6ta. Edición, Ciudad Autónoma de Buenos Aires: Instituto Nacional del Cáncer, 2018, 100 p. En: http://www.msal.gob.ar/images/stories/bes/
graficos/0000001365cnt-registro-oncopediatrico-argentino-digital.pdf, consultado febrero 2019.
2. OMS. El cáncer infantil, OMS, 2016. En: https://www.who.int/cancer/es/; consultado febrero 2019.
3. Moreno F, Loria D, Abriata G, Terracini B, ROHA network. Childhood cancer: Incidence and early deaths in Argentina, 2000-2008. Eur J Cancer 2013; 49: 465-73.
4. Felice M, Díaz V, Livio V, et al. Análisis de la mortalidad en enfermedades hemato-oncológicas malignas en pediatría en hospitales públicos de Argentina. Rev Argent Salud Pública 2013; 4: 23-31.
5. Dang-Tan T, Franco EL. Diagnosis delays in childhood cancer. A Review. Cancer 2007; 110: 703-13.
6. Burg MA, Zebrack B, Walsh K, et al. Barriers to accessing quality health care for cancer patients: a survey of members of the association of oncology social work. Soc Work Health Care 2010; 49: 38-52.
7. Dang-Tan T, Trottier H, Mery LS, et al. Delays in diagnosis and treatment among children and adolescents with cancer in Canada. Pediatr Blood Cancer 2008; 51:468-74.
8. Handayani K, Sitaresmi E, Supriyadi, et al. Delays in diagnosis and treatment of childhood cancer in Indonesia. Pediatr Blood Cancer 2016; 63: 2189-96.
9. Fajardo-Gutiérrez A, Sandoval-Mex AM, Mejía-Arangure JM, Rendón-Macías ME, Martínez-García MC. Clinical and social factors that affect the time to diagnosis of Mexican children with cancer. Med Pediatr Oncol 2002; 39: 25-31.
10. NHS Improvement: Delivering cancer waiting times. A Good Practice Guide. En: https://www.england.nhs.uk/wp-content/uploads/2015/03/delivering-cancer-wait-times.pdf; consultado diciembre de 2018.
11. Moreno F. ¿Cuándo sospechar cáncer en el niño? Guías/Abordajes/Estrategias 2018. Instituto Nacional del Cáncer, Ministerio de Salud, Argentina. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000029cnt-2018-cuando_sospechar_cancer_en_el_nino.pdf; consultado enero 2019.
12. Steliarova-Foucher E, Stiller C, Lacour B, Kaatsch P. International Classification of Childhood Cancer, third edition. Cancer 2005; 103: 1457-67.
13. Moreno F. Registro Oncopediátrico Hospitalario Argentino: incidencia 2000-2013, tendencia temporal de incidencia 2000-2013 Sobrevida 2000-2009 / – 1a ed.; Ciudad Autónoma de Buenos Aires: Instituto Nacional del Cáncer, 2015.
14. Lyratzopoulos G, Vedsted P, Singh H. Understanding missed opportunities for more timely diagnosis of cancer in symptomatic patients after presentation. Br J Cancer 2015; 112: 84-91.
15. Ahrensberg JM, Fenger-Grøn M, Vedsted P. Use of primary care during the year before childhood cancer diagnosis: a nationwide population-based matched comparative study. PLoS One 2013; 8: e59098.
16. De Angelis C, Pacheco C, Lucchini G, et al. The experience in Nicaragua: childhood leukemia in low income countries-the main cause of late diagnosis may be “medical delay”. Int J Pediatr 2012: 129707.
17. Chukwu BF, Ezenwosu OU, Ikefuna AN, Emodi IJ. Diagnostic delay in pediatric cancer in Enugu, Nigeria:
A prospective study. Pediatr Hematol Oncol 2015; 32: 164-71.
18. Venkatasai JP, Srinivasamaharaj S, Sneha LM, Scott JX, Baby AK, Rajan M. Pediatric hematological malignancy: Identification of issues involved in the road to diagnosis. South Asian J Cancer 2017; 6: 28-30.
19. Hansen RP, Vedsted P, Sokolowski I, Søndergaard J, Olesen F. Time intervals from first symptom to treatment of cancer: a cohort study of 2,212 newly diagnosed cancer patients. BMC Health Services Research 2011; 11: 284.
20. Molineus A, Boxberger N, Redlich A, Vorwerk P. Time to diagnosis of brain tumors in children: a single-centre experience. Pediatr Int 2013; 55: 305-9.
21. Marko TA, Diessner BJ, Spector LG. Prevalence of metastasis at diagnosis of osteosarcoma: an international comparison. Pediatr Blood Cancer 2016; 63: 1006-11.
22. Kivela T. The epidemiological challenge of the most frequent eye cancer: Retinoblastoma, an issue of birth and death. Br J Ophthalmol 2009; 93: 1129-31.
23. Butros LJ, Abramson DH, Dunkel IJ. Delayed diagnosis of retinoblastoma: analysis of degree, cause, and potential consequences. Pediatrics 2002; 109: 45.
24. Chantada G, Fandiño A, Manzitti J, Urrutia L, Schvartzman E. Late diagnosis of retinoblastoma in a developing country. Arch Dis Child 1999; 80: 171-4.
25. Moreno F, Banafsheh S, Fandiño A, Dussel V, Orellana L, Chantada G. Population-based study of retinoblastoma incidence and survival in Argentine children. Pediatr Blood Cancer 2014; 9999: 1-6.
26. Wallach M, Balmer A, Munier F, et al. Shorter time to diagnosis and improved stage at presentation in Swiss patients with retinoblastoma treated from 1963 to 2004. Pediatrics 2006; 118: 1493-8.
27. Instituto Nacional de Estadística y Censos (INDEC) Presidencia de la Nación Argentina. Condiciones de vida. Vol. 1, n° 12. Incidencia de la pobreza y la indigencia en 31 aglomerados urbanos. Primer semestre de 2017. ISSN 2545-6768 En: https://www.indec.gob.ar/uploads/informesdeprensa/eph_pobreza_01_17.pdf-; consultado enero 2019.
28. Pujol CJA, Bertonea CL, Acosta LD. Morbimortalidad por cáncer infantil en la República Argentina. 2006-2008. Arch Argent Pediatr 2014; 112: 50-4.
29. Moreno F, Dussel V, Orellana L; ROHA network. Childhood cancer in Argentina: survival 2000-2007. Cancer Epidemiol 2015; 39: 505-10.
30. Moreno F, Cacciavillano W, Cipolla M, et al. Childhood osteosarcoma: Incidence and survival in Argentina. Report from the National Pediatric Cancer Registry, ROHA Network 2000–2013. Pediatr Blood Cancer 2017; e26533.
31. Rubinstein A, Zerbino MC, Cejas C, López A. Making universal healthcare effective in Argentina: a blueprint for reform. Health Systems & Reform 2018; 4: 203-13.
32. Fedorovsky JM, Cuervo LG, Luciani S. Pediatric cancer registries in Latin America: the case of Argentina´s pediatric cancer registry. Rev Panam Salud Pública 2017; 41: e152.
33. Dang-Tan T, Trottier H, Mery LS, et al. Determinants of delays in treatment initiation in children and adolescents diagnosed with leukemia or lymphoma in Canada. Int J Cancer 2010; 126: 1936-43.
34. Friedrich P, Ortiz R, Fuentes S, et al. and the Central American Association of Pediatric Hematologists and Oncologists (AHOPCA). Barriers to effective treatment of pediatric solid tumors in middle-income countries: Can we make sense of the spectrum of non-biological factors that influence outcomes? Cancer 2014; 120: 112-25.
35. Feraco AM, Dussel V, Orellana O, et al. Tumor Talk and Child Well-Being: Perceptions of “good” and “bad” news among parents of children with advanced cancer. J Pain Symptom Manage 2017; 53: 833-41.
36. Renner LA, McGill G. Exploring factors influencing healthseeking decisions and retention in childhood cancer treatment programmes: perspectives of parents in Ghana. Ghana Med J 2016; 50: 149-56.
