ALEJANDRO GARCÍA 1, CONSTANZA LORENTE 1, BORIS ELSNER 1, ALEJANDRA AVAGNINA 1, VALERIA DENNINGHOFF 2*
1Servicio de Patología, 2 Patología Molecular, Centro de Educación Médica e Investigaciones Clínicas Norberto Quirno (CEMIC), Buenos Aires, Argentina
Resumen El melanoma maligno es la forma más agresiva de cáncer de piel, con una tasa de mortalidad en Argentina 1997-2001 = 1.1/100 000 en varones y 0.6 en mujeres. El proto-oncogén BRAF es foco de intensa investigación, su mutación es uno de los principales promotores tumorales y pueden presentarse en 50% de los melanomas. Se han aprobado varios fármacos con actividad clínica sobre las mutaciones BRAF. El objetivo del trabajo es evaluar el estado mutacional de BRAF (exón 15) en biopsias con melanoma maligno cutáneo y su relación con las características histopatológicas. Realizamos un estudio observacional, retrospectivo, de muestras fijadas en formol e incluidas en parafina. Revisamos edad, sexo, diagnóstico y datos histopatológicos, tamaño y porcentaje tumoral, viabilidad para análisis molecular y presencia de melanina. Evaluamos mutaciones de BRAF con PCR/secuenciación Sanger. Utilizamos test de Student, Chi cuadrado, Wilcoxon y prueba exacta de Fisher. De 49 casos se pudo purificar y secuenciar el 76% (38/49), 13/38 (34%) mujeres y 25/38 (66%) varones, edad mediana 70 años. Localización más frecuente: tórax con 14/35 (40%). Tipo histológico: extensivo superficial 18/38 (47%). Niveles de Clark, 11/38 (29%): I-II y 27/38 (71%): III, IV y V. Mediana del Breslow: 1.6 mm. Fase de crecimiento radial 11/38 (29%) y 27/38 (71%) vertical. Presentaron mutaciones 16/38 (42%). Como lo informado por otros autores, no se encontró asociación entre el estado mutacional del exón 15 y los parámetros clínicos o histopatológicos.
Palabras clave: melanoma, BRAF, histopatología
Abstract Mutational status of BRAF and histopathological characteristics in cutaneous malignant melanoma. Malignant melanoma (MM) is the more aggressive form of skin cancer with a mortality rate in Argentina 1997-2001 = 1.1/100 000 in men and 0.6 in women. BRAF proto-oncogene is focus of intense research; its mutation is one of the main tumor promoters and occurs in approximately 50% of MM. Several drugs with clinical activity on BRAF mutations have been approved. The aim of the study is to evaluate the mutational status of BRAF (exon 15) in cutaneous MM biopsies and its relationship with histopathological characteristics. We carried out an observational, retrospective study of samples fixed in formaldehyde and paraffin embedded; reviewing age, sex, diagnosis, histopathological data, tumor size and percentage, viability for molecular analysis and melanin presence. We evaluated BRAF mutations with PCR/Sanger sequencing. For statistics we used Student’s t test, Chi square, Wilcoxon and Fisher’s exact test. We were able to purify and sequence 76% (38/49) samples, 13/38 (34%) from women and 25/38 (66%) from men, the median age being 70 years. Most frequent location: thorax 14/35 (40%). Histological type: Superficial spreading 18/38 (47%). Clark´s levels, 11/38 (29%): I-II and 27/38 (71%): III, IV and V. Breslow´s median: 1.6 mm. Radial growth phase 11/38 (29%) and 27/38 (71%) vertical. Presented mutations 16/38 (42%). As reported by other authors, no association was found between the mutational state of exon 15 and clinical or histopathological parameters.
Key words: melanoma, BRAF, histopathology
Dirección postal: Valeria Denninghoff, Servicio de Patología, CEMIC, Av. E. Galván 4102, 1431 Buenos Aires, Argentina
e-mail: vcdennin@yahoo.com.ar
El melanoma maligno (MM) es la forma más agresiva de cáncer de piel y un problema de salud pública a nivel mundial. En EE.UU. se estimó que para 2018 se diagnosticaron 91 270 nuevos casos con 9320 muertes por MM, con una incidencia en aumento en los últimos 30 años (American Cancer Society 2018) 1.
En la Argentina son escasos los datos de ocurrencia de MM, la tasa de mortalidad, durante el período 1997-2001 fue de 1.1/100 000 habitantes para varones y 0.6/100 000 para mujeres, con tendencia creciente de las tasas durante el período 1997-2004 (3% aproximadamente, por año en ambos sexos) 2. La edad promedio de presentación es 63 años, aunque puede suceder a cualquier edad, incluso en niños 3. Los factores de riesgo para desarrollar melanoma incluyen: exposición a la radiación ultravioleta (UV) alta y/o intermitente, nevos displásicos, historia familiar de MM, tipo de piel, etc.
Puede desarrollarse en cualquier localización de la piel, pero es más frecuente en tórax en hombres y piernas en mujeres. Otros sitios frecuentes son cabeza y cuello 3. Puede ser asintomático y diagnosticarse solo en su etapa tardía por sus metástasis 4. A pesar de representar el 4% de las neoplasias malignas de la piel, es el responsable de las dos terceras partes de las muertes atribuibles a dichas neoplasias 5 y ha incrementado su incidencia en las últimas décadas 6.
Se reconocen cuatro subtipos histológicos principales: extensivo superficial (ES), lentigo maligno (LM), acrolentiginoso (AL) y nodular (N). Los tres primeros presentan una fase de crecimiento intra-epidérmico inicial, mientras que el último posee crecimiento intradérmico invasivo de novo, lo que ensombrece el pronóstico. El MM puede surgir de los melanocitos (o de sus células madres) de la piel normal o de lesiones precursoras (nevo displásico o atípico, nevo melanocítico congénito gigante, etc.). En la piel, los melanocitos se sitúan en la capa basal de la epidermis, y bajo el estímulo de dos hormonas: la estimuladora del melanocito (alfa MSH) y la adrenocorticótropa, que elaboran pigmento melánico. Las funciones principales de la melanina son dos, protección frente a radiaciones, particularmente, la UV, y el poder de captación de radicales. Una vez sintetizada se deposita en la matriz proteica de los melanosomas 7. La melanina representa una de los problemas mayores en el estudio del melanoma 8. En la primera parte del siglo XXI, hubo avances tecnológicos que facilitaron una nueva comprensión de la patogénesis molecular de una amplia variedad de enfermedades incluyendo el MM 9, así como también de las nuevas terapias 10. Las mutaciones presentes en BRAF, NRAS, c-KIT y GNAQ son las principales causas de desregulación de la vía MAPK en MM 11. El proto-oncogen BRAF (v-raf murine sarcoma viral oncogene homolog B1) ha sido recientemente foco de intensa investigación, ya que su mutación es uno de los principales promotores tumorales en diversos tumores malignos 12. Este gen codifica la proteína BRAF, la cual juega un papel regulatorio en la vía MAPK, que afecta la división celular, la diferenciación y la expresión génica 13. Las mutaciones del gen BRAF pueden estar presentes en el 30% de las neoplasias humanas y en aproximadamente el 50% de los MM 14.
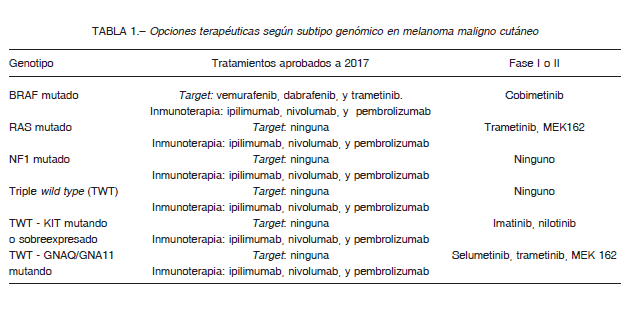
El 80% corresponde a sustitución de una valina por un glutamato en el codón 600 (V600E) en el exón 15, dentro del dominio quinasa, promoviendo activación constitutiva de la proteína BRAF 13, 14. Se han desarrollado drogas que inhiben a BRAF y han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos de América (FDA) y la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica de la Argentina (ANMAT) para el tratamiento de pacientes con MM avanzado cuyo tumor presente mutación V600E (terapia dirigida) 11. La importancia de determinar este biomarcador radica en que determina un subgrupo de pacientes que podrían ser tratados de forma individualizada con inhibidores específicos, sobre todo aquellos con enfermedad avanzada y/o metástasis irresecables no curables con tratamiento quirúrgico (Tabla 1).
El objetivo del presente trabajo es evaluar en nuestro medio el estado mutacional del gen BRAF en biopsias de individuos con diagnóstico de MM primario cutáneo, su relación con las características histopatológicas y discutir algunos aspectos técnicos de dicha determinación con respecto a la melanina.
Materiales y métodos
Se realizó un estudio observacional y retrospectivo de 49 casos con diagnóstico de MM primario cutáneo, cuya resección de piel fue fijada en formol neutro al 10% e incluida en parafina. Se evaluó tamaño y porcentaje tumoral en la muestra y viabilidad para análisis molecular. Este estudio adhiere a la Declaración de Helsinki. Estudiamos las siguientes variables: edad, sexo, diagnóstico histopatológico, presencia de melanina (se estableció la presencia o ausencia de melanina, mediante un score cualitativo de 0 a 3 según la intensidad del pigmento, siendo 0 = ausencia de pigmento 3 = mayor intensidad. Se evaluó además el porcentaje de células neoplásicas con pigmento sobre el número total de células neoplásicas), porcentaje de células tumorales, viabilidad para el análisis molecular (porcentaje final de células tumorales en relación a las células normales acompañantes en el área seleccionada para microdisección ≥ 70%). Se realizó la búsqueda del gen BRAF utilizando la base de datos RefSeq 15 y Ensembl 2015 16. Se estudió la variante 1 de transcripto (ENST00000646891.1) que contiene 18 exones. Dicho transcripto (Refseq NM_004333.5) codifica para un ARN mensajero de 6459 pares de bases y se traduce en una proteína de 766 aminoácidos 17. Se diseñaron primers 5´ y 3´ secuencia específicos flanqueantes a dicho exón utilizando herramientas bioinformáticas como BLAST (Basic Local Alignmentsearch Tool) 18 y Primer3 19. Primer: BRAFnat15Fw: 5´-TCATAATGCTTGCTCTGATAGGA-3´, y BRAFnat15Rev: 5´-GGCCAAAAATTTAATCAGTGGA-3´, con amplicón de 224 pb. Se purificó ADN genómico a partir de cortes de 25 μm de la muestra incluida en parafina. Se enriqueció el porcentaje de células tumorales mediante microdisección de un área del tumor donde se encontraba la mayor proporción de ADN tumoral.
En una primera etapa se estudió la tasa de efectividad de extracción y amplificación, siguiendo 3 estrategias con el objetivo de eliminar la presencia de melanina de las muestras.
Extracción de ADN. 1. Digestión enzimática con Buffer-PK (100mM Tris ClH-pH = 8, 25mM EDTA, 0.5% SDS, 0.01% PK) a 42 °C durante la noche. Extracción de las fracciones lipo-proteicas con fenol-cloroformo-isoamílico (CARLO ERBA, Italia). Precipitación del ADN purificado ClNa/isopropanol. 2. Purificación por columna mediante HIGH pure PCR Template Preparation Kit (Roche DiagnosticsGmbH, Mannheim, Alemania). 3. Purificación por columna a partir de nuevos cortes de tejido mediante QIAamp® DNA FFPE Tissue (Qiagen, #55404).
Amplificación de ADN: a- PCR a partir de 100 ng de ADN. b- PCR anidada o nested a partir de una alícuota de 5 μl de la primera reacción de PCR. c- PCR simple con el agregado de 5 y 10 μl de BSA (Promega, Madison, WI, USA).
La pureza y el rendimiento del ADN se midieron por espectroscopia. Los amplicones del gen BRAF fueron evaluados con electroforesis en geles de poliacrilamida al 9% en buffer TBE 1X y visualizados con bromuro de etidio bajo luz ultravioleta. Se realizó la PCR a partir de 50 a 100 ng de ADN de cada muestra. Los amplicones de la PCR obtenidos del exón 15 del gen BRAF fueron evaluados mediante electroforesis en gel de agarosa al 2% en buffer TBE 1X (Tris-Bórico-EDTA) y visualizados con bromuro de etidio bajo luz ultravioleta. Se realizó la purificación de los productos de amplificación utilizando las columnas High Pure PCR product purification kit (Roche, Suiza). Para la reacción de secuenciación se utilizó el kit BigDye Terminator v3.1 (Thermo Fisher, USA). Las secuencias fueron separadas por electroforesis capilar utilizando el ABI PRISM 310 Genetic Analyzer (Applied Biosystem, Foster City, CA, EE.UU.). Las secuencias obtenidas se analizaron con el Sequencing Analysis Software v5.2 (Applied Biosystem, Foster City, CA, EE.UU.).
Para realizar el análisis estadístico se confeccionó una base con los datos epidemiológicos básicos, estudios histopatológicos y de biología molecular, para cada paciente. La información recolectada se examinó mediante un análisis descriptivo para clasificar, representar y resumir los resultados, lo cual nos permitió sintetizar la información contenida en los mismos. En las variables cuantitativas se obtuvo promedio, desvío estándar o mediana y percentilos 25 y 75, según correspondiese.
En las variables cualitativas se obtuvo porcentaje e intervalo de confianza al 95%. Para evaluar asociación se utilizaron los test de Student (para variables cuantitativas) y Chi cuadrado (para variables cualitativas). Alternativamente, se aplicaron los test no paramétricos de suma de rangos de Wilcoxon y la prueba exacta de Fisher, para evaluar asociación con tamaños de muestra pequeños.
Resultados
De los 49 casos con diagnóstico de MM primario cutáneo, se pudo realizar purificación del ADN y posterior
secuenciación en el 76% (38/49), utilizando las diferentes estrategias:
1° Digestión enzimática con Buffer-PK y posterior amplificación: a. PCR simple se obtuvieron 37% de positividad, b. PCR nested, se obtuvieron 0% resultados positivos adicionales, c. PCR simple más el agregado de BSA, se lograron 9% positivos adicionales. Se estableció que la mejor estrategia fue la PCR simple.
2° Se purificó el ADN por columna mediante High Pure PCR Template Preparation Kit y posterior PCR simple, resultado en 47% de los casos positivos.
3° Se realizó una nueva extracción de ADN por columna QIAamp® DNA FFPE Tissue (Qiagen, #55404) y posterior PCR simple, resultado en 76% de los casos positivos.
Se estableció a la extracción de ADN mediante columna QIAamp® DNA FFPE Tissue (Qiagen, #55404) y PCR simple, como la mejor estrategia.
La localización anatómica más frecuente fue en la región del tórax con 14/35 (40%) casos. La distribución
completa y lateralidad pueden observarse en la Tabla 2. En relación a los resultados del estudio anatomopatológico sobre el preparado histológico, según el tipo histológico, niveles anatómicos de Clark y el espesor de Breslow, la fase de crecimiento, el tipo celular, el índice mitótico por mm2, ulceración, linfocitos intratumorales (TILs) y la proporción de melanina se expresan en la Tabla 3. En ninguno de los 36 casos de melanoma invasor se observó invasión linfovascular. Se evidenció infiltración perineural en 1/36 (3%) casos y áreas de regresión en 2/36 (6%).
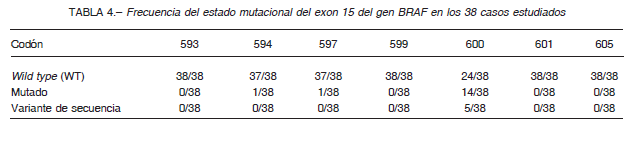
De los 38 pacientes estudiados, presentaron mutación 16/38 (42%) y fueron no mutados o wild type (WT) 22/38 (58%). La mutación más frecuente fue V600E, correspondiendo a 13/16 (81%) de las mismas. Se observó además una mutación c.1798_1799delGTinsAG (V600R), una mutación D594G (GAT > GGT) y una mutación L597Q (CTA > CAA). En los codones 593, 599, 601 y 605, no se observan cambios en la secuencia del ADN (Tabla 4). No se encontraron diferencias significativas entre el estado mutacional del exón 15 del gen BRAF y los parámetros clínicos e histopatológicos evaluados.

Discusión
El MM representa la forma más agresiva de cáncer de piel, siendo hasta ahora el diagnóstico precoz y el tratamiento quirúrgico la única metodología efectiva para controlar la enfermedad. El gen BRAF se encuentra mutado en aproximadamente 50% de los casos y la mutación más frecuente es la V600E. Se desarrollaron drogas que inhiben BRAF que fueron aprobadas para el tratamiento de MM en estadios avanzados que presenten la mutación V600E. Evidencia científica creciente indica que el MM es un grupo heterogéneo de tumores con subgrupos biológicamente distintos. Bauer y col. comunicaron que los MM con BRAF mutados se producirían con mayor frecuencia en un grupo etario menor, en piel sin elastosis solar marcada en áreas no expuestas a la luz solar en comparación con los MM-WT20. Los hallazgos indicarían que los MM con BRAF mutado se originarían temprano en la vida con baja dosis acumulativa de rayos UV mientras que los melanomas sin mutaciones en BRAF requerirían altas dosis acumulativas de UV en el tiempo 20. Un estudio reciente establece que el subtipo histológico de MM y la edad en combinación con la exposición UV influirían significativamente en la probabilidad de presentar una mutación V600E 21. En otro trabajo se encontró asociación significativa entre la mutación V600E y la presencia de pigmento en el tumor, hipotetizando que la mutación activaría la vía MAPK y modularía la función de MITFy la diferenciación melanocitica 22. Los dos casos amelanóticos de este trabajo fueron BRAF-WT. Estudios recientes subrayan características clínicas y morfológicas que predecirían la presencia de algunas mutaciones, en particular la de BRAF 23.
Nuestro estudio no mostró diferencias significativas entre los grupos mutado y WT en el análisis de las características de los individuos (edad, género) y del tumor (localización anatómica y parámetros histopatológicos). Con respecto a la frecuencia, nuestros resultados son semejantes a los informados en la literatura 24, y la mutación más frecuente fue V600E coincidiendo también con la literatura 25.

Con respecto a la interferencia de la melanina, Geng y col. describieron en bacterias una nueva propiedad de la melanina para interactuar con el ácido desoxirribonucleico (ADN) 26. La interacción mostró un efecto inhibitorio sobre el metabolismo de las células y una probable explicación biológica sería que el descenso del metabolismo celular le permitiría mayor tiempo a la bacteria para repararse a sí misma cuando el ADN es dañado por los rayos UV26. Durante la extracción de los ácidos nucleicos, hay tendencia a que la melanina coprecipite junto con estas macromoléculas. Estos polímeros de melanina contienen gran número de residuos de ácidos carboxílicos libres, que son responsables por su fuerte carácter aniónico y probablemente responsables de la unión a moléculas cargadas 27. Esto coincide con publicaciones que indican que la presencia de restos de melanina se asocia al ADN genómico aislado de líneas celulares pigmentadas interfiriendo con la PCR y demuestran que la melanina es un potente inhibidor de la ADN polimerasa termoestable in vitro y que el efecto inhibitorio es conferido por una interacción directa y reversible entre la melanina y la ADN polimerasa 28, 29.
En este trabajo se realizaron diferentes estrategias secuenciales para eliminar la melanina. La última utilizada mediante el uso de nuevas columnas de resina para el aislamiento de ADN (Qiagen) elevó la tasa de efectividad de secuenciación. Sin embargo, algunos de los casos no pudieron ser secuenciados. Esto lleva al análisis de otras condiciones a tener en cuenta, como los parámetros preanalíticos de las biopsias obtenidas: tiempo de isquemia fría, tiempo de fijación, uso de formol tamponado, etc. que también pueden interferir en la PCR 30.
La limitación de nuestro trabajo radica en el bajo número de casos, pero nuestro objetivo fue determinar una estrategia para la purificación del ADN a partir de las muestras que tenían melanina en diferentes grados en la práctica clínica, permitiendo a los pacientes acceder al estado mutacional del BRAF de su tumor, blanco terapéutico para esta patología; y por otro lado evaluar la fortaleza del método de secuenciación Sanger que permite la evaluación de codones que no son analizados por otras técnicas como Real time PCR, donde sólo se evalúa el codón 600, quedando entre un 10 a 20% de los casos mutados sin diagnóstico.
En conclusión, en nuestro medio la prevalencia de mutación del exón 15 del gen BRAF en la población estudiada es similar a lo informado en otras series, siendo la mutación más frecuente la V600E. La importancia de la determinación del estado mutacional de este oncogén radica en que las mutaciones en BRAF, nos permiten la selección de pacientes con enfermedad avanzada o irresecable que se beneficiarían con terapias dirigidas en términos de sobrevida y calidad de vida.
Agradecimientos: A María Teresa Cuello y Mariana dos Santos, por su aporte en el Laboratorio de Patología Molecular
Conflictos de Intereses: Ninguno para declarar
Bibliografía
1. American Cancer Society. Cancer Facts and Figures 2014. Atlanta, GA: American Cancer Society; 2014.
En: http://www.cancer.org/cancer/skincancer-melanoma/detailedguide/melanoma-skin-cancer-key-statistics; consultado septiembre 2018.
2. Loria D, Latorre C, RAMC Collaborative group. A melanoma registry in Argentina: a collaborative hand in preventive actions. Presentation, 3rd International Cancer Control Congress. Cernobbio, Italy, 2009.
3. LeBoit P, Burg G, Weedon D, Sarasin A. Pathology and Genetics of Skin Tumours WHO Classification of Tumours, 3rd ed, Volume 6, 2006.
4. Milton G, Shaw H, McCarthy W. Occult primary malignant melanoma: factors influencing survival. Br J Surg 1977; 64: 805-8.
5. Hurt M, Santa Cruz D. Tumours of the skin. En: Fletcher C. Diagnostic histopathology of tumours. 4th ed. Hong Kong: Churchill Livingtone, 2013.
6. Programa Nacional de Consensos Inter-Sociedades. Programa Argentino de Consensos de Enfermedades Oncológicas. Consenso Nacional Inter-Sociedades sobre Melanoma Cutáneo, Argentina, 2011.
7. Denninghoff V, Falco J, Kahn A, Trouchot V, Curuchet H, Elsner B. Sentinel node in melanoma patients. Triple negativity with routine techniques and PCR as positive prognostic factor for survival. Mod Pathol 2008; 21: 438-44.
8. Lagonigro M, De Cecco L, Carninci P, et al. CTAB–Urea method purifies RNA from melanin for cDNA microarray analysis. Pigment Cell Res 2004; 17: 312–5.
9. Thompson J, Scolyer R, Kefford R. Cutaneous melanoma in the era of molecular profiling. Lancet 2009; 374: 362-5.
10. Eggermont A, Kroemer G, Zitvogel L. Immunotherapy and the concept of a clinical cure. Eur J Cancer 2013; 49: 2965-7.
11. Ponti G, Manfredini M, Greco S, et al. BRAF, NRAS and C-KIT advanced melanoma: clinico-pathological features, targeted-therapy strategies and survival. Anticancer Res 2017; 37: 7043-8.
12. Rubinstein J, Sznol M, Pavlick AC, et al. Incidence of the V600K mutation among melanoma patients with BRAF mutations, and potential therapeutic response to the specific BRAF inhibitor PLX4032. Transl Med 2010; 8: 67-9.
13. Arkenau H, Kefford R, Long GV. Targeting BRAF for patients with melanoma. Br J Can 2011; 104: 392-8.
14. Bradish J, Cheng L. Molecular pathology of malignant melanoma: changing the clinical practice paradigm toward a personalized approach. Hum Pathol 2014; 45: 1315-26.
15. O’Leary N, Wright M, Brister J, et al. Reference sequence (RefSeq) database at NCBI: current status, taxonomic expansion, and functional annotation. Nucleic Acids Res 2016 4; 44: D733-45.
16. Cunningham F, Amode M, Barrell D, et al. Ensembl 2015. Nucleic Acids Res 2015; 43: D662-9.
17. Shigematsu H, Takahashi T, et al. Somatic mutations of the HER2 kinase domain in lung adenocarcinomas. Cancer Res 2005; 65: 1642-6.
18. Altschul S, Gish W, Miller W, et al. Basic local alignment search tool. Mol Biol 1990; 215: 403-10.
19. Untergasser A, Cutcutache I, Koressaar T, et al. Primer3-new capabilities and interfaces. Nucleic Acids Res 2012; 40: e115.
20. Bauer J, Büttner P, Murali R, et al. BRAF mutations in cutaneous melanoma are independently associated with age, anatomic site of the primary tumor, and the degree of solar elastosis at the primary tumor site. Pigment Cell Melanoma Res 2011; 24: 345-51.
21. Gaiser M, Skorokhod A, Gransheier D, et al. Variables that influence BRAF mutation probability: A next-generation sequencing, non-interventional investigation of BRAFV600 mutation status in melanoma. PLoS One 2017; 12: e0188602.
22. Liu S, Ren S, Howell P, et al. Identification of novel epigenetically modified genes in human melanoma via promoter methylation gene profiling. Pigment Cell Melanoma Res 2008; 21: 545-58.
23. Broekaert S, Roy R, Okamoto I, et al. Genetic and morphologic features for melanoma classification. Pigment Cell Melanoma Res 2010; 23: 763-70.
24. Flaherty K, Puzanov I, Kim K, ,et al. Inhibition of mutated, activated BRAF in metastatic melanoma. N Engl J Med 2010; 363: 809-19.
25. Maurer G, Tarkowski B, Baccarini M. Raf kinases in cancer–roles and therapeutic opportunities. Oncogene 2011; 30: 3477-88.
26. Geng J, Yuan P, Shao C, et al. Bacterial melanin interacts with double-stranded DNA with high affinity and may inhibit cell metabolism in vivo. Arch Microbiol 2010; 192: 321-9.
27. Satyamoorthy K, Li G, Van Belle P, Elder DE, Herlyn M. A versatile method for the removal of melanin from ribonucleic acids in melanocytic cells. Melanoma Res 2002; 12: 449-52.
28. Price K and Linge C. The presence of melanin in genomic DNA isolated from pigmented cell lines interferes with successful polymerase chain reaction: a solution. Melanoma Res 1999; 9: 5-9.
29. Eckhart L, Bach J, Ban J, Tschachler E. Melanin binds reversibly to thermostable DNA polymerase and inhibits its activity. Biochem Biophys Res Commun 2000; 271: 726-30.
30. García A, Lorente C, Cuello M, et al. Performance assessment of epidermal growth factor receptor gene sequencing according to sample size in daily practice conditions. Appl Immunohistochem Mol Morphol 2018; 26: 495-500.
– – – –
5. Credo che l’accumulo della conoscenza avvenga sempre cossÌ: per linee spezzate anziché continue; attraverso false partite, correzione, dimenticanze, riscoperte; grazie a filtri, e schemi che accecano e fanno vedere nello stesso tempo. In questo senso la vicenda interpretativa che o ricostruito con minuzia forse eccessiva può essere considerata quasi banale: non l’eccezione ma la regola.
5. Creo que el acúmulo del conocimiento acontece siempre así: por líneas rotas en vez de continuas; a través de partidas falsas, correcciones, olvidos redescubrimientos; gracias a filtros y esquemas que enceguecen y a la vez hacen ver. En este sentido el caso interpretativo que he reconstruido con minucia tal vez excesiva puede ser considerado casi banal: no la excepción sino la regla.
Carlo Ginzburg
Il filo e le tracce. Vero, falso, finto. Milano; Feltrinelli. 2006. En: Gli europei scoprono (o riscoprono) gli schamani, p111
