LUCRECIA M. BURGOS, MIGUEL A. CRACCO, PABLO FERNÁNDEZ OSES, ANA C. IRIBARREN, RICARDO RONDEROS, FRANCISCO NACINOVICH
Instituto Cardiovascular de Buenos Aires (ICBA), Buenos Aires, Argentina
Resumen La epidemiología de la endocarditis infecciosa (EI) ha sufrido cambios debido a una serie de factores como el envejecimiento, las comorbilidades y los procedimientos médicos. El objetivo de este estudio fue evaluar las principales modificaciones clínicas, epidemiológicas y etiológicas de la EI en los últimos 25 años en Argentina. Se realizó un análisis comparativo de tres registros prospectivos observacionales en los que se incluyeron de forma consecutiva casos de EI definidas y posibles según los criterios de Duke: dos estudios multicéntricos (EIRA-1 [1992-1994] y EIRA-2 [2001-2002]) y un estudio en un centro de referencia de cardiología de tercer nivel (CRC [2007-2017]). En los 1065 episodios de EI evaluados, no existieron diferencias respecto al sexo, y los pacientes fueron más añosos en cada periodo (p < 0.001). La EI asociada a dispositivos intracardiacos fue más frecuente en la última década: infección asociada a marcapasos (5.4 vs. 23% p < 0.0001) y EI de prótesis valvulares (8.5% vs. 19.2% vs. 47.5% p < 0.0001). Por otra parte, la EI asociada a drogas endovenosas (p < 0.0001) y cardiopatías congénitas (p = 0.001) fue significativamente menos frecuente. La etiología cambió sustancialmente: Streptococcus del grupo viridans disminuyó (30.8% vs. 26.8% vs. 15.9%; p < 0.001) y la EI por Staphylococcus spp. predominó por sobre otros microorganismos, con un aumento estadísticamente significativo del Staphylococcus coagulasa negativa (SCN). El tratamiento quirúrgico fue implementado con más frecuencia en la última década y estuvo acompañado de una tendencia a menor mortalidad en el CRC (23.5%, 24.3% vs. 17.2% p = 0.058).
Palabras clave: endocarditis, endocarditis infecciosa, enfermedades de las válvulas cardíacas, cirugía torácica, mortalidad hospitalaria
Abstract Infective endocarditis in Argentina: what have we learned in the last 25 years? The epidemiology of infectious endocarditis (IE) has undergone changes due to a series of factors such as aging, comorbidities and medical procedures. The aim of this study was to evaluate the main clinical, epidemiological and etiological changes of the IE in the last 25 years in Argentina. A comparative analysis of three observational prospective registries was performed in which cases of definite and possible IE were consecutively included according to the Duke criteria: two multicentre studies (EIRA-1 [1992-1994] and EIRA-2 [2001-2002]) and one study in a reference cardiology center (CRC [2007-2017]). In the 1065 episodes of EI evaluated, there were no differences regarding sex, and the patients were older in each period (p < 0.001). Intracardiac device-associated IE was more frequent in the last decade: pacemaker (5.4 vs. 23% p < 0.0001) and prosthetic valve IE (8.5% vs. 19.2% vs. 47.5% p < 0.0001). On the other hand, IE associated with intravenous drugs (P < 0.0001) and congenital heart diseases (p = 0.001) was significantly less frequent. The etiology changed substantially: Streptococcus viridans group decreased (30.8% vs. 26.8% vs. 15.9%, p < 0.001) and IE by Staphylococcus spp. predominated over other microorganisms, with a statistically significant increase in IE due to coagulase-negative Staphylococcus. Surgical treatment was more frequently implemented in the last decade and was accompanied by a trend towards lower mortality in the CRC (23.5%, 24.3% vs. 17.2% p = 0.058).
Key words: endocarditis, infective endocarditis, diseases of the cardiac valves, thoracic surgery, hospital mortality
Dirección postal: Lucrecia M. Burgos, Instituto Cardiovascular de Buenos Aires, Blanco Encalada 1543, 1428 Buenos Aires, Argentina
e-mail: lucreciamburgos@gmail.com
La endocarditis infecciosa (EI) es una enfermedad que, por sus características y complejidad, pone a prueba el criterio clínico y resulta en un verdadero desafío para su tratamiento. Se estima que ocurren 15 000 nuevos casos de EI cada año en los EE.UU. 1 siendo aún desconocida la incidencia en Argentina 2. Más del 50% de los pacientes sufren algún tipo de complicación grave durante el transcurso de la enfermedad, como insuficiencia cardíaca, accidente cerebrovascular (ACV) y extensión perivalvular 3-5, y actualmente el 40-50% de los pacientes se someten a cirugía cardíaca durante la hospitalización 6-9.
Aunque son múltiples los progresos alcanzados en todos los aspectos de la EI, desde la comprensión de su
fisiopatología, los avances en los métodos diagnósticos, la terapia médica y el desarrollo de las técnicas quirúrgicas, la mortalidad en la fase aguda (hospitalaria) sigue siendo elevada (15-25% global) y, de los que sobreviven al episodio inicial, la mortalidad a los 6 meses y al año se calcula en 30-40% 10-13.
Los estudios poblacionales, multicéntricos y aquellos elaborados por instituciones con experiencia en el manejo de la EI, aun con las limitaciones propias de este tipo de análisis, han aportado sin embargo una valiosa información y permitido comprender mucho más sobre el comportamiento de esta enfermedad, que puede tener características particulares según la región y el país analizado 12, 14-19.
De hecho, estos estudios han mostrado con claridad los cambios que se han observado tanto en la epidemiología de la EI, así como en sus características clínicas y microbiológicas. Sin embargo es curioso que, entre esos cambios manifiestos, la mortalidad global de la EI en gran parte del mundo siga siendo la misma que hace 60 años atrás 10. Este escenario puede ser explicado por diversas causas, entre las cuales la forma clásica de presentación de la EI, la microbiología, y las características de los individuos afectados, que ha cambiado sustancialmente: el aumento de la edad de los pacientes, el incremento de la enfermedad valvular degenerativa (en contraste con una disminución de la enfermedad reumática), la mayor indicación de dispositivos intracardiacos (válvulas protésicas y marcapasos) y una mayor exposición de los individuos a diferentes tipos de procedimientos invasivos con la consecuente posibilidad de bacteriemia (lo que se denomina endocarditis asociada a los cuidados de la salud) entre otras razones 2, 20-25, explican algunos de los cambios observados en la epidemiología de la EI. Además, otros aspectos de importancia en la evolución de la enfermedad son las dificultades por el tratamiento antibiótico inadecuado, a pesar de la existencia de guías y recomendaciones de fácil acceso 26-29.
Entre lo antes mencionado, se destaca que la EI es una enfermedad frecuentemente no sospechada en la práctica diaria, como consecuencia de ello, la demora en el diagnóstico tiene gran importancia en la evolución de la enfermedad30. Esta dificultad en el diagnóstico temprano y, por lo tanto en la implementación del tratamiento adecuado, se observa más frecuentemente en la población añosa, debido a la presentación atípica de la enfermedad y a la falta de signos clínicos 31.
Hace 25 años, a partir del registro EIRA-1 (Endocarditis Infecciosa en la República Argentina) se pudieron conocer por primera vez las características de esta enfermedad en nuestro país 16. Una década después, el EIRA 2 17-19 evidenció cambios significativos caracterizados por pacientes de mayor edad, mayor prevalencia de cardiopatía subyacente (en particular prótesis valvulares y enfermedades valvulares degenerativas), mayor frecuencia de infección causada por Staphylococcus aureus y menor por Streptococcus del grupo viridans (SGV); finalmente (y quizás llamativamente) no se encontraron cambios en la tasa de mortalidad intrahospitalaria de la enfermedad.
Desde la realización de esos registros, y hasta la elaboración de este análisis, no contábamos aún con los datos del estudio EIRA 3 32; por lo cual el objetivo del presente trabajo fue evaluar los principales cambios clínicos, epidemiológicos y etiológicos de la EI, así como algunos aspectos del manejo en la Argentina en los últimos 25 años, de modo de actualizar la información disponible acerca de esta entidad y aportar una mirada distinta que ofrezca herramientas que permitan mejorar el impacto que la EI tiene en los individuos afectados por ella.
Materiales y métodos
Se realizó un estudio analítico a partir de datos obtenidos de tres fuentes: el registro prospectivo propio, en el que se incluyeron episodios consecutivos de EI definidas y posibles según los criterios de Duke modificados, en pacientes mayores de 18 años (incluidos en una base de datos creada a tal fin) en un centro de referencia de cardiología de tercer nivel (CRC), durante el periodo enero 2007-enero 2017, y los datos publicados de los registros multicéntricos Primer 16 y Segundo estudio Nacional prospectivo sobre Endocarditis Infecciosa en la República Argentina 17-19.
El registro EIRA-1 se realizó en el período julio 1992- enero 1994, en él se incluyeron los episodios de EI de pacientes mayores de 18 años provenientes de 33 centros asistenciales de nuestro país. El estudio EIRA-2, por su parte, fue un registro prospectivo conducido en 82 hospitales de 16 provincias de la Argentina entre junio 2001 y noviembre 2002.
Dado que el CRC también participó en ambos registros, para evitar superponer casos solo se consideraron aquellos incluidos durante el periodo 2007-2017. Por otra parte, debido a que el CRC es un centro de referencia y derivación de episodios de EI, y que los estudios fueron registros observacionales, con metodología similar, con los mismos criterios de inclusión y definiciones de las variables, se llevó adelante un análisis secundario en base a los datos publicados de los mismos. Las diferentes tablas fueron construidas a partir de los hallazgos relevados en el estudio EIRA-1 y EIRA-2 considerando las poblaciones totales de pacientes con EI incorporadas en ambos estudios (casos de EI definida y posible).
En los registros y en nuestro estudio se usaron las mismas definiciones de variables.
Endocarditis infecciosa: Se utilizó la clasificación de Duke y solo se incluyeron los casos definitivos o probables 33, 34.
Cardiopatía subyacente: Enfermedad valvular, congénita, o a la presencia de prótesis cardíaca, excluyéndose el marcapasos definitivo.
Evento predisponente: Todo procedimiento potencialmente productor de bacteriemia efectuado al menos tres meses antes del diagnóstico de EI.
Localización de la EI: Se clasificó de acuerdo con los hallazgos anatómicos y/o con los hallazgos del ecocardiograma.
EI con hemocultivos negativos: Cuadro clínico, de laboratorio e imágenes compatibles con endocarditis infecciosa, pero con hemocultivos negativos.
Mortalidad total intrahospitalaria: Número de pacientes fallecidos por todas las causas durante la fase hospitalaria de la enfermedad.
Las variables categóricas se expresaron mediante números y porcentajes, y las continuas, según su distribución, como media o mediana, con su correspondiente desvío estándar o intervalo intercuartilo. Para la comparación de variables múltiples continuas se utilizó el test de ANOVA o Kruskal y Wallis. Las comparaciones entre proporciones se realizaron mediante el test de Chi cuadrado o el test exacto de Fisher dependiendo de la frecuencia de valores esperados. Se definió una p menor de 0.05 a dos colas como estadísticamente significativa.
Nuestro estudio se llevó a cabo en cumplimiento con la ley nacional de protección de datos personales 25.326, fue conducido de acuerdo a las normas éticas nacionales (ley CABA 3301) y Ley nacional de investigación clínica en seres humanos, declaración de Helsinki, y contó con la aprobación del comité de Investigación y Ética de nuestra Institución.
Resultados
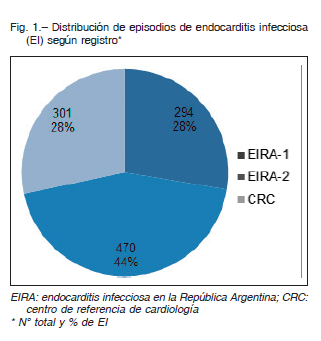
Se analizaron un total de 1065 episodios de EI: en el registro EIRA-1 se incluyeron 294 episodios de EI (74% definidas), en el EIRA-2, 470 episodios (definidas 83%), y en nuestro estudio se incluyeron 301 casos (80% definidas) (Fig. 1).
No existieron diferencias respecto al sexo en los tres períodos; el sexo masculino fue predominante y se
mantuvo estable (68-69%; p = 0.96); sin embargo, los pacientes fueron más añosos en cada periodo: con una
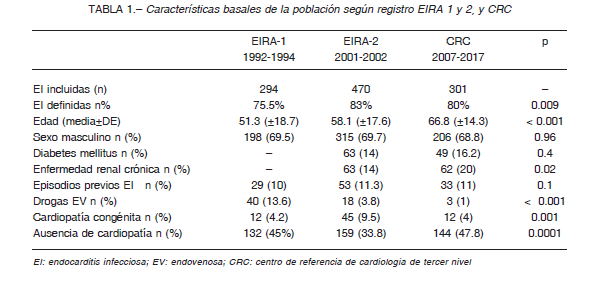
media de 51.3 años (DE ± 1.7), 58.1 años (DE ± 17.6) y 66.8 años (DE ± 14.34) en los registros EIRA-1, EIRA-2 y CRC respectivamente.
Respecto a las comorbilidades, en el CRC en comparación al EIRA-2 no hubo diferencias en la prevalencia de diabetes mellitus (p = 0.4) pero se observó un aumento de enfermedad renal crónica (20% vs. 14%, p = 0.02)
en los casos de EI. En el EIRA-1, el 45% no presentaba cardiopatía subyacente, en el EIRA-2 el 33.8%, y en el CRC 47.8% (p = 0.0001). La presencia de cardiopatía congénita fue similar en el EIRA-1 y CRC (cercano al 4%) pero más del doble en el EIRA-2 (9.5%; p = 0.001).
El uso de drogas endovenosas fue decreciendo en cada periodo, siendo del 13.6% en el EIRA-1 y del 1% en el CRC (p < 0.001). En los tres registros, 10-11% de los pacientes incluidos tenían antecedentes de EI previa (p = 0.1) (Tabla 1).
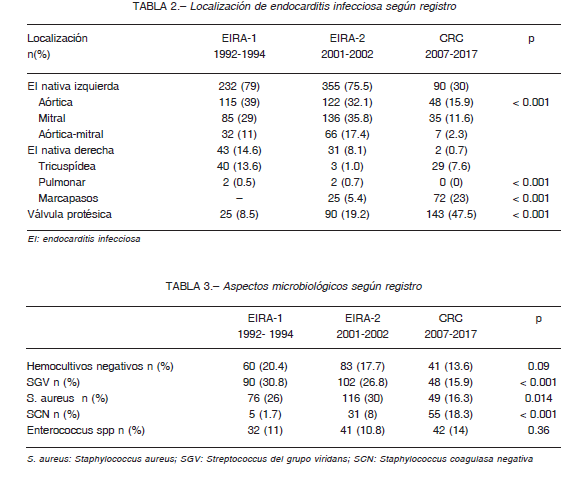
La localización de la EI varió significativamente, siendo más frecuente la infección asociada a prótesis valvular en la última década: 8.5% en el EIRA-1, 19.2% en el EIRA-2 y 47.5% en el CRC (p < 0.001). La infección asociada a marcapasos fue solo descrita en el EIRA-2 (5.4%) con un significativo aumento en el último periodo (23%; p<0.001) (Tabla 2). En coincidencia con la frecuencia de adicción intravenosa, la EI de válvulas derechas (no asociadas a dispositivos intracardiacos) fue más frecuente en el primer periodo (14.6%) mientras que hubo una notable disminución en los otros dos estudios (8.1% en el EIRA-2, y 0.7% en el CRC). Como contrapartida al aumento de EI sobre válvulas protésicas, se observa un descenso en la EI de válvula nativa izquierda (75-79% en los dos registros EIRA, al 30% en el CRC). La válvula más frecuentemente afectada fue la aórtica, seguida por la mitral y, menos prevalente, la infección concomitante de ambas válvulas (Tabla 2).
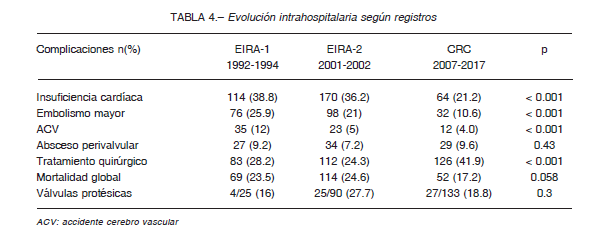
Como ya se había observado en el registro EIRA-2, se mantuvo la disminución de la EI por SGV de forma
significativa, siendo del 30% en el primer periodo y del 15.9% en el último (p<0.001). Sin embargo, el ascenso encontrado del S. aureus como agente etiológico de la EI entre el EIRA-1 y EIRA-2, cayó en el último periodo significativamente, con prevalencias del 26%, 30% y 16.3% respectivamente (p = 0.014). Por otra parte, se observó un aumento estadísticamente significativo en las EI por Staphylococcus coagulasa negativa (SCN) con cifras cercanas al 2% en el EIRA-1, 8% en el EIRA-2, y 18.3% en el CRC (p < 0.001). La EI por Enterococcus spp no evidenció cambios en los últimos 25 años (10-14%; p = 0.36).
Los episodios de EI con hemocultivos negativos tuvo una tendencia al descenso no estadísticamente significativa (p = 0.09) aunque en términos absolutos, es la mitad en el CRC, en relación al EIRA-2 (Tabla 3).
La gran mayoría de las complicaciones intrahospitalarias presentaron una disminución a lo largo de los años. El desarrollo de insuficiencia cardíaca fue más frecuente en el primer periodo, descendiendo progresivamente: 38.8%, 36.6% y 21.2% (p < 0.001). La misma tendencia se observó en el embolismo mayor: 25.9% en EIRA-1, 21% en EIRA-2, y 10.6% en CRC (p < 0.001); el diagnóstico de complicaciones perivalvulares (absceso) se mantuvo sin variaciones (p = 0.43).
En la última década el tratamiento quirúrgico fue más frecuentemente implementado, siendo del 41.9% en comparación al 28.2% del EIRA-1 y 24% del EIRA-2 (p < 0.001).
La mortalidad global intrahospitalaria tuvo una tendencia a disminuir en cada periodo, siendo de 23.5% en el EIRA-1, 24.6% en EIRA-2 y 17.2% en CRC, encontrándose esta diferencia en el límite de la significancia estadística (p = 0.058), sin existir diferencias en la mortalidad en las EI de válvula protésica (Tabla 4).
Discusión
Realizamos un análisis comparativo de dos grandes registros multicéntricos llevados a cabo en nuestro país (15 y 25 años atrás) con un registro unicéntrico prospectivo contemporáneo en una institución monovalente, dedicada exclusivamente a la atención de pacientes con enfermedades cardiovasculares. Nuestro estudio tiene varios hallazgos para destacar.
En cuanto a las características generales, los individuos de sexo masculino continúan siendo los más afectados (característica que no ha podido ser explicada aún) con una distribución similar a la evidenciada en estudios previos 10, 35-37. Se observó un marcado aumento de la media de edad de la población en cada periodo, igual a lo evidenciado a nivel internacional; la edad ha aumentado constantemente durante los últimos 40 años 38-40. Esta tendencia probablemente se deba a los factores mencionados en la introducción, una clara disminución en la incidencia e importancia de la enfermedad cardíaca reumática como factor de riesgo para la EI y la creciente proporción de adultos mayores en la población general, más propensos a desarrollar enfermedad valvular degenerativa, a requerir de dispositivos intracardiacos, tales como marcapasos, implantes de válvulas protésicas, implantación de válvula aórtica transcatéter y mayor exposición a procedimientos invasivos de distinta índole (vinculados a los cuidados de la salud, sean o no intravasculares) los cuales están asociados con un mayor riesgo de EI 41. De hecho, en una gran cohorte internacional de EI realizada de forma prospectiva a principios de la década de 2000, más de la mitad de los pacientes de edad avanzada informaron procedimientos invasivos en los 6 meses anteriores a la aparición de la EI, en comparación al 38.5% en los pacientes jóvenes39. Es interesante mencionar el lugar que adquieren las cardiopatías congénitas en los adultos, las que como enfermedad cardiaca subyacente representan una condición de riesgo para padecer la enfermedad, aunque en una proporción menor. Sin embargo, más importante aún que la enfermedad valvular subyacente, es la ocurrencia de EI en ausencia de la misma, situación que se observa con frecuencia creciente. Es probable que en algunos episodios la enfermedad valvular previa fuera desconocida para el paciente (como suele ocurrir en el caso de la aorta bicúspide) 42. Pero la ausencia de enfermedad valvular, junto a los microorganismos predominantes (Staphylococcus spp. y Enterococcus spp.) están estrechamente relacionados con la EI asociada a procedimientos invasivos relacionados a los cuidados de la salud y, por lo tanto, son episodios potencialmente prevenibles 41.
En el caso de los microorganismos del género Staphylococcus, existe una razón fisiopatológica que explica
este escenario: a diferencia del SGV que requiere de endocardio dañado para desarrollar la enfermedad, el S. aureus, por ejemplo, puede asentarse en una válvula sin que la misma tenga enfermedad manifiesta 43. En la misma dirección se explica el notable incremento de las EI que afectan dispositivos intracardiacos en la última década.
En coincidencia con la tendencia actual 41 se observó una disminución progresiva en el porcentaje de pacientes con uso de drogas intravenosas, pasando del 13% en el EIRA-1 al 1% en el CRC. En un estudio retrospectivo observacional entre los años 1998-2010, la endocarditis asociada a drogadicción endovenosa ocurrió en sujetos más jóvenes, varones, y se asociaban a una mayor mortalidad 44. La disminución de los pacientes que consumen drogas intravenosas también está relacionada con los cambios que han ocurrido en los últimos 20 años en el hábito de consumo de drogas ilegales en nuestro país, entre los cuales el uso de drogas intravenosas ha perdido espacio frente al consumo inhalatorio y de pastillas. En cuanto a las comorbilidades, la enfermedad renal crónica está probablemente relacionada a la edad de la población.
En pacientes mayores de 65 años, es más frecuente esta comorbilidad, así como la insuficiencia cardíaca, la EI protésica, el cáncer y la diabetes mellitus 44.
A pesar de que los hemocultivos tienen un papel principal en el diagnóstico de EI32, en los tres periodos la tasa de hemocultivos negativos fue elevada; los registro EIRA-1 y 2 mostraron una proporción inaceptablemente alta y no varió de forma significativa en las últimas décadas, aunque con una tendencia a la disminución en tiempos recientes. Los resultados negativos en hemocultivos pueden ocurrir debido al uso previo de antibióticos, infección con organismos de difícil crecimiento u hongos. La incidencia de EI con hemocultivos negativos podría disminuir con el aporte de nuevas técnicas de cultivo e identificación, que son significativamente más rápidas que los métodos de cultivo estándar 45. Es necesario insistir en la obtención de muestras de sangre para cultivo de modo de poder alcanzar frecuencias menores de EI con hemocultivos negativos, acercándose al 5% que se estima en centros de países desarrollados 46.
En cuanto a la microbiología, no es ya una sorpresa la importancia del género Staphylococcus spp., que fue claramente establecido en el EIRA-2 en sintonía con lo que se observaba en otros centros del mundo 10, 47-50, siendo más frecuente tanto en válvulas nativas como protésicas, tanto en las adquiridas de la comunidad como en las nosocomiales, asociándose a una mayor estadía hospitalaria y mayor mortalidad que las infecciones estreptocócicas 51.
La EI estafilocócica ha prevalecido sobre la estreptocócica, probablemente debido a la notable reducción en la incidencia de enfermedad reumática, ya que Streptococcus spp. sigue siendo el principal agente patógeno en países donde la enfermedad reumática aguda es endémica 52, 53, pero también al aumento de infecciones relacionadas al cuidado de la salud y de las EI asociadas a la presencia de dispositivos intracardiacos (válvulas protésicas y marcapasos) 54. Al igual que lo evidenciado en el último periodo, los SCN tienen una prevalencia creciente de aproximadamente 10%, y desempeñan un papel principal en las EI protésicas que ocurre en el primer año después del procedimiento inicial 55-57. Es importante destacar que también estos microorganismos han surgido como una causa frecuente de EI en las válvulas nativas 58. En cuanto al rol predominante del SGV en la última década, observado en un centro monovalente, debe ser considerado con cuidado pues, como centro de referencia, el nuestro recibe pacientes derivados desde otras instituciones de diferentes puntos del país. Por otra parte, es importante mencionar que el período de estudio abarcó los cambios en la prevención de la endocarditis infecciosa. La American Heart Association revisó las pautas de consenso para la profilaxis antibiótica en el año 2007, recomendando un uso mucho más restrictivo de esta estrategia 59. Los principales cambios fueron la eliminación de las recomendaciones para la profilaxis antibiótica de rutina para procedimientos dentales invasivos en pacientes de riesgo bajo y moderado y para la mayoría de los otros procedimientos invasivos en todos los pacientes, que podrían haber influido en los patrones epidemiológicos de la endocarditis infecciosa.
Respecto a las complicaciones, observamos una tendencia estadísticamente significativa en la disminución de insuficiencia cardíaca, embolismo mayor y ACV. En comparación a otros estudios, el diagnóstico de insuficiencia cardíaca fue menor a lo reportado, la cual asciende a cifras de 40-60% de las EI de VN izquierdas 7, 60. El mismo fenómeno fue observado en la disminución de eventos embólicos. Esto podría explicarse probablemente por el diagnóstico precoz y tratamiento antibiótico temprano en pacientes con alta sospecha de EI, como es en aquellos con prótesis valvulares o marcapasos, que representaron más de la mitad de la población del CRC.
El tratamiento quirúrgico fue implementado en el 41% de los episodios de EI en el último periodo, siendo significativamente más frecuente que en los registros multicéntricos EIRA-1 (28.2%) y EIRA-2 (17.2%). Estas cifras son similares a las reportadas a nivel internacional y en otros centros de referencia 6-9, 50, 51, pero más elevada que los datos provenientes de centros que no asisten pacientes con esta enfermedad con frecuencia 47, 61, posiblemente como resultado del sesgo de selección de población. Es interesante mencionar, sin embargo, que en un estudio prospectivo observacional a 3 años en un centro de tercer nivel de alta complejidad, dos terceras partes de los pacientes que tenían una indicación de cirugía, aun así no fueron operados, mostraron una mayor mortalidad 62.
En el análisis realizado, observamos una tendencia a una menor mortalidad hospitalaria global en el último periodo, siendo esta no estadísticamente significativa. Debe considerarse, sin embargo, que en el CRC se incluyeron pacientes con peor pronóstico: mayor EI protésica y microorganismos más virulentos (Staphylococcus spp.) que suelen tener evoluciones más tórpidas y más frecuencia de complicaciones y muerte 41.
En nuestra institución funciona desde 1998, un grupo multidisciplinario (Endocarditis team) dedicado a
evaluar pacientes con endocarditis infecciosa y acordar las estrategias de diagnóstico y tratamiento de manera individualizada. Este enfoque multidisciplinario, que ya ha demostrado ser útil en el manejo de la enfermedad valvular 63 demostró reducir significativamente la mortalidad a 1 año, del 18.5% al 8.2% en países como Francia 65 y también en EE.UU. 65. Es por esto que el Grupo de Trabajo sobre el manejo de la EI de la European Society of Cardiology apoya firmemente el control y tratamiento de estos pacientes por un equipo especializado en los centros de referencia, Endocarditis team 66, que pueda disipar dudas y añadir celeridad en las estrategias de diagnóstico y tratamiento de pacientes que, por la evolución de la enfermedad, pueden derivar en mayor riesgo quirúrgico y/o desarrollo de complicaciones.
A pesar de los avances en el diagnóstico precoz, en el tratamiento antibiótico y en los beneficios de la cirugía, la mortalidad sigue siendo elevada, y no ha mejorado en más de 2 décadas, fenómeno ya evidenciado en centros de referencia a nivel mundial 67.
Posterior a la realización de este análisis se publicó el registro EIRA-3 32, en el que se aprecian cambios similares a los evidenciados en nuestro estudio. Con una población más añosa y con mayores comorbilidades (24.5% de diabetes y 16.5% con enfermedad renal crónica) fue también más frecuente la infección de dispositivos intracardiacos, con una disminución de las EI de válvulas nativas derechas.
En cuanto a los microorganismos, también predominó el género Staphylococcus, siendo asimismo más
frecuente el SCN en EI de válvulas protésicas. Respecto a las complicaciones, también se observó una disminución de las intrahospitalarias, tales como insuficiencia cardíaca y embolias periféricas. Al igual que lo evidenciado en nuestra cohorte, se implementó más frecuentemente el tratamiento quirúrgico, siendo superior al 40%, con estabilidad de la tasa de mortalidad intrahospitalaria, que continúa siendo elevada.
En nuestro estudio, existen limitaciones metodológicas que deben ser tenidas en cuenta para interpretar los resultados. Se trata de un trabajo retrospectivo, con la posibilidad de sesgo inherente a este tipo de estudios. Otra limitación relevante es que, a pesar de constar en los tres registros, los datos de las complicaciones intrahospitalarias, en algunas de las variables (insuficiencia cardíaca, accidente cerebrovascular, absceso en el anillo) no se encuentran definidas en los registros EIRA-1 y EIRA-2, existiendo la posibilidad de variaciones en la definición entre los registros. Además, para interpretar los resultados, debemos considerar el posible sesgo de derivación, como resultado de la selección sistemática de pacientes de centros de atención terciaria para su inclusión en los estudios, ya que las características clínicas de los casos que se presentan en centros de referencia de atención terciaria con una enfermedad particular, difieren de los de la comunidad o población general 68, 69. Finalmente, el análisis en el último periodo fue desarrollado en un único centro cardiovascular de alta complejidad, pudiendo así la muestra no ser representativa de la realidad en otros centros de nuestro país; sin embargo, los resultados del recientemente publicado EIRA-3, sostienen los hallazgos reproducidos en este análisis 33.
En conclusión y de acuerdo a nuestro conocimiento, este estudio es el primero en evaluar la evolución de las características epidemiológicas, clínicas y microbiológicas de pacientes con endocarditis infecciosa en Argentina en un periodo de tiempo prolongado. A los aportes sustanciales que los registros multicéntricos EIRA 1 y 2 (y el más actual EIRA-3) ofrecieron para la comprensión de la enfermedad en nuestro país, hemos sumado los datos obtenidos del análisis de la experiencia de un centro monovalente de alta complejidad cardiovascular y su grupo de trabajo especializado (Endocarditis team).
Observamos que en los últimos años son más frecuentes las EI asociadas a dispositivos intracardiacos y el rol del género Staphylococcus spp. como microorganismos predominantes junto al claro descenso del SGV. Relacionamos la mayor indicación de tratamiento quirúrgico en el CRC al trabajo multidisciplinario (Endocarditis team) que se emparenta, tal como ocurre en países del hemisferio norte, con una tendencia a menor mortalidad hospitalaria global. Si bien estos datos corresponden a un solo centro, muestran un cambio en el perfil de la EI en Argentina y destacan la importancia del control y tratamiento de esta compleja enfermedad en centros con amplia experiencia en el cuidado de pacientes con EI.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Baddour LM, Wilson WR, Bayer AS, et al. Infective endocarditis: diagnosis, antimicrobial therapy, and management of complications: a statement for healthcare professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, and the Councils on Clinical Cardiology, Stroke, and Cardiovascular Surgery and Anesthesia, American Heart Association: endorsed by the Infectious Diseases Society of America. Circulation 2005; 111: e394-434.
2. Casabé JH. Endocarditis infecciosa: Una enfermedad cambiante. Medicina (B Aires) 2008; 68: 164-74.
3. Mocchegiani R, Nataloni M. Complications of infective endocarditis. Cardiovasc Hematol Disord Drug Targets 2009; 9: 240-8.
4. Mylonakis E, Calderwood SB. Infective endocarditis in adults. N Engl J Med 2001; 345: 1318-30.
5. Prendergast BD. The changing face of infective endocarditis. Heart 2006; 92: 879-85.
6. Lalani T, Chu VH, Park LP, et al. In-hospital and 1-year mortality in patients undergoing early surgery for prosthetic valve endocarditis. JAMA Intern Med 2013; 173: 1495-504.
7. Nadji G, Rusinaru D, Remadi JP, et al. Heart failure in leftsided native valve infective endocarditis: characteristics, prognosis, and results of surgical treatment. Eur J Heart Fail 2009; 11: 668-75.
8. Delahaye F, Alla F, Beguinot I, et al. In-hospital mortality of infective endocarditis: prognostic factors and evolution over an 8-year period. Scand J Infect Dis 2007; 39: 849-57.
9. Leone S, Ravasio V, Durante-Mangoni E, et al. Epidemiology, characteristics, and outcome of infective endocarditis in Italy: the Italian Study on Endocarditis. Infection 2012; 40: 527-35.
10. Slipczuk L, Codolosa JN, Davila CD, et al. Infective endocarditis epidemiology over five decades: a systematic review. PLoS One 2013; 8:e82665.
11. Park LP, Chu VH, Peterson G, et al. Validated risk score for predicting 6-month mortality in infective endocarditis. J Am Heart Assoc 2016; 5:e003016.
12. Murdoch DR, Corey GR, Hoen B, et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med 2009; 169: 463-73.
13. Mirabel M, Sonneville R, Hajage D, et al. Long-term outcomes and cardiac surgery in critically ill patients with infective endocarditis. Eur Heart J 2014; 35: 1195-204.
14. Tleyjeh IM, Abdel-Latif A, Rahbi H, et al. A systematic review of population-based studies of infective endocarditis. Chest 2007; 132: 1025-35.
15. Selton-Suty C, Célard M, Le Moing V, et al. AEPEI study group. Preeminence of Staphylococcus aureus in infective endocarditis: a 1-year population-based survey. Clin Infect Dis 2012; 54: 1230-9.
16. Casabé JH, Pellegrini CD, Hershson AR, et al. Endocarditis infecciosa en la República Argentina. Resultados Generales. Rev Argent Cardiol 1996; 64: 9-19.
17. Ferreiros ER, Casabé JH, Nacinovich F, et al. Endocarditis infecciosa por Staphylococcus aureus en la
Argentina: EIRA 2. Rev Argent Cardiol 2006; 74: 35-42.
18. Modenesi JC, Ferreirós ER, Swieskowski S, et al. Predictores de mortalidad intrahospitalaria de la endocarditis infecciosa en la República Argentina: resultados del EIRA-II. Rev Argent Cardiol 2005; 73: 283-90.
19. Ferreiros E, Nacinovich F, Casabé JH, et al. Epidemiologic, clinical, and microbiologic profile of infective endocarditis in Argentina: a national survey. The Endocarditis Infecciosa en la República Argentina-2 (EIRA-2) Study. Am Heart J 2006; 151: 545-52
20. Devlin RK, Andrews MM, Von Reyn CF. Recent trends in infective endocarditis: influence of case definitions. Curr Opin Cardiol 2004; 19: 134-39.
21. Mouly S, Ruimy R, Launay O, et al. The changing clinical aspects of infective endocarditis: descriptive review of 90 episodes in a French teaching hospital and risk factors for death. J Infect 2002; 45: 246-56.
22. Cabell CH, Jollis JG, Peterson GE, et al. Changing patient characteristics and the effect on mortality in endocarditis. Arch Intern Med 2002; 162: 90-4.
23. Loupa C, Mavroidi N, Boutsikakis I, et al. Infective endocarditis in Greece: a changing profile. Epidemiological, microbiological and therapeutic data. Clin Microbiol Infect 2004; 10: 556-61.
24. Hoen B, Alla F, Selton-Suty C, et al. Changing profile of infective endocarditis – Results of a 1-year survey in France. JAMA 2002; 288: 75-81.
25. Cecchi E, Forno D, Imazio M, et al. New trends in the epidemiological and clinical features of infective endocarditis: results of a multicenter prospective study. Ital Heart J 2004; 5: 249-56.
26. Pilar T. Endocarditis infecciosa: ¿tratamos correctamente a nuestros pacientes? Rev Esp Cardiol 2002; 55: 789-90.
27. Dalton SC. Infective endocarditis: Why bother with guidelines? Eur Heart J 2000; 21: 305.
28. Nacinovich F, Montes JL, Bermejo J, et al. Consenso de endocarditis infecciosa. Rev Argent Cardiol 2016; 84: Suplemento.
29. Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015; 36: 3075-128.
30. Baddour LM, Wilson WR, Bayer AS, et al. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: A Scientific Statement for Healthcare Professionals from the American Heart Association. Circulation 2015; 132: 1435-86.
31. Fernández Guerrero ML, Álvarez B, Manzarbeitia F, et al. Infective endocarditis at autopsy: a review of pathologic manifestations and clinical correlates. Medicine (Baltimore) 2012; 91: 152-64.
32. Bassetti M, Venturini S, Crapis M, et al. Infective endocarditis in elderly: An Italian prospective multi-center observational study. Int J Cardiol 2014; 177: 636-8.
33. Avellana PM, García Aurelio M, Swieszkowski S, et al. Endocarditis infecciosa en la República Argentina. Resultados del estudio EIRA 3. Rev Argent Cardiol 2018; 86: 20-8.
34. Li JS, Sexton DJ, Mick N, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis 2000; 30: 633-8.
35. Devlin RK, Andrews MM, Von Reyn CF. Recent trends in infective endocarditis: influence of case definitions. Curr Opin Cardiol 2004; 19: 134-9.
36. Hill EE, Herijgers P, Herregod MC, et al. Evolving trends in infective endocarditis. Clin Microbiol Infect 2006; 12: 5-12.
37. Ferraris L, Milazzo L, Rimoldi SG, et al. Epidemiological trends of infective endocarditis in a single center in Italy between 2003-2015. Infect Dis 2018; 50: 1-8.
38. Hill EE, Herijgers P, Claus P, et al. Infective endocarditis: changing epidemiology and predictors of 6-month mortality: a prospective cohort study. Eur Heart J 2007; 28: 196-203.
39. Durante-Mangoni E, Bradley S, Selton-Suty C, et al. Current features of infective endocarditis in elderly patients: results of the International Collaboration on Endocarditis Prospective Cohort Study. Arch Intern Med 2008; 168: 2095-103.
40. Castillo FJ, Anguita M, Castillo JC, et al. Changes in clinical profile, epidemiology and prognosis of left-sided nativevalve infective endocarditis without predisposing heart conditions. Rev Esp Cardiol 2015; 68: 445-8.
41. Fowler VG Jr, Miro JM, Hoen B, et al. Staphylococcus aureus endocarditis: a consequence of medical progress. JAMA 2005; 293: 3012-21.
42. Becerra-Muñoz VM, Ruíz-Morales J, Rodríguez-Bailón I, et al. Infective endocarditis in patients with bicuspid aortic valve: Clinical characteristics, complications, and prognosis. Enferm Infecc Microbiol Clin 2017; 35: 645-50.
43. Moreillon P, Que YA. Infective endocarditis. Lancet 2004; 363: 139-49.
44. Marks DJ, Hyams C, Koo CY, et al. Clinical features, microbiology and surgical outcomes of infective endocarditis: a 13-year study from a UK tertiary cardiothoracic referral centre. QJM 2015; 108: 219-29.
45. Gould FK, Denning DW, Elliott TS, et al. Guidelines for the diagnosis and antibiotic treatment of endocarditis in adults: a report of the Working Party of the British Society for Antimicrobial Chemotherapy. J Antimicrob Chemother 2012; 67: 269-89.
46. Seng P, Drancourt M, Gouriet F, et al. Ongoing revolution in bacteriology: routine identification of bacteria by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Clin Infect Dis 2009; 49: 543-51.
47. Bayer AS, Bolger AF, Taubert KA, et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-48.
48. DeSimone DC, Tleyjeh IM, Correa de Sa DD, et al. Temporal trends in infective endocarditis epidemiology from 2007 to 2013 in Olmsted County, MN. Am Heart J 2015; 170: 830-6.
49. Ambrosioni J, Hernandez-Meneses M, Tellez A, et al. The changing epidemiology of infective endocarditis in the Twenty-First Century. Curr Infect Dis Rep 2017; 19: 21.
50. Fedeli U, Schievano E, Buonfrate D, et al. Increasing incidence and mortality of infective endocarditis: a population based study through a record-linkage system. BMC Infect Dis 2011; 11: 48.
51. Cecchi E, Chirillo F, Castiglione A, et al. Clinical epidemiology in Italian Registry of Infective Endocarditis (RIEI): Focus on age, intravascular devices and enterococci. Int J Cardiol 2015; 190: 151-6.
52. Murdoch DR, Corey GR, Hoen B, et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med 2009; 169: 463-73.
53. Trabelsi I, Rekik S, Znazen A, et al. Native valve infective endocarditis in a tertiary care center in a developing country (Tunisia). Am J Cardiol 2008; 102: 1247-51.
54. Xu H, Cai S, Dai H. Characteristics of infective endocarditis in a tertiary hospital in East China. PLoS One 2016; 11:e0166764.
55. Wang A, Athan E, Pappas PA, et al. Contemporary clinical profile and outcome of prosthetic valve endocarditis. JAMA 2007; 297: 1354-61.
56. López J, Revilla A, Vilacosta I, et al. Definition, clinical profile, microbiological spectrum, and prognostic factors of early-onset prosthetic valve endocarditis. Eur Heart J 2007; 28: 760-5.
57. Alonso-Valle H, Fariñas-Álvarez C, García-Palomo J.D, et al. Clinical course and predictors of death in prosthetic valve endocarditis over a 20-year period. J Thorac Cardiovasc Surg 2010; 139: 887-93.
58. Athan E, Chu VH, Tattevin P, et al. Clinical characteristics and outcome of infective endocarditis involving implantable cardiac devices. JAMA 2012; 307: 1727-35.
59. Chu VH, Woods CW, Miro JM, et al, International Collaboration on Endocarditis-Prospective Cohort Study Group. Emergence of coagulase-negative staphylococci as a cause of native valve endocarditis. Clin Infect Dis 2008; 46: 232-42.
60. Wilson W, Taubert KA, Gewitz M, et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007; 116: e376-7.
61. Hasbun R Vikram HR Barakat LA, et al. Complicated leftsided native valve endocarditis in adults: risk classification for mortality. JAMA 2003; 289: 1933-40.
62. Pericart L, Bernard A, Bourguignon T, et al. Comparison of outcome of possible versus definite infective endocarditis involving native heart valves. Am J Cardiol 2017;119: 1854-61.
63. Korem M, Israel S, Gilon D, et al. Epidemiology of infective endocarditis in a tertiary-center in Jerusalem: A 3-year prospective survey. Eur J Intern Med 2014: 25; 550-5.
64. Lancellotti P, Rosenhek R, Pibarot P, et al. ESC Working Group on Valvular Heart Disease position paper—heart valve clinics: organization, structure, and experiences. Eur Heart J 2013; 34: 1597-606.
65. Botelho-Nevers E, Thuny F, Casalta JP, et al. Dramatic reduction in infective endocarditis-related mortality with a management-based approach. Arch Intern Med 2009; 169: 1290-98.
66. Chirillo F, Scotton P, Rocco F, et al. Impact of a multidisciplinary management strategy on the outcome of patients with native valve infective endocarditis. Am J Cardiol 2013; 112: 1171-6.
67. Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015; 36: 3075-128.
68. Cahill TJ, Baddour LM, Habib G, et al. Challenges in infective endocarditis. J Am Coll Cardiol 2017; 69: 325-44.
69. Melton LJ. Selection bias in the referral of patients and the natural history of surgical conditions. Mayo Clin Proc 1985; 60: 880-5.
70. Al-Hasan MN, Eckel-Passow JE, Baddour LM. Influence of referral bias on the clinical characteristics of patients with Gram-negative bloodstream infection. Epidemiol Infect 2011; 139: 1750-6.
