GABRIELA V. CARRO 1, ELSA CARLUCCI 1, GRACIELA PRIORE 2, FERNANDO GETTE 3, MARÍA DE LOS ÁNGELES LLANOS 4, MARÍA VICTORIA DICATARINA LOSADA 1, MARÍA LAURA NOLI 1, PABLO S. AMATO 5
1 Servicio de Clínica Médica, 2 Sección Microbiología, 3 Cirugía Vascular, 4 Servicio de Fisiatría, 5 Servicio de Traumatología, Unidad de Pie Diabético, Hospital Nacional Profesor Alejandro Posadas, El Palomar, Buenos Aires, Argentina
Resumen Las infecciones del pie diabético se asocian a complicaciones graves y constituyen la principal causa de hospitalización relacionada con diabetes y amputación de miembros inferiores. Para evitar su progresión, se requiere una conducta inicial rápida y adecuada que incluye toma de muestras para cultivos e inicio inmediato de tratamiento antibiótico empírico, según las características de las lesiones y la prevalencia local de microorganismos. Por ello, es necesario conocer y vigilar la microbiología local y la resistencia a los antimicrobianos. El objetivo de este trabajo fue describir la frecuencia de gérmenes en infecciones de pie diabético en pacientes ambulatorios asistidos en nuestro hospital en 2018 e identificar el esquema antibiótico con mayor cobertura, en comparación con los resultados de un estudio similar realizado en 2015. Fueron analizadas 72 muestras tomadas mediante punción por piel sana de partes blandas. Entre los 68 gérmenes aislados, los Gram negativos fueron los más frecuentes (47.1%), lo que representa un aumento significativo en relación a la frecuencia observada en 2015 (24.6%) p = 0.01 y un aumento de la sensibilidad a ciprofloxacina de 25% a 62.5% (p=0.03). El esquema con mayor cobertura fue amoxicilina-clavulánico con ciprofloxacina (77.9%) mientras que en 2015 fue amoxicilina-clavulánico con trimetoprima sulfametoxazol. La vigilancia de la microbiología local es fundamental para la elección del antibiótico empírico en las infecciones de pie diabético. En nuestro hospital, cuando la infección es de partes blandas, se recomienda la combinación amoxicilina-clavulánico más ciprofloxacina como esquema antibiótico empírico según los hallazgos de este estudio.
Palabras clave: infección de pie diabético, tratamiento empírico, antibiótico, microbiología
Abstract Infections in diabetic foot. Choice of empirical antibiotic regimen. Diabetic foot infections are related to severe complications and constitute the main reason for diabetes-related hospitalization and lower limb amputations. A diabetic foot infection requires prompt actions to avoid progression of the infected wound; a soft tissue sample has to be taken for microbiological culture and empiric antibiotic therapy must be started immediately. Empiric antibiotic schemes should be chosen based on the severity of the infection and the local prevalence of microbial causal agents. Therefore, it is important to monitor these indicators. The aim of this study was to determine which microorganisms were more prevalent in cultures of diabetic foot infections during 2018 and what antibiotic combination was better to cover local microbiology, compared with data available from 2015 for a similar cohort. A total of 68 positive cultures were obtained of 72 soft tissue specimens analyzed. The most frequent microorganisms were Gram negative (47.1%), and resulted significantly more frequent than in 2015 (24.6%) p = 0.01. These Gram negative germs also resulted more sensitive to ciprofloxacin than in 2015 (62.5% vs. 25.0%) p = 0.03. Amoxicillin-clavulanate plus ciprofloxacin was the optimal combination therapy in 2018, while in 2015 it was amoxicillin-clavulanate plus trimethoprim sulfamethoxazole. In agreement with these results, we recommend amoxicillin-clavulanate plus ciprofloxacin as the empiric antibiotic regimen of choice for soft tissue infections in diabetic foot. We consider surveillance of local microbiology to be an important tool in the management of diabetic foot infections.
Key words: diabetic foot infection, empiric regimen, antibiotic, microbiology
Dirección postal: Gabriela V. Carro, Maison 769, 1714 Castelar, Buenos Aires, Argentina
e-mail: gabivcarro@yahoo.com.ar
El pie diabético (PD) es definido por la OMS como la ulceración, infección o gangrena del pie. Está asociado a neuropatía diabética y enfermedad arterial periférica, y es el resultado de la interacción compleja de diferentes factores, principalmente metabólicos 1.
Entre el 19 y el 34% de los pacientes con diabetes mellitus (DM) tienen una úlcera en el pie a lo largo de su vida 2 y entre el 14 y el 24% de dichos pacientes requiere amputación 3-5. Luego de una amputación mayor, la sobre vida del paciente disminuye hasta un 50% a los 5 años, lo cual implica una mortalidad más alta que la de varios tipos de cáncer 6-8.
Los gérmenes involucrados en la infección del PD varían de acuerdo a las características y el tiempo de evolución de la lesión, el lugar de residencia del paciente y el uso previo de antibióticos, entre otros factores 6, 7. En úlceras sin infección no está recomendado el tratamiento antibiótico. En lesiones clínicamente infectadas se recomienda la toma de muestra para cultivo y el inicio de tratamiento antibiótico empírico con el fin de evitar la progresión del daño de los tejidos mientras se espera la identificación del agente infeccioso. Este tratamiento inicial es elegido sobre la base de la severidad de la infección y los datos disponibles acerca de la prevalencia local de patógenos 7, 8. La identificación del germen en el cultivo demora desde 48 horas hasta varios días, por lo cual el tratamiento empírico deberá ser lo más adecuado posible a los datos microbiológicos del medio en el cual se atiende el paciente.
Durante muchos años, la elección del tratamiento antibiótico empírico en nuestro medio se ha basado en recomendaciones y datos microbiológicos de la bibliografía internacional procedente de países de diferente nivel socioeconómico, clima y ubicación geográfica. En 2015, se realizó el primer relevamiento prospectivo de gérmenes en infecciones de PD en el Hospital Nacional Prof. A. Posadas, de Argentina (Carro, GV, Priore G, Di Bartolomeo S, Llanos MA, Gette F. Informe no publicado). En ese estudio se determinó que el esquema compuesto por trimetoprima sulfametoxazol junto con amoxicilina clavulánico presentaba mayor cobertura para las infecciones de PD ambulatorias en dicho hospital que las combinaciones ciprofloxacina-clindamicina o ciprofloxacina-metronidazol que se utilizaban hasta entonces.
Los objetivos de este trabajo fueron: (i) determinar la frecuencia de los diferentes gérmenes en los cultivos de partes blandas tomadas de úlceras de PD clínicamente infectadas en pacientes ambulatorios durante 2018 en consultorio externo de nuestro hospital, (ii) describir el porcentaje de cobertura de las diferentes combinaciones de antibióticos, y (iii) comparar los resultados con los de un estudio similar realizado en 2015 en el mismo hospital para evaluar si el esquema sugerido como empírico en ese año sigue siendo el de elección en 2018.
Materiales y métodos
Se trata de un estudio comparativo descriptivo observacional llevado a cabo en pacientes ambulatorios con PD con lesiones clínicamente infectadas asistidos en el período 01/03/18 01/09/18 en el consultorio de pie diabético del Hospital Nacional Prof. Alejandro Posadas. Las lesiones fueron consideradas clínicamente infectadas cuando cumplían al menos dos de los siguientes criterios 7: edema o induración local, dolor local, eritema >0.5 cm alrededor de la herida, calor local, descarga de material purulento. Fueron incluidas muestras de partes blandas tomadas mediante punción por piel sana (PPS), previo lavado con solución fisiológica y clorhexidina seguido de antisepsia con iodo-povidona. La toma de muestra se realizó con una aguja 16×5-25 GX 5/8 instilando 1 ml de solución fisiológica y luego aspirando el material, o bien punzando el contenido de una colección.
Las muestras fueron sembradas en placas agar sangre de carnero, agar chocolate, agar MacConkey y caldo tioglicolato. Las placas fueron incubadas 48 horas, y el caldo durante 7 días, en atmósfera al 5% de CO 2. La tipificación y la sensibilidad a antibióticos de los gérmenes aislados fueron determinadas por el método automatizado VITEK 2 (Biomerieux). Para anaerobios la siembra se realizó en placas de agar cerebro corazón (BHI) enriquecidas con sangre lacada, vitamina K y amikacina y las placas fueron incubadas 48 horas en atmósfera anaeróbica. La identificación de estos gérmenes se realizó por tipificación manual.
Los resultados fueron comparados con los datos de pacientes ambulatorios obtenidos en 2015 en el mismo hospital.
Para variables cualitativas la muestra se describe mediante medidas de proporción. Se realizó test de Chi2 para tablas de doble entrada para analizar la asociación de dos variables cualitativas. Se utilizó el programa de estadística VCCstat.
Resultados
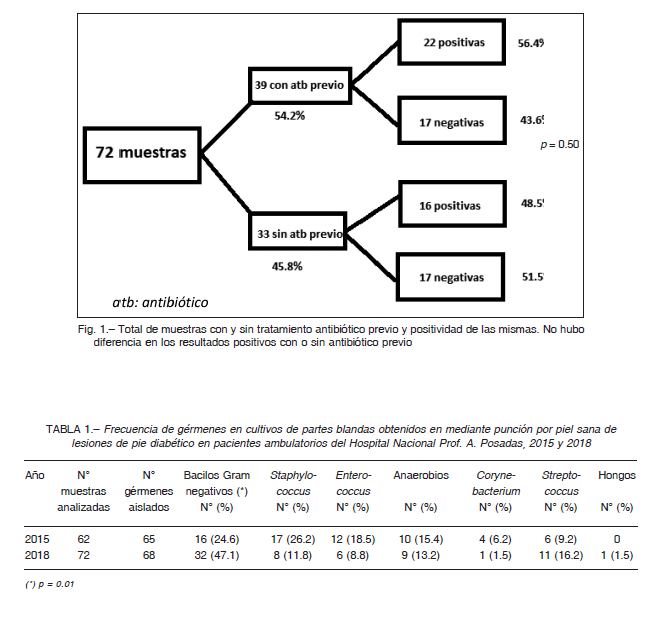
De las 72 muestras analizadas en 2018, 38 (52.8%) fueron positivas, con aislamiento e identificación de 68 gérmenes. Dieciocho cultivos (46.2%) fueron monomicrobianos. Treinta y nueve muestras (54.2%) fueron tomadas de lesiones de pacientes previamente tratados con antibióticos. El rescate de gérmenes en los cultivos fue similar en presencia y ausencia de tratamiento antibiótico p = 0.50 (Fig. 1). De los pacientes con tratamiento, 43.6% (17/39) estaban tratados con un solo antibiótico. El resto (56.4%, 22/39) había recibido más de un antibiótico en el esquema. La Tabla 1 muestra los gérmenes aislados en los cultivos. Estos resultados fueron comparados con los obtenidos en el mismo hospital en 2015 de muestras tomadas mediante la misma técnica de úlceras de 62 diabéticos ambulatorios, con un aislamiento de 65 gérmenes.
Los Gram negativos aumentaron su frecuencia del 24.6% en 2015 al 47.1% en 2018 (p = 0.012). El resto de las diferencias en la frecuencia de gérmenes entre ambos estudios no fue estadísticamente significativo.
El porcentaje de cultivos positivos para bacilos Gram negativos, Staphylococcus, Enterococcus y anaerobios no difirió significativamente en presencia y ausencia de antibióticos.
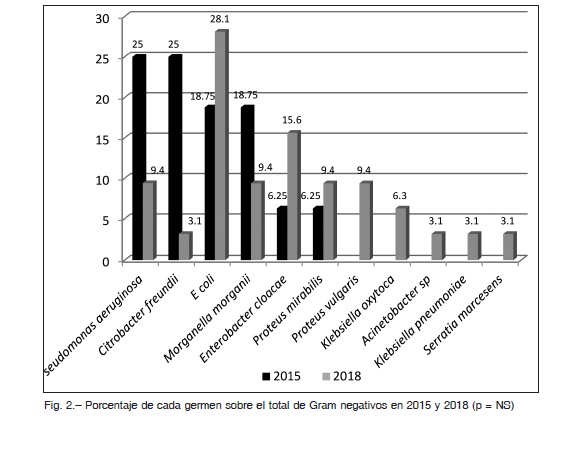
La contribución de cada germen Gram negativo en 2015 y en 2018 se grafica en la Figura 2.
La comparación de la sensibilidad de los diferentes gérmenes a los antibióticos se describe en la Tabla 2. La sensibilidad de los Gram negativos a la ciprofloxacina aumentó del 25% en 2015 al 62.5% en 2018 (p = 0.03). El resto de las variaciones en la sensibilidad a los antibióticos no fue estadísticamente significativo.
En la Tabla 3 se muestra el porcentaje de cobertura de cada combinación de antibióticos en 2015 y en 2018. No hubo diferencias estadísticamente significativas entre la cobertura antibiótica previa (2015) y la actual (2018).
Discusión
La comparación de los resultados de los cultivos de pie diabético por PPS realizados en 2015 y 2018 en pacientes ambulatorios muestra que la frecuencia de gérmenes Gram negativos aumentó en forma estadísticamente significativa en los últimos tres años. Bacterias como Escherichia coli y Enterobacter cloacae aumentaron mientras que otras como Morganella morganii o Pseudomonas aeruginosa disminuyeron, pero estas variaciones no fueron estadísticamente significativas. En varios estudios de países en desarrollo, se ha notado en los últimos años un aumento en la prevalencia de gérmenes Gram negativos como causa de infección en pie diabético, especialmente en climas cálidos y húmedos, y en determinadas condiciones de higiene y socioculturales 8. Los hallazgos de este estudio muestran un aumento similar. Existen además trabajos en India y China que presentan prevalencias mayores de Gram negativos sobre Gram positivos desde hace varios años 9-12. El aumento de Gram negativos en nuestra institución podría ser interpretado como secundario a la mayor gravedad de presentación de las infecciones en pie diabético. El nuestro es un hospital de tercer nivel y en el transcurso de los últimos años se ha profundizado su rol como centro de derivación de casos graves, con múltiples tratamientos y esquemas antibióticos previos, lo cual favorece la presencia de gérmenes Gram negativos 7.
Con respecto a la técnica de PPS, diversos autores no la recomiendan para la toma de muestra de cultivo en PD 13, 14. En las guías de la Infection Disease Society of America 7 se recomienda el cultivo de la lesión infectada por biopsia o legrado del fondo de la úlcera luego de su desbridamiento y se considera un método aceptable la aspiración con aguja fina de secreciones o celulitis. En este estudio, la toma de muestra para cultivo se realizó de acuerdo al procedimiento sugerido en el Consenso PriCUPP 15. A pesar de tratarse de un consenso sobre úlceras por presión, describe en detalle la técnica para la toma de muestra por PPS. En dicho consenso se indica que este tipo de toma de muestra es útil cuando hay reacción inflamatoria perilesional o colecciones.
En nuestro conocimiento, la PPS es una técnica muy utilizada en diferentes centros de nuestro país donde son atendidos pacientes con pie diabético, por su amplia disponibilidad y porque no presenta dificultades técnicas para su realización. Los resultados de PPS orientan el tratamiento antibiótico definitivo en varias instituciones de nuestro medio.
Una debilidad de este trabajo es no haber clasificado los casos según las características de las lesiones y la gravedad de las mismas. Tampoco se registró el índice tobillo-brazo. Teniendo en cuenta que son pacientes tratados en forma ambulatoria, no fueron incluidos aquellos con infección sistémica o enfermedad grave.
Según nuestros resultados, amoxicilina-clavulánico más ciprofloxacina pasó a ser el esquema antibiótico con mayor cobertura en pacientes de consultorio, y esto se explicaría por el aumento de los Gram negativos asociado al aumento de su sensibilidad a la ciprofloxacina. Este aumento podría justificarse si tenemos en cuenta que luego de 2015 se comenzó a utilizar amoxicilina-clavulánico más trimetoprima-sulfametoxazol como esquema empírico de elección, y se abandonó la combinación ciprofloxacina con clindamicina que se empleaba hasta entonces por presentar una menor cobertura. La suspensión del uso de la ciprofloxacina explicaría la disminución observada de la resistencia, ya que su utilización en forma habitual puede generar resistencia en los comensales Gram negativos 16.
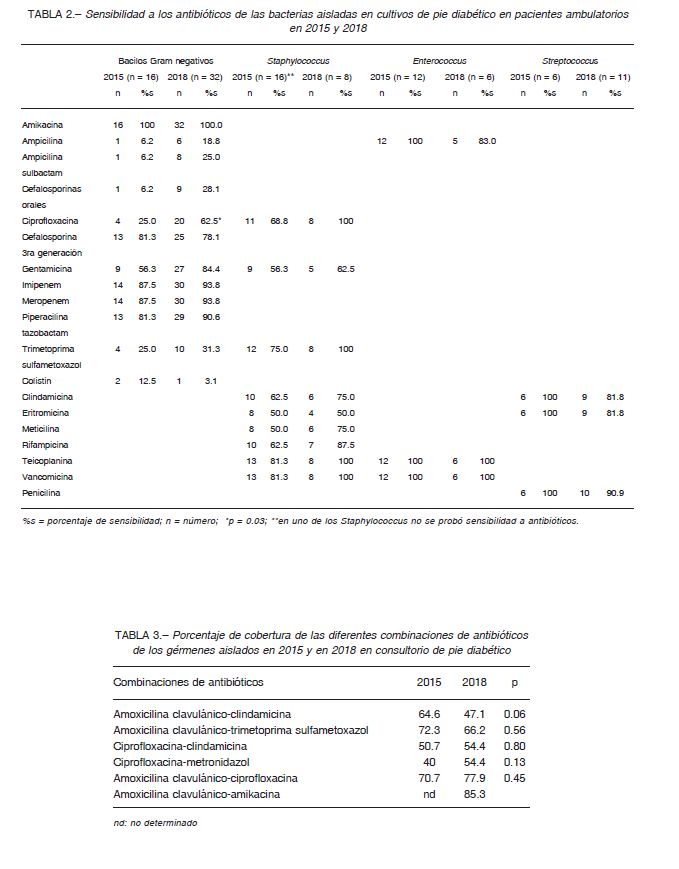
Cuando se elige amoxicilina-clavulánico más ciprofloxacina en forma empírica, debe tenerse en cuenta que para el cálculo de la cobertura se incluyó a los Staphylococcus, que presentaron 100% de sensibilidad a ciprofloxacina. El Staphylococcus aureus es el germen más frecuente en la osteomielitis de pie diabético, aunque suele ser parte de infecciones polimicrobianas 13, 14. Cuando el paciente tiene signos compatibles con osteomielitis, la ciprofloxacina no sería el antibiótico de elección, porque suele generar resistencia durante el tratamiento de la osteomielitis por Staphylococcus 14. En este caso, consideramos aconsejable iniciar tratamiento empírico con amoxicilina clavulánico-trimetoprima sulfametoxazol y luego evaluar el ajuste del esquema según los resultados microbiológicos, tratando de aislar gérmenes en muestra de hueso si el tratamiento de la osteomielitis no fuera quirúrgico y requiriese varias semanas de antibióticos.
En resumen, la elección del tratamiento antibiótico empírico en pie diabético en nuestro hospital, debería estar orientado a los esquemas con mayor cobertura de gérmenes. Amoxicilina-clavulánico más ciprofloxacina es la combinación indicada en casos de infecciones de partes blandas y amoxicilina-clavulánico más trimetoprima-sulfametoxazol lo es en caso de sospecha de osteomielitis.
Consideramos que la vigilancia de la prevalencia de gérmenes en las infecciones en pie diabético debe ser continua para evaluar eventuales cambios y actuar en consecuencia, dada la gravedad de las complicaciones que esta condición genera, tales como amputaciones menores, mayores y la consecuente invalidez.
Agradecimientos: AL Dr. Matías Baldini por su colaboración en la confección y redacción del trabajo.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Boulton A. The diabetic foot: grand overview, epidemiology and pathogenesis. Diabetes Metab Res Rev 2008; 24: S3-S6.
2. Armstrong D, Boulton A, Bus S. Diabetic foot ulcers and their recurrence. N Eng J Med 2017; 376: 2367-75.
3. Consensus Development Conference on Diabetic Foot Wound Care: 7-8 April 1999, Boston, Massachusetts. American Diabetes Association. Diabetes Care 1999; 22: 1354-60.
4. Armstrong, D. Lavery, L. Diabetic foot ulcers: Prevention, diagnosis and classification. Am Fam Physician 1998; 57: 1325-32.
5. Vas P, Edmonds M, Kavarthapu V, et al. The diabetic foot attack: “T´is too late to retreat!”. Int J Low Extrem Wounds 2018; 17: 7-13.
6. Jupiter D, Thorud J, Buckley C, Shibuya N. The impact of foot ulceration and amputation on mortality in diabetic patients. I: From ulceration to death, a systematic review. Int Wound J 2016; 13: 892-903.
7. R, Lispky A. Berendt AR, Cornia PB, et al. 2012 Infectious Diseases Society of America clinical practice guideline for the diagnosis and treatment of diabetic foot infections. Clin Infect Dis 2012; 54: e132-73.
8. Spichtler A, Hurwitz B, Armstrong D, Lipsky B. Microbiology of diabetic foot infections: from Louis Pasteur to crime scene investigation. BMC Med 2015; 13: 2-13.
9. Gadepalli R, Dhawan B, Sreenivas V, Kapil A, Ammini AC, Chaudhry R. A Clinico-microbiological study of diabetic foot ulcers in an Indian tertiary care hospital. Diabetes Care 2006; 29: 1727-32.
10. El-Tahawy AT. Bacteriology of diabetic foot. Saudi Med J 2000; 21: 344-7.
11. Raja NS. Microbiology of diabetic foot infections in teaching hospital in Malaysia: a retrospective study of 194 cases. J Microbiol Immunol Infect 2007; 40: 39-44.
12. Li X, Qi X, Yuang G, et al. Microbiological profile and clinical characteristics of diabetic foot infection in northern China: a retrospective multicentre survey in the Beijing area. J Med Microbiol 2018; 67: 160-8.
13. Malhotra R, Chang CS, Nather A. Osteomyelitis in the diabetic foot. Diabet Foot Ankle 2014; 5: 1.
14. Fraimow, HS. Systemic antimicrobial therapy in osteomyelitis. Semin Plast Surg 2009; 23: 90-9.
15. Primer Consenso de Úlceras por Presión (PriCUPP). Bases para la implementación de un Programa de prevención, diagnóstico y tratamiento de las úlceras por presión. Coordinadores: Acad. Fortunato Benaim y Acad. Jorge Neira. Academia Nacional de Medicina de Buenos Aires. 2017. En: http://www.acamedbai.org.ar/PriCUPP.pdf; consultado en enero 2019.
16. Barwell N, Devers M. Kennon B, et al. Diabetic foot infection: Antibiotic therapy and good practice recommendation. Int J Clin Pract 2017; 71: e13006.
17. Citron D, Goldstein E, Merriam C, Lipsky B, Abramson M. Bacteriology of moderate to severe diabetic foot infections and in vitro activity of antimicrobial agents. J Clin Microbiol 2007; 45: 2819-28.
18. Goldstein E, Citron D, Nesbit C. Diabetic foot infections. Bacteriology and activity of 10 oral antimicrobial agents against bacteria isolated from consecutive cases. Diabetes Care 1996; 19: 638-41.
19. Abdularzak A, Bitar Z, Al-Shamali A, Mobasher L. Bacteriological study of diabetic foot infections. J Diabetes Complications 2005; 19: 138-41.
20. Wheat L, Allen S, Henry M, et al. Diabetic foot infections: Bacteriologic analysis. Arch Intern Med 1986; 146: 1935-40.
21. Pathare N, Bal A, Talvalkar G, Antani U. Diabetic foot infections: a study of micro-organisms associated with the different Wagner grades. Indian J Pathol Microbiol
1998; 41: 437-41.
22. Elguera Falcón F, Solís Villanueva J, Neyra Arizmendiz L. Estudio bacteriológico de pacientes con pie diabético infectado en el Hospital Arzobispo Loayza. Rev Soc Per Med Inter 2006; 19: 5-9.
23. Hunt IA. Foot infections in diabetes are rarely due to a single microorganism. Diabet Med 1992; 8: 749-52.
24. Ozkara A, Tuncay, D. The major clinical outcomes of diabetic foot infections: One center experience. Open Medicine 2008; 3: 464-9.
Richard Horton*
Offline: What is science for? Lancet 2018; 392: 198.
*Editor-in-chief of The Lancet, since 1995.
