NOEL LORENZO VILLALBA 1, EDGAR RIVERA MARTÍNEZ 2, JERÓNIMO ARTILES VIZCAÍNO 3, NERY SABLÓN GONZÁLEZ 4, IVÁN MARRERO MEDINA 3, SATURNINO SUÁREZ ORTEGA 3
1 Service de Médecine Interne Centre Hospitalier Saint Cyr, Francia, 2 Servicio de Medicina Interna, Hospital La Paloma, Gran Canaria, España, 3 Servicio de Medicina Interna. Hospital Universitario de Gran Canaria Dr. Negrín, España, 4 Servicio de Nefrología, Hospital Universitario de Gran Canaria Dr. Negrín, España
Resumen El diagnóstico de hiperaldosteronismo primario (HPAP) aumentó en los últimos años y algunos autores lo consideran la principal causa de hipertensión arterial secundaria. Estudiamos la prevalencia de HPAP en el total de pacientes hipertensos atendidos en la Unidad de Hipertensión Arterial, en el período comprendido entre julio 1999 a julio 2017. Se incluyeron 2500 pacientes y en 79 se diagnosticó HPAP (3.2%). El HPAP fue más frecuente en mujeres (55.7%), observándose un incremento en la edad geriátrica con relación a estudios previos (27.8%). El diagnóstico se sospechó ante la presencia de kaliuria inapropiada y alcalosis metabólica, acompañada de un cociente aldosterona/actividad de renina plasmática superior a 30 (ng/dl)/(ng/ml/h). Tras su confirmación se realizaron estudios de imagen para determinar la etiología. Se detectaron así 29 casos (36.8%) de adenomas productores de aldosterona y 5 de hiperplasia bilateral suprarrenal con nódulos. La tomografía computarizada identificó el 100% de los adenomas y de las hiperplasias con nódulos corticales bilaterales. El tratamiento con suprarrenalectomía y/o antialdosterónicos resultó eficaz en el control de la presión
arterial en el 69.9% de los casos. Se comentan aspectos particulares de esta serie, como la remisión de la insuficiencia renal, la elevada presencia de litiasis urinaria hipercalciúrica y la detección de un carcinoma de mama tras dosis prolongadas de espironolactona.
Palabras clave: hiperaldosteronismo primario, hipokaliemia, kaliuria inapropiada, actividad renina plasmática/aldosterona
Abstract Primary hyperaldosteronism in a population of hypertensive patients. The diagnosis of primary hyperaldosteronism (PHPA) has progressively increased over the last years and some authors consider it as the main cause of secondary hypertension. We studied the prevalence of PHPA in hypertensive patients followed at the Hypertension Unit from July 1999 to July 2017. A total of 2500 patients were included and diagnosis of PHPA was done in 79 of them (3.2%). It was more frequent in women (55.7%) with an increased incidence in the elderly, as compared to previous studies (27.8%). Initial diagnosis was suspected upon the presence of inappropriate kaliuria and metabolic alkalosis, associated to an aldosterone/plasma renin activity ratio > 30 (ng/dl)/(ng/ml/h). After confirmation of the presence of PA, imaging techniques to determine the etiology were performed. In this way, 29 cases (36.8%) of aldosterone-producing adenoma and 5 cases of bilateral adrenal hyperplasia with nodules were identified. Computed tomography identified the adenomas and hyperplasias with bilateral cortical nodules in all patients. Adrenalectomy and/o r antialdosteronics were efficient in controlling blood pressure in 69.9% of cases. Of note in this series was the remission of stage 3 chronic renal failure in two cases, the high prevalence of hypercalciuric urinary lithiasis and a case of breast carcinoma after prolonged treatment with spironolactone.
Key words: primary hyperaldosteronism, hypokalemia, inappropriate kaliuria, Plasma renin activity/aldosterone
Dirección postal: Noel Lorenzo Villalba, Service de Médecine Interne, Centre Hospitalier Saint Cyr, Route de Fumel, Lieu-dit de Brignol, 47300 Francia
e-mail: noellorenzo@gmail.com
No es habitual incluir, para el control de la presión arterial (PA), medidas orientadas al análisis del mecanismo fisiopatológico básico de su génesis en un paciente individual 1-3.
Desconocemos las bases fisiopatológicas que generan la elevación de la PA en gran parte de los sujetos y en una escasa proporción atendemos a la causa etiológica específica. Estos últimos son englobados en el apartado común de hipertensión secundaria 4. ¿Cuándo deberíamos buscar de manera generalizada en los hipertensos una enfermedad específica? Hay que analizar tres aspectos para decidir si se debe realizar una búsqueda etiológica en cada hipertenso de manera genérica: a) prevalencia de la enfermedad, b) factibilidad del proceso diagnóstico y c) utilidad del diagnóstico. La prevalencia porcentual de muchas de estas afecciones hace que en el paciente individual solo sean buscadas cuando existen datos concretos o cuando nos encontramos ante una situación definida de hipertensión refractaria 5. Del mismo modo que la hipertensión arterial (HTA) es un cuadro sindrómico también lo es el hiperaldosteronismo primario (HPAP), término genérico que engloba diversos trastornos asociados y caracterizados por la secreción crónica excesiva de aldosterona, ya de forma parcial o totalmente autónoma de su regulación por el sistema renina-angiotensina 6. El HPAP representa a su vez solo una fracción de un grupo de procesos, los hipermineralocorticismos, vinculados a la aldosterona o a hormonas similares, para diferenciarlos de los ligados al cortisol o síndrome de Cushing. En el HPAP no se trata de un único proceso, sino de un proceso con distintas etiologías y formas de presentación clínica que varían desde el paciente con HTA grave refractaria e hipopotasemia hasta el hipertenso con mínimas elevaciones de PA sin ninguna característica diferenciadora, incluso pacientes con normokalemia y normotensión 7. Fisiopatológicamente, el sistema renina-angiotensina-aldosterona representa la alteración primaria del punto final del sistema regulador de la PA a largo plazo en el desarrollo evolutivo del ser humano.
Los niveles plasmáticos de aldosterona, que pueden estar altos o normales, son excesivos y no suprimibles, la actividad de renina plasmática (ARP) está suprimida, se produce retención de agua y sal y se desarrolla HTA de distinto grado según el caso y el tiempo de evolución del proceso. Estos hallazgos pueden acompañarse de kaliuria inapropiada, es decir, kaliuria elevada en presencia de kaliemia inferior a 4.0 mEq/l 8. El HPAP es la causa más frecuente de HTA de etiología conocida y ello justifica descartarlo ante cualquier hipertenso 9,10. Teniendo en cuenta las consideraciones expuestas, realizamos un estudio descriptivo de prevalencia de HPAP, comenzando por la detección de kaliuria inapropiada en presencia de kaliemia inferior a 4.0 mEql/l.
Materiales y métodos
Se realizó un estudio descriptivo de corte transversal retrospectivo en el período comprendido entre el 1 de julio 1999 al 1 de julio de 2017, incluyendo los hipertensos no controlados o con sospecha de HTA secundaria, atendidos en la Unidad de Hipertensión Arterial del Hospital Universitario de Gran Canaria Dr. Negrín. Se excluyeron aquellos con lesiones tumorales en la valoración inicial, a excepción de aquellos con nódulos adrenales. Se consideró HTA a cifras basales, sin tratamiento farmacológico, de PAS (presión arterial sistólica) = 140 y/o PAD (presión arterial diastólica) = 90 mmHg, según guías europeas y españolas de HTA en el período del estudio 11.
Se recogieron variables generales como sexo, edad e índice de masa corporal y analíticas (hemograma, creatinina, urea, aclaramiento de creatinina, Na, K, ácido úrico, calcio, fósforo, ALT, gases venosos, urianálisis y, en orina de 24 horas, creatinina, microalbuminuria, uratos, calcio, fósforo, Na y K), electrocardiograma y ecografía abdominal. Las determinaciones analíticas fueron realizadas en ausencia de procesos intercurrentes de infección o inflamación. Se incluyeron así 2500 pacientes hipertensos.
Considerando el HPAP como un trastorno hormonal, para su investigación se siguieron las normas clásicas aplicadas en el estudio de los trastornos hormonales. Así, inicialmente se demostró bioquímicamente el HPAP y, posteriormente, se identificó la alteración anatómica que lo produjo.
En el subgrupo con sospecha de HPAP (kaliuria inapropiada > 30 mEq/día con kaliemia inferior a 4.0 mEq/l), se continuó el estudio de forma secuencial con la determinación de la aldosteronemia (A) y la ARP basal o esta determinación directamente en pacientes con incidentalomas 12. La A y ARP se determinaron en decúbito supino y con una dieta de 200 mEq de ClNa, considerándose niveles normales de aldosteronemia por debajo de 18 ng/dl, ARP 0.1-1 ng/ml/h y cociente A/ARP<30(ng/dl)/(ng/mL/h). Cuando la aldosteronemia estaba elevada y el cociente A/ARP era superior a 30, se procedió a un test de supresión con captopril o suero fisiológico, para confirmar el diagnóstico de HPAP, que estuvo presente en 79 pacientes (3.2%). Luego se realizó tomografía abdominal en todos los casos para definir la etiología y el tratamiento 13, 14. Se analizaron aspectos específicos en el HPAP, como la prevalencia de hipernatremia y litiasis urinaria y el nivel de remisión de la insuficiencia renal crónica cuando se trata el HPAP. Los datos se analizaron a través del programa SPSS versión 23 mediante frecuencias y estadísticos descriptivos. Los resultados se presentan en por cientos, medias y desviación estándar. La relación entre variables se estudió utilizando la correlación de Pearson, considerándose significativa en el nivel 0.01 (bilateral).
Resultados
Del total de 2500 pacientes incluidos en el estudio, se demostró la presencia de HPAP en 79 (3.2%), 44 de ellos eran mujeres (55.7%) y la edad media fue de 56 ± 11 años, siendo 22 (27.8%) mayores de 65 años y solo dos de etnia negra. La PAS inicial media fue de 186 ± 19 y la PAD inicial media fue de 105 ± 12 mmHg. Tras tratamiento la media de PAS fue 136 ± 8 y la PAD 83 ± 4 mmHg. El índice de masa corporal medio fue de 27.2 ± 3.6 Kg/m2. La kaliemia media 3.3 ± 0.5 mEq/l y la kaliuria media 78.9 ± 25.9 mEq/ día (intervalo entre 36-142). En 28 (35%) hipertensos la kaliemia se situó entre 3.5 y 4.0 mEq/l. La natremia media fue de 143 ± 2mEq/l, encontrándose hipernatremia en 13 pacientes (16.5%). La calciuria media fue de 270 ± 78.5 mg/dl. Se apreció hipercalciuria (calciuria normal hasta 260 mg de calciuria al día en 46 pacientes (58%) y litiasis urinaria en 19 con HPAP (24%), resultados superiores a los de otros estudios, que tras varias comunicaciones presentadas por nuestro grupo 15 está en torno al 13%.
La aldosteronemia se encontró elevada en todos los casos con una media de 37.6 ± 26.9 ng/dl; incluso en 3 pacientes se superó los 100 ng/dl correspondiendo a aquellos con hiperplasia asociada a adenomas bilaterales múltiples. La media de ARP fue de 0.27±0.16 ng/ml/h. La ARP fue inferior a 0.2 ng/ml/h en 55 casos (69.6%) y en el resto inferior a 1.0 ng/ml/h. Entre 0.2 y 0.3 ng/ml/h se encontraron 13 casos (16.5%). La sensibilidad de un valor inferior a 0.3 ng/ml/h fue del 86.1%. La media del cociente A/ARP resultó 221.58 ± 252.19 (ng/dl)/(ng/ml/h). Se excluyó un caso de 22 donde coexistió el HPAP con HTA renovascular. Tras el test del captopril (70 pacientes) y suero fisiológico (9 pacientes) persistió la inhibición (ARP baja). A todos los hipertensos se les practicó ecografía abdominal dentro del protocolo general de estudio: en 11 se encontró un aumento de una o ambas glándulas adrenales para una sensibilidad de 13.9%, con una aproximación que cumple el diagrama de Pareto y que en esta serie aporta el mismo valor estadístico que la hipernatremia. Entre la kaliemia y la PAS, la correlación fue de s = -0.34 (p = 0.002).
Se realizó tomografía abdominal (TAC) en todos los casos, revelando un nódulo suprarrenal = de 1 cm en 29 (36.8%), e hiperplasia con nódulos bilaterales en 5 (6.3%). En 45 (57.0%) las glándulas suprarrenales fueron inferiores a 1 cm, siendo considerada la hiperplasia como entidad nosológica. La sensibilidad de la TAC para detectar adenoma adrenal y/o hiperplasia bilateral con nódulos en presencia de HPAP fue del 43%. La distribución etiológica tras el estudio con TAC fue de 50 (63.3%) con hiperplasia y 29 (36.8%) con adenoma, de los cuales 13 se localizaron a la derecha y 16 a la izquierda. Se consideró la realización de otros estudios radiológicos complementarios a TAC en 6 para definir la lateralización: en 3 se practicó cateterización de venas suprarrenales y en 3 gammagrafías con yodocolesterol, mostrando en los 6 la localización del adenoma.
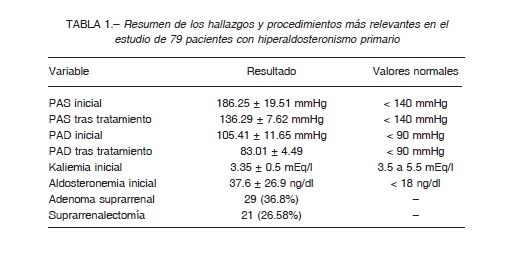
Posteriormente al diagnóstico se procedió a modificaciones del tratamiento previo: 21 casos fueron subsidiarios de suprarrenalectomía laparóscópica y el resto recibió tratamiento bloqueante de la acción mineralcorticoide con antialdosterónicos tipo espironolactona (51 pacientes) o eplerrenona (4 pacientes). En tres que precisaban dosis superiores a 200 mg de espironolactona se asoció eplerrenona con el propósito de yugular sus efectos adversos. Una de las pacientes que recibía dicho tratamiento presentó al séptimo año un carcinoma de mama sin historia genética de cáncer. Con el tratamiento específico, médico o quirúrgico, se logró el control de la presión arterial en 55 pacientes (69.6%) precisando combinaciones con otros antihipertensivos en el resto. En dos afectados de insuficiencia renal en estadio 3b, el tratamiento del HPAP logró la normalización de la función renal en 5 años. Un resumen de los resultados relevantes es presentado en la Tabla 1.
Discusión
Aunque existe una tendencia a considerar el HPAP como una causa importante de HTA 16,17 existen dudas si el espectro que abarca este concepto debe quedar limitado a casos bien definidos, excluyendo los casos limítrofes que podrían incluirse en la HTA refractaria y en la HTA esencial con renina baja 18. La prevalencia de HPAP en esta serie es baja y es inferior a la reportada en estudios publicados en el siglo XXI, acorde con algunos grupos que establecen cifras de alrededor del uno por ciento hasta un 14% por Fardella y col. 9. Esta última visión es la que demuestra este trabajo, la baja prevalencia de HPAP en los hipertensos estudiados y el alto porcentaje de casos con adenomas o hiperplasia adrenal bilateral con nódulos.
En esta serie hubo dos pacientes de etnia negra, por lo que no se analizan diferencias entre caucásicos y dicha etnia 19. El envejecimiento progresivo de la población explica el número considerable de casos de HPAP en la senectud y justifica que la edad no sea un condicionante en la búsqueda de esta entidad en el adulto mayor 20.
El HPAP es un proceso de evolución lenta, por lo que la valoración clínica inicial, seguido de la realización de gases venosos, iones en sangre y kaliuria en orina es el punto de partida del estudio y la investigación se continúa de un modo secuencial 21, a diferencia de los eventos agudos que exigen una actitud no secuencial. Todos los casos presentaban kaliemia = 4.0 mEq/l, siendo un hallazgo sugestivo de esta entidad en el diagnóstico precoz 22.
Establecer una correlación inicial entre la kaliemia y la PAS (cuanto más bajo es el potasio mayor es la PAS) es un parámetro sencillo que nos brinda la oportunidad, estableciendo la correlación entre ambos parámetros, de orientar inicialmente el cuadro hacia un probable HPAP.
Esta correlación no ha sido analizada previamente en otros estudios. Respecto a la hipernatremia, fuera de un proceso intercurrente, en el HPAP tiene una orientación diagnóstica 23 con una sensibilidad del 16.5%, que es superior a la detección de nódulos adrenales por ecografía abdominal (13.9%) en presencia de HPAP. La aldosteronemia estaba elevada en todos los casos, al igual que la relación A/ARP, salvo en un caso en el que la ARP no estaba suprimida por coexistir con HTA renovascular. Este parámetro es la clave del diagnóstico, destacando que la aldosteronemia ha de estar en ng/dl, y se ha considerado el valor de 30 (ng/dl)/(ng/ml/h), que es el punto de corte demostrado a partir del cual la sensibilidad y especificidad son las adecuadas 24. Encontramos un caso de HPAP coexistiendo con HTA renovascular lo que influyó en el valor de 22, frente al valor considerado como normal de 30, por lo que debe tenerse en cuenta esta posibilidad. En relación con estos parámetros se destaca la alta sensibilidad de la ARP = 0.3 ng/ml/h de 86.1%, pero su especificidad, en la población hipertensa estudiada, no se pudo determinar por desconocerse la prevalencia de hipoaldosteronismo hiporreninémico. Una vez confirmado el diagnóstico bioquímico se procede a identificar la etiología.
La primera descripción del HPAP la hizo Conn en un paciente con adenoma suprarrenal 25. Por ello el HPAP recibe el nombre de síndrome de Conn, si bien, teniendo en cuenta que la hiperplasia es la etiología actual más frecuente del HPAP y que existe una transición temporal entre hiperplasia y adenoma, podría decirse que el HPAP es un síndrome encuadrado dentro de los hipermineralocorticismos productores de aldosterona o desoxicorticosterona (DOCA)26, a diferencia de los hipermineralocorticismos secundarios a cortisol 27.
Ante la presencia de un cuadro típico de HPAP con aldosterona elevada en sangre y orina, y ARP disminuida, se ha de confirmar la producción anormal de aldosterona con diversos tests 28. El test de infusión de suero fisiológico (de frenado) ayuda a diferenciar las distintas causas de HPAP, mientras que el test de estimulación de la ARP con la bipedestación muestra resultados heterogéneos. Los test de estimulación con ACTH o sobrecarga de potasio no son útiles, ya que estas lesiones suelen responder incluso exageradamente a estos estímulos con un incremento de la producción de aldosterona. En nuestra serie hemos elegido como test básico para la confirmación bioquímica el test del captopril 29, por su sencillez, ausencia de efectos adversos y costo. En el hipermineralocorticismo por adenoma productor de desoxicorticosterona las cifras de aldosterona están bajas. Esta forma de hiperaldosteronismo, junto a las que se presentan con kaliemia normal o las que coexisten con enfermedad renal, son las que plantean dificultades y retrasos diagnósticos 30, 31. En esta serie el 35% de los HPAP presentaron kaliemia entre 3.5 y 4.0 mEq/l.
Una vez confirmado el diagnóstico de HPAP a nivel bioquímico, las modernas técnicas radiológicas contribuyen de forma sustancial en el diagnóstico diferencial de las distintas causas de HPAP, como la TAC o la resonancia nuclear magnética, si bien otras pruebas, como la cateterización de venas adrenales y la gammagrafía con yodo colesterol, son fundamentales para definir la unilateralidad o bilateralidad que es el paso esencial en la práctica clínica del HPAP 32. La ecografía muestra escasa sensibilidad (13.9% en esta serie), acercándose a cumplir el diagrama de Pareto 33. Aun así, representa la prueba de imagen inicial ante el estudio de un hipertenso con o sin sospecha de HPAP.
La sensibilidad del TAC es elevada para detectar adenoma o nódulos corticales bilaterales (43%) y actualmente se considera la técnica de imagen básica para el estudio de las suprarrenales, que es suficiente para indicar cirugía, si se objetiva la clásica asimetría del adenoma.
Si la TAC no define que estamos ante un adenoma o una hiperplasia con nódulos, ha de recurrirse a otras técnicas para el diagnóstico diferencial, siendo la determinación de aldosterona tras cateterización de ambas venas suprarrenales la prueba gold standard 34, 35. En presencia de adenoma la cateterización revela cifras elevadas de aldosterona en el lado afectado, mientras que en la hiperplasia cortical bilateral estos valores son similares en ambas venas suprarrenales. Se puede recurrir a la gammagrafía o a la flebografía. En esta, el adenoma de más de un cm aparece como una imagen ocupante de espacio que comprime y arquea las venas. En esta serie se ha recurrido en limitadas ocasiones a la realización de cateterización y gammagrafía (3 casos respectivamente) para el diagnóstico diferencial y sin utilización de la flebografía, lo que determina que sean técnicas poco necesarias en la evaluación de la etiología del HPAP.
La suprarrenalectomía laparoscópica es el tratamiento de elección del HPAP secundario a adenoma 36,37, confirmando la anatomía patológica el diagnóstico. Por la lentitud del crecimiento del adenoma, que no produce alteraciones locales, el bloqueo farmacológico también es una opción válida, que permitiría evaluar la evolución del paciente cuando se elige esta alternativa y cuando existan contraindicaciones quirúrgicas. Es muy raro el carcinoma productor de aldosterona, que sí constituye una indicación de cirugía precoz. Por dichas razones 8 pacientes con adenoma no se sometieron a la suprarrenalectomía. A diferencia del adenoma la hiperplasia adrenal bilateral siempre es subsidiaria de tratamiento médico 37. Las dosis de espironolactona recibidas (entre 50 y 200 mg al día) contrastan con las dosis del tratamiento del hiperaldosteronismo secundario. Para evitar efectos adversos de la espironolactona puede recurrirse a la eplerrenona 38 que presenta una potencia del 50% respecto a la espironolactona.
Las modificaciones en las cifras de presión arterial tras tratamiento fueron muy significativas, observándose el descenso de 185/110 a 135/85 mmHg. Los niveles de control con tratamiento específico y los tratamientos seguidos en esta serie son similares a otros estudios descriptivos 10. Entre los fármacos añadidos al tratamiento específico se han usado en primera línea las tiazidas (tienen efecto antihipertensivo superior a otros grupos farmacológicos en el HPAP), pero tras el incremento de riesgo de carcinoma de piel 39 y el efecto estrogénico de la espironolactona se plantean nuevas alternativas, añadiendo como tratamiento inicial antagonistas del calcio.
La remisión de la insuficiencia renal crónica en el HPAP, tras control de la presión arterial demostrada en dos casos de esta serie, que ingresaron con hipertensión acelerada, nos muestra una excepción en la evolución de la nefropatía vascular, que habitualmente evoluciona hacia el empeoramiento 39. En ese sentido, se ha demostrado la relación de la nefropatía asociada al HPAP y a la hipokaliemia con formación de microquistes y su reversión con el control de esa enfermedad 40.
Otro aspecto del estudio de esta serie es la alta prevalencia de litiasis urinaria en el HPAP. Esta debería disminuir al tratarse el HPAP, como consecuencia de la disminución de la eliminación aumentada de calcio en orina, estimulada por la aldosterona, si bien no ha sido estudiada hasta el momento.
En conclusión, la kaliemia inferior a 4.0 mEq/l, asociada a kaliuria inapropiada y alcalosis metabólica han sido parámetros orientadores iniciales en la búsqueda de HPAP, a pesar de la elevada presencia de HPAP con kaliemia normal. En el HPAP es constante la aldosteronemia elevada, la ARP basal baja y un cociente A/ARP >30 que asociados a los hallazgos de la TAC abdominal suelen ser suficientes para el diagnóstico, salvo en los casos hereditarios o productores de DOCA. La suprarrenalectomía laparóscopica fue el tratamiento de elección en el HPAP secundario a adenoma, siendo el tratamiento antialdosterónico la elección en la etiología no adenomatosa y una opción válida en el control de la PA de adenomas con contraindicaciones quirúrgicas.
Se observó elevada relación de HPAP con litiasis urinaria.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Rumantir MS, Jennings GL, Lambert GW, Kaye DM, Seals DR, Esler MD. The “adrenaline hypothesis” of hypertension revisited: evidence for adrenaline release from the heart of patients with essential hypertension. J Hypertens 2000; 18: 717-23.
2. Laragh JH. Abstract, closing summary and table of contents for Laragh’s 25 lessons in pathophysiology and 12 clinical pearls for treating hypertension. Am J Hypertens 2001; 14: 1173-7.
3. Hollenberg NK. Evolution of the treatment of hypertension: What really matters in the 1990s? Am J Med 1992; 31; 93: 4S-10S.
4. Santamaría R, Gorostidi M. Hipertensión arterial secundaria: cuándo y cómo debe investigarse. Nefro Plus 2015; 7: 11-21.
5. Armario P, Castellanos P, Hernández del Rey R. Hipertensión arterial refractaria. Nefro Plus 2008; 1: 23-32.
6. Young WF. Primary aldosteronism: Update on diagnosis and treatment. Endocrinologist 1999; 7: 213-21.
7. Snow MH, Nicol P, Wilkinson R, et al. Normotensive primary aldosteronism. Br Med J 1976; 8: 1125-6.
8. Halperin ML, Kamel KS. Potassium. Lancet 1998; 11: 135-40.
9. Fardella CE, Mosso L, Gómez-Sánchez CE, et al. Primary aldosteronism in essential hypertensives: prevalence, biochemical profile and molecular biology. J Clin Endocrinol Metab 2000; 85: 1863-7.
10. Sabio JM, Mediavilla-García JD, Jaén F, et al. Hiperaldosteronismo primario: análisis de una serie de 54 pacientes. Med Clin (Barc) 2005; 124: 765-8.
11. Gijón-Conde T, Gorostidi M, Camafort M, et al. Documento de la Sociedad Española de Hipertensión-Liga Española para la Lucha contra la Hipertensión Arterial (SEH-LELHA) sobre las guías ACC/AHA 2017 de hipertensión arterial. Hipertens Riesgo Vasc 2018; 35: 119-29.
12. Rossi GP, Bernini G, Caliumi C, et al. A prospective study of the prevalence of primary aldosteronism in 1125 hypertensive patients. J Am Coll Cardiol 2006; 48: 2293-300.
13. Martínez Debén FS. Es conveniente el despistaje del hiperaldosteronismo primario en el paciente hipertenso. Hipertensión 2004; 21: 119-26.
14. Stowasser M, Gordon RD, Rutherford JC, Nikwan NZ, Daunt N, Slater GJ. Diagnosis and management of primary aldosteronism. J Renin Angiotensin Aldosterone
Syst 2001; 2: 156-69.
15. Suarez Ortega S, Artiles Vizcaino J. Hypertension associated to urolithiasis. The Internet J Int Med 2005; 6: 2-6.
16. Young WF Jr. Diagnosis and treatment of primary aldosteronism: practical clinical perspectives. J Intern Med 2019; 285: 126-48.
17. Kaplan NM. The current epidemic of primary aldosteronism: causes and consequences. J Hypertens 2004; 22: 863-9.
18. Kaplan NM. Cautions over the current epidemic of primary aldosteronism. Lancet 2001; 357: 953-4.
19. Calhoun DA, Nishizaka MK, Zaman MA, Thakkar R, Weissman P. Hyperaldosteronism among black and white subjects with resistant hypertension. Hypertension 2002; 40: 892-6.
20. Sánchez Turcios RA. Diagnosis and management of primary aldosteronism. Rev Mex Cardiol 2015; 26: 113-7.
21. Dunn PJ, Espiner EA. Outpatient screening tests for primary aldosteronism. Aust N Z J Med 1976; 6: 131-5.
22. Fardella CE, Mosso LM, Carvajal CA. Primary aldosteronism. Rev Med Chil 2008; 136: 905-14.
23. Gómez Hernández K, Chen Ku CH. Hiperaldosteronismo primario, una nueva perspectiva. Acta Med Costarrice 2007; 49: 13-20.
24. Fogari R, Preti P, Zoppi A, Rinaldi A, Fogari E, Mugellini A. Prevalence of primary aldosteronism among unselected hypertensive patients: a prospective study based on the use of an aldosterone/renin ratio above 25 as a screening test. Hypertens Res 2007; 30: 111-7.
25. Conn W J. Primary aldosteronism: a new clinical syndrome. J Lab Clin Med 1955; 45: 3-17.
26. Ghose RP, Hall PM, Bravo EL. Medical management of aldosterone-producing adenomas. Ann Intern Med 1999; 131: 105-8.
27. Gómez Ordóñez S, Gutiérrez Álvarez AM, Valenzuela Plata EL. Corticoides: 60 años después, una asignatura pendiente. Rev Cienc Salud. Bogotá (Colombia) 2007; 5: 58-69.
28. Byrd JB, Turcu AF, Auchus RJ. Primary aldosteronism. Practical approach to diagnosis and management. Circulation 2018; 138: 823-35.
29. Wu VC, Chang HW, Liu KL, et al. TAIPAI Study Group. Primary aldosteronism: diagnostic accuracy of the losartan and captopril tests. Am J Hypertens 2009; 22: 821-7.
30. Vaidya A, Mulatero P, Baudrand R, Adler GK. The expanding spectrum of primary aldosteronism: implications for diagnosis, pathogenesis, and treatment. Endocr Rev 2018; 39: 1057-88.
31. Hajji M, Rais L, Kheder R, Jebali H, Ben Fatma L, Zouaghi MK. Primary aldosteronism diagnosed in a patient with severe renal disease. Tunis Med 2018; 96: 454-7.
32. Naruse M, Umakoshi H, Tsuiki M, et al. The latest developments of functional molecular imaging in the diagnosis of primary aldosteronism. Horm Metab Res 2017; 49: 929-35.
33. Farrugia FA, Zavras N, Martikos G, et al. A short review of primary aldosteronism in a question and answer fashion. Endocr Regul 2018; 52: 27-40.
34. Magill SB, Raff H, Shaker JL, et al. Comparison of adrenalvein sampling and computed tomography in the differentiation of primary aldosteronism. J Clin Endocrinol Metab 2001; 86: 1066-71.
35. Stewart PM, Allolio B. Adrenal vein sampling for primary aldosteronism time for a reality check. Clin Endocrinol (Oxf) 2010; 72: 146-8.
36. Tobias-Machado M, Rincón Ríos F, Tulio Lasmar M, et al. Suprarrenalectomía laparoscópica retroperitoneal como opción mínimamente invasiva en el tratamiento de tumores adrenales. Arch Esp Uro 2006; 59: 49-54.
37. Vilela LAP, Almeida MQ. Diagnosis and management of primary aldosteronism. Arch Endocrinol Metab 2017; 61: 305-12.
38. McMahon EG. Recent studies with eplerenone, a novel selective aldosterone receptor antagonist. Curr Opin Pharmacol 2001; 1: 190-6.
39. Pedersen SA, Gaist D, Schmidt SAJ, Hölmich LR, Friis S, Pottegård A. Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark. Am Acad Dermatol 2018; 78: 673-81.
40. Torres VE, Young WF, Offord KP, Hattary RR. Association of hypokalemia, hyperaldosteronism, and renal cyst. N Engl J Med 1990; 322: 345-51.
January 6, 1937 The books I have read have almost all gone from my memory; they are confused with my being, leaving no trace, like the cretaceous creatures in the dunes around Folkestone. The white cliffs are clearly visible, but who can find the single shells, reduced by now to a very fine dust, which have form them? In the same way the books I have read formed my mind and my culture, but the individual unity have been dispersed and no effort of memory would ever be able to put them together again for me.
Enero 6, 1937 Los libros que he leído casi todos se han ido de mi memoria; están confundidos con mi ser, sin dejar trazas, como las criaturas cretáceas en las dunas que rodean Folkestone. Los blancos acantilados son claramente visibles ¿pero quién puede encontrar las conchas, reducidas ahora a un muy fino polvo, que las formaron? De la misma manera los libros que he leído formaron mi mente y mi cultura, pero la unidad individual se ha dispersado y ningún esfuerzo de mi memoria sería capaz de reunirlos de nuevo para mí.
Bernard Berenson (1865-1959)
Umberto Morra. Conversations with Berenson. Boston: Houghton Mifflin, 1965. Traduccción del italiano al inglés de Florence Hammond. de Colloqui con Berenson. Milano: Aldo Garzanti, 1967; p 226-7
