EMMARÍA DANESI 1, MARÍA OLENKA CODEBÓ 2, SERGIO SOSA-ESTANI 1-3
1 Centro Nacional de Diagnóstico e Investigación en Endemo-Epidemias (CeNDIE)-ANLIS,
2 Instituto Nacional de Parasitología Dr. Mario Fatala-Chabén (INP)-ANLIS,
3 Centro de Investigación de Epidemiología y Salud Pública (CIESP-IECS-CONICET)
Resumen En Argentina nacen alrededor de 1500 niños por año con infección por Trypanosoma cruzi. La transmisión vertical es la principal vía de generación de nuevos casos de Chagas, y de su presencia en zonas no endémicas. Nuestro objetivo fue relevar datos disponibles sobre infección congénita por T. cruzi, analizar su evolución y relación con indicadores de prevalencia materna y riesgo vectorial por regiones de Argentina. Se investigaron fuentes oficiales y bibliografía científica. Se obtuvieron datos nacionales y provinciales del período 1997-2014 del subsector público de salud. Se observó un aumento de embarazadas controladas, que alcanzó una cobertura del 60.3% en 2014. La prevalencia de infección materna descendió de 9.0% a 2.6%. El control en hijos de mujeres infectadas fue variable (entre 23.3% y 93.6% de los niños en riesgo) y la calidad del dato fue deficiente según provincia y año. La tasa de transmisión congénita tuvo una evolución irregular y, según un indicador corregido, la tasa media nacional fluctuó entre 1.9 y 8.2%. Se observó asociación entre la prevalencia materna y el riesgo vectorial en las provincias (test Wilcoxon p = 0.017). La tasa de transmisión congénita provincial no mostró relación con la tasa de infección materna (regresión lineal p = 0.686) ni con el nivel de riesgo vectorial (test Kruskal-Wallis p = 0.3154). Los datos disponibles muestran una deficiencia en los controles de hijos de madres infectadas y de su notificación en el período analizado. Deben mejorar ambos aspectos para obtener información epidemiológica fiable y permitir el acceso oportuno de los niños infectados al tratamiento.
Palabras clave: enfermedad de Chagas, congénito, vigilancia epidemiológica, salud pública
Abstract Congenital transmission of Trypanosoma cruzi. Argentina 2002-2014. In Argentina, around 1500 children are born each year with Trypanosoma cruzi infection. Mother-to-child transmission is the main source of new cases of Chagas disease and of its occurrence in non-endemic areas. Our objective was to survey the information available on congenital T. cruzi infection, to analyze its evolution and its relation with the index of maternal infection and the risk for vector-borne infection by province of Argentina. Data concerning the public health sector for the period 1997-2014 were retrieved from national and local records. An increase in the number and proportion of pregnant women examined for Chagas was observed, reaching 60.3% coverage in 2014. The prevalence of maternal infection dropped from 9.0% to 2.6%. The control of newborns from infected women was highly variable (23.3%-93.6%), and data quality was deficient, varying amply by province and year. The rate of congenital infection had an irregular evolution and its national average fluctuated between 1.9 and
8.2%. An association was observed between the risk for vector-borne infection and the prevalence of maternal infection by province (Wilcoxon test p = 0.017). The rate of congenital transmission by province was neither associated with the rate of maternal infection (linear regression p = 0.686) nor with the risk for vectorial infec- tion (Kruskal-Wallis test p = 0.3154). The available data show insufficient control of children born from infected mothers, as well as deficient recording of these procedures. Both aspects must be improved to achieve better epidemiological information and to enable timely access of infected children to treatment.
Key words: Chagas disease, congenital, epidemiological monitoring, public health
Dirección postal: : Emmaría Danesi, Centro Nacional de Diagnóstico e Investigación en Endemo-Epidemias (CeNDIE)-ANLIS, Av. Paseo Colón 568, 1063 Buenos Aires, Argentina
e-mail: emmariadanesi@gmail.com
La enfermedad de Chagas o tripanosomiasis americana, causada por el parásito Trypanosoma cruzi, es una de las principales endemias de Argentina. Con el control de la transmisión vectorial y por transfusiones, la transmisión congénita es actualmente la principal vía de generación de nuevos casos: se estima que anualmente nacen en Argentina alrededor de 1500 niños infectados 1. Las leyes nacionales 26271 de Pesquisa Neonatal y 26281 de Prevención y Control del Chagas, y las normas del Ministerio de Salud de Nación establecen el control de Chagas de manera obligatoria en todas las embarazadas y el control del recién nacido hijo de madre infectada 2, 3. Esto implica un seguimiento del niño hasta los 10 meses de vida, período en el cual hay una pérdida de 55-80% de los casos, y por lo tanto pérdida en el acceso al tratamiento, el que en esta etapa de la infección tiene una eficacia cercana al 100% 4, 5.
Los mecanismos implicados en la transmisión congénita del T. cruzi no están aún dilucidados, pero varios estudios mostraron que una carga parasitaria alta es un factor de riesgo importante para su ocurrencia 6-8. Esto se daría por la exposición reciente al vector infectado o por otros factores, como la baja inmunidad que permitiría una mayor reproducción y persistencia del parásito en el organismo 7, 9. Considerando lo primero, en un trabajo en comunidades rurales con alta infestación domiciliaria se observaron tasas de transmisión congénita del 17% 10. Históricamente en las regiones de mayor endemicidad también se han observado las mayores tasas de infección en su población 1, 11-13. Podría suponerse entonces que en las regiones de mayor prevalencia también se daría una mayor tasa de transmisión congénita. Sin embargo, a partir de los controles entomológicos, se redujo la exposición a reinfección y por lo tanto también los niveles de parasitemia (poblacional), incluso manteniendo elevada la prevalencia, que disminuiría más lentamente en las sucesivas generaciones. Al mismo tiempo, por procesos migratorios, regiones sin presencia del vector actualmente muestran prevalencias de infección similares a las de zonas endémicas. Por ello es que no habría una relación directa entre mayor prevalencia y mayor parasitemia, que a su vez está asociada a mayores tasas de transmisión congénita.
En función de estas dinámicas, en la infección por T. cruzi 6-11, se plantean las siguientes hipótesis: i) La tasa de infección materna está relacionada con el riesgo de transmisión vectorial (dado por el nivel de endemicidad); ii) La tasa de transmisión congénita está relacionada con el riesgo de transmisión vectorial por un fenómeno de parasitemia poblacional; iii) La tasa de transmisión congénita no está relacionada con la tasa de infección materna. El presente trabajo tiene como objetivos relevar las fuentes de información sobre controles por infección congénita de Chagas y describir la distribución y asociación entre el riesgo vectorial, la tasa de infección materna y la tasa de transmisión congénita en Argentina.
Materiales y métodos
Se realizó un estudio observacional ecológico utilizando datos secundarios sobre controles de infección por T. cruzi en emba razadas e hijos de mujeres infectadas hasta el año de vida, en el subsector público de salud, agrupados por provincias. Los datos surgen de: a) informes de la Iniciativa del Cono Sur para controlar y eliminar la enfermedad de Chagas (INCOSUR) del Programa Nacional de Chagas (PNCh) en el período 1995-2015 14-32 (no se dispone de informes posteriores), basados en registros del Sistema Nacional de Vigilancia en Salud-Sistema de Vigilancia de Laboratorio (SNVS-SIVILA); b) Anuarios de Estadísticas Vitales 1994-2014, de la Dirección Nacional de Estadística e Información de Salud (DEIS) del Ministerio de Salud de la Nación; c) Censos 2001 y 2010 del Instituto Nacional de Estadística y Censos (INDEC). Se establecieron las siguientes definiciones: a) Riesgo de transmisión vectorial (RTV): se adoptó la categorización dada por el PNCh (sitio web del PNCh10) que se basa en indicadores de infestación intra y peri domiciliaria, casos agudos vectoriales y seroprevalencia en niños menores de 5 años; b) Tasa de infección materna (TIM): Proporción (%) de mujeres infectadas por T. cruzi sobre el total de embarazadas estudiadas, en período determinado, referida a nivel nacional o provincial; c) Tasa de transmisión congénita (TTC): Proporción (%) de niños infectados por T. cruzi sobre el total de hijos de madres infectadas estudiados en un año, referida a nivel provincial o al nacional. Se consideraron como datos válidos aquellos con un denominador ≥30 (muestra representativa) y en los que la tasa no resultase >20% (la mayor tasa publicada en la literatura internacional); d) TIM o TTC trianual: Promedio de las TIM o TTC en 2010, 2011 y 2012. Se eligieron estos años por ser los de referencia para la definición de RTV (2012 y los dos inmediatos anteriores). Esta variable podrá referirse a nivel nacional o provincial.
Se realizaron gráficos de la evolución temporal de la TIM y TTC nacional para el periodo 1997-2014, y tablas comparativas de indicadores provinciales en el primero y el último año disponibles. Se analizó la asociación entre TIM trianual y RTV (Test de Bonferroni o Wilcoxon), entre TTC trianual y RTV (Test de Kruskal-Wallis), y entre TTC trianual y TIM trianual (regresión lineal).
Resultados
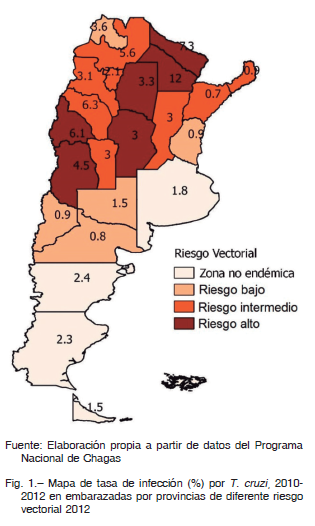
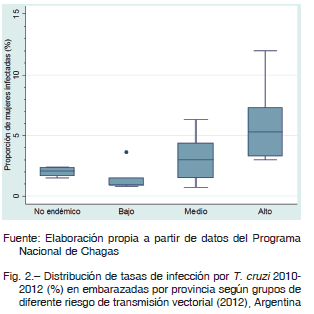
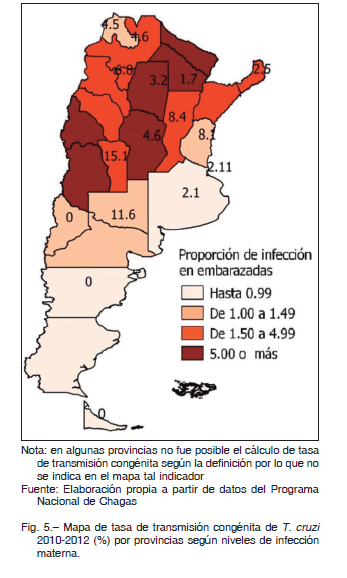
En la Argentina el área de RTV incluye 19 de las 24 provincias. Las regiones Noroeste y Centro son las de mayor endemicidad histórica 12. Considerando el mayor RTV, las poblaciones de zonas de mayor endemicidad presentarían mayor prevalencia de infección por T. cruzi. En el mapa de la Figura 1 observamos que la coincidencia entre provincias con mayor RTV y mayor TIM es solo parcial. La TIM en las provincias de RTV medio (3.1%) no es estadísticamente diferente de aquella en provincias de riesgo bajo (1.5%) o alto (6.0%) (Test Wilcoxon p = 0.2383 y p = 0.0518, respectivamente). Sin embargo, las TIM en provincias de RTV alto es significativamente mayor que en las provincias de RTV bajo (test de Wilcoxon, p = 0.0174, Fig. 2), como se planteó en la primera hipótesis.
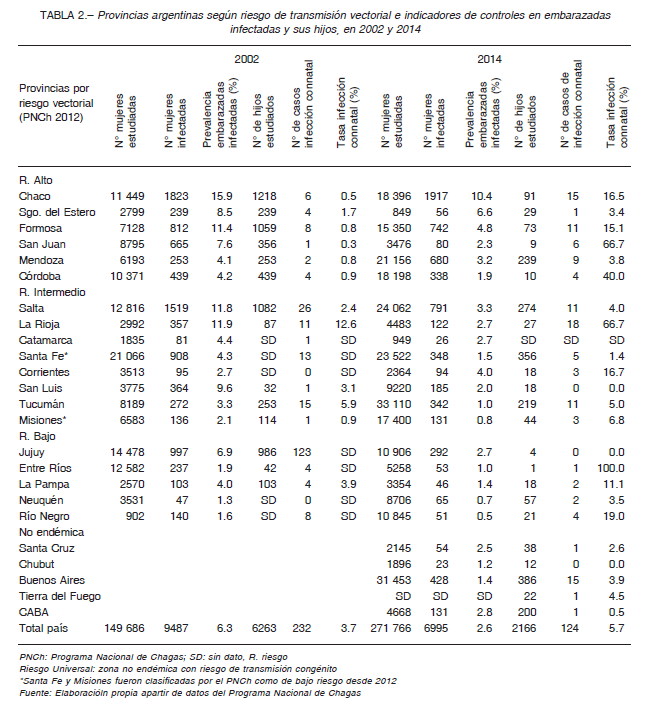
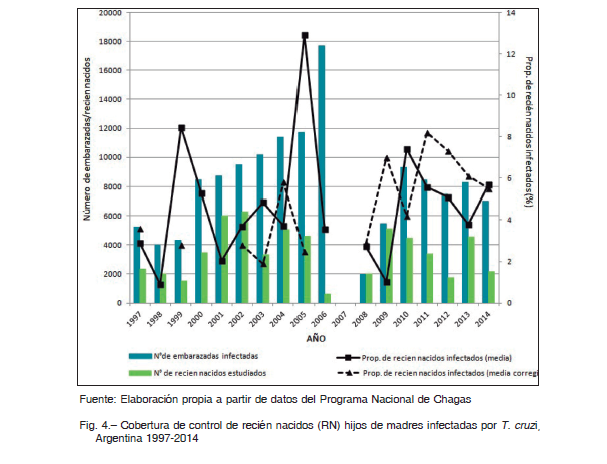
En cuanto a la transmisión congénita, los datos de controles pre y perinatales disponibles corresponden al subsector público de salud. Entre 1997 y 2014 hubo un incremento en el número total de embarazadas controladas para Chagas de 58 196 a 271 776, si bien el avance en la cobertura fue irregular (Fig. 3). Esto pudo estudiarse desde 2002, año a partir del cual está disponible la discriminación necesaria del número de embarazadas por subsistema de salud y provincia. En 2002 se estudió el 36.6% de las embarazadas del subsector público de salud, mientras que en 2014 el tamizaje alcanzó el 60.3% (Tabla 1). En cuanto a la TIM nacional se constató una tendencia general a la disminución: de 9.0% en 1997 a 2.6% en 2014 (Fig. 3). La variación de la TIM por provincias entre 2002 y 2014 ha sido favorable, registrándose una disminución en todas las provincias, excepto en Corrientes (Tabla 2). En 2014 la mayor tasa se registró en Chaco (10.4%).
El control de los hijos de madres diagnosticadas en el embarazo entre 1997 y 2014 fue variable, tanto en números absolutos como relativos, con una cobertura entre 23.3% y 93.6%. No se pudo acceder a información selectiva que permita diferenciar los controles realizados al momento del parto de los de seguimiento hasta los 10 meses de vida. Para 2002 y 2014, si se considera el total de nacidos vivos en Argentina, una prevalencia materna de 4.4% y una tasa de transmisión congénita de 4.7% (promedios 2002 y 2014, Tabla 1), los casos de Chagas congénito informados tendrían un subdiagnóstico-subregistro de 1:6 y 1:13, respectivamente.
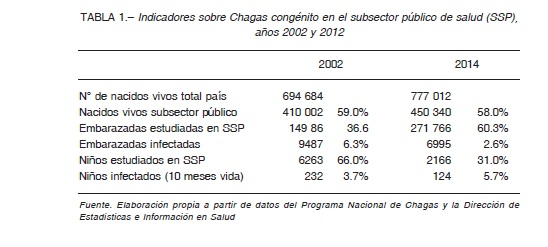
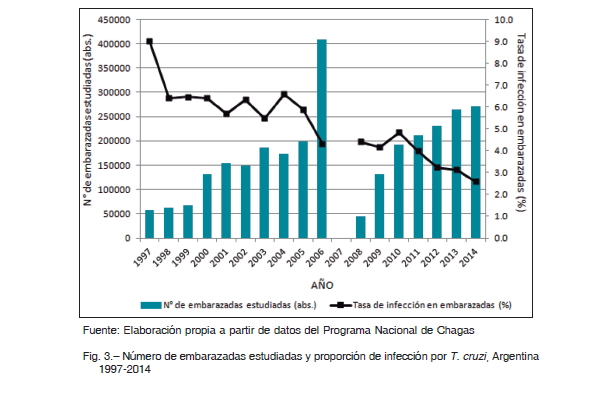
La tasa de transmisión congénita nacional mostró aumentos y disminuciones, siendo 3.7% y 5.7% para 2002 y 2014, respectivamente (Fig. 4, Tabla 1). Tomando los registros provinciales en bruto, la tasa de transmisión congénita fue muy variable entre provincias, con valores entre 0 y 100% (Tabla 2). En este estudio, para obtener una medida nacional, se consideraron solo los datos provinciales posibles según las definiciones. La evolución temporal de la tasa de transmisión congénita mostró un comportamiento irregular, con variaciones de la media nacional entre 1.9 y 8.2% y de la mediana entre 0.9% y 7.7% (Fig. 4). En particular, en 2014 se obtuvo una media corregida de 5.5% y una mediana corregida de 3.8%.
Para analizar la asociación entre TTC y RTV (hipótesis 2), se consideró la TTC provincial trianual 2010-2012 según las definiciones establecidas. No se observó asociación entre estas variables (Test de Kruskal-Wallis p = 0.3154, Fig. 5). Por otro lado, no se comprobó asociación entre TTC y TIM (hipótesis 3). La TTC no mostró relación con la prevalencia de infección en embarazadas (regresión lineal p = 0.686), tampoco acompañó la misma tendencia temporal ni la distribución territorial (Fig. 4, Fig. 5). Mientras que la TIM nacional fue en disminución (Fig. 3), el dato de TTC nacional mostró una evolución irregular en el transcurso de los años, con promedio nacional entre 1.9 y 8.2% (Fig. 4).
Discusión
El control de la infección por T. cruzi en la embarazada y en el hijo de madre infectada está contemplado en la legislación nacional como obligatorio desde 1983 y fue reforzado en 2007 con una nueva ley y además con la implementación de un sistema de notificación online (SNVS-SIVILA). Sin embargo, actualmente la vigilancia se desarrolla de manera sistemática solo en el subsector público de salud, de modo que se desconoce la situación en el subsector privado y de obras sociales, que atienden al 60-70% de la población (censo 2010) 33.
De acuerdo a los datos disponibles de 1997 a 2014, la cobertura del estudio de infección materna y su registro han mostrado una mejora en términos absolutos y relativos a nivel nacional. Sin embargo, según la provincia, se observa que el número de embarazadas estudiadas ha sufrido tanto aumentos como disminuciones. En términos globales, al ampliarse la cobertura y mejorar el registro, la tasa de infección materna nacional se redujo y tendría un valor más representativo, alrededor del 3%. Resulta interesante comparar estas cifras con un estudio realizado en varones reclutados para el servicio militar 11, el cual mostró una caída de la prevalencia del 10.1% en 1965, a 5.8% en 1981 y 1.9% en 1993. Si bien ambas fuentes muestran una disminución progresiva en la prevalencia de la población estudiada, los indicadores en embarazadas son algo más altos. Estas cifras reflejan el universo de mujeres atendidas en el subsector público de salud pudiendo generar un sesgo de interpretación porque los conscriptos reflejaban la población general. Considerando que no hay antecedentes que indiquen diferencia en la prevalencia entre hombres y mujeres, los indicadores en embarazadas mostrarían que la prevalencia de infección por T. cruzi en la población que se atiende en el subsistema público sería mayor, y que si se trasladara a la población general habría una sobreestimación. Debido a la falta de información del subsector privado y de obras sociales esta hipótesis no se ha podido comprobar y podría ser motivo de futuros estudios.
En 2018 (posterior a la búsqueda y análisis para este trabajo) la Auditoría General de la Nación (AGN) publicó un informe sobre el PNCh en el período 2015-201634, sobre la base de un anterior informe del período 2009-2010. En este informe se menciona el aumento en los controles maternos, que en 2015 llegaron a 309 248 embarazadas, de las cuales resultaron infectadas 7794 (2.5%) en todo el país. Estos indicadores continúan la tendencia observada en los datos incluidos en nuestro trabajo, tanto sobre la ampliación en los controles como en la disminución o ajuste de la prevalencia de infección. Si bien la AGN destaca esta mejora, mantiene la recomendación de “coordinar acciones con las distintas instancias del subsistema de salud público, de obras sociales y privado, para cumplir con el control de Chagas a todas las embarazadas en el conjunto de los establecimientos del país, según lo establece la Ley 26281” (p 31).
Los cambios en las prevalencias estuvieron dados principalmente por las acciones en el control vectorial. A partir de los años 60 se pusieron en marcha acciones en todo el país para el control del vector, y se lograron importantes avances que se tradujeron en la disminución de la tasa nacional de infestación de unidades domiciliarias y de la población infectada, como se observó en el estudio sobre conscriptos del servicio militar. En cuanto a la relación entre nivel de riesgo vectorial y prevalencia de infección en embarazadas (hipótesis 1), se observó una asociación significativa, considerando el grupo de provincias de bajo y alto riesgo. El grupo de riesgo intermedio no llegó a establecer diferencia con los otros dos grupos de riesgo, posiblemente por un efecto de cohorte, ya que la prevalencia en los últimos años se corresponde con el riesgo vectorial de aproximadamente dos décadas atrás, cuando pudo haber ocurrido la infección vectorial. Otro factor importante que puede incidir en la prevalencia es la presencia de poblaciones migrantes de zonas endémicas a zonas no endémicas, o en las que se ha controlado la presencia del vector, como la provincia de Buenos Aires y la Ciudad Autónoma de Buenos Aires, que reciben un importante flujo de personas de provincias endémicas para la transmisión vectorial 2.
Respecto al control de hijos de mujeres infectadas, la calidad de los datos es deficiente, y muestra heterogeneidad en la calidad y la continuidad según las provincias. Con estos datos, los cálculos de tasa de transmisión congénita arrojan valores en todo el rango posible, muchos de los cuales escapan a la factibilidad biológica y estadística del evento, lo que pone en evidencia la inexactitud del dato. Esta heterogeneidad en la notificación podría atribuirse a realidades locales, con diferentes trayectorias en políticas sanitarias, estructuras socioeconómicas, capacidades administrativas, organizativas y de prestación de servicios, entre otros 35. Por otro lado, según los antecedentes en la bibliografía, en estudios de diferentes provincias, grupos de población y metodologías diagnósticas, la tasa de transmisión congénita ha variado entre 0.75% 36 y 17.0% 10. Una revisión internacional de 2013 estimó la tasa de transmisión congénita en 4.7%, siendo más alta esta tasa en países endémicos para la transmisión vectorial (media 5.0%) que en países no endémicos (media 2.7%) 13. En esta observación la tasa media de transmisión congénita nacional fue 4.2% en la serie temporal considerada, con rango de 1.9 a 8.2%.
La calidad deficiente del dato de transmisión congénita dificulta el análisis de asociación de esta variable con riesgo vectorial y prevalencia materna (hipótesis 2 y 3), por lo cual para realizar tal análisis con datos de calidad aceptable se crearon indicadores trianuales en base a indicadores anuales que cumplieran ciertos requisitos epidemiológicos (ver definiciones). Considerando los antecedentes mencionados previamente, y por un fenómeno de mayor parasitemia poblacional, se esperaría encontrar tasas de transmisión congénita más elevadas en zonas de mayor endemicidad 7, 9, 13. Sin embargo, en el análisis realizado no se encontró tal asociación. Esto podría atribuirse, como se mencionó antes, a una falencia de los datos disponibles, o que el fenómeno que explica la hipótesis no esté operando en este contexto debido, por ejemplo, a tasas de infestación menores de las necesarias para observar el fenómeno. A su vez, también podría estar incidiendo el aumento en la indicación del tratamiento tripanocida en niñas y adolescentes desde 1991 por el PNCh, que produciría, por un efecto de cohorte, reducción de transmisión congénita 37, 38 en algunos grupos de madres en el período analizado. Por otro lado, se confirmó la hipótesis de ausencia de relación entre los indicadores de tasa de infección congénita y prevalencia de infección materna. Sin embargo, sería necesario repetir esta observación con datos de mejor calidad para tener mayor certeza de la no asociación de estas variables y aumentar su significación estadística. Para todas las asociaciones analizadas, es necesario considerar que la unidad poblacional empleada (disponible) de “provincia” puede tener diversas heterogeneidades en su interior según las realidades geográficas, de control entomológico y de dinámica de prevalencia poblacional, por lo cual unidades más pequeñas como “municipios” serían más adecuadas para realizar estos análisis ecológicos.
Las falencias en los datos sobre el control de los hijos de mujeres infectadas ponen de manifiesto en primera instancia una implementación y/o registro deficitario, y por otro lado refleja las dificultades propias del seguimiento del niño, que dan lugar a una pérdida de 55-80% 4, 5. Según proyecciones de este estudio, el subregistro de casos de infección congénita, que puede o no ser coincidente con el subdiagnóstico, sería de 1 por cada 6 a 13 casos, en consonancia con lo planteando en estudios anteriores 4. A su vez, los datos presentados por la AGN en su informe 2015-2016 presentan cifras en el mismo sentido, con 137 y 86 niños infectados detectados en esos años sobre el estimado de 1300 por año en el total del país, lo cual mencionan representaría la captación de apenas el 6.6% y 10.5% de los casos respectivamente. Estas preocupantes observaciones deben orientarnos a buscar estrategias para mejorar el diagnóstico y el acceso oportuno al tratamiento de la infección congénita. Desde el punto de vista técnico, se están evaluando varios métodos para adelantar el diagnóstico a los primeros meses de vida y reducir la pérdida. Entre estos se continúa trabajando en la PCR por su alta sensibilidad e independencia de operador 8, 39, 40, y en la ELISA-SAPA, por su mayor facilidad para realizarse en servicios de baja complejidad 41-43.
Los sistemas de vigilancia constituyen herramientas fundamentales para estudiar la epidemiología, analizar la evolución de los fenómenos de interés, evaluar el impacto de las intervenciones y tomar decisiones al respecto. En este sentido el SIVILA tuvo un impacto positivo en la vigilancia de Chagas y otras enfermedades de notificación obligatoria, pero su potencialidad estuvo limitada por la fragmentación del sistema sanitario y la limitación de recursos técnicos y humanos. Desde 2018 se implementó un nuevo sistema del SNVS 2.0 que integra diferente información de la atención de salud, y podría salvar algunas dificultades del anterior sistema. En el caso de la transmisión congénita de Chagas los actuales sistemas de información en la Argentina son deficientes en su implementación y el principal problema reside en el control del niño. Por un proceso histórico, el control de la madre y su registro está mejor implementado, si bien aún quedan brechas por resolver. Los datos actualmente disponibles han mostrado una evolución favorable de los indicadores maternos y han permitido corroborar una mayor prevalencia en zonas de mayor riesgo de transmisión vectorial, pero también una prevalencia importante en zonas no endémicas, causada por transmisión congénita y migraciones. Sobre el control de la infección congénita, en cambio, con los datos actualmente disponibles resulta difícil hacer un diagnóstico de situación preciso, concluyendo sobre la necesidad urgente de la mejora en su implementación y registro. Esto incidirá en la oportunidad de tratamiento temprano, y en términos de salud pública, permitirá analizar la evolución del problema y el desempeño del sistema sanitario, y de este modo orientar las acciones para la mejor asistencia de las personas en riesgo y contribuir en el proceso de eliminación de la enfermedad de Chagas como problema de salud pública.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. World Health Organization. Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Wkly Epidemiol Rec 2015; 90: 33-43.
2. Programa Nacional de Chagas. Plan 2011-2016 para el control de la enfermedad de Chagas en Argentina. Programa Nacional de Chagas. Ministerio de Salud de la Nación. Argentina. Diciembre de 2010. En: http://ecofield.com.ar/blog/salud-publica-plan-nacional-de-chagas-2011-2016/; consultado diciembre 2018.
3. Ministerio de Salud y Desarrollo Social, Presidencia de la Nación. Enfermedad de Chagas. Guia para la Atención del Paciente infectado con Trypanosoma cruzi. 3° Edición, Julio 2018. En: http://www.msal.gob.ar/images/ stories/bes/graficos/0000001391cnt-Guia%20para%20 equipos%20de%20salud%20CHAGAS%202018.pdf; consultado diciembre 2018.
4. Gürtler RE, Segura EL, Cohen JE. Congenital transmission of Trypanosoma cruzi infection in Argentina. Emerg Infect Dis 2003; 9: 29-32.
5. De Rissio AM, Riarte AR, Garcia MM, Esteva MI, Quaglino M, Ruiz AM. Congenital Trypanosoma cruzi infection. Efficacy of its monitoring in an urban reference health center in a non-endemic area of Argentina. Am J Trop Med Hyg 2010; 82: 838-45.
6. Salas NA, Cot M, Schneider D, et al. Risk factors and consequences of congenital Chagas disease in Yacuiba, south Bolivia. Trop Med Int Health 2007; 12: 1498-505.
7. Brutus L, Ernould JC, Postigo J, Romero M, Schneider D, Santalla JA. Influence of pregnancy on Trypanosoma cruzi parasitemia in chronically infected women in a rural Bolivian community. Am J Trop Med Hyg 2011; 84: 808-12.
8. Bua J, Volta BJ, Velazquez EB, Ruiz AM, Rissio AM, Cardoni RL. Vertical transmission of Trypanosoma cruzi infection: quantification of parasite burden in mothers and their children by parasite DNA amplification. Rev Soc Trop Med Hyg 2012; 106: 623-8.
9. Hermann E, Truyens C, Alonso-Vega C, et al. Congenital transmission of Trypanosoma cruzi is associated with maternal enhanced parasitemia and decreased production of interferon-gamma in response to parasite antigens. J Infect Dis 2004; 189: 1274-81.
10. Sosa Estani S, Dri L, Touris C, Abalde S, Dell’Arciprete A, Braunstein J. Transmisión vectorial y congénita del Trypanosoma cruzi en Las Lomitas, Formosa. Medicina (B Aires) 2009; 69: 424-30.
11. Segura EL, Cura EN, Estani SA, et al. Long-term effects of a nationwide control program on the seropositivity for Trypanosoma cruzi infection in young men from Argentina. Am J Trop Med Hyg 2000; 62: 353-62.
12. Zaidemberg M, Spillmann C, Carrizo Paez R. Control de Chagas en la Argentina. Su evolución. Rev Argent Cardiol 2004; 72: 375-80.
13. Howard EJ, Xiong X, Carlier Y, Sosa-Estani S, Buekens P. Frequency of the congenital transmission of Trypanosoma cruzi: a systematic review and meta-analysis. BJOG 2014; 121: 22-33.
14. Iniciativa de Salud del Cono Sur (INCOSUR). IV Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana transfusional. Asunción, Paraguay, 22 al 24 de marzo de 1995. OPS/HPC/HCT/95.97. En: https://www.paho.org/hq/dmdocuments/2011/Tripanosomiasis-triatoma-infestans-IV-REUNION-INCOSUR-2011.pdf; consultado diciembre 2018.
15. Iniciativa de Salud del Cono Sur (INCOSUR). V Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana transfusional. OPS/HPC/HCT/96.067. En: https://www.paho.org/hq/dmdocuments/2011/V-REUNION-INCOSUR.pdf; consultado diciembre 2018.
16. Iniciativa de Salud del Cono Sur (INCOSUR). VI Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión. Santiago, Chile, 10 al 12 de marzo de 1997. OPS/HPC/HCT/98.102. En: https://www. paho.org/hq/dmdocuments/2011/VI-REUNION-INCOSUR.pdf; consultado diciembre 2018.
17. Iniciativa de Salud del Cono Sur (INCOSUR). VII Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión. Buenos Aires, Argentina, 24 al 26 de marzo de 1998. Organización Panamericana de la Salud. OPS/HPC/HCT/98.114. En: https://www.paho.org/hq/dmdocuments/2011/VII-REUNION-CONOSUR.pdf; consultado diciembre 2018.
18. Iniciativa de Salud del Cono Sur (INCOSUR). VIII Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión. Tarija, Bolivia, 16 al
18 de marzo de 1999. Organización Panamericana de la Salud. OPS/HPC/HTC/151.99. En: https://www.paho. org/hq/dmdocuments/2011/VIII-REUNION-CONOSUR.pdf; consultado diciembre 2018.
19. Iniciativa de Salud del Cono Sur (INCOSUR). IX Reunión de la Comisión Intergubernamental para la eliminación del Triatoma Infestans y la Interrupción de la Tripanosomiasis Americana Transfusional. Rio de Janeiro, Brasil, 20-22 de marzo del 2000. En: https://www.paho.org/hq/index.php?option=com_docman&view=download&category_slug=incosur-4062&alias=15346-ix-reunion-comision-intergubernamental-eliminacion-triatoma-infestans-interrupcion-tripanosomiasis-americana-transfusional-rio-janeiro-brasil-20-22-marzo-2000-346&Itemid=270&lang=es; consultado diciembre 2018.
20. Iniciativa de Salud del Cono Sur (INCOSUR). X Reunión de la Comisión Intergubernamental para la eliminación del Triatoma Infestans y la Interrupción de la Tripanosomiasis Americana Transfusional. Montevideo, Uruguay, marzo del 2001. En: https://www.paho.org/hq/dmdocuments/2011/chagas-X-Reunion-Incosur.pdf; consultado diciembre 2018.
21. XI Reunión de la Comisión Intergubernamental para la eliminación del Triatoma Infestans y la Interrupción de la Tripanosomiasis Americana Transfusional. Asunción, Paraguay, 10 al 20 de marzo del 2002. En: https://www. paho.org/hq/dmdocuments/2011/XI-REUNION-INCOSUR.pdf; consultado diciembre 2018.
22. XII Reunión de la Comisión Intergubernamental para la eliminación del Triatoma Infestans y la Interrupción de la Tripanosomiasis Americana Transfusional. Santiago, Chile, marzo del 2003. En: https://www.paho.org/hq/dmdocuments/2011/XII-REUNION-INCOSUR.pdf; consultado diciembre 2018.
23. Iniciativa de Salud del Cono Sur (INCOSUR). XIII Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión. Buenos Aires, Argentina, 29 al 31 de marzo de 2004. Organización Panamericana de la Salud. OPS/DPC/CD/308/04. En: https://www.paho.org/hq/dmdocuments/2011/XIII-REUNION-INCOSUR.pdf; consultado diciembre 2018.
24. Iniciativa de Salud del Cono Sur (INCOSUR). XIV Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión, y Curso de Diagnóstico, manejo y Tratamiento de Enfermedad de Chagas OPS/MSF. Santa Cruz de la Sierra, Bolivia, 28 al 31 de Marzo de 2005. OPS/DPC/CD/364/05.
25. Iniciativa de Salud del Cono Sur (INCOSUR). XV Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la tripanosomiasis americana por transfusión. Brasilia, Brasil, 6 al 9 de junio de 2006. En: https://www.paho.org/hq/dmdocuments/2011/XV-REUNION-INCOSUR.pdf.
26. Iniciativa de Salud del Cono Sur (INCOSUR). XVI Reunión de la Comisión Intergubernamental para la eliminación de Triatoma infestans y la interrupción de la transmisión transfusional de la tripanosomiasis transfusional. Asunción, Paraguay, 25 al 27 de junio de 2008. HSD/CD/ CH/525-08.
27. XVII Reunión de la Comisión Intergubernamental para la eliminación del Triatoma Infestans y la Interrupción de la Tripanosomiasis Americana Transfusional. Santiago, Chile, 3 al 5 de agosto del 2010. HSD/CD/CH/03-11
28. XVIII Reunión de la Comisión Intergubernamental de la Iniciativa Subregional del Cono Sur para la eliminación de Triatoma infestans y la interrupción de la transmisión transfusional de la tripanosomiasis americana. Cocha- bamba, Bolivia, 27 al 29 de julio de 2011. Organización Panamericana de la Salud. OPS/HSD/CD/008-11.
29. Reunión Sudamericana de Iniciativas Subregionales de Prevención, Control y Atención de la Enfermedad de Cha- gas 27 al 29 de agosto de 2012 Buenos Aires, Argentina. En: https://www.paho.org/hq/dmdocuments/2012/2da-Reunion-Sudamer-Chagas-Arg-2012.pdf
30. Programa Nacional de Chagas, Argentina 2012. Reunión de la Comisión Intergubernamental de la Iniciativa Subregional del Cono Sur para la eliminación de Triatoma infestans y la interrupción de la transmisión transfusional de la tripanosomiasis americana. Termas de Río Hondo, Argentina, 7 al 8 de octubre de 2013. Ministerio de Salud, Presidencia de la Nación.
31. Programa Nacional de Chagas, Argentina 2013. XX Reunión de la Comisión Intergubernamental de la Iniciativa Subregional del Cono Sur para la eliminación de Triatoma infestans y la interrupción de la transmisión transfusional de la tripanosomiasis americana. Arequipa, Perú, 12 y 13 de octubre de 2014.
32. Programa Nacional de Chagas, Argentina 2014. XX Reunión de la Comisión Intergubernamental de la Iniciativa Subregional del Cono Sur para la eliminación de Triatoma infestans y la interrupción de la transmisión transfusional de la tripanosomiasis americana. Brasil, noviembre 2015.
33. Instituto Nacional de Estadísticas y Censos (INDEC). Censo Nacional de Población, Hogares y Viviendas 2010. En: https://www.indec.gov.ar/nivel4_default.asp?id_tema_1=2&id_tema_2=41&id_tema_3=135; consultado diciembre 2018.
34. Auditoría General de la Nación. Informe de Auditoría del Programa Nacional de Chagas 2015-2016. Buenos Aires, mayo de 2018. En: https://www.agn.gov.ar/files/informes/2018_079info.pdf; consultado diciembre 2018.
35. Alazraqui M, Motta E, Spinelli H. Sistemas de Información en Salud: de sistemas cerrados a la ciudadanía social. Un desafío en la reducción de desigualdades en la gestión local. Cad Saúde Pública Rio de Janeiro 2006; 22: 2693-702.
36. Szarfman A, Urman J, Otalora A, Larguia A, Yanovsky JF. Specific agglutinin and immunoglobulin levels in congenital Chagas infection. Medicina (B Aires) 1975; 35: 245-50.
37. Sosa-Estani S, Cura EN, Velázquez E, Yampotis C, Segura EL. Etiological treatment of young women infected with Trypanosoma cruzi, and prevention of congenital transmission. Rev Soc Bras Med Trop 2009; 42: 484-7.
38. Fabbro DL, Danesi E, Olivera V, et al. Trypanocide treat- ment of women infected with Trypanosoma cruzi and its effect on preventing congenital Chagas. PLoS Negl Trop Dis 2014; 8: e3312.
39. Schijman AG, Bisio M, Orellana L, et al. International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLoS Negl Trop Dis 2011; 5: e931.
40. Cura CI, Ramírez JC, Rodríguez M, et al. Comparative study and analytical verification of PCR methods for the diagnosis of congenital Chagas disease. J Mol Diagn 2017; 19: 673-81.
41. Affranchino JL, Ibáñez CF, Luquetti AO, et al. Identification of a Trypanosoma cruzi antigen that is shed during the acute phase of Chagas’ disease. Mol Biochem Parasitol 1989; 34: 221-8.
42. Russomando G, Sánchez Z, Meza G, de Guillen Y. Shed acute-phase antigen protein in an ELISA system for unequivocal diagnosis of congenital Chagas disease. Expert Rev Mol Diagn 2010; 10: 705-7.
43. Russomando G, Almiron M, Candia N, Franco L, Sánchez Z, de Guillen I. Implementación y evaluación de un sistema localmente sustentable de diagnóstico prenatal que permite detectar casos de transmisión congénita de la enfermedad de Chagas en zonas endémicas del Paraguay. Rev Soc Bras Med Trop 2005; 38: 49-54.
