MARTÍN HUNTER 1, SANTIAGO BELTRAMINO 1, CECILIA VERA OCAMPO 2, RICARDO SÁNCHEZ MARULL 3, GUSTAVO BADARIOTTI 1, BERNARDO DE DIEGO 1
1Servicio de Terapia Intensiva, 2Servicio de Infectología, 3Servicio de Anatomía Patológica, Sanatorio Mater Dei, Buenos Aires, Argentina
Resumen La estrongiloidiasis es una afección desatendida causada por el parásito Strongyloides stercoralis. En los individuos inmunosuprimidos, fundamentalmente en los que tienen depresión de la inmunidad celular, puede desarrollarse el síndrome de hiperinfección por Strongyloides. La coinfección con virus linfotrópico de células T humanas (HTLV) es un factor de riesgo para el desarrollo de formas graves de estrongiloidiasis. Presentamos el caso de un hombre de 50 años con hiperinfección por Strongyloides y coinfección con HTLV. Se demoró el diagnóstico debido a su epidemiología inusual y a la sospecha inicial de enfermedad inflamatoria intestinal. El diagnóstico se confirmó mediante la identificación del parásito en muestras de lavado bronquio-alveolar y biopsias de mucosa duodenal y colónica. Se utilizó ivermectina subcutánea como tratamiento antihelmíntico con adecuada respuesta terapéutica.
Palabras clave: antihelmínticos, paciente inmunocomprometido, enfermedad olvidada, Strongyloides
Abstract Strongyloides hyperinfection in patient from Patagonia with HTLV-1 co-infection. Strongylodiasis is an unattended condition caused by the parasite Strongyloides stercoralis. The Strongyloides hyperinfection syndrome can develop in immunosuppressed hosts, mainly in those with depression of cellular immunity. Co-infection with human T-cell lymphotropic virus (HTLV) is a risk factor for the development of severe forms of strongyloidiasis. We present the case of a 50-year-old man with Strongyloides hyperinfection and coinfection with HTLV. The diagnosis was delayed owing to its unusual epidemiology and an initial suspicion of inflammatory bowel disease. Identification of the parasite in bronchioalveolar lavage and duodenal and colonic mucosa biopsies confirmed the diagnosis. Subcutaneous ivermectin was used as an anthelmintic treatment with an adequate therapeutic response.
Key words: anthelmintics, immunocompromised patient, neglected disease, Strongyloides
Dirección postal: Martín Hunter, Servicio de Terapia Intensiva, Sanatorio Mater Dei, San Martín de Tours 2952, 1425 Buenos Aires, Argentina
e-mail: huntmart@gmail.com
La estrongiloidiasis es una enfermedad desatendida causada por Strongyloides stercoralis, un nematodo presente en el suelo. Está difundido principalmente en regiones tropicales y subtropicales pero también habita pequeñas áreas de baja endemicidad en climas templados 1. En la República Argentina, se han identificado áreas de alta prevalencia en Misiones, Chaco, Formosa y Salta 2.
En individuos inmunosuprimidos puede producir formas graves potencialmente fatales como el síndrome de hiperinfección por Strongyloides y la estrongiloidiasis diseminada 3. La probabilidad de desarrollar el síndrome de hiperinfección aumenta si la inmunidad celular está alterada como en casos de inmunodeficiencia congénita, malignidad subyacente, desnutrición, alcoholismo, trasplante de células madre hematopoyéticas o administración de corticosteroides o fármacos citotóxicos. Además, la infección por el virus linfotrópico de células T humanas (HTLV-1) es un factor de riesgo significativo para el desarrollo de estrongiloidiasis diseminada y fallo terapéutico 4.
Caso clínico
Hombre de 50 años, operador de maquinaria vial, oriundo de Bolivia, residente en Pico Truncado (provincia de Santa Cruz, Argentina) por más de 30 años. Antecedentes conocidos: apendicetomía (que se complicó con peritonitis por lo que fue reintervenido quirúrgicamente) y nefrolitiasis (tratada con litotricia en dos oportunidades). Comenzó a mediados de 2017 con diarrea acuosa, dolor abdominal y pérdida de peso. Una videocolonoscopía realizada a fines de 2017 demostró la presencia de úlceras lineales confluentes sugestivas de enfermedad de Crohn con anatomía patológica compatible a 40 cm del margen anal. Fue internado en la ciudad de Comodoro Rivadavia en enero de 2018 y se inició tratamiento con pulsos de corticoides endovenosos continuando con dosis de 1 mg/kg/día por vía oral. Evolucionó con registros febriles por lo que requirió nueva internación. Se realizó tomografía computarizada que evidenció engrosamiento del sigmoides. Se interpretó como enfermedad inflamatoria intestinal grave y refractaria al tratamiento. Se planteó inicio de rituximab pero se demoró dada la presencia de serología positiva para anticuerpo anti-core de hepatitis B. Evolucionó con hipotensión arterial, hemoptisis e insuficiencia respiratoria hipoxémica por lo que se realizó intubación orotraqueal y conexión a asistencia respiratoria mecánica y fue derivado a nuestra institución.
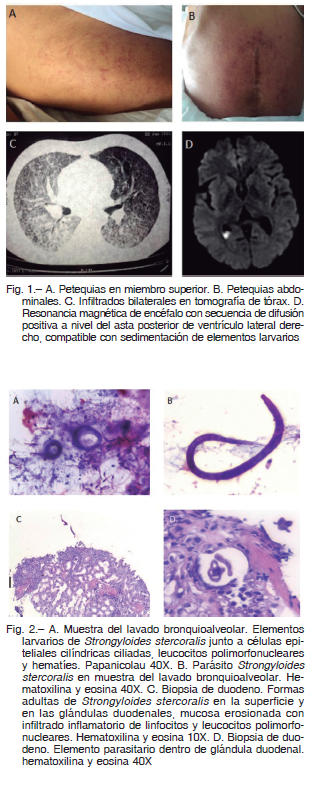
Al ingreso, se encontraba en coma, con petequias en abdomen y en miembros superiores (Fig. 1A y 1B), ruidos hidroaéreos ausentes. Las pruebas de laboratorio de ingreso mostraron hematocrito 25%, leucocitos 8500/mm3 (eosinófilos 0.1%), velocidad de sedimentación globular 80 mm/h, plaquetas y coagulograma normales y serología negativa para virus de inmunodeficiencia humana (HIV). La tomografía computarizada de tórax mostró infiltrados bilaterales (Fig. 1C). Se realizó fibrobroncoscopía que descartó hemorragia alveolar y se tomó lavado bronquioalveolar. Se decidió realizar nuevas endoscopías digestivas. En la videoendoscopía digestiva alta se evidenció una duodenopatía inespecífica de la cual se tomaron biopsias. La videocolonoscopía mostró pérdida del patrón vascular con friabilidad y erosiones de forma parcheada y asimétrica de donde también se tomaron biopsias.
La anatomía patológica reveló la presencia de organismos parasitarios compatibles con Strongyloides stercoralis en lavado bronquioalveolar y en muestras de duodeno y colon (Fig. 2). Se desestimó el diagnóstico de enfermedad inflamatoria intestinal por lo que se suspendió el tratamiento con corticoides y se inició tratamiento con albendazol e ivermectina interpretando hiperinfección por S. stercoralis. La ivermectina fue administrada por vía subcutánea debido a que el paciente se encontraba en íleo grave, con débito de más de 4 litros por día a través de sonda nasogástrica. Dado el diagnóstico de hiperinfección por S. stercoralis en paciente HIV negativo, se solicitó dosaje anticuerpo antivirus linfotrópico de células T humanas (HTLV) I y II y se obtuvo un título reactivo de 150.8 (método enzimoinmunoensayo, valor normal = 1).
A pesar del tratamiento antiparasitario instaurado y la suspensión de la sedoanalgesia, el paciente persistió con cuadro clínico de encefalopatía sin causa clara. Los resultados de una tomografía computarizada de encéfalo, una punción lumbar y un electroencefalograma fueron normales. Se realizó resonancia magnética de encéfalo que evidenció imágenes compatibles con sedimentación de elementos larvarios en ventrículo lateral derecho (Fig. 1D).
El paciente evolucionó lentamente de forma favorable, con resolución del íleo y de la encefalopatía. Fue traqueostomizado y luego decanulado. Egresó de nuestra institución en marzo del 2018 a centro de rehabilitación especializado.
Discusión
El síndrome de hiperinfección por Strongyloides stercoralis es una complicación grave de una infección de larga data en la que hay un aumento excesivo en el número de parásitos dentro del huésped. El factor de riesgo más común es la terapia con corticoides 5. La estrongiloidiasis diseminada se caracteriza por la abundante propagación de las larvas hacia sitios extraintestinales como los pulmones, el corazón, los riñones y el sistema nervioso central 6. Nuestro paciente sufría de sepsis como una complicación del síndrome de hiperinfección y estrongiloidiasis diseminada después de la terapia inmunosupresora.
Consideramos que esta complicación se debió a demoras en el diagnóstico inicial. Esta demora puede explicarse, en primer lugar, por la epidemiología inusual del paciente. Como se mencionó previamente, la prevalencia por S. stercoralis es elevada (hasta 83%) en zonas del noreste y noroeste argentino y casi nula en provincias de la Patagonia según una revisión sistemática de geohelmintiasis publicada en Medicina (B Aires) 2. En segundo lugar, el estudio de anatomía patológica, a partir de la endoscopía realizada inicialmente, orientó el diagnóstico hacia una colitis causada por enfermedad inflamatoria intestinal y no por S. stercoralis.
Los hallazgos macroscópicos de la estrongiloidiasis en los estudios endoscópicos se confunden frecuentemente con aquellos de colitis ulcerosa o enfermedad de Crohn, como ya ha sido informado 7. La videoendoscopía digestiva alta habitualmente revela una mucosa duodenal hiperémica y edematosa, eritema, frialdad y vellosidades duodenales blanquecinas. La videocolonoscopía puede mostrar edema en la mucosa, erosiones, hemorragias en la submucosa y ulceraciones que pueden alternarse con porciones de mucosa sana. La distinción entre estrongiloidiasis y enfermedad inflamatoria intestinal se hace por la microscopía. Sin embargo, existe superposición en las características de estas dos entidades. El examen histológico en la estrongiloidiasis revela edema e infiltración de la lámina propia por linfocitos, plasmocitos y eosinófilos, vellosidades despuntadas, criptitis e hiperplasia de las criptas, hallazgos también frecuentes en la enfermedad inflamatoria intestinal 8. En nuestro caso, la distinción morfológica precisa se vio superada por la aparición de elementos larvarios característicos de S. stercoralis tanto en la muestra obtenida en el lavado bronquioalveolar como en las endoscopías.
Strongiloides stercoralis y HTLV-1 comparten algunas regiones endémicas como Japón, Jamaica y Sudamérica y en otras regiones se los diagnostica principalmente en inmigrantes de áreas endémicas 9-11. La coinfección con HTLV-1 es un factor de riesgo importante para el desarrollo de formas graves de estrongiloidiasis debido a una respuesta inmune de tipo Th2 disminuida. Un estudio realizado en Perú mostró que pacientes con diagnóstico de hiperinfeción por Strongyloides presentaron una frecuencia de infección por HTLV-1 (18/21 pacientes) significativamente mayor en comparación con un grupo de sujetos sanos con muestras de materia fecal negativas para el parásito (1/21)12. Autores argentinos publicaron recientemente el caso de una mujer oriunda de Perú, residente en la Ciudad de Buenos Aires, con diagnóstico de infección por S. stercoralis y coinfección con HTLV-1 13. Es interesante destacar que, al igual que nuestro caso, en la discusión ellos jerarquizan la epidemiología inusual del caso presentado. Además, la paciente también había recibido tratamiento con corticoides por sospecha de vasculitis con agravamiento clínico inmediato.
El tratamiento antihelmíntico más efectivo para la infección por S. stercoralis es la ivermectina, que paraliza al nematodo al aumentar la permeabilidad de su membrana al ion cloruro. Actualmente, la única vía de administración aprobada para su uso en humanos es la oral. Sin embargo, en infecciones graves hay habitualmente compromiso extenso del intestino delgado por lo que la administración enteral es poco tolerada. Una casuística describió el uso intravenoso de ivermectina, pero el paciente falleció 14. Existen datos limitados sobre el uso no licenciado de ivermectina subcutánea. Aunque la experiencia en el uso parenteral de ivermectina es aún limitada, hay evidencia preliminar de su inocuidad y eficacia en el tratamiento de la estrongiloidiasis grave 15. En nuestro caso, fue necesario realizar un pedido a la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para obtener ivermectica subcutánea, presentación disponible para uso veterinario.
En síntesis, el caso descrito representa una hiperinfección por Strongyloides stercoralis en un paciente con epidemiología inusual, dado que fue derivado desde la Patagonia, área no endémica para este parásito. El diagnóstico se postergó debido a hallazgos endoscópicos compatibles con enfermedad inflamatoria intestinal y el desconocimiento inicial de la infección por HTLV. Respondió de manera favorable a la suspensión de los corticoides y a la implementación del tratamiento antiparasitario específico.
Conflictos de interés: Ninguno para declarar
Bibliografía
1. WHO: Strongyloidiasis. En: https://www.who.int/intestinal_worms/epidemiology/strongyloidiasis/en/; consultado diciembre 2018.
2. Socías ME, Fernández A, Gil JF, Krolewiecki AJ. Geohelmintiasis en la Argentina: una revisión sistemática. Medicina (B Aires) 2014; 74: 29-36.
3. Marcos LA, Terashima A, Canales M, Gotuzzo E. Update on strongyloidiasis in the immunocompromised host. Curr Infect Dis Rep 2011; 13: 35-46.
4. Porto MA, Alcântara LM, Leal M, Castro N, Carvalho EM. Atypical clinical presentation of strongyloidiasis in a patient co-infected with human T cell lymphotrophic virus type I. Am J Trop Med Hyg 2005; 72: 124-5.
5. Boulware DR, Stauffer WM, Hendel-Paterson BR, et al. Maltreatment of Strongyloides infection: case series and worldwide physicians-in-training survey. Am J Med 2007; 120: 545.e1-8.
6. Keiser PB, Nutman TB. Strongyloides stercoralis in the immunocompromised population. Clin Microbiol Rev 2004; 17: 208-17.
7. Poveda J, El-Shatkawy F, Arosemena LR, Garcia-Buitrago MT, Rojas CP. Strongyloides colitis as a harmful mimicker of inflammatory bowel disease. Case Rep Pathol 2017; 2017: 2560719.
8. Thompson BF, Fry LC, Wells CD, et al. The spectrum of GI strongyloidiasis: an endoscopic-pathologic study. Gastrointest Endosc 2004; 59: 906-10.
9. Chieffi P, Chiattone CS, Feltrim EN, Alves RC, Paschoalotti MA. Coinfection by Strongyloides stercoralis in blood donors infected with human T-cell leukemia/lynphoma virus type 1 in São Paulo City, Brazil. Mem Inst Oswaldo Cruz 2000; 95: 711-2.
10. Saito A. Strongyloidiasis: epidemiology, clinical manifestations and new methods for diagnosis and treatment. J Infect Chemother 1995; 1: 98-106.
11. Robinson RD, Lindo JF, Neva FA, et al. Immunoepidemiologic studies of Strongyloides stercoralis and human T lymphotropic virus type 1 infections in Jamaica. J Infect Dis 1994; 169: 692-6.
12. Gotuzzo E, Terashima A, Alvarez H, et al. Strongyloides stercorales hyperinfection associated with human T cell lymphotropic virus type-1 infection in Peru. Am J Trop Med Hyg 1999; 60: 146-9.
13. Quintero O, Berini CA, Waldbaum C, et al. Importance of a rapid and accurate diagnosis in Strongyloides stercoralis and Human T-Lymphotropic Virus 1 co-infection: A case report and review of the literature. Front Microbiol 2017; 8: 2346.
14. Gupta S, Jain A, Fanning TV, Couriel DR, Jimenez CA, Eapen GA. An unusual cause of alveolar hemorrhage post hematopoietic stem cell transplantation: a case report. BMC Cancer 2016; 6: 87.
15. Barrett J, Broderick C, Soulsby H, Wade P, Newsholme W. Subcutaneous ivermectin use in the treatment of severe Strongyloides stercoralis infection: two case reports and a discussion of the literature. J Antimicrob Chemother 2016; 71: 220-5.
