JUAN CARLOS AVALOS 1, FRANCISCO 2, BARBARA ROSSO 1, ANA GABRIELA BESOCKE 1, MARÍA DEL CARMEN GARCÍA 2
1Sección Epilepsia, Servicio Neurología, 2Unidad de Análisis de Neuroimágenes, Centro de Esclerosis Múltiple de Buenos Aires, Hospital Italiano de Buenos Aires, Argentina
Resumen El objetivo de este estudio fue combinar dos métodos automatizados de análisis estructural de imágenes de resonancia magnética para identificar cambios estructurales en pacientes nacidos en Argentina con epilepsia generalizada idiopática (EGI) en comparación con un grupo control de adultos sanos. Fueron incluidos 28 pacientes con EGI y 26 controles sin diferencias demográficas significativas. El análisis de las estructuras cerebrales se realizó con dos métodos automatizados de análisis de imágenes de resonancia magnética: la morfometría basada en vóxel y con la herramienta de segmentación y registro integrada FSL (FSL-FIRST). FSL mostró una disminución del volumen en ambos tálamos en EGI en comparación con el grupo control (tálamo izquierdo: 8092 mm3 grupo control vs. 7424 mm3 EGI, p = 0.0015; tálamo derecho: 7951 mm3 grupo control vs. 7247 mm3 EGI, p = 0.0016). Se observó una reducción en el volumen de ambos núcleos caudados (izquierdo: 3612 mm3 grupo control vs. 3376 mm3 EGI, p = 0.01; derecho 3683 mm3 grupo control vs. 3459 mm3 EGI, p = 0.04). La morfometría basada en vóxel mostró una disminución del volumen en ambos núcleos caudados en EGI en comparación con el grupo control. Las otras estructuras cerebrales analizadas no mostraron diferencias significativas entre los grupos. Este estudio muestra la reducción en el volumen en las estructuras subcortical, tálamos y núcleos caudados en pacientes con EGI comparado con un grupo control..
Palabras clave: epilepsia generalizada, morfometría basada en vóxel, volumetría, resonancia magnética, tálamo
Abstract Cerebral structural changes in generalized idiopathic epilepsy identified by automated magnetic resonance imaging analysis. The purpose of this study was to combine two automated methods of magnetic resonance imaging (MRI) structural analysis in order to identify structural changes in patients born in Argentina with idiopathic generalized epilepsy (IGE) compared to a healthy adult control group. Twenty-eight patients with IGE and 26 controls with no significant demographic differences were included. The analysis of the brain structures was conducted with two automated methods of magnetic resonance image analysis: voxel-based morphometry and FSL-integrated registration and segmentation toolbox (FSL-FIRST). FSL showed volume decrease in both thalamus in patients with IGE compared to the control group (left: 8092 mm3 control group vs. 7424 mm3 IGE, p = 0.0015; right: 7951 mm3 control group vs. 7247 mm3 IGE, p = 0.0016). A reduction in the volume of both caudate nuclei was also seen (left: 3612 mm3 control group vs. 3376 mm3 IGE, p = 0.01; right: 3683 mm3 control group vs. 3459 mm3 IGE, p = 0.04). Voxel-based-morphometry showed a volume decrease in both caudate nuclei in patients with IGE compared to the control group. The other cerebral structures analyzed did not show significant differences between the groups. In conclusion, this study shows the reduction in volume in the subcortical, thalamic, and caudate nuclei structures in patients with IGE in comparison to control group. This study conducted in our country delves into the analysis of brain structural changes in patients with EGI compared to healthy subjects.
Key words: generalized epilepsy, voxel-based morphometry, volumetry, magnetic resonance, thalamus
Dirección postal: Juan Carlos Avalos, Hospital Italiano de Buenos Aires, Tte. Gral. Juan Domingo Perón 4190, 1199 Buenos Aires, Argentina
e-mail: juancavalos.neurologia@gmail.com
La epilepsia generalizada idiopática (EGI) comprende un grupo heterogéneo de síndromes epilépticos que tienen inicio no focal y ninguna otra causa identificable más que la predisposición genética 1. La EGI abarca los síndromes de epilepsia de ausencia infantil (EAI), de ausencia juvenil (EAJ), mioclónica juvenil (EMJ) y con crisis tónico-clónicas generalizadas (ETGC), así como algunos casos que no encajan en uno de estos síndromes claramente definidos 2. La patogenia de la EGI es poco conocida; sin embargo, la evidencia reunida sugiere que los circuitos del tálamo-cortical desempeñan un papel crítico, y sus anomalías podrían estar asociadas con la generación de descargas de punta onda 3.
La resonancia magnética convencional (IRM) en pacientes con EGI no ha mostrado anomalías. Sin embargo, las evaluaciones cuantitativas que utilizan la Morfometría Basada en Voxel (MBV) han mejorado la sensibilidad de esta técnica de imagen en la detección de anomalías cerebrales en EGI y demostrado ser sensible en la detección de alteraciones estructurales sutiles que no pueden medirse mediante IRM convencional 4.
A pesar de estas mejoras, los estudios MBV sobre EGI no son concluyentes en términos de cambios estructurales. Algunos estudios de segmentación manual del tálamo no encontraron diferencias volumétricas 5-7. Otros hallazgos sugieren una disminución de los volúmenes talámicos en EGI 8,9 mientras que los aumentos también se han demostrado 10.
Los hallazgos de MBV no solo se limitan al tálamo. Se han encontrado cambios volumétricos en el lóbulo frontal, los ganglios basales, el lóbulo parietal, la ínsula, el lóbulo temporal y la corteza cingulada 7,11,12. Otro método de análisis utilizado actualmente es el FIRTS (Herramienta de Segmentación y Registro Integrado del FMRIB). Segmenta automáticamente las estructuras cerebrales utilizando un enfoque probabilístico bayesiano que, junto con otras herramientas de análisis, permite la evaluación de los volúmenes de la estructura cerebral 13. Los estudios realizados utilizando este método han mostrado alteraciones en las estructuras subcorticales en la EGI 14. El propósito de este estudio fue combinar dos métodos automatizados de análisis de IRM estructural para identificar cambios estructurales en la materia gris cortical y subcortical, y la materia blanca, en pacientes nacidos en Argentina con IGE en comparación con un grupo control.
Materiales y métodos
Se realizó un estudio retrospectivo de 28 adultos mayores de 18 años con EGI en seguimiento en el Programa de Epilepsia del Hospital Italiano de Buenos Aires. El diagnóstico de EGI se basó en los criterios electroclínicos propuestos por el International League Against Epilepsy (ILAE) 1, 2. Todos cumplieron con los siguientes criterios de inclusión: (a) clara semiología de epilepsia de ausencia juvenil, mioclónica juvenil o con crisis tónico-clónicas generalizadas; (b) sin evidencia de anomalías en el examen neurológico y un rendimiento cognitivo global > 28/30 en el Mini-Mental State Examination (MMSE); (c) al menos un electroencefalograma con evidencia de descargas interictales generalizadas de punta onda de 3-5 Hz con predominio frontal y central y actividad de base normal; y (d) ausencia de anomalías en la resonancia magnética convencional.
En el grupo control (GC), se incluyeron 26 personas emparejadas por sexo y edad que cumplieron con los siguientes criterios de inclusión: (a) sin evidencia de anomalías en un examen neurológico y un rendimiento cognitivo global > 28/30 en el MMSE; (b) sin antecedentes personales o familiares de epilepsia; (c) no abuso de alcohol o drogas; y (d) resonancia magnética convencional normal. Las correcciones se utilizaron por edad y género. Este estudio fue aprobado por el Comité de Ética de los protocolos de investigación del Hospital Italiano de Buenos Aires, código 3621.
Se utilizó un escáner Siemens Magnetom Essenza 1.5T (Alemania) para recopilar imágenes de RM para el posterior procesamiento. Se obtuvieron imágenes volumétricas T1 de alta resolución. Para identificar posibles estructuras anormales, se realizaron además T2 y FLAIR. Los volúmenes cerebrales se midieron en imágenes T1 utilizando el programa SIENAX 13-15. El mismo determina el volumen cerebral total de manera transversal, así como los volúmenes de sustancia blanca y gris de forma selectiva. El volumen talámico se estimó utilizando FIRST incorporado en la biblioteca FSL (www.fmrib.oxlibrary.ac.uk) que permitió la segmentación de estructuras subcorticales.
Los datos de ambos grupos (pacientes y controles) obtenidos con SIENAX y FIRST se compararon mediante ANOVA y se realizaron pruebas post hoc de Bonferroni. Los valores de p <0.05 se consideraron significativos. El software Stata v14.0 se utilizó para la recopilación y análisis de datos.
Por otro lado, las imágenes fueron procesadas además con otra herramienta automatizada llamada Statistical Parametric Mapping 8 (SPM8) y utilizamos un método de registro no lineal llamado DARTEL (Registro anatómico defeomórfico a través de algebra exponencial). Dicho método nos permite realizar grandes deformaciones de las imágenes, primero segmentando los tejidos es sus componentes esenciales, sustancia gris (SG) y sustancia blanca (SB) para luego crear plantillas de SG y SB en el grupo control que nos permitan comparar con las imágenes de los pacientes con EGI previamente segmentadas. 16,17. Para evaluar las diferencias en las concentraciones de SG y SB entre el grupo control y el de EGI se realizó una comparación vóxel a vóxel de la concentración de cada tejido aplicando el método estadístico llamado Modelo Lineal General o análisis de regresión múltiple 18.
Resultados
Fueron incluidos veintiocho pacientes (20 mujeres; edad media: 27 años) y 26 controles (19 mujeres; edad media: 27 años) sin diferencias significativas en edad o género.
Respecto al tipo de epilepsia, se incluyeron 15 ETCG, 11 EMJ y 2 EAJ. La edad de inicio de la enfermedad fue de 17 ± 4.3 años (rango: 9-27). Los años de progresión de la enfermedad fueron 11 ± 8.6 años (rango: 1-32). Los fármacos antiepilépticos administrados fueron valproato como monoterapia para 17 pacientes, lamotrigina como monoterapia para 7 y levetiracetam como monoterapia para 3. Solo uno recibió una combinación de valproato y lamotrigina.
El análisis de los volúmenes estándar de ambos tálamos realizados con SIENAX mostró una disminución significativa en el grupo EGI en comparación con el GC (tálamo izquierdo: 8092 mm3 GC vs. 7424 mm3 EGI, p = 0.0015; tálamo derecho: 7951 mm3 GC vs. 7247 mm3 EGI (p = 0.0016).
Además, los volúmenes de ambos núcleos caudados (NC) mostraron una reducción importante en el grupo EGI en comparación con el GC (NC izquierdo: 3612 mm3 GC frente a 3376 mm3, EGI p = 0.01; NC derecho de 3683 mm3 GC frente a 3459 mm3 EGI, p = 0.04.
El volumen total de materia gris en ambos grupos no mostró diferencias importantes (materia gris: 81 3912 mm3 GC vs. 81 8079 mm3 EGI, p = 0.8). Tampoco hubo diferencias significativas en el volumen total de materia blanca (materia blanca: 77 0021 mm3 GC frente a 78 0521 mm3 EGI, p = 0.4.
En comparación con el análisis MBV del GC, los pacientes con EGI mostraron una reducción considerable en el volumen de materia gris en ambos NC (coordenadas MNI NC derecho 20, 3, 23, p < 0.05; coordenadas MNI NC izquierdo -18, 6, 21, p < 0.05). No se encontraron otras diferencias importantes entre el GC y los pacientes con EGI en el análisis de MG y MB (Fig. 1).
Discusión
Este estudio examina los volúmenes cerebrales de los pacientes con EGI en comparación con un GC a través de dos técnicas automatizadas de pos-procesamiento de análisis de IRM.
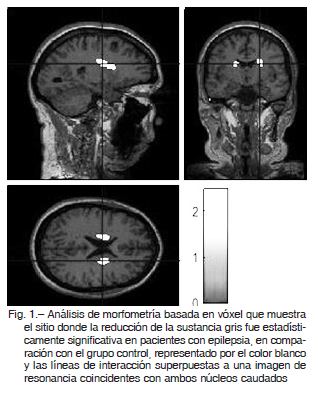
De acuerdo con las técnicas de IRM convencionales, no se han encontrado anomalías estructurales en EGI 19. Sin embargo, se han observado anomalías neuroanatómicas en las técnicas automatizadas de pos-procesamiento de imágenes en los últimos años20. Nuestro trabajo mostró una disminución en el volumen talámico con una diferencia estadísticamente significativa en ambos tálamos en comparación con el GC utilizando el método de análisis FIRST.
Los elementos celulares de las redes talámicas y corticales son bien conocidos. Un gran número de señales ingresan al tálamo y son transmitidas a la corteza cerebral a través de sinapsis excitatorias especialmente en las capas corticales III-IV y IV-V. La corteza tiene su propio circuito excitatorio e inhibitorio y desde aquí se proyectan neuronas hacia el tálamo, siendo en su mayoría interneuronas GABAérgicas. De esta forma, el tálamo no solo es un simple relevo de información entre los centros aferentes y la corteza, sino que es el encargado de procesamiento de la información, e influye por lo tanto sobre las funciones corticales. En este circuito participan otras estructuras subcorticales pertenecientes a los ganglios de la base, como por ejemplo los núcleos caudados 21. De aquí que la alteración funcional del circuito-tálamo cortical puede generar diferentes síndromes clínicos. Con respecto a esto último, se ha estudiado el papel del tálamo en los diferentes síndromes de epilepsia generalizada (EAI, EAJ, EMJ, EGTC). Esto fue demostrado a través de estudios electrofisiológicos en animales, en donde la inyección de penicilina, un antagonista del GABA (ácido gamma aminobutírico), condujo a la aparición descargas punta onda (PO) que son el sello distintivo de las de la EGI. La actividad de PO se observó tanto en la corteza como en el tálamo. En adición, la eliminación del tálamo, la corteza o sus conexiones abolía las descargas PO lo que sugiere que tanto la corteza como el tálamo son necesarios para la generación de descargas PO 22.
Esto llevó en los últimos años a la creación de herramientas de post proceso de imágenes de resonancia que nos permitan estudiar la presencia de alteraciones anatómicas en EGI, a través de un método no cruento como es la IRM. Con respecto a esto, nuestro grupo de trabajo encontró una reducción de los volúmenes de ambos tálamos en EGI en comparación con un grupo de cerebros control, siendo estos resultados consistentes con publicaciones previas en la literatura 23, 24 .
Por otro lado, también existen trabajos que muestran diferentes resultados. Publicaciones sobre segmentación manual del tálamo no han encontrado diferencias volumétricas en EGI 25,26, y a la inversa se encontró aumento en el volumen talámico en otras publicaciones 27. En razón de esta disparidad en los resultados publicados y dada las diferentes técnicas aplicadas en ellos, nuestro grupo de trabajo propuso aplicar dos técnicas de post proceso de resonancia magnética, a diferencia de otros trabajos en los cuales se aplica una sola técnica. Esto nos permitió, por un lado, comparar los dos grupos explorados, y por el otro explorar si existían diferencias con las dos técnicas de post proceso de IRM aplicadas en los mismos grupos y de este modo, aproximarnos a explicar los diferentes resultados encontrados en la literatura.
Con respecto a esto, al aplicar el análisis FIRTS encontramos una disminución en los volúmenes de ambos tálamos en EGI en comparación con el grupo control. Esto no pudo ser reproducido al realizar la técnica DARTEL. Esta diferencia en los resultados puede explicarse porque DARTEL utiliza un algoritmo difeomorfo para crear una plantilla del grupo de control y estandariza las estructuras cerebrales a través de las interacciones 16. Esto lleva al análisis de cada estructura segmentada por separado y con un gran número de interacciones para obtener una comparación significativa entre los grupos 28,29. Por lo tanto, para encontrar diferencias estadísticas, DARTEL puede requerir un aumento en el número de sujetos por grupo. Por el contrario, el algoritmo FIRST segmenta cada estructura subcortical automáticamente mediante la combinación de conceptos bayesianos con modelos de apariencia activa que conducen a un método más sensible para medir los volúmenes cerebrales 30. Al parecer ambas herramientas de pos-procesamiento son de hecho complementarias en el análisis visual de las imágenes.
Un hallazgo de este trabajo es que no solo DARTEL sino también FIRST han mostrado una reducción en el volumen de ambos NC en comparación con el GC. Esto podría explicarse porque el NC es parte de una red cerebral que está vinculada a los circuitos tálamo-corticales como hemos explicado anteriormente.
En este sentido, un estudio publicado por Wang y col. encontraron una disminución en los volúmenes talámicos en comparación con el grupo de control al usar MBV. Al evaluar la conectividad funcional a través de la RM funcional, se encontró una reducción en la conectividad entre ambos núcleos caudados, el putamen, la amígdala y el giro orbitofrontal en el mismo grupo de pacientes 31.
Los resultados obtenidos en nuestro trabajo apoyan y complementan estos hallazgos, ya que se encontró una diferencia estructural en los volúmenes del NC.
Por otro lado, un trabajo realizado en pacientes con EGI de reciente diagnóstico y antes del inicio del tratamiento con drogas antiepilépticas, mostró una reducción del volumen de materia gris del tálamo. Esto demuestra que la disminución del volumen del tálamo es una consecuencia intrínseca de la afección y no una consecuencia del uso a largo plazo de fármacos antiepilépticos 32.
Aunque los informes anteriores describen la pérdida de volumen en el hipocampo, la sustancia blanca putamen en EGI, no pudimos encontrar ninguna diferencia en estas estructuras en comparación con el grupo control. Nuestras observaciones refuerzan el concepto establecido por la Comisión de Clasificación y Terminología de ILAE que define a las epilepsias generalizadas como aquellas en las que las convulsiones se originan en algún lugar de las estructuras cerebrales profundas con una distribución bilateral rápida 33.
Una de las limitaciones del estudio es el pequeño tamaño de la muestra. Aunque las investigaciones futuras, con un tamaño mayor, nos permitirán establecer una relación con variables clínicas como la duración de la epilepsia y la frecuencia de las convulsiones.
En conclusión, este estudio muestra la reducción de volumen en las estructuras tálamicas subcorticales y del núcleo caudado en pacientes argentinos con EGI en comparación con el grupo de control, lo que contribuye a la cantidad de publicaciones relevantes en el mundo que nos permite comprender mejor la anomalía de la red subyacente de este trastorno.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Proposal for revised classification of epilepsies and epileptic syndromes. Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia 1989; 30: 389-99.
2. Classification of the epilepsies: New concepts for discussion and debate-Special report of the ILAE Classification Task Force of the Commission for Classification and Terminology. Epilepsia Open 2016; 1: 37-44.
3. Blumenfeld H. Cellular and network mechanisms of spikewave seizures. Epilepsia 2005; 46 Suppl 9: 21-33.
4. Huppertz HJ, Wellmer J, Staack AM, Altenmuller DM, Urbach H, Kroll J. Voxel-based 3D MRI analysis helps to detect subtle forms of subcortical band heterotopia. Epilepsia 2008; 49: 772-85.
5. Bernasconi A, Bernasconi N, Natsume J, Antel SB, Andermann F, Arnold DL. Magnetic resonance spectroscopy and imaging of the thalamus in idiopathic generalized epilepsy. Brain 2003; 126: 2447-54.
6. Roebling R, Scheerer N, Uttner I, Gruber O, Kraft E, Lerche H. Evaluation of cognition, structural, and functional MRI in juvenile myoclonic epilepsy. Epilepsia 2009; 50: 2456-65.
7. Liu M, Concha L, Beaulieu C, Gross DW. Distinct white matter abnormalities in different idiopathic generalized epilepsy syndromes. Epilepsia 2011; 52: 2267-75.
8. Kim JH, Lee JK, Koh SB, et al. Regional grey matter abnormalities in juvenile myoclonic epilepsy: a voxel-based morphometry study. NeuroImage 2007; 37: 1132-7.
9. Pulsipher DT, Seidenberg M, Guidotti L, et al. Thalamofrontal circuitry and executive dysfunction in recent-onset juvenile myoclonic epilepsy. Epilepsia 2009; 50: 1210-9.
10. Betting LE, Li LM, Lopes-Cendes I, Guerreiro MM, Guerreiro CA, Cendes F. Correlation between quantitative EEG and MRI in idiopathic generalized epilepsy. Hum Brain Mapp 2010; 31: 1327-8.
11. Tae WS, Hong SB, Joo EY, et al. Structural brain abnormalities in juvenile myoclonic epilepsy patients: volumetry and voxel-based morphometry. Korean J Radiol 2006; 7: 162-72.
12. Ciumas C, Savic I. Structural changes in patients with primary generalized tonic and clonic seizures. Neurology 2006; 67: 683-6.
13. Patenaude B, Smith SM, Kennedy DN, Jenkinson M. A Bayesian model of shape and appearance for subcortical brain segmentation. Neuroimage 2011; 56: 907-22.
14. Kim JH, Kim JB, Seo WK, Suh SI, Koh SB. Volumetric and shape analysis of thalamus in idiopathic generalized epilepsy. J Neurol 2013; 260: 1846-54.
15. Smith SM, Zhang Y, Jenkinson M, et al. Accurate, robust, and automated longitudinal and cross-sectional brain change analysis. Neuroimage 2002; 17: 479-89.
16. Ashburner J. A fast diffeomorphic image registration algorithm. Neuroimage 2007; 38: 95-113.
17. Ashburner J, Friston KJ. Voxel-based morphometry-the methods. Neuroimage 2000; 11: 805-21.
18. Genovese CR, Lazar NA, Nichols T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage 2002; 15: 870-8.
19. Koepp MJ. Juvenile myoclonic epilepsy-a generalized epilepsy syndrome? Acta Neurol Scand Suppl 2005; 181: 57-62.
20. Avoli M. A brief history on the oscillating roles of thalamus and cortex in absence seizures. Epilepsia 2012; 53: 779-89.
21. Blumenfeld H. The thalamus and seizures. Arch Neurol 2002; 59: 135-7.
22. Avoli M, Gloor P. Role of the thalamus in generalized penicillin epilepsy: observations on decorticated cats. Exper Neurol 1982; 77: 386-402.
23. Chan CH, Briellmann RS, Pell GS, Scheffer IE, Abbott DF, Jackson GD. Thalamic atrophy in childhood absence epilepsy. Epilepsia 2006; 47: 399-405.
24. Pardoe H, Pell GS, Abbott DF, Berg AT, Jackson GD. Multi-site voxel-based morphometry: methods and a feasibility demonstration with childhood absence epilepsy. Neuroimage 2008; 42: 611-6.
25. Bernasconi N, Andermann F, Arnold DL, Bernasconi A. Entorhinal cortex MRI assessment in temporal, extratemporal, and idiopathic generalized epilepsy. Epilepsia 2003; 44: 1070-4.
26. Seeck M, Dreifuss S, Lantz G, et al. Subcortical nuclei volumetry in idiopathic generalized epilepsy. Epilepsia 2005; 46: 1642-5.
27. Betting LE, Mory SB, Lopes-Cendes I, et al. MRI volumetry shows increased anterior thalamic volumes in patients with absence seizures. Epilepsy Behav 2006; 8: 575-80.
28. Shen S, Sterr A. Is DARTEL-based voxel-based morphometry affected by width of smoothing kernel and group size? A study using simulated atrophy. J Magn Reson Imaging 2013; 37: 1468-75.
29. Klein A, Andersson J, Ardekani BA, et al. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage 2009; 46: 786-802.
30. Woolrich MW, Jbabdi S, Patenaude B, et al. Bayesian analysis of neuroimaging data in FSL. Neuroimage 2009;45(1 Suppl): S173-86.
31. Wang Z, Zhang Z, Jiao Q, et al. Impairments of thalamic nuclei in idiopathic generalized epilepsy revealed by a study combining morphological and functional connectivity MRI. PloS one 2012; 7: e39701.
32. Perani S, Tierney TM, Centeno M et al. Thalamic volume reduction in drug-naive patients with new-onset genetic generalized epilepsy. Epilepsia 2018; 59: 226-34.
33. Berg AT, Berkovic SF, Brodie MJ, et al. Revised terminology and concepts for organization of seizures and epilepsies: report of the ILAE Commission on Classifica tion and Terminology, 2005-2009. Epilepsia 2010; 51: 676-85.
