LEÓN E. LITWAK1, IVANNA QUERZOLI2, CARLA MUSSO3, ALEJANDRO DAIN4, SOLANGE HOUSSAY4, ADRIÁN PROIETTI5, JOSÉ E. COSTA GIL5
1Servicio de Endocrinología, Metabolismo y Medicina Nuclear, Hospital Italiano de Buenos Aires, 2Departamento Médico Sanofi, 3Coordinadora de Diabetes, Fundación Favaloro, 4Hospital Tornú, 5Facultad de Ciencias Médicas, Universidad Favaloro, Buenos Aires, Argentina
Resumen Un adecuado control glucémico evita o retarda la aparición y/o evolución de las complicaciones crónicas en pacientes con diabetes mellitus (DM). Para lograrlo es necesario adecuar las dosis de insulina en personas con DM tipo 1 o tipo 2 en insulinoterapia, por el tradicional automonitoreo de glucosa capilar (AGC) que presenta aún limitaciones para generar un registro adecuado de datos, es invasivo y tiene baja adherencia. En contraposición, los nuevos sistemas de monitoreo continuo de glucosa (MCG) brindan una información más completa, más dinámica y con mejor tolerancia. Están constituidos por un sensor subcutáneo que informa ininterrumpidamente los niveles de glucosa del tejido celular subcutáneo y un módulo receptor que permite su lectura y almacenamiento. Los modelos de tiempo real (MCG-RT) permiten observar continuamente los datos, mientras que los sistemas intermitentes (MCG-Flash/EI) los muestran siempre y cuando se acerque el receptor al módulo sensor, generando una lectura voluntaria e intermitente, aunque almacenan todo en la memoria. El MCG informa además las tendencias glucémicas, indicando si están en ascenso o descenso y a qué velocidad cambian. El uso del MCG vs. AGC reduce la hemoglobina glicosilada (A1c) entre 0.53 y 1.0% con disminución significativa (38%) del tiempo de exposición a hipoglucemias. Presenta además, mayor adherencia. Los objetivos de esta revisión son: describir la homeostasis glucémica, evaluar la precisión del MCG, interpretar los datos adecuadamente y finalmente, sugerir en forma práctica los cambios para incorporar a la insulinoterapia tradicional, basados en la información que aportan estos novedosos sistemas de monitoreo.
Palabras clave: diabetes mellitus, auto-monitoreo de glucosa capilar, sistemas de monitoreo continuo de glucosa, insulina
Abstract Continuous glucose monitoring. Utility and indications. An adequate glycemic control prevents and/or delays the development and/or progression of chronic complications in patients with diabetes mellitus (DM). To achieve this control, it is necessary to adjust insulin doses, in type 1 or insulinized type 2 DM persons, based on traditional capillary glucose self-monitoring, which has limitations to generate an adequate data record, is invasive and has low adherence. In contrast, new continuous glucose monitoring (CGM) systems provide more complete and dynamic information, and better compliance. In these systems, a subcutaneous sensor continuously sends glucose values which are captured and stocked by a receptor module. Real-time models (CGM- RT) allow continuous and real-time readings of interstitial glucose, whereas CGM-Flash/EI systems require lector approach to sensor module performing intermittent scanning. CGM shows if glycemic levels are increasing or decreasing and how fast it is happening (tendency). CGM decreases glycosylated hemoglobin between 0.53% and 1.0%, as well as time in hypoglycemia by 38%, increasing the time in range of glucose levels, in patients with high adherence. The objectives of this review are to describe the glycemic homeostasis, to evaluate the accuracy of the CGM to interpret the data adequately and finally, based on the information provided by these novel monitoring systems, to suggest a practical way to be added to the traditional intensive insulin therapy.
Key words: diabetes mellitus, capillary glucose self-monitoring, continuous glucose monitoring, insulin
Recibido: 23-VI-2017 Aceptado: 25-XI-2017
Dirección postal: Dr. Francisco R. Spivacow, Instituto de Investigaciones Metabólicas, Libertad 836, 1012 Buenos Aires, Argentina
e-mail: spiva@idim.com.ar
Un adecuado control glucémico evita o retarda la aparición y/o la evolución de las complicaciones crónicas en pacientes con diabetes mellitus (DM). Numerosos trabajos han sugerido el beneficio de mantener niveles de hemoglobina glicosilada (A1c) inferiores a 7%, principalmente en los primeros años de la enfermedad (“memoria metabólica”) y durante el mayor tiempo posible1-4.
A pesar de esta evidencia, solo el 30% de los pacientes con DM tipo 1 (DT1) mantiene niveles de A1c menores a 7% y no superan el 50% aquellos con DM tipo 2 (DT2) bien controlados5-7.
El clásico automonitoreo de glucosa capilar (AGC), necesario para calcular las dosis de insulina, aún mantiene ciertas limitaciones, dado que presenta dificultades para llevar un registro adecuado de los datos, y porque sigue siendo invasivo y no muestra las tendencias de variación de la glucemia. Además, es necesario mantener un mínimo de 3 (óptimamente 5) controles diarios en pacientes tratados con insulina para alcanzar una adecuada A1c8, 9. Se estimó que por encima de 3 monitoreos diarios, cada control agregado mejora la A1c en 0.3%10. Recientemente, se han incorporado a la práctica clínica, sistemas de medición con- tinua de glucosa en el tejido celular subcutáneo, mediante un sensor que envía en forma ininterrumpida los datos que son captados por un módulo receptor que los almacena.
Los sistemas de monitoreo continuo de glucosa (MCG) se agrupan, de acuerdo con el tipo de lectura, en modelos de tiempo real (RT-Real Time) que permiten observar en el momento y en forma continua los niveles de glucosa intersticial, o bien modelos en los que se ne- cesita acercar el lector al módulo sensor, realizando un escaneo intermitente. (Flash/EI). Los primeros requieren seguir realizando 2 a 4 auto-monitoreos diarios para su calibración; en cambio, en el modelo Flash/EI, esto no es necesario, ya que es calibrado en fábrica. Algunos sistemas tienen alarmas visuales o auditivas que alertan el riesgo potencial de hiper o hipoglucemias y todos per- miten descargar los datos de la memoria en forma digital mediante programas específicos.
Una ventaja sobresaliente del MCG es la posibilidad
de determinar los cambios glucémicos generados por situaciones cotidianas e intercurrencias, contribuyendo a un mejor ajuste terapéutico al dar la posibilidad de educar y entrenar a los pacientes para la toma de decisiones11. A pesar de que el MCG podría sobre o subestimar lige- ramente los niveles de glucosa, aporta una información dinámica de los datos, permitiendo apreciar las tendencias y anticipar si habrá elevación o descenso de glucosa, permitiendo adecuar las conductas terapéuticas.
Los objetivos de esta revisión son revisar los antece- dentes del monitoreo de glucosa, proponer las indicacio- nes para su uso y sugerir los cambios terapéuticos que debieran realizarse con esa información.
Antecedentes
La glucosuria, como reflejo de la hiperglucemia marcó, al inicio, el diagnóstico de diabetes12. Desde entonces y por muchos años las soluciones de Fehling y de Benedict cuantificaron la glucosuria, permitiendo el diagnóstico y el control de la DM13. En los años 50, el laboratorio Miles-Ames de Elkhart (EE.UU.) creó diferentes reactivos (Clinitest® y Clinistix®) para detectar glucosa en orina, posibilitando a los pacientes medir la glucosuria, y permi- tiendo así, mejores ajustes en el tratamiento14. En 1965, el mismo laboratorio, introdujo la primer tirilla reactiva para medir la glucosa en sangre capilar (Dextrostix®), y en 1971 Anton Clemens patentó el Reflectance Meter 5541®, primer glucómetro por fotometría para leer el Dextrostix®, lo que permitió a los pacientes comenzar a realizar el AGC, que es el estándar de oro para guiar la insulinoterapia, principalmente en pacientes con DT1 o con (DT2) insulinizados. El estudio DCCT comprobó que la hiperglucemia era el principal factor generador de las complicaciones crónicas en DM y que el tratamiento in- tensificado con insulina (TII) disminuye marcadamente su aparición y progresión ubicando al AGC como un recurso indispensable para el TII 1, 15-21.
La aceptación del AGC en el tratamiento de la DT2 tiene aún controversias, aunque demostró su utilidad en pacientes con tratamiento de insulina, o en aquellos que permanecen en unidades de cuidado intensivo o en internación hospitalaria general22-24. En mujeres con dia- betes gestacional y/o pre-gestacional el AGC demostró gran efectividad, disminuyendo significativamente las complicaciones materno-fetales25-28.
Aun cuando los pacientes con DT1 en insulinoterapia intensificada realicen 3 a 5 autocontroles por día, la di- ficultad para recolectar los datos en ciertas situaciones (por ej, durante el sueño) y la imposibilidad de lograr información dinámica de las tendencias y fluctuaciones de la glucemia, han impulsado el desarrollo de sistemas de medición continua.
El primer método de MCG se aprobó en EE.UU. en 1999 (CGMS Gold, MiniMed®). Consistió en un sensor con glucosa oxidasa como enzima, implantado en el tejido subcutáneo (durante 3 días), que determinaba la glucosa intersticial cada 5 minutos, y entregaba los datos en forma retrospectiva29, 30. Se intentó obtener datos en tiempo real (GlucoWatch®) en 2001, mediante iontoforesis reversa para determinar la glucosa en la piel, pero fue retirado del mercado por reacciones adversas locales y dificultades en su calibración31. Los sistemas de MCG mejoraron su precisión, simplicidad, duración del sensor y aporte de datos, logrando una menor incidencia de hipoglucemias, y mejor adherencia y calidad de vida32-36.
Actualmente existen varios sistemas de MCG que se describirán destacando su precisión, facilidad de uso, indi- caciones y su posible efecto en el tratamiento con insulina.
Homeostasis glucémica y fundamentos del monitoreo continuo de glucosa
La glucemia de ayuno depende de la capacidad de secreción de insulina en condiciones basales. En con- diciones normales hay mayor sensibilidad a la insulina en la primera parte de la noche y una disminución en la segunda mitad (fenómeno del alba). Así, la concentración de insulina basal nocturna es significativamente menor en la primera parte de la noche con respecto a la segunda. La falta de insulina se acompaña del aumento de la secreción de glucagón. Como consecuencia de este desbalance, se incrementa la producción hepática de glucosa, tanto nocturna como inter prandial, manteniendo un nivel ade- cuado de glucemia37.
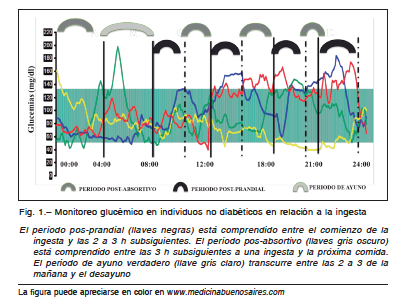
Cuando la glucosa se absorbe a nivel intestinal se produce un primer pico de secreción de insulina entre los 20 y 30 minutos pos-ingesta y luego un segundo pico más tardío, que dura hasta 120-150 minutos y que depende del monto de carbohidratos ingerido y el tiempo de duración de la comida, constituyendo en conjunto el bolo prandial de insulina. La glucemia vuelve a los niveles del ayuno luego de aproximadamente 5 horas. A este período tardío se lo denomina pos absortivo. Los GLUTs2 hepáticos permiten que el hígado incorpore la glucosa proveniente de los alimentos para convertirla en glucógeno, y durante el período pos-absortivo la glucogenolisis hepática mantiene la glucemia dentro de límites normales38-40.
Se distinguen así claramente el período de ayuno, el pos-prandial y el pos-absortivo. El área bajo la curva de
insulina dependerá de la composición de nutrientes y del contenido calórico de la ingesta. El bolo alimenticio
estimula la liberación de las gastro-entero-hormonas llamadas incretinas (polipéptido inhibidor gástrico y GLP-1,
glucagonlikepeptide 1, principalmente), potenciando la liberación de insulina y disminuyendo la secreción de
glucagón. GLP-1, enlentece además el vaciamiento gástrico y produce disminución central del apetito41, 42.
Un mayor conocimiento de estas fluctuaciones diarias generaría tratamientos más racionales y eficientes37, 43,
44. En la Figura 1 se resumen los distintos períodos en relación al uso racional de insulina.
Importancia en la toma de decisiones terapéuticas
La toma de decisiones es un proceso continuo en el cual el paciente y el equipo de salud interactúan para reducir el nivel de incertidumbre. La obtención de datos, su robustez y nivel de exactitud son limitantes al definir
un tratamiento adecuado y oportuno45, 46. En DT1 los métodos que informan el valor, la tendencia y el rango de glucemia son muy importantes para la toma de decisiones clínicas47.
Los métodos disponibles para evaluar el grado de control metabólico y variabilidad glucémica son los siguientes48:
1. Métodos analíticos: glucemia, hemoglobina glicosilada A1c, marcadores de inflamación, etc.
2. Métodos para determinar la glucemia capilar
3. Métodos para determinar la glucosa subcutánea
a. Sistema FLASH (FMCG)
b. Monitoreo continuo de glucosa MCG (combinables o no combinables con bomba de infusión de insulina (BPI)
Importancia de la exactitud y de la precisión de los métodos en el control metabólico
El término estándar de oro (gold standard) para la toma de decisiones es el mejor método disponible en un
determinado momento, para comparar las variables en estudio49, 50. El gold standard actual en DM es la glucosa
de sangre venosa o bien sangre capilar según normas ISO 15197:2015 51, 52. Los requisitos que debe cumplir un
glucómetro para ser considerado exacto y preciso los siguientes52:
1. Seguir las normas ISO 2013-2015
2. Ser exacto
3. Ser preciso
4. Presentar bajo nivel de sesgos sistemáticos.
5. Presentar algoritmo de lectura exacto
Por lo tanto, un método para medición de glucosa que posea una alta exactitud presentando un intervalo de confianza (IC) con menor rango y bajo sesgo, y que además presente homogeneidad de los resultados, es el método con el cual podremos tomar decisiones médicas con mejores chances de lograr el éxito terapéutico53,54.
Exactitud y precisión en los sistemas de monitoreo continuo de glucosa
Los sistemas de MCG no están homologados por las nor- mas ISO, utilizándose otros métodos, como el MARD (por sus siglas en inglés Mean Absolute Relative Difference) para evaluarlos. Éste expresa la diferencia media entre las mediciones de los sistemas evaluados y el estándar de referencia. Una limitante del MARD es su gran varia- bilidad en situaciones de cambios rápidos de la glucosa, aunque también depende de los días de utilización (6, 7, 14 o más) y de la necesidad de su calibración capilar. En la conferencia anual 2017 de Advanced Technologies and Treatments for Diabetes (ATTD 2017), se consensuó en un MARD aceptable de 10%. La calibración capilar de los sistemas de MCG permite mejorar su exactitud y precisión. Los MCG combinables con BPI requieren 2 a 3 calibraciones capilares por día55-57.
Lectura e interpretación práctica del monitoreo continuo de glucosa
Para el análisis integral de los niveles y oscilaciones de la glucosa, se divide el día en los siguientes períodos, con el objetivo de esquematizar y obtener datos que permitan de- sarrollar un plan de insulinización en la práctica clínica58-61: sobre todo la segunda parte de la noche donde tiene un mayor impacto terapéutico la insulinización basal. En general es un período del día donde no hay grandes fluctuaciones glucémicas. Las eventuales causas de fluctuaciones glucémicas durante el día (mucho más frecuentes) suelen ser: ingestas o colaciones al momento de acostarse por temor a hipoglucemias, actividad física en la última parte del día, poca ingesta de carbohidratos o cuadros gastrointestinales con vómitos, diarrea, cálculo inadecuado de dosis de insulina prandial, entre otros. Una vez finalizado el análisis de la noche se deben observar los períodos pre-prandiales, según los hábitos individuales y horarios de las ingestas de cada individuo. Finalmente, los períodos pos-absortivos se ven influenciados por la acción remanente del bolo de insulina prandial de la in- gesta previa, que se suma a la concentración de insulina basal circulante y puede modificarse por la actividad física.
Todo esto nos indicaría que, además de los momentos clásicamente aceptados para la colocación de insulina en el esquema basal prandial, deberíamos considerar su utilización en los momentos pos-absortivos (Fig. 1).
Se considera tiempo en rango al porcentaje del tiempo diario en el que los niveles de glucosa están en el obje- tivo deseado (70 a 180 mg/dl), tiempo en hipoglucemia cuando los niveles son menores a 70 mg/dl y tiempo en hiper-glucemia, al porcentaje de tiempo diario donde se superan los 180 mg/dl.
Indicaciones del monitoreo continuo de glucosa
Se recomienda el MCG en tiempo real (MCG -RT) o el MCGFlash/EI en:
1° Período nocturno temprano considerado pos-
- Adultos y niños con DT1 y A
>7%, en los que no
absortivo de la cena (00:00 a 04:00 horas)2° Período nocturno tardío (verdadero ayuno) (04:00 se pudo lograr su descenso y que pueden, deseen y demuestren capacidad para utilizar estos sistemas62, 63.
a 08:00 horas)
- Adultos y niños con DT1 y A
< 7%, con hipogluce-3° Períodos pre-prandiales (30 previos a una de las ingestas del día y momento habitual de aplicación de la insulina prandial)4° Períodos pos prandiales (hasta 2 a 3 horas posingesta)5° Períodos pos absortivos (entre 3 y 8 horas posingesta)Para cada período se deberán identificar, en primer lugar, la presencia de eventos con mayor riesgo (hipo- glucemias) y luego los de menor riesgo (hiperglucemias)mias leves/moderadas reiteradas o nocturnas/graves64,65.
- 3. Niños y adolescentes con DT1 en crecimiento y adultos que experimentan gran variabilidad glucémica, o tienen episodios frecuentes, graves, no advertidos, o hipoglucemias nocturnas, o bien con dificultades para el control de la glucosa durante el ejercicio y el estrés63.
Las evidencias para recomendar el MCG-RT o el MCG-Flash/EI en personas con DT2 son por ahora escasas, aunque sí tendría indicación en los casos deDT2 insulino-tratados, ya que en los pacientes con DT2
para intentar reducir las oscilaciones glucémicas. Estosmal controlados, (A 8.8%), tratados con régimen de
datos permitirán modificar las dosis de insulina basal y prandial. Sin embargo, el uso racional del MCG permite aplicar correcciones de insulina en momentos pos absor- tivos y alejados de las comidas.En el momento de realizar la lectura e interpretación debe considerarse en primer lugar el período nocturno, insulina basal-prandial, la utilización del MCG redujo las hipoglucemias11.Diferentes estudios avalan el uso del MCG, sobre todo en casos con DT1 y con DT2 insulinizados. Se aleatoriza- ron 322 pacientes mayores de 8 años con A1c 8 a 10%, al uso de un equipo de MCG-RT (más del 80% tratados con BPI), observándose en la semana 26 un descenso de la A1c (-0.53%, IC 95%: -0.71 a -0.35) en el subgrupo de mayores de 25 años, mientras que en los grupos de menor edad, la mejoría fue estadísticamente significativa si el equipo se utilizaba más de seis días por semana32.
En el estudio DIAMOND, 158 adultos en tratamiento con insulina fueron asignados en forma aleatoria a monitoreo
continuo de glucosa o automonitoreo glucémico capilar por 6 meses; la A1c basal (8.6%), mejoró 1% con el MCGRT
versus 0.4% con AGC (diferencia media ajustada 0.6%, p < 0.001), con alta adherencia al MCG-RT62. Por
otra parte, se estudió el potencial del MCG-RT medido mediante el sensor Dexcom G5® para reemplazar el AGC
en el tratamiento de la , en un ensayo clínico abierto aleatorizado de 226 adultos con buen control (A1c: 7.1±
0.7%) que comparó el MCG-RT en forma aislada con el MCG-RT asociado al AGC. La utilización combinada de
ambos sistemas no impactó en el tiempo en rango objetivo de glucemia (70-180 mg/dl), como objetivo primario.
Esto respalda la utilización del MCG en forma totalmente independiente del automonitoreo64.
Por este motivo la FDA aprobó uno de los sistemas de MCG-RT Dexcom G5 Mobil, en reemplazo del AGC en
personas con DM mayores de 2 años de edad, aunque aún se requieren 2 mediciones de sangre capilar diarias
para calibrar el equipo66.
El MCG-Flash/EI en DT1 se evaluó en 328 pacientes adultos con A1c ≤ 7.5% (68% con TII y 32% con BPI),
que utilizaron sus equipos Free Style Libre ® por 14 días, sin acceso a los datos, y este período fue comparado con otro posterior de 14 días donde sí se les permitió acceso a los datos del MCG-Flash/EI. El objetivo primario,
tiempo en hipoglucemia (< 70 mg/dl), se redujo un 38%65.
Recientemente se publicaron resultados del uso del MCGRT en vida real que demostraron, en 515 pacientes con
DT1 mal controlada, que su utilización se asoció a una disminución significativa de la A1c, con una reducción de
hospitalizaciones por hipoglucemia grave y cetoacidosis diabética (de 16 a 4%), menor tasa de ausentismo laboral
y disminución del temor a las hipoglucemias, mejorando significativamente la calidad de vida63.
Limitaciones del monitoreo continuo de glucosa-Real Time y del monitoreo continuo-Flash/EI
– Se requiere continuar con AGC para calibrar diariamente
los equipos, aunque esto no es necesario en los equipos
MCG-Flash/EI.
– Puede haber diferencias episódicas en el rendimiento del sensor en la misma persona.
– Los sensores tienen un tiempo de utilización determinado.
– Las diferencias entre los datos de glucosa intersticial
y capilar son más pronunciadas durante los períodos de cambio rápido de los valores de glucosa, tales como los
períodos prandiales o post-ejercicio67, debido al tiempo de retardo de medición de los equipos y el impacto del
ejercicio en los diferentes compartimentos orgánicos68,69.
Se han registrado reacciones alérgicas en el sitio de inserción del parche cutáneo (gel de poliacrilato), desprendimiento de los sensores por sudoración excesiva, pérdida de los sensores o lectores, interrupciones en
la transmisión durante la noche (fallas de captura), mal funcionamiento del sensor y silenciamiento involuntario de
las alarmas70. El ajuste de las dosis de insulina en base a los valores de MCG-RT conlleva un riesgo de sobre o
sub-insulinización. Sin embargo, en la práctica, el uso de los datos del MCG-RT aumenta el tiempo dentro del rango
objetivo de los valores de glucosa en comparación con el AGC11,64. En conjunto estos eventos adversos ocurrieron
en alrededor del 4% de los pacientes.
Aunque en Argentina aún no hay cálculos de costo-eficacia, el costo mensual del MCG es similar a la utilización
de 5 tirillas diarias del automonitoreo glucémico capilar (cantidad habitualmente utilizada en pacientes con DT1 o
DT2 insulinizados). Los datos del MCG son suficientemente confiables para ser utilizados con BPI ya que permiten
el ajuste, tanto de las dosis de insulina basal como de los bolos prandiales, en base al registro de los valores
de glucosa, su tendencia y la velocidad de cambio71,72.
Con la educación y el entrenamiento correcto, todos estos sistemas aportan información útil y fácilmente disponible
para la toma de decisiones clínicas.
Con el MCG se pueden obtener datos en forma continua y dinámica durante períodos prolongados, lo que permite
conocer los valores de glucosa intersticial, sus tendencias y fluctuaciones en los diferentes momentos del día. Al
observar un determinado valor de glucosa, éste se acompaña por flechas que indican si dicho nivel está estable,
en ascenso o en descenso. Esta información adicional es lo que nos permitiría adoptar una conducta terapéutica
anticipatoria para evitar hiperglucemias o hipoglucemias riesgosas. Si bien existe amplia experiencia en las conductas a tomar frente a hiper o hipoglucemias en los momentos pre-prandiales o en ayuno, no hay experiencia
de qué medidas tomar frente a estas situaciones en el período pos-absortivo. Esto es precisamente lo novedoso
del MCG. Con el objetivo de intervenir racionalmente desde el punto de vista terapéutico, sugerimos en base a la
información obtenida realizar el siguiente proceso de lectura y efectuar las siguientes modificaciones terapéuticas:
1) Analizar las glucemias nocturnas (primera y segunda mitad); en base a ellas modificar dosis de insulina del bolo
de la pre-cena si se quiere modificar nivel de glucosa en la primera parte de la noche o bien dosis basal, si se busca cambiar los niveles de glucosa del ayuno.
2) Analizar las glucemias del día, primero las preprandiales para modificar el aporte de insulina basal
y luego las pos-prandiales para modificar dosis de los bolos pre-comida.
3) Analizar los períodos pos absortivos para evitar las hiper o hipoglucemias entre las comidas.
4) Efectuar más rápidamente las modificaciones para evitar hipoglucemias y luego hacer las modificaciones para evitar las hiperglucemias.
Es muy importante capacitar al paciente y a su familia
para interpretar y poder también actuar de acuerdo a la información del MCG.
Las recomendaciones a los pacientes son:
– Colocar el programa del sistema de MCG que esté
utilizando en su computadora o smartphone.
– Efectuar una lectura retrospectiva al finalizar cada día con el objeto de entender por qué los niveles de glucosa pudieron haber bajado o subido y con qué hechos se pueden relacionar estas fluctuaciones.
– Efectuar, independientemente de que el sistema graba permanentemente, numerosas lecturas en el día. Los trabajos que analizaron el uso de MCG en condiciones de vida real muestran que a mayor número de lecturas
mejores resultados se obtienen. El promedio ideal son 12 a 13 lecturas por día73. Recordar que mínimamente hay
que efectuar una lectura cada 8 horas para que el sistema funcione correctamente.
– Capacitar a los pacientes para intervenir frente a lecturas que indican tendencias (por las flechas) aumentando
o disminuyendo la dosis de insulina. Muchas veces esto ocurre en períodos pos-absortivos en los que
habitualmente no se recomendaba aplicar insulina. Sin embargo, si se analizan los datos de glucosa junto a las flechas se podría considerar la aplicación de insulina en estos periodos del día. En la siguiente sección se proponen las conductas a seguir en base a las tendencias.
Conductas prácticas sugeridas en base a la información obtenida por el monitoreo continuo de glucosa (verificando previamente con el automonitoreo glucémico capilar)
En la Tabla 1 se puede observar cómo aparece la información en las pantallas de ambos sistemas. Dentro de
las 3 horas posteriores a la aplicación de un bolo preingesta se sugiere no realizar modificaciones (porque
aún se encuentra en el área bajo la curva de la cinética de acción de la insulina aplicada en la comida anterior).
Las siguientes indicaciones son válidas solamente para los períodos pos-absortivos y en la medida que aún falte
tiempo para la próxima comida.
Indicaciones frente a situaciones de hiperglucemia:
a) Si las flechas hacia arriba que se observan en el gráfico se asocian con un valor de glucosa < 150 mg/dl se sugiere no colocar insulina y seguir observando cada 10 minutos.
b) Con glucosa > 150 mg/dl colocar 1 unidad de insulina regular o análogo de insulina rápida cada 50 mg/dl
de glucosa y esperar sin tomar otra conducta hasta 2 h después, excepto que comience la próxima ingesta frente
a la cual se procederá con la indicación del bolo prandial.
c) En caso de no estar frente a una nueva ingesta a las 2 h y la glucosa fuera > 250 mg% se sugiere dosar
cetonas, administrar otro bolo de insulina utilizando los mismos criterios de corrección (1 unidad cada 50 mg/dl
por encima de 150 mg/dl) y si en la próxima hora la tendencia no cambia (confirmando con glucosa capilar), dar
un bolo adicional o bien, en caso de bomba de insulina, cambiar el catéter de infusión.
d) Si las flechas hacia arriba son 3 para el MCG-RT o bien son flechas a 90 grados en MCG-El comenzar las
mismas correcciones con glucemias mayores a 100 mg/ dl y menores a 150 mg/dl.
Si se observan tendencias de hipoglucemia en el período pos-prandial y pos-absortivo: Durante las 3 h posteriores a la aplicación de un bolo
pre-ingesta y ante la aparición de síntomas de hipoglucemia y/o valores de glucosa < 100 mg/dl, verificados por
medición capilar y en base a los datos enunciados en la Tabla 1, seguir las indicaciones que se dan a continuación,
siempre que no se encuentre próximo a la siguiente comida (en cuyo caso simplemente deberá adelantarla):
a) En el caso de la primera fila de la tabla (2-3 flechas verticales hacia abajo para el sistema MCG-RT o bien a 90 grados hacia abajo en el sistema MCG-EI) ingerir 30g de carbohidratos de absorción rápida
b) Acorde a las flechas de la segunda fila (1 flecha vertical hacia abajo en el sistema MGG-RT o bien a 45 grados en MCG-EI) ingerir solo 15 g de carbohidratos de absorción rápida
En conclusión, la posibilidad de que las personas con DM determinen sus propias glucemias es uno de los avances más importantes para el control de esta enfermedad,
desde el descubrimiento de la insulina en 1921. El AGC permite conocer el grado de control glucémico y además tomar decisiones terapéuticas a los pacientes
que quieran estar bien controlados74. Es importante estimular, motivar y educar para que él/ella participe activamente en el control y manejo de su enfermedad a
través del autoanálisis de la glucosa, y pueda tomar decisiones, tales como elegir el momento para aplicarse la insulina, adecuar su dosis y evaluar resultados (“decisión y acción”). Sin embargo, el AGC clásico es un sistema limitado ya que determina solo la glucemia estáticamente, sin evidenciar tendencias ni fluctuaciones; además, suele ser difícil de realizar en ciertos momentos críticos (por ejemplo, durante el sueño o la actividad física) y continúa
siendo un método invasivo y con baja adherencia.
Diferentes estudios han demostrado que el MCG es un nuevo y eficaz recurso para medir la glucosa con potencial para mejorar el control y tratamiento de la DM32, 62, 64, 66, informando tanto el valor de glucosa como su tendencia en momentos difíciles de acceder mediante el AGC. Esto facilita cambios dinámicos e incluso anticipados, que permiten mayor control y menor tiempo de exposición a hiper o a hipoglucemias, mejorando la calidad de vida,
generando un mayor cumplimiento y adherencia a la terapéutica63, 65.
El MCG es un componente muy robusto de la educación terapéutica y, junto al conteo de hidratos de carbono, permite decidir la dosis prandial y evaluar si ella
fue correcta. Permite mejorar la titulación de la insulina basal y/o precisar los perfiles basales en las BPI, detectar momentos de riesgo y entrenar para emergencias o momentos de excepción.
Es fundamental que el equipo de salud sepa cómo decodificar los resultados y enseñe a los pacientes cómo proceder con ellos. Para eso se requiere del conocimiento
previo e incluso de un corto entrenamiento para obtener el mayor provecho y evitar potenciales dificultades.
El MCG tiene indicaciones preferentes, o bien transitorias y relativas. Es muy importante considerar la exactitud y precisión de estos nuevos sistemas. Así, cuando se plantean dudas se debe recurrir al AGC para confirmar el dato. La incorporación de los sensores a las BPI representa
un avance importante para los sistemas cerrados de administración de insulina.
El uso del monitoreo de la glucosa se ha transformado en un recurso esencial para el control y el tratamiento de
la diabetes. El advenimiento de los sistemas de medición continua de la glucosa intersticial en tiempo real o de escaneado de glucosa en forma intermitente, amplía la perspectiva para el logro de las metas terapéuticas de los pacientes con DM.Conflictos de intereses: León Litwak, José Costa Gil y Solange Houssay fueron disertantes de laboratorios Abbott.
Alejandro Dain es miembro del Advisory Board y disertante para Roche Diabetes Care. Adrian Proietti es disertante de Laboratorios Abbott y Medtronic. Ivanna Querzoli es miembro del departamento médico de Sanofi. Carla Musso no presenta conflictos de intereses.
Bibliografía
1. Diabetes Control and Complications Trial Research Group, Nathan DM, Genuth S, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-86.
2. Ohkubo Y1, Kishikawa H, Araki E, et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non-insulindependent diabetes mellitus: a randomized prospective 6-year study. Diabetes Res Clin Pract 1998; 28:103-17.
3. Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000; 321: 405-12.
4. Lachin JM, Genuth S, Nathan DM, Zinman B, Rutledge BN, DCCT/EDIC Research Group. Effect of glycemic exposure on the risk of microvascular complications in the diabetes control and complications trial revisited. Diabetes 2008; 57: 995-1001.
5. Shivashankar R, Kirk K, Kim WC, et al. Quality of diabetes care in low- and middle-income Asian and Middle Eastern countries (1993-2012): 20-year systematic review. Diabetes Res ClinPract 2015; 107: 203-23.
6. Ali MK1, Bullard KM, Saaddine JB, Cowie CC, Imperatore G, Gregg EW. Achievement of goals in U.S. diabetes care 1999-2010. N Engl J Med 2013; 368: 1613-24.
7. Mudaliar U1, Kim WC, Kirk K, Rouse C, Narayan KM, AliM. Are recommended standards for diabetes care met in Central and South America? A systematic review. Diabetes Res ClinPract 2013; 100: 306-29.
8. Evans JM, Newton RW, Ruta DA, MacDonald TM, Stevenson RJ, Morris AD. Frequency of blood glucose monitoring in relation to glycaemic control: observational study with diabetes database. BMJ 1999; 319: 83-6.
9. Litwak LE, MileoVaglio R, Alvarez A,Gutman RA. Autocontrol de la glucemia capilar: Evaluación del resultado a largo plazo (3 a 7 años). Medicina (B Aires) 1999; 59: 71-8.
10. Skyler JS, Skyler DL, Seigler DE, O’Sullivan MJ. Algorithms for adjustment of insulin dosage by patients who monitor blood glucose. Diabetes Care 1981; 4: 311-8.
11. Bailey TS, Grunberger G, Bode BW, et al. American Association of Clinical Endocrinologists and American College of Endocrinology. 2016 Outpatient Glucose Monitoring Consensus Statement. Endocr Pract 2016; 22: 231-61.
12. Matthew Dobson (1735?-1784) clinical investigator of diabetes mellitus. JAMA 1968; 205: 698.
13. Purdie, Irvine JC. The alkylation of sugars. J Chem Soc 1903; 83:1021-37.
14. Clarke SF, Foster JR. A history of blood glucose meters and their role in self-monitoring of diabetes mellitus. Br J Biomed Sci 2012; 69: 83-93.
15. Howe-Davies S, Holman RR, Phillips M, Turner RC. Home blood sampling for plasma glucose assay in control of diabetes. Br Med J 1978; 2: 596-8.
16. Sönksen PH, Judd SL, Lowy C. Home monitoring of bloodglucose. Method for improving diabetic control. Lancet 1978; 1: 729-32.
17. Danowski TS, Sunder JH. Jet injection of insulin during self-monitoring of blood glucose. Diabetes Care 1978; 1: 27-33.
18. Walford S, Gale EA, Allison SP, Tattersall RB. Self- monitoring of blood-glucose. Improvement of diabetic control. Lancet 1978; 1:732-5.
19. Skyler JS, Lasky IA, Skyler DL, Robertson EG, Mintz DH. Home blood glucose monitoring as an aid in diabetes management. Diabetes Care 1978; 1:150-7.
20. Peterson CM, Jones RL, Dupuis A, Levine BS, Bernstein R, O’Shea M. Feasibility of improved blood glucose control in patients with insulin-dependent diabetes mellitus. Diabetes Care 1979; 2: 329-35.
21. Ikeda Y, Tajima N, Minami N, Ide Y, Yokoyama J, Abe M. Pilot study of self-measurement of blood glucose using the Dextrostix-Eyetone system for juvenile-onset diabetes. Diabetologia 1978; 15: 91-3.
22. International Diabetes Federation, Clinical Guidelines Task Force. Global Guideline for Type 2 Diabetes. Chapter 8: Self-monitoring. International Diabetes Federation, 2005.
23. Farmer AJ, Perera R, Ward A, et al. Meta-analysis of individual patient data in randomised trials of self monitoring of blood glucose in people with non-insulin treated type 2 diabetes. BMJ 2012; 344: e486.
38. Thorens B, Mueckler M. Glucose transporters in the 21st Century. Am J Physiol Endocrinol Metab 2010; 298: E141-5.
39. McCulloch LJ, van de Bunt M, Braun M, Frayn KN, Clark A,
Gloyn AL. GLUT2 (SLC2A2) is not the principal glucose transporter in human pancreatic beta cells: implications for understanding genetic association signals at this locus. Mol Genet Metab 2011; 104: 648-53.
40. Pingitore A, Ruz-Maldonado I, Liu B, Huang GC, Choudhary P, Persaud SJ. Dynamic profiling of insulin secretion and ATP generation in isolated human and mouse islets reveals differential glucose sensitivity. Cell Physiol Biochem 2017; 44: 1352-9.
41. Monnier L, Collete C, Dunseath GJ, Owens DR. The loss of postprandial glycemic control precedes stepwise deterioration of fasting with worsening diabetes. Diabetes Care 2007; 30: 263-9.
42. Schrot RJ. Targeting plasma glucose: preprandial versus postprandial. Clin Diabetes 2004; 22: 169-72.
43. Ceriello A, Colagiuri S. International Diabetes Federation guideline for management of postmeal glucose: a review of recommendations. Diabet Med 2008; 25: 1151-6.
44. Parkin C. Is postprandial glucose control important? Is it practical in primary care settings? Clin Diabetes 2002;20: 71-6.
45. Banning M. A review of clinical decision making: Models and current research. J Clin Nurs 2008; 17: 187-95.
46. Bergenstal RM, Ahmann AJ, Bailey T, et al. Recommendations for standardizing glucose reporting and analysis to optimize clinical decision making in diabetes: the Ambulatory Glucose Profile (AGP). Diabetes Technol Ther 2013; 15: 198-211.
47. Kirchsteiger H, Jørgensen JB, RenardE, del Re L (eds). Prediction Methods for Blood Glucose Concentration, 1st ed. Switzerland: Springer International Pulblishing, 2016, p 265.
48. Pleus S, Schmid C, Link M, et al. Performance evaluation of a continuous glucose monitoring system under conditions similar to daily life. J Diabetes Sci Technol 2013; 7: 833-41.
49. Claassen JAHR. The gold standard: not a golden standard. BMJ 2005; 330: 1121.
50. Rudd P. In esarch of the gold standard for compliance measurement. Arch Intern Med 1979; 139: 627.
51. Breton M, Kovatchev B. Analysis, modeling, and simulation of the accuracy of continuous glucose sensors. J Diabetes Sci Technol 2008; 2: 853-62.
52. Heinemann L, Lodwig V, Freckmann G. Accuracy in blood glucose measurement: what will a tightening of requirements yield? J Diabetes Sci Technol 2012; 6: 435-43.
53. Campos-Náñez E, Furtwaengler K, Breton MD. Clinical impact of blood glucose monitoring accuracy: an In-Silico Study. J Diabetes Sci Technol 2017; 11: 1187-95.
54. Freckmann G, Schmid C, Baumstark A, Pleus S, Link M, Haug C. System accuracy evaluation of 43 blood blucose monitoring systems for self-monitoring of blood glucose according to DIN EN ISO 15197. J Diabetes Sci Technol 2012; 6: 1060-75.
55. Reiterer F, Polterauer P, Schoemaker M, et al. Significance and reliability of MARD for the accuracy of CGM systems. J Diabetes Sci Technol 2017; 11: 59-67.
56. Luijf YM, Mader JK, Doll W, et al. Accuracy and reliability of continuous glucose monitoring systems: a head-to-head comparison. Diabetes Technol Ther 2013; 15: 721-6.
57. Castle JR, DeVries JH, Kovatchev B. Future of automated insulin delivery systems. Diabetes Technol Ther 2017; 19: 67-72.
58. Joubert M, Baillot Rudoni S, Catargi B, et al. Indication, organization, practical implementation and interpretation guidelines for retrospective CGM recording: a French position statement. Diabetes Metab 2015; 41: 498-508.
59. Scheiner G. CGM Retrospective data analysis. Diabetes Technol Ther2016; 18 Suppl 2: S14-22.
60. Kaufman FR. Insulin pumps and continuous gGlucose monitoring: A user´s guide to effective diabetes management, 1st ed. Alexandria, Virginia, USA: American Diabetes Association, 2012, p 120.
61. King A. Continuous glucose monitoring-guided insulin dosing in pump-treated patients with type 1 diabetes; a clinical guide. J Diabetes Sci Technol 2012; 6: 191-203.
62. Beck RW, Riddlesworth T, Ruedy K, et al. Effect of continuous glucose monitoring on glycemic control in adults with type 1 diabetes using insulin injections: the DIAMOND randomized clinical trial. JAMA 2017; 317: 371-8.
63. Charleer S, Mathieu C, Nobels F, et al. Effect of continuous glucose monitoring on glycemic control, acute admissions, and quality of life: A real-world study. J Clin Endocrinol Metab 2018; 103:1224-32.
64. Aleppo G, Ruedy KJ, Riddlesworth TD, et al. REPLACEBG: a randomized trial comparing continuous glucose monitoring with and without routine blood glucose monitoring in adults with well-controlled type 1 diabetes. Diabetes Care 2017; 40: 538-45.
65. Bolinder J, Antuna R, Geelhoed-Duijvestijn P, Kröger J, Weitgasser R. Novel glucose-sensing technology and hypoglycaemia in type 1diabetes: A multicentre, nonmasked, randomised controlled trial. Lancet 2016; 388:
2254-63.
66. US Food and Drug Administration (2016) FDA expands indication for continuous glucose monitoring system, first to replace finger stick testing for diabetes treatment decisions. En: www.fda.gov/NewsEvents/Newsroom/ PressAnnouncements/ucm534056.htm; consultado octubre 2018.
67. Taleb N, Emami A, Suppere C, et al. Comparison of two continuous glucose monitoring systems, Dexcom G4 Platinum and Medtronic Paradigm Veo Enlite System, at rest and during exercise. Diabetes Technol Ther 2016; 18: 561-7.
68. Kulcu E, Tamada JA, Reach G, Potts RO, Lesho MJ. Physiological differences between interstitial glucose and blood glucose measured in human subjects. Diabetes Care 2003; 26: 2405-9.
69. Bergenstal RM, Garg S, Weinzimer SA, et al. Safety of a hybrid closed-loop insulin delivery system in patients with type 1 diabetes. JAMA 2016; 316: 1407-8.
70. Rodbard D. Continuous glucose monitoring: a review of successes, challenges, and opportunities. Diabetes Technol Ther 2016; 18: S2-13.
71. Anderson SM, Raghinaru D, Pinsker JE, et al. Multinational home use of closed-loop control is safe and effective. Diabetes Care 2016; 39: 1143-50.
72. Petrie JR, Peters AR, Bergenstal RM et al. Improving the clinical value and utility of CGM systems: issues and recommendations. A joint statement of the European Association for the Study of Diabetes and the American Diabetes Association Diabetes Technology Working Group. Diabetologia 2017; 60: 2319-28.
73. Aleppo G, Laffel LM, Ahmann AJ, et al. A practical approach to using trend arrows on the Dexcom G5 CGM System for the management of adults with diabetes. J Endocr Soc 2017; 1: 1445-60.
74. Commendatore VF, Linari MA, Dieuzeide G, et al. Automonitoreo y monitoreo de la glucosa y cetonas en la persona con diabetes. Rev Soc Arg Diab 2007; 41: 95-104.
24. Polonsky WH, Fisher L, Schikman CH, et al. Structured self-monitoring of blood glucose significantly reduces A1C levels in poorly controlled noninsulin-treated type 2 diabetes: results from the Structured Testing Program study. Diabetes Care 2011; 34:262-7.
25. The Organizing Committee, Metzger BE, Coustan DR. Summary and recommendations of the Fourth International Workshop-Conference on Gestational Diabetes Mellitus. Diabetes Care 1998; 21: B161-7.
26. Negrato CA, Zajdenverg L. Self-monitoring of blood glucose during pregnancy: indications and limitations. Diabetol Metab Syndr 2012; 4:54.
27. Moy FM, Ray A, Buckley BS, West HM. Techniques of monitoring blood glucose during pregnancy for women with pre-existing diabetes. Cochrane Database Syst Rev 2017; 6:CD009613.
28. Raman P, Shepherd E, Dowswell T, Middleton P, Crowther CA. Different methods and settings for glucose monitoring for gestational diabetes during pregnancy. Cochrane Database Syst Rev 2017; 10:CD011069. 2 9 .
Mastrototaro JJ. The MiniMed continuous glucose monitoring system. Diabetes Technol Ther 2000; Suppl 1: S13-8.
30. Kaufman FR, Gibson LC, Halvorson M, Carpenter S, Fisher LK, Pitukcheewanont P. A pilot study of the continuous glucose monitoring system: clinical decisions and glycemic control after its use in pediatric type 1 diabetic subjects. Diabetes Care 2001; 24: 2030-4.
31. Isaacs L. What happened to the gluco watch biographer? En: http://www.diabetesmonitor.com/glucose-meters/ what-happened-to-the-glucowatch.htm; consultado octubre 2018.
32. Beck RW, Hirsch IB, et al. Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group. The effect of continuous glucose monitoring in well-controlled type 1 diabetes. Diabetes Care 2009; 32: 1378-83.
33. Tamborlane WV, Beck RW, Bode BW, et al. Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group. Continuous glucose monitoring and intensive treatment of type 1 diabetes. N Engl J Med 2008; 359: 1464-76.
34. Foundation Continuous Glucose Monitoring Study Group, Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group, Beck RW, Buckingham B, Miller K, et al. Factors predictive of use and of benefit from continuous glucose monitoring in type 1 diabetes. Diabetes Care 2009; 32: 1947-53.
35. Juvenile Diabetes Research Group, Kordonouri O, Pankowska E, Rami B, et al. Sensor- augmented pump therapy from the diagnosis of child- hood type 1 diabetes:
Results of the Paediatric Onset Study (ONSET) after 12 months of treatment. Diabetologia 2010; 53: 2487-95.
36. SWITCH Study Group, Battelino T1, Conget I, et al. The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomised controlled trial. Diabetologia 2012; 55: 3155-62.
37. Ferrarini E. Physiology of glucose homeostasis and insulin therapy in type 1 and type 2 diabetes. Endocrinol Metab Clin N Am 2012; 41: 25-39.
