JAVIER FARINA 1, WANDA CORNISTEIN 2, CARINA BALASINI 3, JUAN CHULUYAN 4, MIRIAM BLANCO 5
1Hospital Mariano y Luciano de la Vega, Moreno, Provincia de Buenos Aires, 2Hospital Universitario Austral, Provincia de Buenos Aires, 3Hospital Interzonal General de Agudos José de San Martín, La Plata, Provincia de Buenos Aires, 4Hospital General de Agudos Dr. Teodoro Álvarez, Buenos Aires, 5Hospital de Alta Complejidad en Red El Cruce, Florencio Varela, Provincia de Buenos Aires, Argentina
Resumen Representantes de la Sociedad Argentina de Infectología (SADI) y la Sociedad Argentina de Terapia
Intensiva (SATI) se reunieron para trabajar en la elaboración de recomendaciones concretas de diagnóstico, tratamiento y prevención de las infecciones asociadas a catéteres venosos centrales (IAC). La metodología utilizada fue el análisis de la bibliografía publicada en los últimos 10 años complementada con la opinión de expertos y datos locales. En este documento se pretende ofrecer herramientas básicas de optimización de diagnóstico sobre la base de criterios clínicos y microbiológicos, orientar acerca de los esquemas antibióticos empíricos y dirigidos, la posología y la administración de antibióticos en pacientes críticos, y promover las medidas efectivas para reducir el riesgo de IAC. Asimismo, se ofrece un algoritmo de diagnóstico y tratamiento para uso en la actividad asistencial y consideraciones sobre la dosificación de antibióticos. Este trabajo conjunto de infectólogos e intensivistas pone en evidencia la preocupación por el manejo de las IAC y la importancia de velar por la mejora en las prácticas cotidianas. A través de esta recomendación se establecen pautas locales para optimizar el diagnóstico, el tratamiento y la prevención de las IAC con el objeto de disminuir la morbimortalidad, los días de internación, los costos y la resistencia antimicrobiana.
Palabras clave: catéter, infección, bacteriemia, diagnóstico, tratamiento, prevención
Abstract Central venous catheter related infections. Inter-Societies update and recommendations.
Representatives of the Argentine Society of Infectious Diseases (SADI) and the Argentine Society of Intensive Therapy (SATI) joined together to issue specific recommendations for the diagnosis, treatment, and prevention of intravascular catheter related infections (CRI). The methodology used was the analysis of the literature published in the last 10 years, complemented with the opinion of experts and local data. This document aims to promote effective measures to reduce the risk of CRI and to offer basic tools for diagnosis optimization based on clinical and microbiological criteria, orientation on empirical and targeted antibiotic schemes, posology, and administration of antibiotics in critical patients. It also offers a diagnostic and treatment algorithm for use in the care activity, as well as considerations on the dosage of antibiotics. The joint work of both societies highlights the concern for the management of CRI and the importance of ensuring improvement in daily practices. Through this recommendation, local guidelines are established to optimize the diagnosis, treatment and prevention of CRI in order to reduce morbidity and mortality, days of hospitalization, costs, and antimicrobial resistance.
Key words: catheter, bloodstream infection, diagnosis, treatment, prevention
Dirección postal: Javier Farina, Hospital Mariano y Luciano de la Vega, Av. del Libertador 710, 1744 Moreno, Buenos Aires, Argentina
e-mail: dr.javierfarina@gmail.com
Este documento es el resultado del trabajo conjunto de los miembros del Comité de Infecciones Asociadas al Cuidado de la Salud y Seguridad del Paciente (IACS-SP) de la Sociedad Argentina de Infectología (SADI) y el Comité de Infectología Crítica (CIC) de la Sociedad Argentina de Terapia Intensiva (SATI), sobre enfoque y control de las infecciones en Unidades de Terapia Intensiva de adultos (UTI). Para su elaboración se realizó una búsqueda siste- mática, cuyas fuentes fueron Medline, Pubmed, Embase, Lilac`s, Ovid, Cochrane, etc. Se utilizaron palabras claves, términos MESH, en idioma español e inglés, para el pe- ríodo 2005-2017. Los trabajos analizados fueron guías, revisiones sistemáticas, estudios clínicos aleatorizados y estudios observacionales. Se estableció como bibliografía principal las guías internacionales vigentes más recono- cidas de EE.UU. y España2, 3, las que fueron adaptadas a nuestro escenario acorde a las características y la epidemiología de nuestras unidades críticas.
Este documento forma parte de recomendaciones inter-sociedades y ha sido diseñado para colaborar con médicos (residentes, becarios, internistas, intensivistas, infectólogos), personal de enfermería y cualquier otro personal de la salud que asista a pacientes con CVC, en lo relacionado a prevención, diagnóstico y tratamiento de IAC.
El documento está estructurado de la siguiente mane- ra: (1) Definiciones; (2) Epidemiología y fisiopatogenia; (3) Enfoque inicial y metodologías diagnósticas; (4) Tratamiento antibiótico empírico y dirigido; (5) Medidas recomendadas para la prevención.
Definiciones
Las IAC engloban diferentes entidades: (i) bacteriemia asociada a catéter (BAC); (ii) infección del sitio de inser- ción (eritema, induración, mayor sensibilidad y/o exudado en un área de 2 cm en torno al punto de exteriorización del catéter); (iii) infección del túnel (eritema, aumento de la sensibilidad y/o induración a más de 2 cm del sitio de salida y lo largo del trayecto subcutáneo de un catéter tunelizado); (iv) infección del bolsillo (eritema y/o indura- ción en el bolsillo subcutáneo de un catéter totalmente implantable)2. En este documento abordaremos el manejo de las BAC por ser las que tienen mayor importancia en la morbimortalidad de los pacientes de UTI.
Es importante diferenciar la definición epidemiológica de la definición clínica de BAC. La definición epidemiológi- ca hace referencia a una infección del torrente sanguíneo (sin infección localizada) que se desarrolla en un paciente con un CVC insertado por lo menos 48 horas antes de la aparición de la bacteriemia (el cultivo de la punta del catéter o el retrocultivo no es un criterio necesario en esta definición)1.
La definición clínica de BAC se refiere al hallazgo de al menos un hemocultivo periférico positivo en un paciente con clínica de infección (fiebre, escalofríos y/o hipoten- sión) sin otra fuente aparente de infección del torrente sanguíneo, con una punta de catéter o un retrocultivo positivo (con tiempo diferencial) con idéntico germen y antibiograma2. Los parámetros para identificar al catéter como fuente de la bacteriemia son rigurosos y serán des- criptos en la sección Diagnóstico microbiológico de BAC.
Epidemiología y fisiopatogenia
Al igual que otras infecciones asociadas a los cuidados de la salud, las BAC son prevenibles. Esto fue demostrado en EE.UU. donde se logró reducir la tasa de BAC de 3.64 a 1.65/1000 días CVC entre 2001 y 2009. Esta reducción se mantiene en el tiempo, posiblemente como resultado de esfuerzos de prevención generalizados, utilización de guías basadas en la evidencia, listas de revisión y paquetes de medidas4. En cambio, en América Latina, Asia, África y Europa, desde 2004 hasta 2009 las tasas de incidencia continuaron siendo sustancialmente altas, hallándose 6.8 BAC/1000 días CVC5. Muchos de estos resultados se encuentran en zonas con recursos limitados, y la alta incidencia se relaciona con la falta de programas de prevención5.
El Programa Nacional de Vigilancia de Infecciones Hospitalarias de Argentina (VIHDA) publicó en 2017 la información de 157 establecimientos con un índice de utilización de CVC del 68%; las tasas de BAC, que se han mantenido constantes en los últimos años, fueron 3.78/1000 días CVC en UTIs polivalentes y 5.63/1000 días CVC en UTIs médico-quirúrgicas6.
Los factores de riesgo asociado con BAC son: enfer- medad grave crónica, trasplante de médula ósea, inmu- nodepresión (principalmente neutropenia), desnutrición, nutrición parenteral total, BAC previas, edades extremas y pérdida de integridad de los tejidos.
La BAC es atribuible a cuatro causas: la colonización de la piel en el sitio de inserción, la contaminación in- traluminal o de los conectores, la siembra secundaria a bacteriemia y la contaminación del líquido de infusión7. La presencia de biofilms en la superficie externa e interna de los CVC puede desempeñar un papel importante en el proceso de colonización, producido por una combinación de factores del huésped, como fibrinógeno y fibrina y productos microbianos como glucocálix o slime7.
Un aspecto esencial en el manejo de las BAC es el conocimiento de los principales agentes etiológicos locales en cada unidad de terapia intensiva y su actuali- zación periódica, elemento necesario para el tratamiento empírico adecuado.
Antes de 1990, los cocos Gram positivos (CGP) eran los gérmenes predominantes en estas unidades; en los últimos años los bacilos Gram negativos (BGN) y las especies de Candida han incrementado su importancia. Los estafilococos continúan siendo, mundialmente, los principales agentes etiológicos de las BAC2. En el informe del VIHDA 2017 sobre las UTI de adultos en Argentina los principales gérmenes aislados fueron Klebsiella pneumo- niae, Staphylococcus aureus, Pseudomonas aeruginosa y Acinetobacter spp6.
Enfoque inicial y metodologías diagnósticas
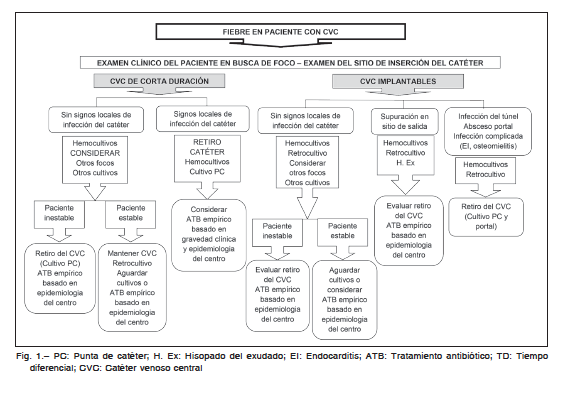
Para el control de las infecciones relacionadas a CVC se debe tener en cuenta varios aspectos: tipo de catéter, signos relacionados a compromiso del catéter, estado clínico del paciente y resultado de los cultivos. La sola presencia de fiebre no es indicación para el retiro del catéter, siendo esta conducta una de las más controvertidas.
A continuación se mencionan las situaciones en las que se recomienda el retiro del catéter2, 3: signos locales de
supuración en el punto de inserción, shock séptico, bacteriemia persistente (luego de 72 h de tratamiento antibiótico
adecuado), complicaciones metastásicas, infección del túnel, endocarditis infecciosa, tromboflebitis séptica y
confirmación microbiológica de bacteriemia relacionada a CVC (puede considerarse retener el CVC si el germen
es un estafilococo coagulasa negativo).
Diagnóstico microbiológico de bacteriemia asociada a catéter
Existen dos métodos principales de estudio microbiológico de BAC, que se clasifican según exista o no remoción del
CVC. En ambas situaciones, y sea cual fuera la técnica utilizada, el cultivo del catéter debe identificar al mismo
germen que el aislado en al menos un hemocultivo periférico (con similar resultado en el antibiograma).
Métodos con remoción del catéter
A) Cultivo semicuantitativo de la punta del catéter (técnica de Maki8). Se cultiva la superficie externa de la punta del
catéter (3-5 cm) en agar sangre durante 48 horas. Punto de corte: ≥ 15 UFC/placa.
B) Cultivos cuantitativos de la punta del catéter. Existen diferentes metodologías, algunas evalúan solo superficie
externa y otros consideran ambas localizaciones.
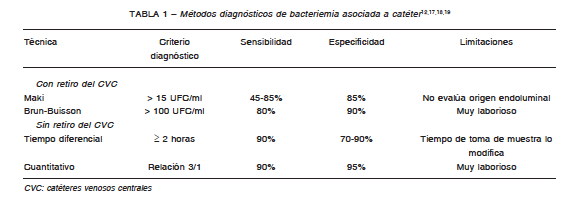
Cada laboratorio seleccionará el método más adecuado y al momento de instaurar una metodología se
considerarán las probables vías de infección del catéter (Tabla 1). Recomendamos el uso combinado del método
de Maki junto con el de Brun-Buisson para incrementar la sensibilidad y especificidad en el diagnóstico de BAC8, 9.
Métodos sin remoción del catéter
A) Tiempo diferencial de positividad. Aprovecha la capacidad de los métodos automatizados de detectar el
tiempo exacto en que se positiviza un hemocultivo. Los hemocultivos con mayor inóculo tienen menor tiempo de
positivización. Las diferencias en tiempo de crecimiento entre hemocultivos tomados simultáneamente de cada
una de las luces del catéter y de una vía periférica colocados en un mismo tipo de frasco, con el mismo volumen
y colocados a la vez en el equipo, pueden orientar sobre un origen de la bacteriemia en la punta del catéter. Blot
y col.10 establecen un tiempo diferencial de 120 minutos (primero el retrocultivo) como predictor de que la bacteriemia
sea asociada al catéter. No hay evidencia de que esta metodología sea aplicable a las candidemias3.
B) Hemocultivos cuantitativos. Cuando no contamos con métodos automatizados que permitan calcular el
tiempo diferencial, una relación superior a 3:1 (retrocultivo/ periférico respectivamente) entre los recuentos de ambos
hemocultivos es indicativa de BAC3, 11, 12. Las principales desventajas son el costo, lo laborioso de la técnica y la
necesidad del procesamiento inmediato de la muestra.
Los métodos de diagnóstico microbiológico se resumen en la Tabla 1. No hay hasta la fecha evidencia suficiente
para el uso de métodos moleculares (ej.: PCR real time) en el diagnóstico de BAC en la práctica clínica3.
Los métodos rápidos de identificación microbiológica como la espectrometría de masas con tiempo de vuelo
(MALDI-TOF MS) es una de las nuevas tecnologías que permite la identificación microbiana en menor tiempo
de los aislamientos en cultivos de sangre. Según los métodos utilizados para obtener la colonia (método de
pátina o purificación) esta tecnología ha demostrado alta sensibilidad y especificidad para la identificación rápida
de microbios en hemocultivos positivos. Existen algunas limitaciones como los Streptococcus spp., Gram negativos
no fermentadores y especies de Candida no albicans.
Así mismo las técnicas de detección molecular directa de microorganismos en sangre y otras muestras son un
enfoque prometedor para mejorar el control y los resultados en los pacientes. Todavía no pueden reemplazar en
todas las situaciones al cultivo tradicional y siguen siendo costosos. La combinación de ambas metodologías, en el
contexto de un algoritmo de trabajo, pueden reducir los tiempos y optimizar los costos13.
El enfoque diagnóstico y terapéutico inicial se describe en la Figura 1, mientras que el diagnóstico definitivo de
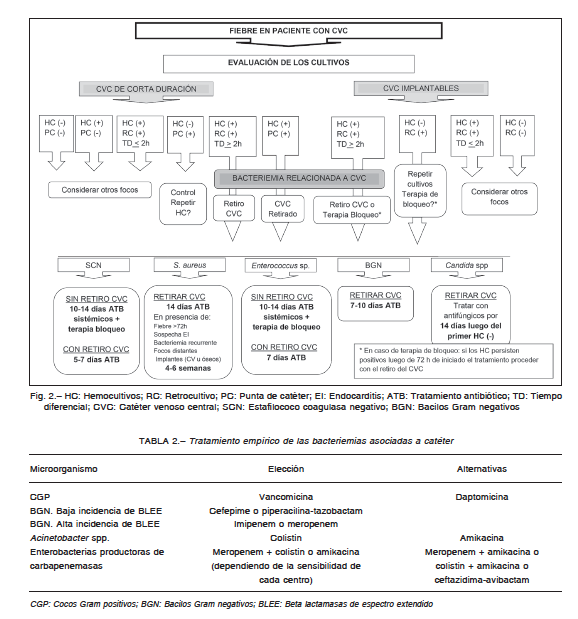
BAC junto con la duración del tratamiento, se describen en la Figura 2.
Tratamiento antibiótico
Como en cualquier infección asociada a los cuidados de la salud, el esquema de tratamiento antibiótico empírico
debe estar apoyado por la epidemiología de cada centro, la cual debe ser estudiada y actualizada en forma
permanente (ej.: cada 6 meses). El conocimiento de la colonización previa del paciente también puede ser
considerado al momento de escoger el tratamiento inicial.
Los datos epidemiológicos nacionales avalan un tratamiento empírico que incluya cobertura tanto para
cocos Gram positivos (CGP) como para bacilos Gram negativos (BGN)6. La inclusión de antibióticos activos
frente a enterobacterias productoras de beta lactamasas de espectro extendido (BLEE), productoras de carbapenemasas
o Acinetobacter spp. debe estar fundamentada por la epidemiología de cada centro. Excepto en casos
puntuales seleccionados, no se recomienda ampliar el esquema empírico para cubrir enterococos vancomicina
resistentes (EVR) o Candida spp.
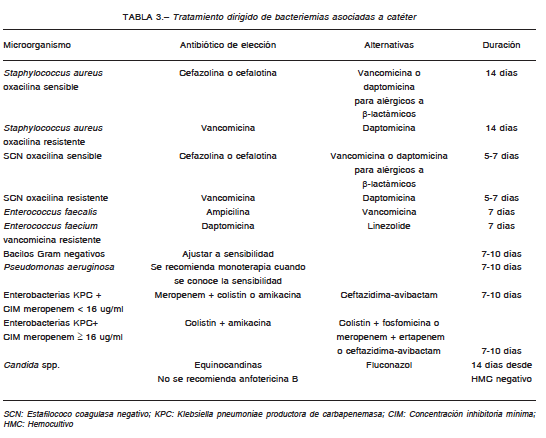
Las recomendaciones para el tratamiento empírico y el dirigido a microorganismos específicos se describen en
las Tablas 2 y 3, respectivamente. No intentan dar una indicación para todas las situaciones posibles, pero sí una
guía ante las más frecuentes en la práctica.
Duración
La duración del tratamiento se considera luego de retirado el catéter ante la presencia o ausencia de complicaciones
a distancia. Si el paciente tiene buena evolución y el tratamiento empírico inicial fue adecuado, la tendencia
actual es realizar los tratamientos más cortos3.
Si el catéter no es retirado, se debe realizar tratamiento sistémico más terapia de bloqueo (termino en inglés: lock
therapy) por 14 días (solo tiene eficacia comprobada en estafilococos coagulasa negativos y no es recomendado
para otros gérmenes)2, 3.
Terapia de bloqueo (Lock therapy)
La terapia de bloqueo consiste en la administración del antibiótico (que posteriormente no va a utilizarse) en la luz
de un catéter central durante al menos 12 h (idealmente 24 h), buscando de esta forma eliminar la colonización
intraluminal del mismo2, 3, 14. Se utiliza esta herramienta en catéteres de larga duración y ante el aislamiento de
microorganismos poco virulentos (eficacia comprobada en estafilococo coagulasa negativo, sin evidencia en otras
etiologías, ante las que solo va a utilizarse como “salvataje” si hay extrema dificultad en la remoción del catéter)3,
14. Siempre será asociada a antibiótico sistémico. Los más utilizados son la vancomicina, amikacina, ciprofloxacina
y daptomicina. Se prepara una dilución con solución fisiológica y se infunde la cantidad necesaria para llenar
la luz del catéter (2-5 ml en la mayoría de los casos). Las concentraciones propuestas son: vancomicina 5 mg/ml,
amikacina 2 mg/ml, ciprofloxacina 2 mg/ml, daptomicina 5 mg/ml2, 3. El etanol y la taurolidina también han sido utilizados en forma de lock therapy, con escasa experiencia en nuestro país3.
Medidas para la prevención de las bacteriemias asociadas a catéter1, 4, 15, 16
– Educar al personal de salud sobre las indicaciones de uso del CVC, los procedimientos adecuados para su
inserción y mantenimiento y las medidas de control de infecciones adecuadas para prevenir las BAC
– Utilizar lista de chequeos
– Evaluar periódicamente el conocimiento y la adhesión a las directrices para todo el personal involucrado en la
inserción y el mantenimiento de CVC
– Designar solamente personal calificado que demuestre competencia para la inserción y el mantenimiento
de CVC
– Utilizar técnica aséptica para la inserción del catéter que consiste en: higiene quirúrgica de manos y utilización de máximas barreras estériles que incluyen uso de gorra, barbijo, camisolín estéril, antiparras, guantes estériles y campo de cuerpo completo estéril.
– Realizar la desinfección de la piel preferentemente con clorhexidina al 2-4% (la opción alternativa es alcohol al 70%, no iodopovidona por prolongado período para inicio de su acción)
– Los CVC insertados con técnica no aséptica deben ser reemplazados tan pronto como sea posible, antes de las 48 h
– Utilizar nuevos guantes estériles antes de utilizar el nuevo CVC cuando se realizan intercambios bajo guía
de alambre
– Retirar CVC que no sean necesarios
– No reemplazar rutinariamente CVC, hacerlo solo cuando se considere que esté infectado
– Se recomienda el uso de un lumen exclusivo para nutrición parenteral
– No utilizar rutinariamente anticoagulantes para reducir el riesgo de infección
– Limpiar el conector con alcohol 70% cada vez que se administren soluciones
Las recomendaciones para la colocación y el mantenimiento de los catéteres se resumen en la Tabla 4.

Conflicto de intereses
El Dr. Javier Farina ha recibido honorarios como orador de Pfizer y Biomerieux. La Dra. Wanda Cronistein ha recibido
honorarios como oradora y advisory board de Pfizer, Biomerieux y MSD. El resto de los autores no tienen conflicto de
intereses para declarar.
Bibliografía
1. Centers for Disease Control and Prevention (CDC). Vital signs: central line-associated blood stream infections-
-United States, 2001, 2008, and 2009. MMWR Morb Mortal Wkly Rep 2011; 60: 243-8.
2. Mermel LA, Allon M, Bouza E, et al. Clinical practice guidelines for the diagnosis and management of intravascular
atheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin infect Dis 2009; 49: 1-45.
3. Diagnosis and treatment of catheter related bloodstream infection. Clinical Guidelines of the Spanish Society of
Clinical Microbiology and Infectious Diseases (SEIMC) and Spanish Society of Intensive Care Medicine and
Coronary Units (SEMICYUC). En: http://www.seimc.org/contenidos/documentoscientificos/guiasclinicas/seimcguiasclinicas-
2017-Catheterrelated_Bloodstream_Infection. pdf; consultado junio 2018
4. Pronovost PJ, Watson SR, Goeschel CA, Hyzy RC, Berenholtz SM. Sustaining reductions in central line-associated bloodstream infections in Michigan Intensive Care Units: A 10-year analysis. Am J Med Qual 2016; 31: 197-202.
5. Rosenthal VD, Bijie H, Maki DG, et al. International Nosocomial Infection Control Consortium (INICC) report, data
summary of 36 countries, for 2004-2009. Am J Infect Control 2012; 40: 396-407.
6. VIHDA. Estudio nacional de diagnóstico institucional y prevalencia de infecciones asociadas al cuidado de la
salud de hospitales de Argentina. VIHDA 2017. En: www.vihda.com.ar; consultado junio 2018.
7. García-Rodríguez J, de Pablos Gómez M, Gutiérrez Altés A. El microbiólogo y la infección asociada a catéter. Rev
Esp Quimioter 2010; 23: 53-62.
8. Maki DG, Weise CE, Sarafin HW. A semiquantitative culture method for identifying intravenous-catheter-related
infection. N Engl J Med 1977; 296: 1305-9.
9. Brun-Buisson C, Abrouk F, Legrand P, Huet Y, Larabi S, Rapin M. Diagnosis of central venous catheter-related
sepsis. Critical level of quantitative tip cultures. Arch Intern Med 1987; 147: 873-7.
10. Blot F, Nitenberg G, Chachaty E, et al. Diagnosis of catheter- related bacteraemia: a prospective comparison of the time to positivity of hub-blood versus peripheral-blood cultures. Lancet 1999; 354: 1071-7.
11. Bouza E, Burillo A, Muñoz P. Catheter-related infections: diagnosis and intravascular treatment. Clin Microbiol
Infect 2002; 8: 265-74.
12. Safdar N, Fine JP, Maki DG. Meta-analysis: methods for diagnosing intravascular device-related bloodstream infection. Ann Intern Med 2005; 142: 451-66.
13. Chaves F, Garnacho-Montero J, Del Pozo JL, et al. Executive summary: Diagnosis and Treatment of Catheter-
Related Bloodstream Infection: Clinical Guidelines of the Spanish Society of Clinical Microbiology and Infectious
Diseases (SEIMC) and the Spanish Society of Intensive Care Medicine and Coronary Units (SEMICYUC). Enferm
Infecc Microbiol Clin 2018; 36: 112-9.
14. Joshi A, Hart P. Antibiotic catheter locks in the treatment of tunneled hemodialysis catheter-related blood stream
infection. Semin Dial 2013; 26: 223-6.
15. Pronovost PJ. Ensuring that guidelines help reduce patient harm. J Oncol Pract 2013; 9: e172-3.
16. Grady N, Alexander M, Burns L, et al. Guidelines for the Prevention of Intravascular Catheter-Related Infections,
2011. En: https://www.cdc.gov/hai/pdfs/bsi-guidelines-2011.pdf, consultado agosto 2018
17. Cleri DJ, Corrado ML, Seligman SJ. Quantitative culture of intravenous catheters and other intravascular inserts.
J Infect Dis 1980; 141: 781-6.
18. Sherertz RJ, Raad II, Belani A, et al. Three-year experience with sonicated vascular catheter cultures in a clinical
microbiology laboratory. J Clin Microbiol 1990; 28: 76-82.
19. Ferrer C, Almirante B. Infecciones relacionadas con el uso de los catéteres vasculares. Enferm Infecc Microbiol Clin
2014; 32: 115-24.
– – – –
Une propreté parfaite!
Si j´avais l´honneur d´être chirurgien [….], non seulement ne me servirais que d´instruments d´une propreté parfaite, mais après avoir nettoyé mes mains avec le plus grand soin et les avoir soumises a un flambage rapide…je n´emploierais que de la charpie, des bandelettes, des éponges, préalablement exposées dans un air porté a une température
de 130° a 150°; je n´emploierais jamais qu´une eau qui aurait subi la température de 110° a 130°.
Una limpieza perfecta!
Si tuviera el honor de ser cirujano […], no solo usaría instrumentos perfectamente
limpios, sino que después de limpiarme las manos con sumo cuidado y someterlas a un
rápido flameado … solo usaría hilos, vendas, esponjas, previamente expuestas al aire
a una temperatura de 130° a 150°; nunca usaría agua que no hubiera sido sometida a
temperaturas de 110° a 130°.
Louis Pasteur, 1878
En: Cita expuesta en la muestra “Pasteur, l´expérimentateur”. Palais de la Découverte,
Paris, julio 2018.
Bibliografía
1. Cassidy SB, Schwartz S, Miller JL, Driscoll DJ. Prader-Willi syndrome. Genet Med 2012; 14: 10-26.
2. Kalsner L, Chamberlain SJ. Prader-Willi, Angelman, and 15q11-q13 duplication syndromes. Pediatr Clin North Am 2015; 62: 587-606.
3. Dagli AI, Williams CA. Angelman Syndrome. En: https://www.ncbi.nlm.nih.gov/books/NBK1144; consultado mayo 2017
4. Margolis SS, Sell GL, Zbinden MA, Bird LM. Angelman syndrome. Neurotherapeutics 2015; 12: 641-50.
5. Finucane BM, Lusk L, Arkilo D, et al. 15q Duplication syndrome and related disorders. En: https://www.ncbi.nlm.nih.gov/books/NBK367946; consultado mayo 2017
6. Horsthemke B, Wagstaff J. Mechanisms of imprinting of the Prader-Willi/Angelman region. Am J Med Genet Part A 2008; 146: 2041-52.
7. Dawson AJ, Cox J, Hovanes K, Spriggs E. PWS/AS MS-MLPA confirms maternal origin of 15q11.2 microduplication. Case Rep Genet 2015; 2015: 1-3.
8. Bittel DC, Kibiryeva N, Talebizadeh Z, Butler MG. Microarray analysis of gene/transcript expression in Prader-Willi syndrome: deletion versus UPD. J Med Genet 2003; 40: 568-74.
9. Perk J, Makedonski K, Lande L, Cedar H, Razin A, Shemer R. The imprinting mechanism of the Prader-Willi/Angelman regional control center. EMBO J 2002; 21: 5807-14.
10. Ramsden SC, Clayton-Smith J, Birch R, Buiting K. Practice guidelines for the molecular analysis of Prader-Willi and Angelman syndromes. BMC Med Genet 2010; 70: 1-11.
11. Libov A, Maino M. D. Prader-Willi Syndrome. J Am Optom Assoc 1994; 65: 355-9.
12. Tan WH, Bacino CA, Skinner SA, et al. Angelman syndrome: Mutations influence features in early childhood. Am J Med Genet 2011; 155: 81-90.
13. Depienne C, Moreno-De-Luca D, Heron D, et al. Screening for genomic rearrangements and methylation abnormalities of the 15q11-q13 region in autism spectrum disorders. Biol Psychiatry 2009; 66: 349-59.
14. Chai JH, Locke DP, Greally JM, et al. Identification of four highly conserved genes between breakpoint hotspots BP1 and BP2 of the Prader-Willi/Angelman syndromes deletion region that have undergone evolutionary transposition mediated by flanking duplicons. Am J Hum Genet 2003; 73: 898-925.
15. Buiting K, Cassidy SB, Driscoll DJ, et al. Clinical utility gene card for: Prader-Willi Syndrome. Eur J Hum Genet 2014; 22.
16. Nygren AOH, Ameziane N, Duarte HMB, et al. Methylation-specific MLPA (MS-MLPA): simultaneous detection of CpG methylation and copy number changes of up to 40 sequences. Nucleic Acids Res 2005; 33: 1-9.
17. Procter M, Chou LS, Tang W, Jama M, Mao R. Molecular diagnosis of Prader-Willi and Angelman syndromes by methylation-specific melting analysis and methylation-specific multiplex ligation-dependent probe amplification. Clin Chem 2006; 52: 1276-83.
18. Branham MT, Marzese DM, Laurito SR, et al. Methylation profile of triple-negative breast carcinomas. Oncogenesis 2012; 1: 1-7.
19. Goldstone AP, Patterson M, Kalingag N, et al. Fasting and postprandial hyperghrelinemia in Prader-Willi syndrome Is partially explained by hypoinsulinemia, and is not due to peptide YY 3-36 deficiency or seen in hypothalamic obesity due to craniopharyngioma. J Clin Endocrinol Metab 2005; 90 : 2681-90.
20. Takano K, Lyons M, Moyes C, Jones J, Schwartz C. Two percent of patients suspected of having Angelman syndrome have TCF4 mutations. Clin Genet 2010; 78: 282-8.
21. Cassidy SB, Dykens E, Williams CA. Prader-Willi and Angelman syndromes: sister imprinted disorders. Am J Med Genet 2000; 97: 136-46.
22. Robinson WP, Christian SL, Kuchinka BD, et al. Somatic segregation errors predominantly contribute to the gain or loss of a paternal chromosome leading to uniparental disomy for chromosome 15. Clin Genet 2000; 57: 349-58.
23. Varela MC, Kok F, Otto PA, Koiffmann CP. Phenotypic variability in Angelman syndrome: comparison among different deletion classes and between deletion and UPD subjects. Eur J Hum Genet 2004;12 : 987-92.
24. Wandstrat AE, Leana-Cox J, Jenkins L, Schwartz S. Molecular cytogenetic evidence for a common breakpoint in the largest inverted duplications of chromosome 15. Am J Hum Genet 1998; 62: 925-36.
25. Henkhaus RS, Kim S-J, Kimonis VE, et al. Methylation-specific multiplex ligation-dependent probe amplification and identification of deletion genetic subtypes in Prader-Willi syndrome. Genet Test Mol Biomarkers 2012; 16: 178-86.
